2. 400038 重庆,陆军军医大学(第三军医大学)药学与检验医学系微生物与生化药学教研室
2. Department of Microbiology and Biochemical Pharmacy, Faculty of Pharmacy and Laboratory Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038, China
幽门螺杆菌(Helicobacter pylori, H.pylori)是一种革兰阴性微需氧菌,全球近一半的人口感染此细菌,其持续感染导致慢性胃炎[1],1994年世界卫生组织已将其列为Ⅰ类致癌因子[2]。尽管幽门螺杆菌相关胃炎的发生机制尚不清楚,但细菌和胃上皮细胞之间的相互作用可能是决定性因素。尤其是由细胞毒素相关基因A(cytotoxin associated gene A,CagA)蛋白所引起的炎症效应[3-4]。DNA损伤应答蛋白1 (regulated in development and DNA damage responses-1,REDD1)又称DNA损伤诱导转录因子4(DNA damage-inducible transcript4,DDIT4)和应激诱导蛋白801(stress-triggered protein,RTP801),是一种保守并且普遍存在的蛋白质,可在多种刺激下瞬时诱导反应。研究证明,作为哺乳动物雷帕霉素靶点(mammalian target of rapamycin,mTOR)信号通路的内源性抑制剂,REDD1可以调节细胞生长、线粒体功能、氧化应激和凋亡[5-6]。在不同的炎症性疾病中,REDD1可以发挥相反的作用。在活动性溃疡性结肠炎中,REDD1与中性粒细胞来源的IL-1β炎症反应相关[7];在流感病毒和水泡性口炎病毒感染中,REDD1作为一种新的宿主防御因子起到保护作用[8]。然而, 在发病率如此高的幽门螺杆菌相关胃炎中,REDD1的表达,调控机制和临床意义尚待阐明。
本研究旨在明确REDD1在H.pylori感染中的表达变化,探究H.pylori诱导REDD1上调的调控机制,为探明H.pylori感染致病机制及相关胃炎及胃癌的防治提供新的思路。
1 材料与方法 1.1 临床标本的获取我们从西南医院接受胃大部切除术的胃癌患者切除的新鲜胃组织中,分离距离肿瘤部位至少5 cm处的新鲜非肿瘤胃组织。志愿者均为成年人,并且在收集标本前已经获得每个志愿者的知情同意。人体样本实验得到陆军军医大学第一附属医院伦理委员会批准[批件号:(A)KY2021045]。
1.2 小鼠C57BL/6野生型(WT)小鼠购买于陆军军医大学实验动物中心,饲养在无病原体条件下。所有动物研究符合陆军军医大学动物使用规范,并得到陆军军医大学动物保护管理委员会批准。
1.3 主要试剂兔抗人/小鼠REDD1抗体购买于Abcam公司(no.Ab106356),兔抗人p38抗体购买于Cell signaling technology公司(no.8690),兔抗人p-p38抗体购买于Cell signaling technology公司(no.4511S),兔抗人/小鼠GAPDH抗体购买于Cell signaling technology公司(no.5174S),兔抗人NF-κB p65抗体购买于Cell signaling technology公司(no.8242S),兔抗人IgG抗体购买于Abcam公司(no.ab172730),辣根酶标记山羊抗兔IgG(H+L) 抗体(no.ZB2301)、ECL显色液二抗购买于北京中杉金桥公司,定量PCR试剂盒购买于TOYOBO公司,逆转录试剂盒购买于TaKaRa公司,蛋白提取液购买于Thermo Scientific公司,U0126、BAY 11-7082、SP600125、SB203580、FLLL32、GSK-3β inhibitor Ⅵ购买于Merck Millipore公司。
1.4 细胞和细菌来源、培养细菌及其培养条件: 野生型(wild type,WT) H.pylori 11637(NCTC,cagA positive)以及相同菌株背景的cagA毒力因子敲除株(△cagA H.pylori 11637) 在-80 ℃中长期保存,H.pylori细菌培养使用Skirrow血平板(含1.5%琼脂粉、5%兔全血、0.5%葡萄糖); 液体培养使用Skirrow液体培养基(含10%小牛血清、0.5%葡萄糖),培养条件为37 ℃、5%O2、10%CO2。AGS、BGC-823、GES-1、HGC-27和SGC-7901胃上皮细胞系(美国ATCC)。
1.5 方法 1.5.1 H.pylori感染小鼠选取6~8周雌性C57小鼠165只,按照随机数字表分成3组(n=55),分别用WT H.pylori 11637和△cagA H.pylori菌液连续灌胃5次,每半天1次,共2天半。未感染组用无菌PBS代替菌液。灌胃后每周每组随机处死小鼠5只,取胃组织分为4部分,分别用于提取RNA、DNA、蛋白和制作石蜡切片。
1.5.2 组织分离单细胞新鲜组织用含1%胎牛血清的Hanks溶液洗涤3次,切成小块,收集在含1 mg/mL胶原酶Ⅳ和10 mg/mL DNaseⅠ的RPMI1640培养基中,然后使用MACS解离器(Miltenyi Biotec)机械解离。解离后的细胞继续在37 ℃孵育0.5~1 h。然后将细胞悬浮液通过70 μm的细胞过滤器(BD Labware)过滤。
1.5.3 H.pylori刺激胃上皮细胞提前1 d将AGS细胞铺于无菌培养平板,待细胞充分贴壁,更换为不含青链霉素的培养基。用无菌PBS将H.pylori从培养基上洗脱,测量600 nm处光密度。按照相应的感染复数(MOI,细菌∶细胞数量) (0、10、20、50、100)加入到每孔细胞培养基中。置于37 ℃、5%CO2的孵箱中培养相应的时间(0、3、6、12、24 h),收集细胞和细胞培养上清待后续处理。
1.5.4 实时荧光定量PCR采用TRIzol法提取细胞和组织中的总RNA,实时荧光定量SYBR Green法检测H.pylori感染的AGS、BGC-823、GES-1、HGC-27、SGC-7901、人或小鼠胃组织中REDD1 mRNA的表达,引物设计见表 1。抽提后的RNA经电泳检验RNA无降解,用Nanodrop one微量紫外可见分光光度计测定RNA浓度,根据浓度计算体积后取RNA 500 ng按照逆转录试剂盒步骤以10 μL体系进行逆转录。取cDNA在Real-time PCR仪上按照试剂说明以10 μL体系进行反应。设复孔取均值,每个样本每个指标重复3次。使用Bio-Rad CFX Manager、Excel和GraphPad Prism 5等软件统计分析数据。
| 基因 | 引物或探针(序列5′→3′) |
| Human GAPDH | 上游ACCCAGAAGACTGTGGATGG 下游CAGTGAGCTTCCCGTTCAG |
| Mouse Redd1 | 上游TAAGTTCTGCCAACTCTTCCTT 下游CGGAGCTGTAGAGTTTCTTCTT |
| Human REDD1 | 上游GATGCCTAGCCAGTTGGTAAG 下游CTAAACAGCCCCTGGATCTTG |
| Mouse Gapdh | 上游TAAGTTCTGCCAACTCTTCCTT 下游CGGAGCTGTAGAGTTTCTTCTT |
| H.pylori 16s rDNA | 上游TTTGTTAGAGAAGATAATGACGGTATCTAAC 下游CATAGGATTTCACACCTGACTGACTATC 探针CGTGCCAGCAGCCGCGGT |
1.5.5 Western blot法检测蛋白表达
收集细胞或组织,使用RAPI裂解法提取细胞培养总蛋白。BCA法测定总蛋白浓度,以每条泳道10 μg蛋白上样,用10%十二烷基磺酸钠-聚丙烯酰胺(SDS-PAGE) 进行电泳,利用湿法电转将蛋白转印至PVDF膜。PBST洗膜,5% BSA室温封闭1 h,加入一抗(GAPDH抗体1 ∶1 000稀释、REDD1 antibody 1 ∶1 000稀释、p-p38 antibody 1 ∶1 000稀释、p38 antibody 1 ∶1 000稀释)4 ℃过夜,加入辣根过氧化物酶标记的二抗(1 ∶10 000)室温孵育1 h,ELC发光检测蛋白表达量。用ImageLab软件记录和分析成像结果。
1.5.6 免疫组织化学染色H.pylori灌胃感染7周的小鼠胃组织标本用中性甲醛固定,石蜡包埋后切片,经二甲苯和梯度乙醇脱蜡水化,在柠檬酸盐修复液中微波加热煮沸12 min修复抗原,3%过氧化氢溶液浸泡30 min,0.5%Triton X-100室温通透15 min,1%BSA 37 ℃封闭30 min后,加入一抗(REDD1抗体)1 ∶100(PBS代替一抗作为阴性对照),在湿盒中4 ℃过夜。PBS清洗,滴加二抗(辣根酶标记山羊抗兔IgG)37 ℃孵育1 h,清洗后滴加二氨基联苯胺(DAB)显色,苏木精染核,透明、脱水、封片。用显微镜(Nikon ECLIPSE 80i) 采集并分析图像。
1.5.7 信号通路抑制实验将AGS细胞铺于无菌12孔板或6孔板,待细胞充分贴壁,PBS清洗细胞3次,信号通路阻断剂U0126、BAY 11-7082、SP600125、SB203580、FLLL32、GSK-3β inhibitor Ⅵ (10 nmol/L)处理细胞2 h(1%FBS的F12培养基,37 ℃,5%CO2) (同体积的DMSO作为对照),再进行WT H.pylori 11637与细胞共培养实验。
1.6 统计学处理采用SPSS 13.0软件进行统计分析,计量数据用x±s表示,用t检验比较组间差异,炎症评分数据通过Mann-Whitney U检验进行分析。对于多组比较,采用单因素方差分析。采用Pearson相关分析和线性回归分析评估参数之间的相关性。计数资料用百分比表示,检验水准α=0.05。
2 结果 2.1 在幽门螺杆菌感染的人或小鼠胃黏膜中,REDD1表达增高比较H.pylori感染和未感染小鼠的原代胃黏膜组织, 结果发现, 在第6~9周,相比于未感染H.pylori的小鼠, H.pylori感染小鼠胃黏膜REDD1表达明显增高(图 1A)。由于cagA与胃炎的发生密切相关[9],因此,研究cagA与REDD1的相关性,在第6~9周,相比于未感染小鼠或△cagA H.pylori感染小鼠,WT H.pylori感染小鼠胃黏膜中REDD1表达明显增高,并且在感染后第7周达到峰值(图 1A)。免疫组化染色(图 1B)和蛋白印迹法(图 1C)结果也显示,相比于未感染组或△cagA H.pylori感染组,WT H.pylori感染组小鼠胃黏膜中REDD1表达明显增高。由此表明在H.pylori感染小鼠时,cagA对于诱导REDD1表达发挥关键作用。此外,体外H.pylori感染胃黏膜实验结果表明,相比于未感染组或△cagA H.pylori感染组,WT H.pylori感染组人或小鼠原代胃黏膜中REDD1 mRNA和蛋白表达明显增高(图 1D)。这些数据表明,REDD1在H.pylori感染患者和小鼠的胃黏膜中表达增加。

|
|
a: P < 0.01,与未感染组比较;b: P < 0.01,与未感染组及WT H.pylori组比较 A:WT H.pylori感染、ΔcagA H.pylori感染和未感染小鼠胃黏膜中REDD1表达的动态变化(每组每时间点n=5);B:免疫组化染色结果(×100);C:分析第7周WT H.pylori感染、ΔcagA H.pylori感染和未感染小鼠胃黏膜中REDD1表达;D:实时荧光定量PCR和Western blot分析未感染H.pylori的患者体外H.pylori(WT H.pylori或ΔcagA)感染后原代胃黏膜中REDD1 mRNA和蛋白表达情况(n=4) 1:未感染; 2:WT H.pylori感染; 3:△cagA感染;E:实时荧光定量PCR和Western blot分析未感染H.pylori的小鼠体外H.pylori(WT H.pylori或ΔcagA)感染后原代胃黏膜中REDD1 mRNA和蛋白表达情况(n=4) 1:未感染; 2:WT H.pylori感染; 3:△cagA感染 图 1 在H.pylori感染的人或小鼠胃黏膜中REDD1的表达 |
2.2 H.pylori依赖毒力因子cagA诱导胃上皮细胞REDD1表达增高,并且感染呈时间依赖以及浓度依赖
胃上皮细胞(gastric epithelial cells, GECs)是幽门螺杆菌感染时胃黏膜中最先接触的细胞类型[9]。H.pylori诱导人胃上皮细胞系AGS细胞、人原代胃上皮细胞以及小鼠原代胃上皮细胞REDD1表达增高,与未感染或ΔcagA H.pylori感染的相比,WT H.pylori感染的AGS细胞、人原代胃上皮细胞以及小鼠原代胃上皮细胞REDD1 mRNA和蛋白的表达显著增加(图 2A~C), H.pylori依赖感染时间(3、6、12、24 h) 诱导AGS细胞REDD1表达显著升高(P < 0.05,图 2D)。并且H.pylori依赖感染剂量在转录水平和翻译水平显著诱导AGS细胞REDD1表达增高(P < 0.05,图 2E)。综上数据表明,H.pylori依赖毒力因子cagA诱导胃上皮细胞中REDD1的表达,并与感染时间和感染剂量正相关。
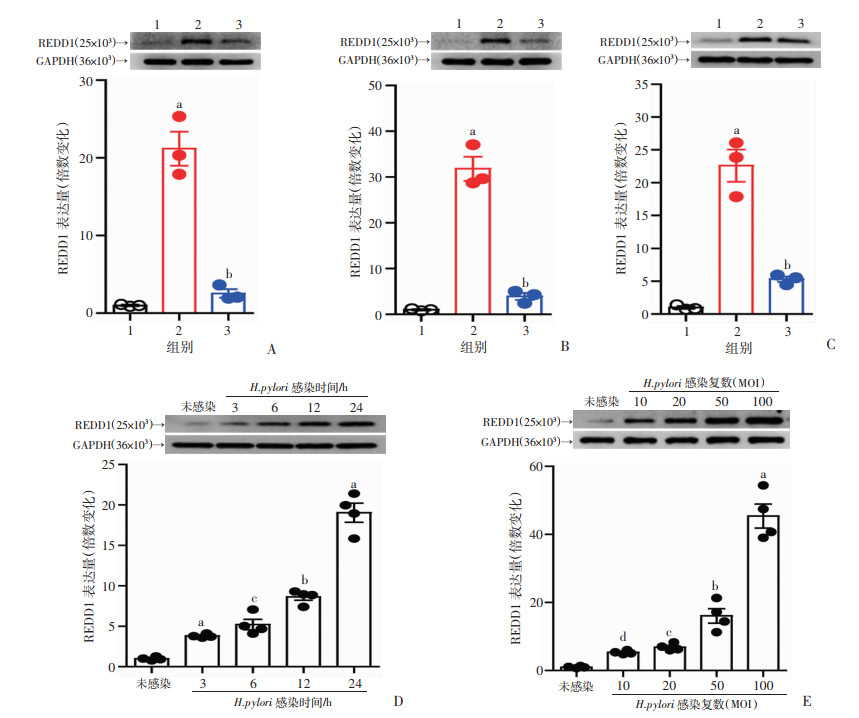
|
|
a: P < 0.01,与未感染组比较;b: P < 0.01,与未感染组或MOI=100或24 h组比较;c: P < 0.01,与未感染组或MOI=50或12 h组比较;d: P < 0.01,与未感染组或MOI=20组比较 A、B、C:实时荧光定量PCR和Western blot分析WT H.pylori感染、ΔcagA H.pylori感染或未感染的AGS细胞(A)、人原代胃上皮细胞(B)以及小鼠原代胃上皮细胞(C)中REDD1 mRNA和蛋白的表达情况(n=3) 1:未感染; 2:WT H.pylori感染; 3:△cagA感染;D、E:实时荧光定量PCR和Western blot分析不同时间点(MOI=100) (D)和不同MOI (24 h) (E) WT H.pylori感染或未感染AGS细胞中REDD1 mRNA和蛋白的表达情况(n=4) 图 2 REDD1在H.pylori感染AGS细胞中的表达 |
2.3 H.pylori通过磷酸化的cagA蛋白激活MAPKp38通路诱导胃上皮细胞表达REDD1
H.pylori刺激后AGS细胞REDD1表达升高,而MAPKp38信号通路抑制剂(SB203580)预处理后,AGS再与H.pylori共培养(MOI=100),则AGS细胞REDD1表达下调(图 3A)。p38作为MAPKp38通路的直接下游底物,在H.pylori感染的AGS细胞中发生磷酸化,经MAPKp38通路抑制剂SB203580预处理后磷酸化被抑制(图 3B)。为了证实cagA是否可以通过MAPKp38途径诱导REDD1表达,用WT H.pylori或ΔcagA H.pylori感染AGS细胞,或者用cagA- pcDNA3.1转染AGS细胞。结果发现,与感染ΔcagA H.pylori或转染载体(pcDNA3.1)的AGS细胞相比,感染WT H.pylori或转染cagA-pcDNA3.1的AGS细胞中REDD1 mRNA和蛋白表达增加,p38磷酸化水平升高,而在使用MAPKp38通路抑制剂SB203580或cagA磷酸化抑制剂PP2预处理后,上述情况被抑制(图 3B~D)。综上所述,这些结果表明H.pylori通过磷酸化的cagA激活MAPKp38通路诱导GECs表达REDD1。
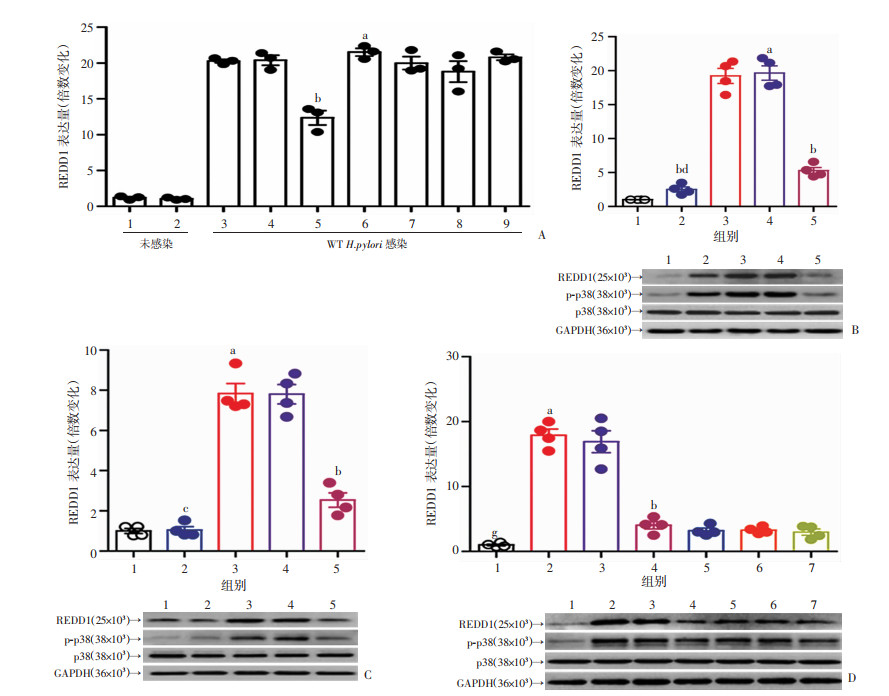
|
| A:用信号通路抑制剂预处理AGS细胞,然后用WT H.pylori (MOI=100)感染24 h。比较不同处理组AGS细胞中REDD1的表达情况(n=3) 1:Medium; 2:DMSO; 3:Medium; 4:DMSO; 5:SB203580;6:GSK-3β inhibitor; 7:SP600125;8:U0126;9:FLLL32 a:P < 0.01,与1组比较;b:P < 0.01,与1组及6组比较;B:用SB203580或溶剂DMSO预处理AGS细胞,然后用WT H.pylori或ΔcagA H.pylori(MOI=100)感染24 h,采用实时荧光定量PCR和Western blot分析REDD1、p38和p-p38 mRNA和蛋白表达(n=4) 1:未感染;2:△cagA感染;3:WT H.pylori感染;4:WT H.pylori+DMSO;5:WT H.pylori+SB203580;a:P < 0.01,与1组比较;b:P < 0.01,与1组及3组比较;C:用质粒pcDNA3.1或cagA-pcDNA3.1转染AGS细胞24 h,然后用或不用SB203580处理2 h,再培养24 h。采用实时荧光定量PCR和Western blot分析REDD1、p38和p-p38 mRNA和蛋白表达(n=4) 1:Mock;2;pcDNA3.1;3:cagA-pcDNA3.1;4:cagA-pcDNA3.1+DMSO; 5:cagA-pcDNA3.1+SB203580 a:P < 0.01,与1组比较;b:P < 0.01,与1组及4组比较; c: P < 0.01,与5组比较;D:用PP2或不用PP2预处理AGS细胞,然后用WT H.pylori或ΔcagA H.pylori(MOI=100)感染AGS细胞24 h,采用实时荧光定量PCR和Western blot分析REDD1、p38和p-p38 mRNA和蛋白表达(n=4) 1:未感染;2:WT H.pylori感染;3:WT H.pylori+DMSO;4:WT H.pylori+PP2;5:△cagA感染;6:△cagA+DMSO;7:△cagA+PP2 a:P < 0.01,与1组比较;b:P < 0.01,与1组及3组比较 图 3 H.pylori诱导GECs表达REDD1机制研究结果 |
3 讨论
在H.pylori感染过程中,宿主胃黏膜发生一系列炎症反应,进而发展为慢性胃炎。H.pylori感染引起的持续炎症是导致慢性胃炎进展为胃溃疡甚至胃癌的关键因素。REDD1是一种保守且普遍存在的蛋白,有报道称REDD1参与H.pylori感染[10], 是mTOR信号通路的内源性抑制剂[5-6],这表明REDD1在H.pylori相关性胃炎中潜在的作用。本研究检测感染H.pylori和未感染H.pylori小鼠胃黏膜组织中REDD1的表达,结果发现与未感染小鼠相比,H.pylori感染小鼠胃黏膜REDD1表达明显增高,进一步表明H.pylori诱导胃上皮细胞表达REDD1增高。此前有报道称,幽门螺杆菌毒力因子空泡细胞毒素(vacA)在线粒体中的扰动与细胞氨基酸稳态的改变有关,这导致了哺乳动物雷帕霉素靶蛋白1(mTORC1)的抑制,进而导致自噬[11]。本研究证明了H.pylori感染导致胃上皮细胞REDD1的增加,这是由毒力因子cagA介导的,在H.pylori诱导的胃炎中发挥重要作用。
H.pylori粘附于胃上皮细胞,细菌毒力因子cagA通过Ⅳ型分泌系统注入宿主细胞[12],激活多个信号通路,包括JAK-STAT3、PI3K-AKT和Wnt-β-catenin信号通路[13]。在胃上皮细胞中,H.pylori诱导REDD1表达依赖cagA激活MAPKp38信号通路。据报道,非磷酸化的cagA活性有利于上皮细胞增殖和促炎反应[14]。然而,本研究在胃上皮细胞中进一步证实cagA EPIYA基序磷酸化是REDD1上调的必要条件。在我们的体外细胞模型和体内小鼠模型中,数据显示,与未感染H.pylori相比,ΔcagA H.pylori在诱导REDD1表达方面有适度反应。可能有其他因素参与调控REDD1的表达,因此需要进一步研究其潜在的机制。
炎症通常被认为是对刺激的一种生理反应,包括激活多种类型的免疫细胞以消除原因和修复受损组织,然而,慢性炎症可能对组织修复有负面影响。REDD1在炎症性疾病中发挥着多种作用[15-16]。对于免疫细胞来说,REDD1是T细胞增殖和存活所必需的[17],它能抑制流感病毒、水疱性口炎病毒[8, 18]和麻疹病毒[19]的复制。除了T细胞外,巨噬细胞和中性粒细胞的激活也需要REDD1的参与[20-21],这表明REDD1可能参与了先天和适应性免疫应答以应对感染[22]。对于上皮细胞,有报道称肺泡Ⅱ型上皮细胞中的REDD1是在内毒素应答中激活肺部炎症所必需的[23-24]。因此在REDD1如何促进炎症发展方面需要进一步研究探讨。
| [1] |
HOOI J K Y, LAI W Y, NG W K, et al. Global prevalence of Helicobacter pylori infection: systematic review and meta-analysis[J]. Gastroenterology, 2017, 153(2): 420-429. |
| [2] |
MCCOLL KE. Clinical practice. Helicobacter pylori infection[J]. N Engl J Med, 2010, 362(17): 1597-1604. |
| [3] |
LV Y P, TENG Y S, MAO F Y, et al. Helicobacter pylori-induced IL-33 modulates mast cell responses, benefits bacterial growth, and contributes to gastritis[J]. Cell Death Dis, 2018, 9(5): 457. |
| [4] |
LV Y P, CHENG P, ZHANG J Y, et al. Helicobacter pylori-induced matrix metallopeptidase-10 promotes gastric bacterial colonization and gastritis[J]. Sci Adv, 2019, 5(4): eaau6547. |
| [5] |
BRITTO F A, DUMAS K, GIORGETTI-PERALDI S, et al. Is REDD1 a metabolic double agent? Lessons from physiology and pathology[J]. Am J Physiol Cell Physiol, 2020, 319(5): C807-C824. |
| [6] |
LIPINA C, HUNDAL H S. Is REDD1 a metabolic éminence grise?[J]. Trends Endocrinol Metab, 2016, 27(12): 868-880. |
| [7] |
ANGELIDOU I, CHRYSANTHOPOULOU A, MITSIOS A, et al. REDD1/autophagy pathway is associated with neutrophil-driven IL-1β inflammatory response in active ulcerative colitis[J]. J Immunol, 2018, 200(12): 3950-3961. |
| [8] |
MATA M A, SATTERLY N, VERSTEEG G A, et al. Chemical inhibition of RNA viruses reveals REDD1 as a host defense factor[J]. Nat Chem Biol, 2011, 7(10): 712-719. |
| [9] |
AMIEVA M, PEEK R M. Pathobiology of Helicobacter pylori-induced gastric cancer[J]. Gastroenterology, 2016, 150(1): 64-78. |
| [10] |
CANALES J, VALENZUELA M, BRAVO J, et al. Helicobacter pylori induced phosphatidylinositol-3-OH kinase/mTOR activation increases hypoxia inducible factor-1α to promote loss of cyclin D1 and G0/G1 cell cycle arrest in human gastric cells[J]. Front Cell Infect Microbiol, 2017, 7: 92. |
| [11] |
KIM I J, LEE J, OH S J, et al. Helicobacter pylori infection modulates host cell metabolism through VacA-dependent inhibition of mTORC1[J]. Cell Host Microbe, 2018, 23(5): 583-593. e8. |
| [12] |
ZIMMERMANN S, PFANNKUCH L, AL-ZEER M A, et al. ALPK1- and TIFA-dependent innate immune response triggered by the Helicobacter pylori type Ⅳ secretion system[J]. Cell Rep, 2017, 20(10): 2384-2395. |
| [13] |
ODENBREIT S, PVLS J, SEDLMAIER B, et al. Translocation of Helicobacter pylori CagA into gastric epithelial cells by type Ⅳ secretion[J]. Science, 2000, 287(5457): 1497-1500. |
| [14] |
SUZUKI M, MIMURO H, KIGA K, et al. Helicobacter pylori CagA phosphorylation-independent function in epithelial proliferation and inflammation[J]. Cell Host Microbe, 2009, 5(1): 23-34. |
| [15] |
YOSHIDA T, METT I, BHUNIA A K, et al. Rtp801, a suppressor of mTOR signaling, is an essential mediator of cigarette smoke-induced pulmonary injury and emphysema[J]. Nat Med, 2010, 16(7): 767-773. |
| [16] |
OTA K T, LIU R J, VOLETI B, et al. REDD1 is essential for stress-induced synaptic loss and depressive behavior[J]. Nat Med, 2014, 20(5): 531-535. |
| [17] |
REUSCHEL E L, WANG J, SHIVERS D K, et al. REDD1 is essential for optimal T cell proliferation and survival[J]. PLoS One, 2015, 10(8): e0136323. |
| [18] |
KUSS-DUERKOP S K, WANG J, MENA I, et al. Influenza virus differentially activates mTORC1 and mTORC2 signaling to maximize late stage replication[J]. PLoS Pathog, 2017, 13(9): e1006635. |
| [19] |
TIWAREKAR V, WOHLFAHRT J, FEHRHOLZ M, et al. APOBEC3G-regulated host factors interfere with measles virus replication: role of REDD1 and mammalian TORC1 inhibition[J]. J Virol, 2018, 92(17): e00835-18. |
| [20] |
SKENDROS P, CHRYSANTHOPOULOU A, ROUSSET F, et al. Regulated in development and DNA damage responses 1 (REDD1) links stress with IL-1β-mediated familial Mediterranean fever attack through autophagy-driven neutrophil extracellular traps[J]. J Allergy Clin Immunol, 2017, 140(5): 1378-1387. |
| [21] |
IP W K E, HOSHI N, SHOUVAL D S, et al. Anti-inflammatory effect of IL-10 mediated by metabolic reprogramming of macrophages[J]. Science, 2017, 356(6337): 513-519. |
| [22] |
LEE D K, KIM J H, KIM J, et al. REDD-1 aggravates endotoxin-induced inflammation via atypical NF-κB activation[J]. FASEB J, 2018, 32(8): 4585-4599. |
| [23] |
NADON A M, PEREZ M J, HERNANDEZ-SAAVEDRA D, et al. Rtp801 suppression of epithelial mTORC1 augments endotoxin-induced lung inflammation[J]. Am J Pathol, 2014, 184(9): 2382-2389. |
| [24] |
GUPTA I, GANGULY S, ROZANAS C R, et al. Ascorbate attenuates pulmonary emphysema by inhibiting tobacco smoke and Rtp801-triggered lung protein modification and proteolysis[J]. Proc Natl Acad Sci USA, 2016, 113(29): E4208-E4217. |




