2. 400038 重庆,陆军军医大学(第三军医大学)军事预防医学系: 营养与食品卫生学教研室
2. Department of Nutrition and Food Hygiene, Faculty of Military Preventive Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038, China
线粒体自噬(mitochondrial autophagy,mitophagy)是一种基于自噬体的线粒体降解过程,是目前唯一已知的清除细胞应激(营养缺乏、活性氧、细胞衰老等)后受损或功能失调线粒体的途径,以有效调节细胞内线粒体数量和维持线粒体正常功能[1]。细胞具有多种线粒体自噬调控机制,不同的刺激可以通过不同细胞环境中的多个信号级联反应促进线粒体自噬,其调控通路主要分为泛素依赖性或非依赖性[2],前者如PINK1-Parkin通路。近期研究发现位于线粒体内膜上的一种蛋白受体——抗增殖蛋白2(Prohibitin 2,PHB2)在线粒体外膜破裂时被暴露,随后与在自噬体外部起监视作用的自噬蛋白LC3-Ⅱ相互作用,以此激活线粒体自噬[3]。随着对线粒体自噬研究的深入,研究者发现线粒体自噬与衰老以及大量的病理过程有关,如神经退行性疾病、肌病、代谢疾病、炎症和癌症[4]。因此,针对线粒体自噬的干预措施可能具有治疗潜力,一些合成或天然的化合物已被证明可以调节线粒体自噬[4-5]。二氢杨梅素(dihydromyricetin),又名双氢杨梅树皮素、白蔹素,1940年由KOTAKE和KUBOTA首次分离得到并命名为蛇葡萄素(ampelopsin)[6],是显齿蛇葡萄茎叶(藤茶)中含量极高的一类黄酮类化合物,在藤茶叶中含量可达30%[7]。二氢杨梅素具有明显的抗炎、抗氧化、抗菌、降脂、心血管保护等生物学活性[8],但其机制尚未明确。近年来,研究证实二氢杨梅素可参与多种细胞自噬信号通路的调控[9-11],另外,前期研究发现二氢杨梅素通过活化AMPK通路激活细胞自噬,上调LC3的表达,增加自噬体的形成,这将有助于PHB2暴露时与LC3相互作用激活线粒体自噬[12]。然而,二氢杨梅素能否通过PHB2调控血管内皮的线粒体自噬活性,进而维持线粒体稳态有待进一步研究。本研究以人脐静脉血管内皮细胞(human umbilical vein endothelial cells,HUVECs)为研究对象,观察二氢杨梅素对线粒体自噬的影响,探讨PHB2在其中的作用,从新的角度阐明二氢杨梅素的药理作用机制,为心血管疾病防治研究提供新的证据。
1 材料与方法 1.1 材料人脐静脉血管内皮细胞HUVECs和iCell原代内皮细胞培养体系购自上海赛百慷生物技术股份有限公司。二氢杨梅素(使用二甲基亚砜DMSO配成100 mmol/L的储备液)、氯喹(溶酶体抑制剂)和DMSO购自美国Sigma-Aldrich公司。胎牛血清(FBS)购自美国HyClone公司;胰蛋白酶购自以色列Biological Industries(BI)公司。Prohibitin 2抗体、Prohibitin 2 siRNA和control siRNA购自美国Santa Cruz公司。羰基氰化物间氯苯腙(carbonyl cyanide 3-chlorophenylhydrazone,CCCP,线粒体自噬激动剂)购自美国MedChemExpress公司。MitoTracker® Deep Red FM(MTDR)购自美国Cell Signaling Technology公司。Opti-MEMTM I减血清培养基购自美国Gibco公司。Lipofectamine2000购自美国Invitrogen公司。β-actin抗体购自北京中杉金桥公司。
1.2 细胞培养与处理HUVECs用含体积分数10% FBS和1%双抗的iCell培养基于37 ℃、5%CO2、100%湿度培养箱中培养,当HUVECs融合达80%~90%时,用胰蛋白酶消化传代。为探索二氢杨梅素对血管内皮细胞线粒体自噬的调控作用,根据文献[13-14]结果,以不同浓度(0、0.1、1、10、100 μmol/L)二氢杨梅素处理HUVECs 12 h,另以氯喹(25 μmol/L)预处理1 h后,再用不同浓度二氢杨梅素处理12 h或CCCP(10 μmol/L)处理6 h。
1.3 siRNA转染将HUVECs以1×105/孔接种于12孔板,细胞贴壁且生长达50%~70%时根据siRNA转染说明书完成转染。转染4~6 h后,更换为含10% FBS的iCell完全培养基,继续培养24 h后按分组进行处理。实验分为4组:control siRNA+氯喹组、control siRNA+氯喹+二氢杨梅素组、Prohibitin 2 siRNA+氯喹组、Prohibitin 2 siRNA+氯喹+二氢杨梅素组。
1.4 线粒体自噬检测将对数增长期的HUVECs以1×105/孔接种于12孔板。细胞贴壁且生长达70%~80%时,不同浓度二氢杨梅素(0、0.1、1、10、100 μmol/L)处理细胞或氯喹(25 μmol/L)预处理12 h后,采用一种基于流式细胞技术检测MTDR荧光强度的方法评估线粒体自噬水平[15]。具体方法如下:用胰蛋白酶消化细胞5 min,1 200 r/min离心5 min,弃上清,加入37 ℃预热的MTDR(一种广泛使用的线粒体特异性探针)染色工作液(细胞完全培养基稀释至工作浓度25 nmol/L),轻吹重悬细胞,置于细胞培养箱中孵育15 min。离心后弃上清,PBS洗涤细胞3次,最后每管用150 μL 37 ℃预热的PBS重悬混匀,过滤后运用流式细胞仪检测MTDR荧光强度。MTDR的最大激发波长和最大发射波长分别为644、665 nm。
1.5 荧光显微镜检测MTDR水平将HUVECs按1×105/孔接种于12孔板。细胞贴壁生长达70%~80%后,以不同浓度二氢杨梅素处理细胞。处理结束后,吸弃培养液,用37 ℃预热的PBS清洗1次,加入37 ℃的MTDR染色工作液,放置于细胞培养箱中孵育20 min。孵育结束后,吸弃染液,PBS清洗3次,最后每孔加入1 mL PBS,置于倒置荧光显微镜观察并拍照。
1.6 qRT-PCR检测Prohibitin 2 mRNA表达① 设计Prohibitin 2引物,正义链为5′-CTACGGTGTGCGCGAATCTGTGTT-3′,反义链为5′-CACCACA-CTCTTGAGCACCTCGTT-3′。②使用TRIzol试剂提取细胞总RNA。运用NanoDrop One/OneC微量核酸蛋白浓度测定仪(Thermo Scientific,美国)检测各组RNA浓度和D(260)/D(280)比值。③逆转录合成cDNA,按照逆转录试剂盒RevertAid first strand cDNA synthesis Kit说明书进行RNA逆转录,获得cDNA,存于-20 ℃备用。④real-time PCR反应,按照SYBR Green Master Mix说明书配制反应溶液,采用CFX-96 real-time PCR system(Bio Rad)完成反应,条件:预变性95 ℃ 30 s,95 ℃ 5 s、60 ℃ 30 s,循环40次,随后95 ℃ 1 min,60 ℃ 30 s,95 ℃ 30 s。对所得结果运用2-ΔΔCt方法分析基因的相对表达量。
1.7 Western blot检测以不同浓度二氢杨梅素处理细胞后,提取细胞总蛋白,利用BCA法检测蛋白浓度。根据蛋白浓度,以40 μg蛋白置于95 ℃中10 min变性,配制12%(质量分数)聚丙烯酰胺凝胶,完成蛋白上样、电泳,用半干式转膜法将蛋白转移至PVDF膜(0.22 μmol/L)。以TBST漂洗后置于5%的脱脂奶粉(TBST配制)中室温封闭1~2 h,转于Prohibitin 2、β-actin一抗(一抗稀释液1 ∶1 000稀释)中4 ℃孵育过夜,用TBST振摇洗膜10 min×3次;随后,将PVDF膜置于TBST稀释的二抗(1 ∶5 000)中,室温振荡孵育1 h,再用TBST振摇洗膜3次后,加入化学发光液,运用VILBER FUSION FX7成像系统显影并拍照,利用Image J软件进行条带分析。
1.8 统计学分析计量资料数据以x±s表示,应用GraphPad Prism 8软件作图并进行统计分析,两组间比较采用t检验,多组间比较采用单因素方差分析,P<0.05表示差异具有统计学意义。
2 结果 2.1 二氢杨梅素对血管内皮细胞线粒体自噬的影响与对照组(0 μmol/L二氢杨梅素)相比,当二氢杨梅素浓度≥0.1 μmol/L时,MTDR荧光强度明显降低(P<0.05,图 1)。同时,流式细胞术检测证实二氢杨梅素处理可以显著降低血管内皮细胞MTDR水平(P<0.05,图 2)。进一步以氯喹预处理抑制溶酶体功能后,二氢杨梅素(≥10 μmol/L)处理可以显著增加血管内皮细胞MTDR荧光强度(P<0.05),与线粒体自噬激动剂CCCP效应相一致(图 3)。以上结果说明二氢杨梅素能明显增强线粒体自噬。
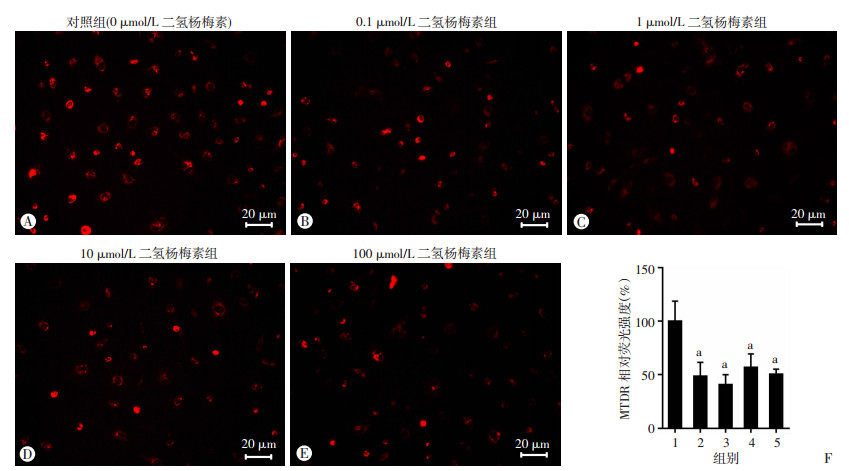
|
| A~E:荧光显微镜观察各组MTDR荧光强度;F:半定量分析 1:对照组(0 μmol/L二氢杨梅素);2:0.1 μmol/L二氢杨梅素组;3:1 μmol/L二氢杨梅素组;4:10 μmol/L二氢杨梅素组;5:100 μmol/L二氢杨梅素组;a:P<0.05,与对照组比较 图 1 二氢杨梅素对血管内皮细胞MTDR水平的影响 |
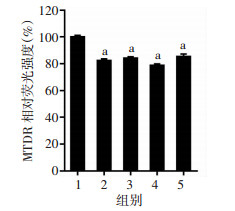
|
| 1:对照组(0 μmol/L二氢杨梅素);2:0.1 μmol/L二氢杨梅素组;3:1 μmol/L二氢杨梅素组;4:10 μmol/L二氢杨梅素组;5:100 μmol/L二氢杨梅素组;a:P<0.05,与对照组比较 图 2 流式细胞术检测二氢杨梅素对MTDR水平的影响 |
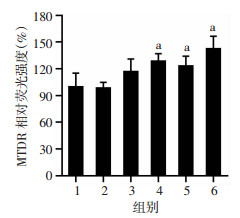
|
| 1:氯喹组;2:氯喹+0.1 μmol/L二氢杨梅素组;3:氯喹+1 μmol/L二氢杨梅素组;4:氯喹+10 μmol/L二氢杨梅素组;5:氯喹+100 μmol/L二氢杨梅素组;6:10 μmol/L CCCP+氯喹组;a:P<0.05,与氯喹(溶酶体抑制剂)组比较 图 3 二氢杨梅素对线粒体自噬水平的影响 |
2.2 二氢杨梅素对血管内皮细胞Prohibitin 2的调控作用
与对照组(0 μmol/L二氢杨梅素)相比,在较低浓度(≤10 μmol/L)二氢杨梅素处理时,Prohibitin 2蛋白表达变化不明显(P>0.05)。而当二氢杨梅素浓度为100 μmol/L时,Prohibitin 2蛋白表达显著增加(P<0.05,图 4)。
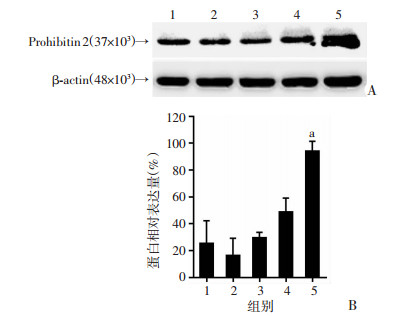
|
|
1:对照组(0 μmol/L二氢杨梅素);2:0.1 μmol/L二氢杨梅素组;3:1 μmol/L二氢杨梅素组;4:10 μmol/L二氢杨梅素组;5:100 μmol/L二氢杨梅素组;a:P<0.05,与对照组比较 A:Western blot检测Prohibitin 2蛋白表达;B:半定量分析 图 4 二氢杨梅素对血管内皮细胞Prohibitin 2蛋白表达的影响 |
同样地,与对照组(0 μmol/L二氢杨梅素)相比,在较低浓度(0.1 μmol/L) 二氢杨梅素处理时,Prohibitin 2 mRNA表达水平增加,但差异无统计学意义(P>0.05);当二氢杨梅素浓度≥1 μmol/L时,Prohibitin 2 mRNA表达水平显著增加(P<0.05,图 5)。
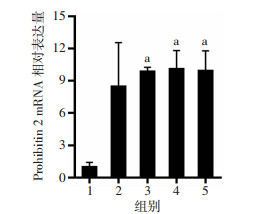
|
| 1:对照组(0 μmol/L二氢杨梅素);2:0.1 μmol/L二氢杨梅素组;3:1 μmol/L二氢杨梅素组;4:10 μmol/L二氢杨梅素组;5:100 μmol/L二氢杨梅素组;a:P<0.05,与对照组比较 图 5 二氢杨梅素对血管内皮细胞Prohibitin 2转录水平的影响 |
2.3 Prohibitin 2在二氢杨梅素调控血管内皮细胞线粒体自噬中的作用
如图 6所示,与氯喹单独处理相比,氯喹+二氢杨梅素处理可显著增加MTDR荧光强度(P<0.05);而以siRNA转染沉默Prohibitin 2后,二氢杨梅素对线粒体自噬的诱导被明显抑制(P<0.05)。
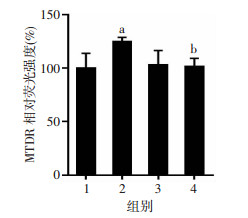
|
| 1:control siRNA+氯喹组;2:control siRNA+氯喹+二氢杨梅素组;3:Prohibitin 2 siRNA+氯喹组;4:Prohibitin 2 siRNA +氯喹+二氢杨梅素组;a:P<0.05,与control siRNA+氯喹组比较;b:P<0.05,与control siRNA+氯喹+二氢杨梅素组比较 图 6 Prohibitin 2基因沉默对二氢杨梅素诱导血管内皮细胞线粒体自噬的影响 |
3 讨论
损伤的线粒体释放活性氧中间体,诱导炎性体活化,进一步促使细胞发生焦亡[13, 16]。线粒体自噬对于减少损伤线粒体对细胞的不良影响以及真核生物的正常发育至关重要,越来越多的研究发现,线粒体自噬障碍与衰老和多种病理状况有关,例如神经退行性疾病、异常的炎症性疾病、癌症以及代谢紊乱等[2]。相反地,过表达自噬核心蛋白LC3、ATG5等能显著上调血管内皮细胞的线粒体自噬水平,并可在一定程度上延缓细胞衰老进程[17];另外,研究发现阿魏酸(Ferulic acid)能通过明显增强线粒体自噬逆转缺氧和葡萄糖剥夺导致的脑微血管内皮细胞的氧化应激,减轻线粒体功能障碍[18]。因此,积极探寻有效促线粒体自噬的药物或植物化合物具有重要的临床意义。近年来发现,二氢杨梅素能促进人脐静脉内皮细胞自噬相关蛋白LC3及Beclin-1的表达,诱导血管内皮细胞发生自噬[12],进而抑制高糖诱导的动脉粥样硬化[19];另外,二氢杨梅素可通过减少线粒体活性氧水平有效抑制血管内皮细胞NLRP3炎性体活化[13],然而,二氢杨梅素能否调控线粒体自噬及其机制尚不清楚。基于MAURO-LIZCANO等[15]开展的一项采用流式细胞技术检测线粒体自噬水平的新技术,也被用于探讨肝细胞和肾小管细胞线粒体自噬水平[20-21]。本研究首先通过荧光显微镜和流式细胞技术发现二氢杨梅素可以明显降低细胞MTDR荧光强度。鉴于线粒体自噬是唯一已知降解线粒体的途径[22],再结合前期研究证实二氢杨梅素可以有效增强内皮细胞LC3-Ⅱ表达[12],提示二氢杨梅素可能诱导了细胞线粒体自噬;随后,本研究采用溶酶体抑制剂氯喹预处理后,观察到二氢杨梅素干预的细胞MTDR荧光水平明显更高,与CCCP(线粒体自噬激动剂)效应相一致,进一步证实二氢杨梅素诱导了内皮细胞线粒体自噬的发生。
线粒体自噬是一种进化上保守的细胞过程,通过选择性去除功能失调或多余的线粒体,微调线粒体数量,保持能量代谢。线粒体自噬的选择性依赖于自噬受体的介导,目前已报道的线粒体自噬受体包括OPTN、DNP52、FUNDC1、BNIP3等[23]。这些受体主要定位于或被募集到线粒体外膜上,而后与自噬体上的LC3-Ⅱ结合介导线粒体自噬。近年研究显示,在线粒体发生去极化和蛋白酶体依赖性外膜破裂时,位于线粒体内膜的蛋白受体PHB2暴露,与在自噬体外部起监视作用的LC3-Ⅱ蛋白相互作用,激活线粒体自噬,并证实PHB2是Parkin诱导哺乳动物细胞线粒体自噬所必需的[3]。本课题组前期研究发现二氢杨梅素能通过活化AMPK通路有效上调LC3的表达,增加自噬体的形成[11-12],这将有助于PHB2暴露时与LC3相互作用,激活线粒体自噬;另外,研究表明AMPK对于PHB发挥效应具有调控作用[24],值得注意的是,另一黄酮类化合物葡萄籽原花青素B2可通过上调PHB有效减少内皮细胞凋亡,以上研究提示二氢杨梅素可能对PHB2具有调控作用。本研究进一步证实二氢杨梅素可显著增强PHB2的转录及蛋白表达,另外,通过siRNA转染沉默PHB2后,二氢杨梅素对线粒体自噬的诱导作用被明显抑制,表明PHB2在二氢杨梅素诱导血管内皮细胞线粒体自噬中发挥了关键作用。
本研究存在一定的局限性和不足。首先,本研究只初步阐明PHB2在二氢杨梅素调控线粒体自噬中发挥作用,其具体作用机制仍需深入研究。另外,目前针对线粒体自噬水平多依赖于线粒体-自噬体共定位的荧光显微镜分析以及基于线粒体蛋白和自噬标志性蛋白的蛋白质印迹进行评估,而本研究采用了一种基于流式细胞术的新方法来定量检测线粒体自噬水平[15],虽有相关研究陆续报道[20-21],但此方法是以MTDR的荧光强度表示线粒体数量,再联合溶酶体抑制剂处理,来间接反映线粒体自噬的发生与否,尚需更直接定量检测线粒体自噬水平的方法验证。即使如此,本研究结果联合了荧光显微镜观察及溶酶体抑制剂的运用,可为后续研究提供一些参考。下一步,我们将在此基础上联合运用其他检测手段深入探讨,并将重点围绕二氢杨梅素对PHB2及其介导的线粒体自噬的具体调控机制展开研究,为二氢杨梅素的心血管干预研究提供新的实验依据。
| [1] |
LAHIRI V, KLIONSKY D J. PHB2/prohibitin 2: an inner membrane mitophagy receptor[J]. Cell Res, 2017, 27(3): 311-312. |
| [2] |
PALIKARAS K, LIONAKI E, TAVERNARAKIS N. Mechanisms of mitophagy in cellular homeostasis, physiology and pathology[J]. Nat Cell Biol, 2018, 20(9): 1013-1022. |
| [3] |
WEI Y J, CHIANG W C, SUMPTER R Jr, et al. Prohibitin 2 is an inner mitochondrial membrane mitophagy receptor[J]. Cell, 2017, 168(1/2): 224-238. |
| [4] |
PALIKARAS K, DASKALAKI I, MARKAKI M, et al. Mitophagy and age-related pathologies: Development of new therapeutics by targeting mitochondrial turnover[J]. Pharmacol Ther, 2017, 178: 157-174. |
| [5] |
GEORGAKOPOULOS N D, WELLS G, CAMPANELLA M. The pharmacological regulation of cellular mitophagy[J]. Nat Chem Biol, 2017, 13(2): 136-146. |
| [6] |
周天达, 周雪仙. 藤茶中双氢黄酮醇的分离、结构鉴定及其药理活性[J]. 中国药学杂志, 1996, 31(8): 10-13. ZHOU T D, ZHOU X X. Isolation, structure determination and pharmacological activity of flavanonol from Ampelopsis grosedentata[J]. Chin Pharm J, 1996, 31(8): 10-13. |
| [7] |
陈夏静, 姚汉玲, 张秋琼, 等. 大叶蛇葡萄中蛇葡萄素含量的高效液相色谱法测定[J]. 时珍国医国药, 2010, 21(5): 1053-1054. CHEN X J, YAO H L, ZHANG Q Q, et al. Content determination of ampelopsin in Ampelopsis megalophylla by HPLC[J]. Lishizhen Med Mater Med Res, 2010, 21(5): 1053-1054. |
| [8] |
CHEN J, WANG X, XIA T, et al. Molecular mechanisms and therapeutic implications of dihydromyricetin in liver disease[J]. Biomed Pharmacother, 2021, 142: 111927. |
| [9] |
ZHOU X, YU L, ZHOU M, et al. Dihydromyricetin ameliorates liver fibrosis via inhibition of hepatic stellate cells by inducing autophagy and natural killer cell-mediated killing effect[J]. Nutr Metab (Lond), 2021, 18(1): 64. |
| [10] |
GUO L, TAN K, LUO Q, et al. Dihydromyricetin promotes autophagy and attenuates renal interstitial fibrosis by regulating miR-155-5p/PTEN signaling in diabetic nephropathy[J]. Bosn J Basic Med Sci, 2020, 20(3): 372-380. |
| [11] |
SHI L Y, ZHANG T, LIANG X Y, et al. Dihydromyricetin improves skeletal muscle insulin resistance by inducing autophagy via the AMPK signaling pathway[J]. Mol Cell Endocrinol, 2015, 409: 92-102. |
| [12] |
LIANG X Y, ZHANG T, SHI L Y, et al. Ampelopsin protects endothelial cells from hyperglycemia-induced oxidative damage by inducing autophagy via the AMPK signaling pathway[J]. BioFactors, 2015, 41(6): 463-475. |
| [13] |
HU Q, ZHANG T, YI L, et al. Dihydromyricetin inhibits NLRP3 inflammasome-dependent pyroptosis by activating the Nrf2 signaling pathway in vascular endothelial cells[J]. Biofactors, 2018, 44(2): 123-136. |
| [14] |
侯小龙. 二氢杨梅素保护内皮细胞、抑制炎症反应的抗动脉粥样硬化作用及机制研究[D]. 武汉: 华中科技大学, 2015. HOU X L. Dihydromyricetin prevents atherosclerosis by protecting endothelial cells and inhibiting inflammatory reaction and the underlying mechanisms[D]. Wuhan: Huazhong University of Science and Technology, 2015. |
| [15] |
MAURO-LIZCANO M, ESTEBAN-MARTÍNEZ L, SECO E, et al. New method to assess mitophagy flux by flow cytometry[J]. Autophagy, 2015, 11(5): 833-843. |
| [16] |
ZHOU R B, YAZDI A S, MENU P, et al. A role for mitochondria in NLRP3 inflammasome activation[J]. Nature, 2011, 469(7329): 221-225. |
| [17] |
MAI S, MUSTER B, BEREITER-HAHN J, et al. Autophagy proteins LC3B, ATG5 and ATG12 participate in quality control after mitochondrial damage and influence lifespan[J]. Autophagy, 2012, 8(1): 47-62. |
| [18] |
CHEN J L, DUAN W J, LUO S, et al. Ferulic acid attenuates brain microvascular endothelial cells damage caused by oxygen-glucose deprivation via punctate-mitochondria-dependent mitophagy[J]. Brain Res, 2017, 1666: 17-26. |
| [19] |
陈璐, 周洁, 廖慧颖, 等. 二氢杨梅素对高脂诱导动脉粥样硬化兔自噬相关蛋白表达的影响[J]. 临床心血管病杂志, 2016, 32(6): 624-629. CHEN L, ZHOU J, LIAO H Y, et al. Effect of dihydromyricetin on expression of autophagy related protein in atherosclerosis rabbits[J]. J Clin Cardiol, 2016, 32(6): 624-629. |
| [20] |
LU X, XUAN W, LI J, et al. AMPK protects against alcohol-induced liver injury through UQCRC2 to up-regulate mitophagy[J]. Autophagy, 2021, 17(11): 3622-3643. |
| [21] |
FU Z J, WANG Z Y, XU L, et al. HIF-1alpha-BNIP3-mediated mitophagy in tubular cells protects against renal ischemia/reperfusion injury[J]. Redox Biol, 2020, 36: 101671. |
| [22] |
ASHRAFI G, SCHWARZ T L. The pathways of mitophagy for quality control and clearance of mitochondria[J]. Cell Death Differ, 2013, 20(1): 31-42. |
| [23] |
YAN C J, GONG L L, CHEN L, et al. PHB2 (prohibitin 2) promotes PINK1-PRKN/Parkin-dependent mitophagy by the PARL-PGAM5-PINK1 axis[J]. Autophagy, 2020, 16(3): 419-434. |
| [24] |
ARTAL-SANZ M, TAVERNARAKIS N. Prohibitin couples diapause signalling to mitochondrial metabolism during ageing in C. elegans[J]. Nature, 2009, 461(7265): 793-797. |




