2. 400038 重庆,陆军军医大学(第三军医大学)高原军事医学系:高原生理学与病理学教研室;
3. 400038 重庆,陆军军医大学(第三军医大学)高原军事医学系:极端环境医学教育部重点实验室
2. Department of High Altitude Physiology and Pathology, Army Medical University (Third Military Medical University), Chongqing, 400038, China;
3. Key Laboratory of Extreme Environmental Medicine of Ministry of Education, Army Medical University (Third Military Medical University), Chongqing, 400038, China
缺氧性肺动脉高压(hypoxic pulmonary artery hypertension,HPH)是一组由缺氧引起的肺动脉压力持续增高并伴有右心室肥大的慢性进行性疾病[1-4]。以肺远端中小动脉血管壁增厚为特征的肺血管重建是其主要的结构变化及重要的致病机理。缺氧条件下肺动脉平滑肌细胞过度增殖是肺血管重建的关键环节,在缺氧性肺动脉高压的发生、发展中起着重要作用[5-6]。因此,研究缺氧引起肺动脉平滑肌细胞增殖的机制对防治缺氧性肺动脉高压起着至关重要的作用。近年越来越多的文献报道,肺动脉高压的发生发展与炎症密切相关[7-10],肺血管周围炎症程度与肺动脉高压的血流动力学、肺血管重建和临床结果相关[11],提示缺氧条件下的炎症是缺氧性肺血管重建的关键因素;但是炎症参与缺氧性肺血管重塑的具体分子机制仍待进一步阐明。
缺氧可激活Toll样受体-9(toll-like receptor 9,TLR9)介导的炎症通路;亦可导致线粒体功能不足或受损,尤其是骨骼肌、心肌、脑等组织中的线粒体结构、功能受损更明显[12-14]。损伤后的线粒体释放包括线粒体DNA在内的多种内容物到细胞质或细胞外。线粒体DNA是一类重要的线粒体来源的损伤相关分子模式,含有大量与细菌DNA类似的未甲基化CpG序列,能被TLR9等多种受体识别,进而激活炎症通路[15]。细胞自噬溶酶体中的TLR9识别线粒体DNA后激活的炎症反应不仅参与了包括动脉粥样硬化[16]、左心衰[17]、自发性高血压[18]、非酒精性脂肪性肝炎[19]、急性肾损伤[20]、血管炎[21]在内的一系列心血管疾病的发生,还在肿瘤细胞的异常增殖中发挥重要作用。有研究[22]指出:缺氧时肝癌细胞中的TLR9表达增高从而促进肝癌细胞增殖。缺氧性肺动脉高压是一种缺氧条件下以肺动脉平滑肌异常增殖为关键致病机制的肺血管疾病,我们假设TLR9可能在其发生、发展中发挥着重要作用。因此,本研究以大鼠肺动脉平滑肌细胞(rat pulmonary artery smooth muscle cells,RPASMCs)为研究对象,通过缺氧诱导细胞增殖,应用小干扰RNA等技术探索TLR9在缺氧诱导的RPASMCs增殖中的作用和机制。
1 材料与方法 1.1 材料 1.1.1 细胞原代RPASMCs购买自齐氏(上海)生物科技有限公司。胎牛血清购自美国HyClone公司;DMEM/F-12培养基购自广州鼎国生物技术有限公司(GF3115),细胞冻存液购自广州赛业生物科技有限公司,PBS购自北京中杉金桥生物技术有限公司,胰蛋白酶EDTA消化液购自美国HyClone公司。
1.1.2 主要试剂和仪器小干扰RNA序列和阴性对照(negative control,NC)序列均购自上海吉玛制药技术有限公司,TLR9干扰序列的靶序列为GCUCCACACGCUGCACCUUTT。Lipofectamine RNAiMAX (货号:13778 150)、Opti-MEM Ⅰ减血清培养基(货号:31985062)均购自美国Thermo Fisher Scientific公司。TLR9激动剂CpG ODN1826购自美国InvivoGen公司(货号:tlrl-1826),JNK小分子抑制剂SP600125(货号:HY-12041)购自MCE。TLR9抗体(货号:ab62577)、JNK(货号:ab208035)、p-JNK抗体(货号:ab76572)均购自英国Abcam公司;α-Tubulin(货号:2125s)抗体购自美国CST公司。PBS、TBS、封闭蛋白干粉购自博士德公司;细胞组织裂解液(RIPA)、PMSF、磷酸酶抑制剂、BCA蛋白浓度测定试剂盒、辣根过氧化物酶标记的山羊抗兔IgG均购自碧云天公司;RNA提取试剂盒(货号:R6834 02)购自美国OMEGA公司,反转录试剂盒和SYBR Green试剂购自日本TaKaRa公司,大鼠TLR9上游引物5′-CGAGTGCTTGATGTGGGTGG-3′,下游引物5′-TTGGAGTTCAGCGAGTGGAGA-3′,大鼠β-actin上游引物5′-CTAAGGCCAACCGTGAAAAGAT-3′,下游引物5′-ACCAGAGGCATACAGGGACAAC-3′,引物由美国Invitrogen公司设计合成。MTT试剂购自碧云天公司。低氧工作站购自英国Baker Ruskinn公司。
1.2 方法 1.2.1 细胞培养RPASMCs采用含10%胎牛血清的DMEM/F-12培养基常规培养,细胞置于常氧(体积分数21% O2、5% CO2、74% N2的混合气体,37 ℃)培养箱中培养。每2~3天换液传代,取对数生长期细胞用于实验。
1.2.2 细胞饥饿及缺氧处理低血清饥饿培养细胞能将细胞阻滞于G0/G1期,起到同步化细胞周期的作用[23]。为更好地体现缺氧对RPASMCs增殖的影响,所有实验在细胞缺氧处理前均对其进行低血清饥饿处理:RPASMC种板后,用含10%胎牛血清的DMEM/F-12培养基培养,待其贴壁稳定生长后换液,用含0.2%胎牛血清的DMEM/F-12培养基饥饿培养12 h后换液,用含10%胎牛血清的DMEM/F-12培养基继续培养,进行后续缺氧或给药处理。3% O2缺氧处理:将经过相应处理后的细胞置于3% O2低氧工作站(体积分数3% O2、5% CO2、92% N2的混合气体,37℃)培养36 h。
1.2.3 实验分组体外培养原代RPASMCs,常氧(21% O2)或缺氧(3% O2)处理36 h,实验分组如下:①构建缺氧诱导细胞增殖模型,细胞分为2组:常氧组和缺氧组。以下干预实验均在细胞缺氧条件下进行。②使用siRNA敲低TLR9表达,细胞分为2组:si-NC(阴性对照)组和si-TLR9组。③给予TLR9激动剂CpG ODN1826细胞(20 μmol/L,36 h)分为2组:缺氧组、缺氧+TLR9激动剂组。④采用JNK抑制剂SP600125处理细胞(5 μmol/L,36 h)分为2组:缺氧组、缺氧+JNK抑制剂组。⑤TLR9激动剂CpG ODN1826复合JNK抑制剂SP600125处理RPASMCs分为3组:缺氧组、缺氧+TLR9激动剂组(20 μmol/L CpG ODN1826,36 h)、缺氧+TLR9激动剂+JNK抑制剂组(20 μmol/L CpG ODN1826 + 5 μmol/L SP600125,36 h)。所有实验均独立重复3次。
1.2.4 荧光定量PCR检测TLR9的mRNA表达水平用RNA提取试剂盒提取细胞总RNA,测定RNA浓度和纯度,用总量1 μg的RNA反转录得到cDNA后,以cDNA为模板,根据Taq PCR Master Mix试剂盒说明书,在iQTM SYBR Green Supermix PCR体系中进行qPCR反应,反应体系总体积为10 μL。PCR反应程序为:95 ℃预变性3 min,95 ℃变性10 s,55 ℃退火30 s,72 ℃延伸60 s,共进行39个循环,结果选用2-ΔΔCt法分析TLR9相对定量数据。实验独立重复3次。
1.2.5 Western blot检测蛋白表达量收取以上各组细胞,加入适量RIPA强裂解液+PMSF+磷酸酶抑制剂,低温超声,离心收取细胞总蛋白,BCA试剂盒测蛋白浓度。将总蛋白与5×loading buffer 4 ∶1混匀,100 ℃变性10 min,-80 ℃保存。每泳道取30 μg蛋白进行SDS-PAGE电泳,电泳结束后恒压电转至PVDF膜上,5%脱脂牛奶封闭1.5 h,TLR9(1 ∶1 000),JNK(1 ∶2 000),p-JNK(1 ∶500),α-Tubulin(1 ∶1 000)一抗分别与相应蛋白条带孵育,4 ℃摇床过夜,TBST洗3次,10 min/次,二抗(1 ∶2 000)37 ℃孵育2 h,TBST洗3次,10 min/次。化学发光法显影,分析结果。实验独立重复3次。
1.2.6 MTT法检测细胞活率将细胞按每孔3×103接种于96孔板施加实验处理因素结束后,吸净每孔中培养基,每孔再加入20 μL 5 mg/mL MTT和80 μL培养基,继续培养4 h,吸净孔内液体,每孔加入150 μL DMSO,置于37 ℃孵箱10 min,溶解甲臜,酶标仪于490 nm处检测光密度值D(490)。设调零孔:既无细胞也不给药的孔。设对照孔:有细胞但不给药的孔。所有组设5个平行复孔。细胞活率=[D(490)处理组-D(490)调零孔]/[D(490)对照组-D(490)调零孔]。以细胞活率反映相对细胞相对增殖水平。实验独立重复3次。
1.2.7 小干扰RNA转染RPASMCs将siRNA配成20 μmol/L的工作液,以6孔板为例(96孔板按比例计算),取450 μL Opti-MEM血清,加入5 μL siRNA工作液,7.5 μL Lipofectamine RNAiMAX,混匀后室温静置10 min,然后加入细胞孔中,培养箱内继续培养36 h后,换液,进行后续相应处理及检测。实验独立重复3次。
1.3 统计学分析不同组间的细胞的相对增殖水平、蛋白相对表达量、mRNA相对表达量均为计量资料,均以x±s表示。应用SPSS 18.0统计软件进行分析。两组间平均数差异比较采用独立样本t检验,多组间差异比较采用方差分析。检验水准α=0.05。
2 结果 2.1 缺氧上调TLR9蛋白表达和JNK磷酸化水平、促进RPASMCs增殖Western blot结果显示:与常氧对照组相比,缺氧组TLR9蛋白的表达量显著增加(图 1A、B,t=4.528,P<0.05),JNK磷酸化增多(图 1C、D,t=6.416,P<0.01)。MTT结果显示,缺氧组细胞相对增殖水平显著高于常氧对照组(图 1E,t=5.634,P<0.01)。表明3% O2缺氧处理RPASMCs 36 h能诱导其增殖,同时上调TLR9和p-JNK蛋白的表达,提示TLR9、JNK可能参与缺氧诱导的大鼠肺动脉平滑肌细胞的增殖。
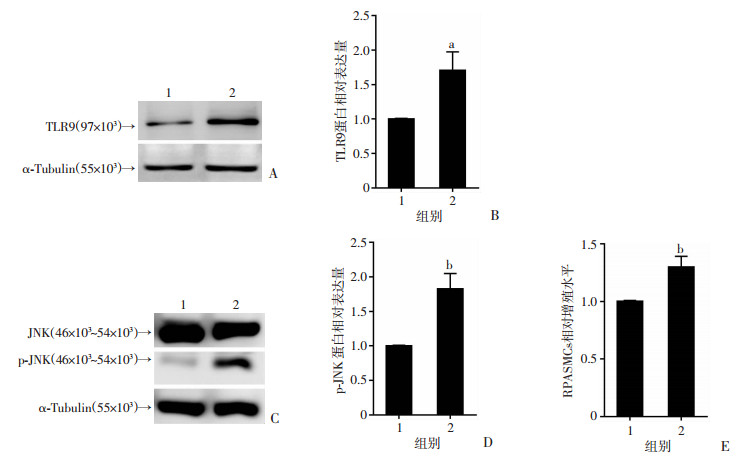
|
| A:Western blot检测缺氧对TLR9蛋白表达的影响;B:TLR9半定量分析结果;C:Western blot检测缺氧对JNK磷酸化的影响;D:p-JNK半定量分析;E:MTT检测两组细胞相对增殖水平 1:常氧组;2:缺氧组;a:P<0.05,b:P<0.01,与常氧组比较 图 1 缺氧对RPASMCs TLR9、p-JNK蛋白表达量和相对增殖水平的影响 |
2.2 敲低TLR9下调JNK磷酸化水平,抑制缺氧时RPASMCs的增殖
为探究TLR9是否参与缺氧诱导RPASMCs增殖,我们使用TLR9特异性siRNA下调RPASMCs中TLR9的表达,MTT法检测下调TLR9对缺氧引起的细胞增殖的影响。荧光定量PCR结果显示,与NC组相比,si-TLR9组细胞缺氧后TLR9 mRNA显著减少(图 2A,t=39.21,P<0.001);Western blot结果显示,si-TLR9显著减少细胞缺氧后TLR9蛋白的表达量(图 2B、C,t=9.711,P<0.001),且减少JNK磷酸化水平(图 2D、E,t=55.21,P<0.001);MTT结果显示,敲低TLR9后,RPASMCs增殖受到显著抑制(图 2F,t=5.989,P<0.01)。结果显示缺氧诱导的TLR9表达上调促进了RPASMCs的增殖,并且TLR9可正向调控JNK的磷酸化,但是TLR9是否通过p-JNK途径参与RPASMCs的增殖尚需进一步研究。
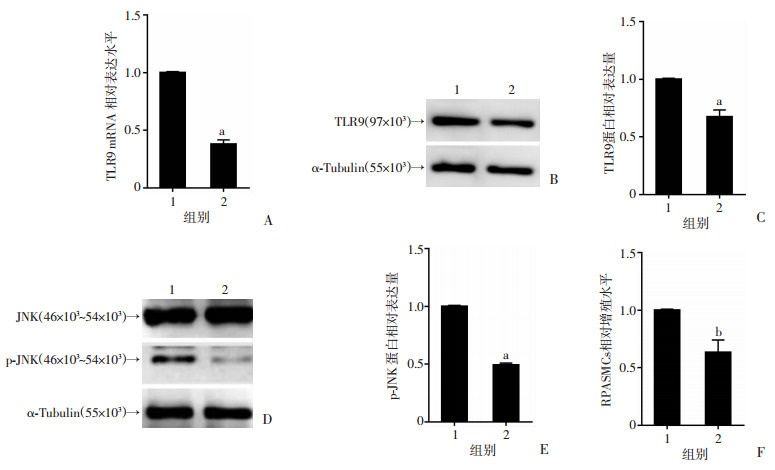
|
| A:荧光定量PCR检测siRNA对TLR9 mRNA水平的敲低效果;B:Western blot检测siRNA对TLR9蛋白水平的敲低效果;C:TLR9半定量结果;D: Western blot检测siRNA敲低TLR9对p-JNK蛋白表达的影响;E:敲低TLR9后p-JNK蛋白半定量结果;F:MTT检测敲低TLR9对RPASMCs增殖的影响 1:si-NC组,2:si-TLR9组;a:P<0.001,b:P<0.01,与si-NC组比较 图 2 siRNA敲低TLR9对RPASMCs JNK磷酸化和相对增殖水平的影响 |
2.3 TLR9激动剂增加JNK磷酸化,促进缺氧时RPASMCs的增殖
为进一步明确TLR9参与对缺氧诱导的RPASMCs增殖的调控,我们在3% O2缺氧条件下,使用TLR9激动剂CpG-ODN1826处理RPASMCs 36 h,检测其对细胞增殖的影响。Western blot和MTT结果分别显示,与单纯缺氧对照组相比,缺氧+TLR9激动剂组细胞中JNK磷酸化增加(图 3A、B,t=4.725,P<0.01),且细胞增殖显著增强(图 3C,t=18.40,P<0.001)。结果提示:TLR9激动剂CpG-ODN1826增强了TLR9下游JNK的磷酸化和缺氧条件下RPASMCs的增殖,进一步证实了TLR9参与调控缺氧诱导的RPASMCs增殖。
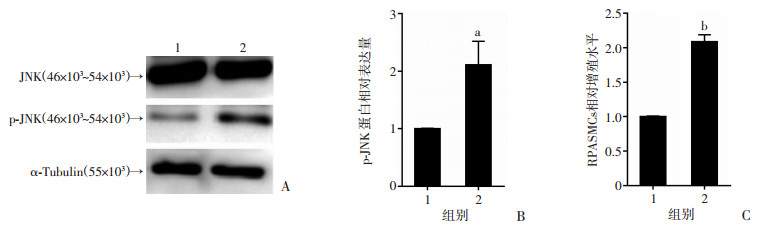
|
| A:Western blot检测TLR9激动剂对JNK磷酸化的影响;B:p-JNK半定量结果;C:MTT法检测两组RPASMCs的相对增殖水平 1:缺氧组;2:缺氧+TLR9激动剂组;a:P<0.01,b:P<0.001,与缺氧组比较 图 3 TLR9激动剂对RPASMCs JNK磷酸化和相对增殖水平的影响 |
2.4 JNK抑制剂SP600125抑制缺氧时RPASMCs的增殖
为明确TLR9是否通过JNK调控缺氧RPASMCs的增殖,我们首先研究了JNK蛋白是否也参与缺氧时RPASMCs增殖,我们在3% O2缺氧条件下使用JNK小分子抑制剂SP600125处理RPASMCs 36 h,检测JNK磷酸化水平和细胞的增殖水平。结果显示:与缺氧组相比,缺氧+JNK抑制剂组JNK的磷酸化减少(图 4A、B,t=4.563,P<0.01),RPASMCs相对增殖水平降低(图 4C,t=7.598,P<0.05)。结果证明JNK抑制剂抑制细胞增殖,JNK参与调控缺氧时RPASMCs的增殖。
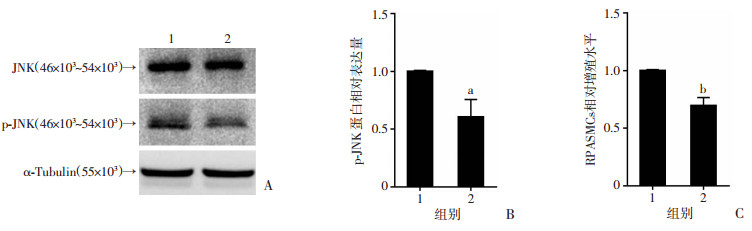
|
| A:Western blot检测JNK抑制剂对JNK磷酸化的影响;B:p-JNK半定量结果;C:MTT法检测两组RPASMCs的相对增殖水平 1:缺氧组;2:缺氧组+JNK抑制剂组;a:P<0.05,b:P<0.01,与缺氧组比较 图 4 JNK抑制剂对RPASMCs JNK磷酸化和相对增殖水平的影响 |
2.5 JNK抑制剂SP6001265抑制TLR9激动剂对RPASMCs的促增殖作用
为了证明TLR9通过激活JNK来调控缺氧时RPASMCs的增殖,我们在3% O2缺氧条件下,使用TLR9激动剂CpG-ODN1826复合JNK抑制剂SP600125处理RPASMCs,检测细胞JNK磷酸化水平和相对增殖水平。结果显示,与缺氧对照组相比,缺氧+ TLR9激动剂组细胞JNK磷酸化增加(图 5A、B,q=4.393,P<0.05),细胞增殖增强(图 5C,q=14.98,P<0.001),与前述实验结果一致;与缺氧+TLR9激动剂组相比,缺氧+TLR9激动剂+JNK抑制剂组细胞的p-JNK蛋白表达量减少(图 5A、B,q=5.742,P<0.05),细胞增殖受到显著抑制(图 5C,q=11.58,P<0.001)。结果显示JNK抑制剂能减弱TLR9激动剂对细胞的促增殖作用,证明p-JNK作为TLR9的下游效应分子参与调控缺氧时RPASMCs的增殖,TLR9-JNK通路参与缺氧诱导的RPASMCs增殖。
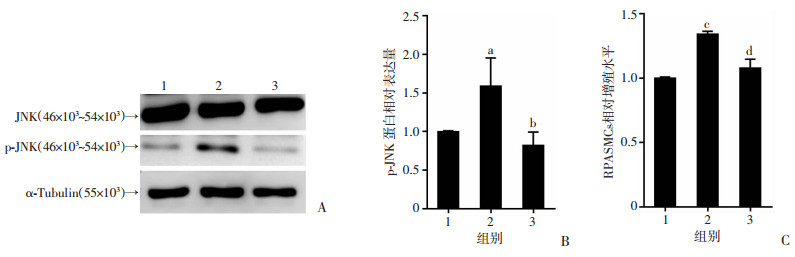
|
| A:Western blot检测3组细胞p-JNK蛋白表达;B:p-JNK半定量结果;C:MTT法检测3组细胞的相对增殖水平 1:缺氧组;2:缺氧+TLR9激动剂组;3:缺氧+TLR9激动剂+JNK抑制剂组;a:P<0.05,c:P<0.001,与缺氧组比较;b:P<0.05,d:P<0.001,与缺氧+TLR9激动剂组比较 图 5 TLR9激动剂复合JNK抑制剂对RPASMCs JNK磷酸化和相对增殖水平的影响 |
3 讨论
高原缺氧等恶劣环境可以引起缺氧性肺动脉高压、高原心脏病,严重威胁高原居民和官兵的生命健康。目前,缺氧性肺动脉高压尚无特效的治疗措施,其原因在于引起缺氧性肺动脉高压的分子机制尚不清楚。
多项研究报道了TLRs参与肺动脉高压的形成,提示TLRs在肺动脉高压的发生中起着重要作用。BAUER等[24]发现TLR4参与慢性缺氧引起的肺动脉高压:在小鼠中敲除TLR4,有效降低了肺动脉压力和肺血管壁厚度。另有研究报道,HMGB1/TLR4通过抑制BMPR2通路促进大鼠缺氧性肺动脉高压的发生[25]。FARKAS等[26]发现,减少TLR3的表达可促进内皮细胞凋亡和肺血管重构。XIAO等[27]通过转录组学分析证实了野百合碱诱导的大鼠肺动脉高压模型中TLR2表达升高。另有研究表明,在利用血红蛋白诱导的肺血管内皮细胞损伤模型中,受损伤的内皮细胞中的TLR9激活,通过IL-6促进肺动脉平滑肌的增殖和迁移[28];ISHIKAWA等[29]发现,TLR9可通过活化NF-κB-IL-6通路参与野百合碱诱导的肺动脉高压的发生,抑制TLR9可以降低肺动脉压力、逆转肺血管周围炎症。
然而TLR9是否参与缺氧性肺血管重塑进而参与缺氧性肺动脉高压的发生尚待阐明。本研究发现,缺氧诱导RPASMCs增殖的同时上调了TLR9的蛋白表达,下调TLR9表达后抑制了缺氧条件下RPASMCs的增殖,而使用TLR9激动剂活化TLR9后,则进一步促进缺氧诱导的平滑肌细胞增殖,实验证实了TLR9参与调控缺氧诱导的RPASMCs增殖。
JNK又被称为应激活化蛋白激酶,是哺乳类细胞中MAPK信号通路的一个亚类,在细胞周期、增殖、凋亡和细胞应激等多种细胞生命活动中发挥重要作用。JNK与肺动脉高压也有密切关系。有研究表明,JNK和P38途径可促进肺动脉高压患者的肺动脉平滑肌细胞的过度增生[30];在小牛缺氧性肺动脉高压模型中,缺氧可通过PDGFβ受体-JNK途径促进肺血管纤维母细胞增殖[31];DAS等[32]的研究发现,JNK参与了小鼠缺氧性肺动脉高压中肺血管的重构。与文献报道一致,本研究中,缺氧时,RPASMCs增殖增加,JNK磷酸化增加,而使用JNK抑制剂可减少其磷酸化,降低细胞增殖水平,证明JNK参与缺氧诱导RPASMCs增殖。
JNK的磷酸化受到包括TLR9在内的多种上游分子调控。在本研究中,缺氧条件下TLR9蛋白以及磷酸化的JNK均增多,使用小干扰RNA敲低TLR9,JNK磷酸化水平降低,而使用TLR9激动剂活化TLR9,JNK磷酸化水平增高,这说明缺氧时TLR9可调控JNK磷酸化。为进一步证明TLR9是通过JNK来调控缺氧时RPASMCs的增殖,我们在缺氧条件下使用上游分子TLR9的激动剂上调TLR9活性的同时给予下游分子JNK的抑制剂处理细胞,结果提示p-JNK作为TLR9的下游效应分子参与对缺氧引起RPASMCs增殖的调控,以此证明了TLR9-JNK信号轴调控缺氧诱导RPASMCs增殖。但要明确TLR9-JNK通路在缺氧性肺血管重塑及缺氧性肺动脉高压中的作用,尚需进一步的动物实验。
总之,本研究发现TLR9-JNK通路正向调控缺氧引起的大鼠肺动脉平滑肌细胞增殖,提示TLR9在缺氧性肺动脉高压中发挥重要作用,为进一步深入研究TLR9参与缺氧性肺动脉高压发生的具体分子机制奠定了实验基础,同时也提示TLR9可能成为防治缺氧性肺动脉高压的新靶点。
| [1] |
高钰琪. 高原军事医学[M]. 重庆: 重庆出版社, 2005: 54-74. GAO Y Q. Plateau military medicine[M]. Chongqing: Chongqing Publishing House, 2005: 54-74. |
| [2] |
HUMBERT M, GUIGNABERT C, BONNET S, et al. Pathology and pathobiology of pulmonary hypertension: state of the art and research perspectives[J]. Eur Respir J, 2019, 53(1): 1801887. |
| [3] |
THENAPPAN T, ORMISTON M L, RYAN J J, et al. Pulmonary arterial hypertension: pathogenesis and clinical management[J]. BMJ, 2018, 360: j5492. |
| [4] |
DODSON M W, BROWN L M, ELLIOTT C G. Pulmonary arterial hypertension[J]. Heart Fail Clin, 2018, 14(3): 255-269. |
| [5] |
TUDER R M. Pulmonary vascular remodeling in pulmonary hypertension[J]. Cell Tissue Res, 2017, 367(3): 643-649. |
| [6] |
SHIMODA L A, LAURIE S S. Vascular remodeling in pulmonary hypertension[J]. J Mol Med Berlin Ger, 2013, 91(3): 297-309. |
| [7] |
ULRICH S, NICOLLS M R, TARASEVICIENE L, et al. Increased regulatory and decreased CD8+ cytotoxic T cells in the blood of patients with idiopathic pulmonary arterial hypertension[J]. Respiration, 2008, 75(3): 272-280. |
| [8] |
BALABANIAN K, FOUSSAT A, DORFMULLER P, et al. CX(3)C chemokine fractalkine in pulmonary arterial hypertension[J]. Am J Respir Crit Care Med, 2002, 165(10): 1419-1425. |
| [9] |
ULRICH S, TARASEVICIENE-STEWART L, HUBER L C, et al. Peripheral blood B lymphocytes derived from patients with idiopathic pulmonary arterial hypertension express a different RNA pattern compared with healthy controls: a cross sectional study[J]. Respir Res, 2008, 9: 20. |
| [10] |
PERROS F, DORFMULLER P, SOUZA R, et al. Dendritic cell recruitment in lesions of human and experimental pulmonary hypertension[J]. Eur Respir J, 2007, 29(3): 462-468. |
| [11] |
STACHER E, GRAHAM B B, HUNT J M, et al. Modern age pathology of pulmonary arterial hypertension[J]. Am J Respir Crit Care Med, 2012, 186(3): 261-272. |
| [12] |
罗勇军, 刘福玉, 后显华, 等. 移居高原早期中性粒细胞的线粒体形态学变化[J]. 西南国防医药, 2011, 21(1): 12-14. LUO Y J, LIU F Y, HOU X H, et al. Early morphologic changes of neutrophil mitochondria in healthy young men after high-altitude migration[J]. Med J Natl Defending Forces Southwest China, 2011, 21(1): 12-14. |
| [13] |
蔡明春, 柳君泽. 大鼠缺氧过程中脑线粒体超微结构变化及形态计量学研究[J]. 高原医学杂志, 2000, 10(2): 12-14, 66. CAI M C, LIU J Z. Study on ultrastructural changes and morphometrics of brain mitochondria during hypoxia in rats[J]. J High Alt Med, 2000, 10(2): 12-14, 66. |
| [14] |
蔡明春, 黄庆愿, 高钰琪. 缺氧及缺氧复合运动大鼠骨骼肌线粒体功能的变化[J]. 西南国防医药, 2008, 18(4): 482-484. CAI M C, HUANG Q Y, GAO Y Q. Effects of training in hypobaric hypoxia on rat muscle mitochondrial function[J]. Med J Natl Defending Forces Southwest China, 2008, 18(4): 482-484. |
| [15] |
BANOTH B, CASSEL S L. Mitochondria in innate immune signaling[J]. Transl Res, 2018, 202: 52-68. |
| [16] |
ZHANG Z Y, MENG P, HAN Y J, et al. Mitochondrial DNA-LL-37 complex promotes atherosclerosis by escaping from autophagic recognition[J]. Immunity, 2015, 43(6): 1137-1147. |
| [17] |
OKA T, HIKOSO S, YAMAGUCHI O, et al. Mitochondrial DNA that escapes from autophagy causes inflammation and heart failure[J]. Nature, 2012, 485(7397): 251-255. |
| [18] |
MCCARTHY C G, WENCESLAU C F, GOULOPOULOU S, et al. Circulating mitochondrial DNA and Toll-like receptor 9 are associated with vascular dysfunction in spontaneously hypertensive rats[J]. Cardiovasc Res, 2015, 107(1): 119-130. |
| [19] |
GARCIA-MARTINEZ I, SANTORO N, CHEN Y, et al. Hepatocyte mitochondrial DNA drives nonalcoholic steatohepatitis by activation of TLR9[J]. J Clin Invest, 2016, 126(3): 859-864. |
| [20] |
HAN S J, LI H, KIM M, et al. Kidney proximal tubular TLR9 exacerbates ischemic acute kidney injury[J]. J Immunol, 2018, 201(3): 1073-1085. |
| [21] |
HOLLE J U, WINDMOLLER M, LANGE C, et al. Toll-like receptor TLR2 and TLR9 ligation triggers neutrophil activation in granulomatosis with polyangiitis[J]. Rheumatology (Oxford), 2013, 52(7): 1183-1189. |
| [22] |
LIU Y, YAN W, TOHME S, et al. Hypoxia induced HMGB1 and mitochondrial DNA interactions mediate tumor growth in hepatocellular carcinoma through Toll-like receptor 9[J]. J Hepatol, 2015, 63(1): 114-121. |
| [23] |
TONG J J, SUN D D, YANG C, et al. Serum starvation and thymidine double blocking achieved efficient cell cycle synchronization and altered the expression of p27, p53, bcl-2 in canine breast cancer cells[J]. Res Vet Sci, 2016, 105: 10-14. |
| [24] |
BAUER E M, SHAPIRO R, ZHENG H, et al. High mobility group box 1 contributes to the pathogenesis of experimental pulmonary hypertension via activation of Toll-like receptor 4[J]. Mol Med, 2013, 18: 1509-1518. |
| [25] |
WANG J, TIAN X T, PENG Z, et al. HMGB1/TLR4 promotes hypoxic pulmonary hypertension via suppressing BMPR2 signaling[J]. Vascul Pharmacol, 2019, 117: 35-44. |
| [26] |
FARKAS D, THOMPSON A A R, BHAGWANI A R, et al. Toll-like receptor 3 is a therapeutic target for pulmonary hypertension[J]. Am J Respir Crit Care Med, 2019, 199(2): 199-210. |
| [27] |
XIAO G, ZHUANG W, WANG T, et al. Transcriptomic analysis identifies Toll-like and Nod-like pathways and necroptosis in pulmonary arterial hypertension[J]. J Cell Mol Med, 2020, 24(19): 11409-11421. |
| [28] |
LOOMIS Z, EIGENBERGER P, REDINIUS K, et al. Hemoglobin induced cell trauma indirectly influences endothelial TLR9 activity resulting in pulmonary vascular smooth muscle cell activation[J]. PLoS ONE, 2017, 12(2): e0171219. |
| [29] |
ISHIKAWA T, ABE K, TAKANA-ISHIKAWA M, et al. Chronic inhibition of Toll-Like receptor 9 ameliorates pulmonary hypertension in rats[J]. J Am Heart Assoc, 2021, 10(7): e019247. |
| [30] |
WILSON J L, YU J, TAYLOR L, et al. Hyperplastic growth of pulmonary artery smooth muscle cells from subjects with pulmonary arterial hypertension is activated through JNK and p38 MAPK[J]. PLoS ONE, 2015, 10(4): e0123662. |
| [31] |
PANZHINSKIY E, ZAWADA W M, STENMARK K R, et al. Hypoxia induces unique proliferative response in adventitial fibroblasts by activating PDGFβ receptor-JNK1 signalling[J]. Cardiovasc Res, 2012, 95(3): 356-365. |
| [32] |
DAS M, ZAWADA W M, WEST J, et al. JNK2 regulates vascular remodeling in pulmonary hypertension[J]. Pulm Circ, 2018, 8(3): 2045894018778156. |




