2. 400038 重庆,陆军军医大学(第三军医大学)药学与检验医学系临床血液学教研室
2. Department of Clinical Hematology, Faculty of Pharmacy and Laboratory Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038, China
由各种原因所致的骨骼肌萎缩在临床极为常见,主要表现为骨骼肌体积/质量的减少和肌力等功能的减退;严重的肌萎缩不仅加重原发性疾病,同时还常常引起多种并发症;目前临床尚缺乏有效的病理性肌萎缩防治手段[1-2]。
血红素加氧酶1(heme oxygenase-1,HO-1)是机体内血红素分解代谢的关键酶,具有重要的抗炎、抗氧化等作用。近年研究显示诱导HO-1表达能显著减轻由制动及脓毒症等所致的骨骼肌萎缩[3-4];但有关此过程的细胞分子机制尚不清楚。炎性小体(inflammasome) 是胞内由模式识别受体、适配蛋白和效应分子胱冬肽酶(Caspase-1)组成的蛋白复合物,其中NLRP3是分布广泛、研究最多的受体蛋白。近年有研究发现NLRP3参与炎症及衰老所致的骨骼肌萎缩,敲除NLRP3基因能有效阻止上述情况下骨骼肌萎缩的发生[5-6],同时结合在一些病理情况下HO-1对炎性小体活化的抑制作用[7-8],我们推测HO-1的肌萎缩拮抗效应可能是通过对骨骼肌组织内NLRP3炎性小体活化的抑制发挥其作用。因此,本研究首先应用小鼠尾悬吊方法建立下肢肌萎缩模型[9],然后观察注射HO-1诱导剂血红素对骨骼肌萎缩的拮抗作用,重点检测了诱导HO-1对NLRP3等炎性小体分子表达的影响,并通过慢病毒干预抑制NLRP3表达,同步观察其对肌萎缩发生的影响。
1 材料与方法 1.1 材料 1.1.1 实验动物8周雄性C57BL/6小鼠40只,购自陆军军医大学实验动物中心。小鼠在12 h光照-黑暗周期、温度22 ℃下饲养;动物饲料为SPF级大小鼠维持饲料,均由华阜康生物提供。
1.1.2 主要试剂氯化血红素、锌原卟啉(上海麦克林);NLRP3-RNAi慢病毒(上海吉凯);RIPA裂解液、苯甲基磺酰氟化物(PMSF)及BCA蛋白浓度测定试剂盒(上海碧云天);兔单克隆NLRP3抗体、兔多克隆ASC抗体、兔多克隆Caspase-1抗体、鼠单克隆GAPDH抗体、封闭液(武汉博士德);辣根过氧化物酶标记羊抗兔抗体、辣根过氧化物酶标记羊抗鼠抗体(北京中杉金桥);PVDF膜(美国Bio-Rad);ECL检测试剂(美国Millipore);小鼠IL-1β ELISA试剂盒、小鼠IL-18 ELISA试剂盒、超氧化物歧化酶活性检测试剂盒、丙二醛含量检测试剂盒、NAD+检测试剂盒(北京索莱宝)。
1.2 方法 1.2.1 动物分组32只8周雄性C57BL/6小鼠,按照简单随机抽样法分为4组,每组8只。适应性喂养1周后,进行持续性干预。①正常组:正常饲料喂养,不做其他干预;②尾悬吊组:进行尾悬吊干预+腹腔注射140 μL等量二甲亚砜(DMSO),建立经典的后肢肌萎缩模型;③氯化血红素组:进行尾悬吊干预+腹腔注射100 μL浓度为10 mg/μL的氯化血红素(hemin)溶液+40 μL等量DMSO,诱导HO-1表达;④锌原卟啉组:进行尾悬吊干预+腹腔注射100 μL浓度为10 mg/μL的hemin+40 μL浓度为10 mg/μL的ZnPP溶液,拮抗HO-1表达。以上均为隔天注射,从第1天悬吊起注射,隔天注射1次,共注射7次,持续干预2周后处死,部分小鼠直接取材用于蛋白检测,另一部分固定用于HE染色等。
在上述实验的基础上,通过慢病毒转染对诱导HO-1降低NLRP3炎性小体及其相关分子表达以缓解骨骼肌萎缩进行分子机制研究。另取8只8周雄性C57BL/6小鼠,异氟烷麻醉后剃除两侧小腿毛,75%酒精棉球擦拭胫前肌表面,每侧小腿胫前肌从近心端至远心端依次选取5个点注射5 μL浓度为109 TU/mL的RNAi慢病毒,左侧小腿胫前肌注射NLRP3-RNAi慢病毒作为慢病毒干预组(LV-Nlrp3),并同时建立尾悬吊模型,NLRP3-RNAi的作用为抑制NLRP3的表达,另一侧注射等量慢病毒空载体作为对照组(LV-CON),并将其与正常组、尾悬吊组进行比较。持续干预2周后处死。分离小鼠胫前肌,称量,保存于-80 ℃。
1.2.2 骨骼肌肌肉体质量比检测小鼠干预2周后,隔夜禁食,行脱颈处死,记录体质量和两侧胫前肌(tibialis anterior,TA)质量,比较不同组间肌肉体质量比的差异。
1.2.3 肌纤维横截面积的检测小鼠脱颈处死,迅速取出胫前肌置于多聚甲醛中固定24 h,然后依次经洗涤、脱水、透明、透蜡、包埋、切片等步骤,制作厚度约8 μm的石蜡切片,并进行HE染色。通过成像系统观察HE染色结果,在200倍视野下随机选取5个视野,采用Image-Pro Plus 6.0软件计算肌纤维相对横截面积。
1.2.4 骨骼肌ASC、NLRP3、Caspase-1蛋白表达的检测小鼠脱颈后处死,取胫前肌标本,放于液氮中速冻;RIPA裂解液和PMSF混合后提取总蛋白;通过BCA法测定蛋白浓度,加入上样缓冲液混匀,100 ℃水浴加热5 min使蛋白变性,进行SDS-PAGE凝胶电泳,湿转后封闭液封闭2 h,一抗4 ℃恒温摇床孵育过夜,TBST洗膜5次,每次9 min,二抗室温孵育1 h,洗膜5次,每次7 min,洗膜后进行ECL检测,通过凝胶成像仪进行化学发光检测。使用Image J软件分析实验结果。
1.2.5 炎性因子IL-1β、IL-18的含量检测小鼠脱颈后处死,取胫前肌标本,放于液氮中速冻;RIPA裂解液和PMSF混合后提取总蛋白;BCA法测定蛋白浓度,按照ELISA试剂盒说明书步骤检测IL-1β、IL-18炎性因子含量。
1.2.6 抗炎抗氧化作用的检测小鼠脱颈后处死,取胫前肌标本,放于液氮中速冻;称取约0.1 g组织,加入1 mL提取液,按照试剂盒说明书步骤检测SOD的活性、MDA及NAD+的含量。
1.3 统计学分析数据以x±s表示,采用Graphpad Prism 8.0软件进行统计分析及图像生成,多组间的连续变量比较采用单因素方差分析,随后通过图基检验进行多重比较;两组间比较采用独立样本t检验。P < 0.05为差异具有统计学意义。
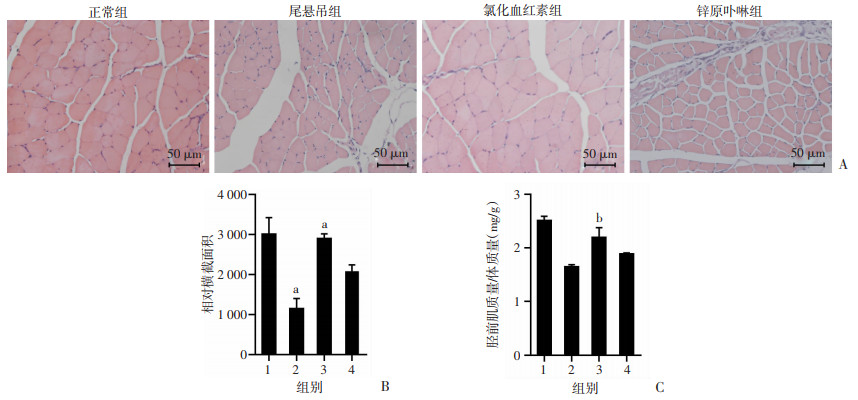
2 结果 2.1 诱导HO-1对小鼠骨骼肌萎缩的影响各组干预2周后,HE结果显示:尾悬吊组胫前肌萎缩较正常组明显加重,氯化血红素组胫前肌萎缩较尾悬吊组明显改善,锌原卟啉组胫前肌萎缩较氧化血红素组加重(图 1A)。与正常组相比,尾悬吊组肌纤维相对横截面积显著减少(P < 0.05,图 1B);与尾悬吊组相比,氯化血红素组肌纤维相对横截面积显著增加(P < 0.05,图 1B),肌肉体质量比增加(P < 0.05,图 1C)。
|
| 1:正常组;2:尾悬吊组;3:氯化血红素组;4:锌原卟啉组;a:P < 0.05,与正常组比较;b:P < 0.05,与尾悬吊组比较;A:HE染色观察各组胫前肌萎缩情况;B:各组胫前肌相对横截面积比较;C:各组胫前肌肌肉体质量比 图 1 诱导HO-1对尾悬吊小鼠骨骼肌萎缩的影响 |
2.2 诱导HO-1抑制NLRP3炎性小体相关分子的表达
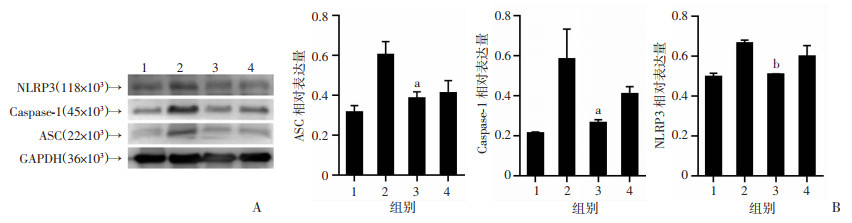
各组干预2周后,蛋白免疫印迹结果显示,氯化血红素组NLRP3、ASC、Caspase-1表达均低于尾悬吊组(P < 0.05),提示诱导HO-1能够降低NLRP3、ASC、Caspase-1的表达;锌原卟啉组的NLRP3炎性小体相关分子表达较氯化血红素组有一定程度的升高,但结果并不显著。见图 2。
|
|
1:正常组;2:尾悬吊组;3:氯化血红素组;4:锌原卟啉组;a:P < 0.05,b:P < 0.01,与尾悬吊组比较 A:Western blot检测诱导HO-1后NLRP3炎性小体相关分子的表达;B:半定量分析 图 2 诱导HO-1对骨骼肌萎缩小鼠NLRP3炎性小体相关分子的影响 |
2.3 NLRP3-RNAi调控NLRP3对小鼠骨骼肌萎缩的影响
肌注慢病毒2周后,与LV-CON组相比,LV-Nlrp3组肌肉体质量比增加(P < 0.05);HE结果显示:LV-CON组胫前肌萎缩较正常组明显加重,LV-Nlrp3组胫前肌萎缩较LV-CON明显改善。与正常组相比,LV-CON组肌纤维横截面积显著减少(P < 0.05);与LV-CON组相比,LV-Nlrp3组肌纤维相对横截面积显著增加(P < 0.05)。见图 3。

|
|
1:正常组;2:LV-CON组;3:LV-Nlrp3组;a:P < 0.01,与正常组比较;b:P < 0.05,与LV-CON组比较 A:HE染色观察各组胫前肌萎缩情况;B:胫前肌相对横截面积比较;C:胫前肌肌肉体质量比比较 图 3 NLRP3-RNAi调节NLRP3对小鼠骨骼肌萎缩的影响 |
2.4 NLRP3-RNAi抑制NLRP3炎性小体相关分子的表达
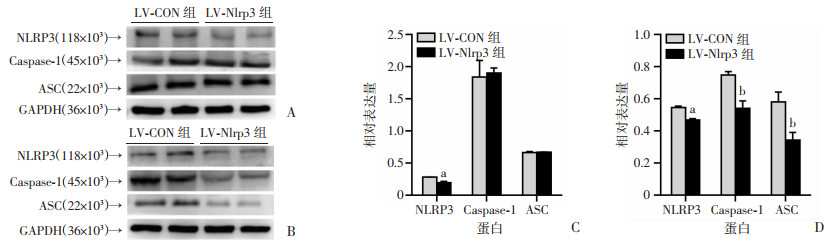
慢病毒干预3 d后,蛋白免疫印迹结果显示,LV-Nlrp3组NLRP3表达低于LV-CON组(P < 0.05),但ASC、Caspase-1无明显差异(图 4A、B)。慢病毒干预2周后,蛋白免疫印迹结果显示,LV-Nlrp3组NLRP3、ASC、Caspase-1表达均低于LV-CON组(P < 0.05,图 4C、D)。提示慢病毒干预有效降低了NLRP3表达,且降低NLRP3表达能够降低ASC、Caspase-1的表达。
|
| a:P < 0.05,b:P < 0.01,与LV-CON组比较A、C:注射慢病毒降低NLRP3表达3 d后相关蛋白表达及半定量分析;B、D:注射慢病毒降低NLRP3表达2周后相关蛋白表达及半定量分析 图 4 Western blot检测NLRP3-RNAi对NLRP3炎性小体及相关蛋白表达的影响 |
2.5 NLRP3-RNAi调控NLRP3降低炎性因子IL-1β和IL-18的含量
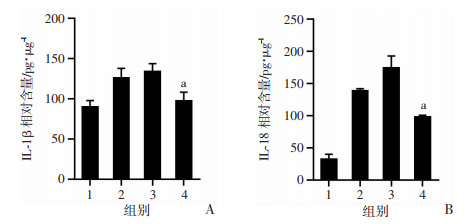
慢病毒干预2周后,LV-Nlrp3组IL-1β、IL-18含量均低于LV-CON组(P < 0.05,图 5)。显示降低NLRP3表达可显著降低肌组织IL-1β、IL-18含量。
|
| 1:正常组;2:尾悬吊组;3:LV-CON组;4:LV-Nlrp3组;a:P < 0.05,与LV-CON组比较 图 5 NLRP3-RNAi调节NLRP3对肌组织炎性因子IL-1β(A)和IL-18(B)含量的影响 |
2.6 NLRP3-RNAi调控NLRP3促进小鼠骨骼肌抗炎和抗氧化作用
慢病毒干预2周后,LV-Nlrp3组较LV-CON组SOD活性升高(P < 0.01,图 6A),且MDA、NAD+水平下降(P < 0.05,图 6B、C)。显示降低NLRP3表达后,小鼠肌组织抗炎、抗氧化能力提高。
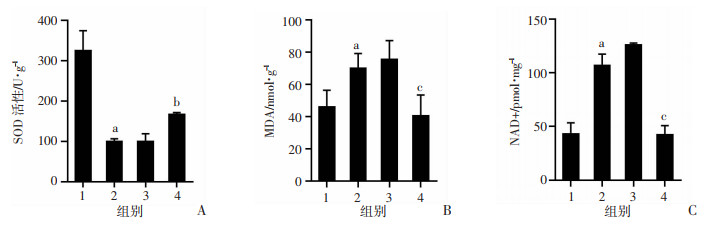
|
| 1:正常组;2:尾悬吊组;3:LV-CON组;4:LV-Nlrp3组;a:P < 0.05,与正常组比较;b:P < 0.01,c:P < 0.05,与LV-CON组比较;A~C:分别为降低NLRP3表达后,SOD活性及MDA、NAD+水平的比较 图 6 NLRP3-RNAi调节NLRP3对肌组织抗炎、抗氧化分子的影响 |
3 讨论
骨骼肌是机体极为重要的运动和代谢器官,具有很强的可塑性。在生物化学水平,肌萎缩的发生是由于肌组织内蛋白合成和降解平衡被破坏导致肌组织内蛋白含量下降,从而使肌纤维萎缩,进而引起肌肉质量/体积的下降。肌萎缩在临床上极为常见,与多种疾病的预后不良有关。但是目前有关其分子调控机制尚不明确,在临床上尚缺乏预防病理性肌萎缩的有效手段[1-2, 10]。
在导致骨骼肌萎缩的分子病理机制中,慢性炎症被认为是一个重要原因[4, 11]。肌组织慢性炎症在一些退行性疾病如增龄性肌肉减少症、骨质疏松症等较为常见[12]。NLRP3炎性小体是先天免疫系统的重要组成部分,作为模式识别受体通过募集ASC,可介导Caspase-1激活,活化的Caspase-1通过切割IL-1β/IL-18前体加工形成其成熟形式。近年有研究发现NLRP3炎性小体的活化与慢性炎症有非常紧密的联系[13-14];在脓毒症及衰老所致的骨骼肌萎缩中,显示敲除NLRP3能有效阻止上述情况下骨骼肌萎缩的发生[5-6]。此外,NLRP3炎性小体的异常激活还与多种炎症性疾病有关[15]。
HO-1作为调节血红素代谢的关键酶,具有重要的抗炎和抗氧化作用[16];研究表明HO-1是多种抗炎分子的作用介质[17-18];同时,近年有报道在一些病理模型下,诱导HO-1表达能显著减轻由慢性炎症所致的骨骼肌萎缩[3-4]。
近年的研究提示,HO-1与NLRP3在一些病理条件下有紧密的联系,例如脓毒症、慢性阻塞性肺疾病、糖尿病、脂肪肝、骨关节炎等[7, 19-22]。然而,诱导HO-1缓解骨骼肌萎缩是否与抑制NLRP3炎性小体活化有关尚不明确。本研究结果显示:通过尾悬吊建立下肢肌萎缩模型后,小鼠胫前肌明显萎缩;通过诱导HO-1可以降低NLRP3炎性小体相关分子的表达,并有效缓解骨骼肌萎缩,提示抑制NLRP3炎性小体的活化与HO-1的升高有关;然后通过胫前肌慢病毒注射干预NLRP3的表达,显示降低了NLRP3炎性小体相关分子的表达并减少了肌组织IL-1β、IL-18的含量,同时有效缓解了骨骼肌萎缩,进一步说明抑制NLRP3炎性小体的活化是诱导HO-1表达缓解骨骼肌萎缩的重要机制。
综上所述,本研究结果显示HO-1通过抑制NLRP3炎性小体对抗肌萎缩,为临床上通过药物治疗肌萎缩提供了一个潜在靶点;但本实验仅从尾悬吊引起制动萎缩的病理模型中证明此机制,后续仍需要在不同病理条件下验证。
作者贡献声明 任春光:主要负责进行实验、收集和分析数据、论文的撰写及退改回复;蒲荣喜、胡蝶:主要负责部分实验及数据的分析;张亚莲、蔡星:主要通过查阅文献等提出研究方案;舒彬、杨忠:主要负责提出研究思路和方案,并负责对文章进行审阅和提出修改意见
| [1] |
SARTORI R, ROMANELLO V, SANDRI M. Mechanisms of muscle atrophy and hypertrophy: implications in health and disease[J]. Nat Commun, 2021, 12(1): 330. |
| [2] |
FURRER R, HANDSCHIN C. Muscle wasting diseases: novel targets and treatments[J]. Annu Rev Pharmacol Toxicol, 2019, 59: 315-339. |
| [3] |
YU X, HAN W, WANG C, et al. Upregulation of heme oxygenase-1 by hemin alleviates sepsis-induced muscle wasting in mice[J]. Oxid Med Cell Longev, 2018, 2018: 8927104. |
| [4] |
PARK C H, JU T J, KIM Y W, et al. Hemin, heme oxygen ase-1 inducer, attenuates immobilization-induced skeletal muscle atrophy in mice[J]. Life Sci, 2013, 92(12): 740-746. |
| [5] |
MCBRIDE M J, FOLEY K P, D'SOUZA D M, et al. The NLRP3 inflammasome contributes to sarcopenia and lower muscle glycolytic potential in old mice[J]. Am J Physiol Endocrinol Metab, 2017, 313(2): E222-E232. |
| [6] |
HUANG N, KNY M, RIEDIGER F, et al. Deletion of Nlrp3 protects from inflammation-induced skeletal muscle atrophy[J]. Intens Care Med Exp, 2017, 5(1): 3. |
| [7] |
CHEN Z, ZHONG H, WEI J, et al. Inhibition of Nrf2/HO-1 signaling leads to increased activation of the NLRP3 inflammasome in osteoarthritis[J]. Arthritis Res Ther, 2019, 21(1): 300. |
| [8] |
VITALI S H, FERNANDEZ-GONZALEZ A, NADKARNI J, et al. Heme oxygenase-1 dampens the macrophage sterile inflammasome response and regulates its components in the hypoxic lung[J]. Am J Physiol Lung Cell Mol Physiol, 2020, 318(1): L125-L134. |
| [9] |
MARZUCA-NASSR G N, VITZEL K F, MURATA G M, et al. Experimental model of hindlimb suspension-induced skeletal muscle atrophy in rodents[J]. Methods Mol Biol, 2019, 1916: 167-176. |
| [10] |
BONALDO P, SANDRI M. Cellular and molecular mechanisms of muscle atrophy[J]. Dis Model Mech, 2013, 6(1): 25-39. |
| [11] |
BYUN M K, CHO E N, CHANG J, et al. Sarcopenia correlates with systemic inflammation in COPD[J]. Int J Chron Obstruct Pulmon Dis, 2017, 12: 669-675. |
| [12] |
SUZUKI K. Chronic inflammation as an immunological abnormality and effectiveness of exercise[J]. Biomolecules, 2019, 9(6): 223. |
| [13] |
HE M, CHIANG H H, LUO H Z, et al. An acetylation switch of the NLRP3 inflammasome regulates aging-associated chronic inflammation and insulin resistance[J]. Cell Metab, 2020, 31(3): 580-591.e5. |
| [14] |
AHECHU P, ZOZAYA G, MARTÍ P, et al. NLRP3 inflammasome: a possible link between obesity-associated low-grade chronic inflammation and colorectal cancer development[J]. Front Immunol, 2018, 9: 2918. |
| [15] |
KELLEY N, JELTEMA D, DUAN Y H, et al. The NLRP3 inflammasome: an overview of mechanisms of activation and regulation[J]. Int J Mol Sci, 2019, 20(13): E3328. |
| [16] |
GONG X, ZHANG L, JIANG R, et al. Anti-inflammatory effects of mangiferin on Sepsis-induced lung injury in mice via up-regulation of heme oxygenase-1[J]. J Nutr Biochem, 2013, 24(6): 1173-1181. |
| [17] |
CHEN H G, XIE K L, HAN H Z, et al. Heme oxygenase-1 mediates the anti-inflammatory effect of molecular hydrogen in LPS-stimulated RAW 264.7 macrophages[J]. Int J Surg, 2013, 11(10): 1060-1066. |
| [18] |
SUBEDI L, LEE J, YUMNAM S, et al. Anti-inflammatory effect of sulforaphane on LPS-activated microglia potentially through JNK/AP-1/NF-κB inhibition and Nrf2/HO-1 activation[J]. Cells, 2019, 8(2): 194. |
| [19] |
KUO N C, HUANG S Y, YANG C Y, et al. Involvement of HO-1 and autophagy in the protective effect of magnolol in hepatic steatosis-induced NLRP3 inflammasome activation in vivo and in vitro[J]. Antioxidants (Basel), 2020, 9(10): E924. |
| [20] |
BIAN H T, WANG G H, HUANG J J, et al. Dihydrolipoic acid protects against lipopolysaccharide-induced behavioral deficits and neuroinflammation via regulation of Nrf2/HO-1/NLRP3 signaling in rat[J]. J Neuroinflamm, 2020, 17(1): 166. |
| [21] |
CASTEJON M L, SÁNCHEZ-HIDALGO M, APARICIO-SOTO M, et al. Dietary oleuropein and its new acyl-derivate attenuate murine lupus nephritis through HO-1/Nrf2 activation and suppressing JAK/STAT, NF-κB, MAPK and NLRP3 inflammasome signaling pathways[J]. J Nutr Biochem, 2019, 74: 108229. |
| [22] |
GAO Y, LI J, CHU S, et al. Ginsenoside Rg1 protects mice against streptozotocin-induced type 1 diabetic by modulating the NLRP3 and Keap1/Nrf2/HO-1 pathways[J]. Eur J Pharmacol, 2020, 866: 172801. |




