2. 400037 重庆,陆军军医大学(第三军医大学)第二附属医院妇产科;
3. 400038 重庆,陆军军医大学(第三军医大学)基础医学院:组织学与胚胎学教研室,教学实验中心
2. Department of Obstetrics and Gynecology, Second Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400037, China;
3. Teaching Experiment Center, College of Basic Medical Sciences, Army Medical University (Third Military Medical University), Chongqing, 400038
膜联蛋白A6(annexin A6,AnxA6)属于膜联蛋白Annexin家族的成员,相对分子量大小为68×103,是该家族中分子质量最大的一个亚型[1-2]。近年研究表明AnxA6在细胞内通过与钙离子结合发挥伴侣分子的作用[3],参与细胞内的信号转导并引起磷酸化等反应[4-5]。有实验证实AnxA6表达增多可稳定激活细胞表面受体[6],参与神经嵴内细胞的迁移过程[7]。相反,AnxA6功能受到抑制会延缓软骨生长板内细胞终末分化能力[8]。可见AnxA6在部分未分化组织细胞的发育中起着重要的调节作用。由此,我们推测AnxA6可能与神经细胞的早期发育分化也有关联,但相关实验证据尚少。
神经祖细胞(neural progenitor cells, NPCs)是胚胎新皮层发育过程中一种具有自我更新和定向分化能力的多能干细胞[9]。体外研究显示在自然条件下,NPCs分化为星型胶质细胞占70%以上,分化为神经元比例占25%左右,仅有不到5%的细胞分化为少突胶质细胞(oligodendrocytes, OLs),表明NPCs定向分化为OLs的能力是有限的[10]。临床孕晚期胎脑白质发育主要由少突胶质前体细胞(oligodendrocyte precursor cells, OPCs)分化为OLs。已有研究证实孕晚期脑白质的发育极易受到缺氧、缺血、高糖等损伤因素的影响,造成转录因子Olig2等表达降低伴随OLs分化受阻,产生不可逆的神经损伤[11]。而NPCs是OPCs的主要来源,因此,NPCs向OLs的定向分化调控及其机制的研究对于脑白质发育及相关疾病防治具有重要意义。然而,AnxA6是否在NPCs的命运决定和定向OLs分化过程中也起着调控作用,目前国内外仍缺少相关报道。本实验通过构建AnxA6敲减以及过表达病毒载体,采用体外NPCs分化模型,探究AnxA6在NPCs定向OLs发育过程的调控作用,为探寻神经系统发育早期定向OLs分化的调控新靶点提供实验室证据。
1 材料与方法 1.1 实验材料 1.1.1 动物健康清洁级新生至3 d SD大鼠,由本校动物实验中心提供。
1.1.2 主要试剂DME/F-12培养基、胎牛血清购自HyClone公司;B27 Supplement购自Gibco公司;bFGF、EGF购自Invitrogen公司;免疫荧光二抗dylight488, 550购自武汉博士德公司;0.25%胰酶购自上海碧云天生物技术有限公司;PrimeScriptTM RT reagent Kit with gDNA Eraser试剂盒、SYBR Green试剂盒购自TaKaRa公司。
1.2 方法 1.2.1 大鼠原代NPCs的体外培养和诱导分化取新生3 d SD大鼠,剥离脑组织除去脑膜及表面血管后,漂洗并装入含无菌PBS的培养皿内,碾碎脑组织后加入0.25%胰酶细胞消化液消化5 min,1 400 r/min离心5 min,弃上清,加入无血清的NPCs培养液(DME/F12培养液,青霉素-链霉素溶液(100倍稀释),b27(50倍稀释),bFGF(5 000倍稀释),EGF(5 000倍稀释)重悬,接种到25 cm2培养瓶中(细胞数约1×106个/瓶),置于37 ℃,5%CO2培养箱中。NPCs在培养3~5 d后,可形成神经球,呈悬浮生长,每2天换半量培养基,7 d后吹打神经球为单细胞悬液,以1×106个/瓶接种到培养瓶中,每4~5天传代1次用于后续分化实验。诱导分化时,更换为含10% FBS的DME/F12的分化培养基,作用24 h计为分化1 d。
1.2.2 过表达/敲减病毒感染细胞AnxA6过表达病毒、AnxA6 CRISPER-Cas9基因敲减病毒及其相应的空白对照病毒购自上海吉凯基因化学技术有限公司。将细胞分为空载体对照组、AnxA6敲减组、AnxA6过表达组。感染前1 d,将NPCs接种于6孔板,每孔接种1×106个细胞,各自加入相应的病毒浓缩液,病毒感染12 h后弃去上清,更换为新鲜培养基继续培养。
1.2.3 qRT-PCR检测设计引物(少突胶质细胞分化相关因子Olig2正义链:5′-GGCGGTGGCTTCA-AGTCATCTT-3′,反义链: 5′-GCGAGTTGGTGAGCAT-CAGGAT-3′;星形胶质细胞分化相关因子Hes1正义链:5′-CTGGAGAGGCTGCCAAGGTT-3′,反义链:5′-GAAGGCGACACTGCGTTAGGA-3′;神经元分化相关因子Ascl1正义链:5′-ACTTCAGTGGCTTCGGCTACAG-3′,反义链:5′-GCGTCTCCACCTTGCTCATCTT-3′;Vimentin正义链:5′-GACATCATGCGGCTGCGAGAA-3′,反义链:5′-TCATACTGCTGGCGGACATCAC-3′;Fyn正义链:5′-AGCGAAACTGACGGAGGAGAGG-3′,反义链:5′-CGGCTGCGTGGAAGTTGTTGTA-3′。传统TRIzol法提取细胞总RNA,用PrimeScriptTM RT reagent Kit with gDNA Eraser试剂盒逆转录成cDNA,以GAPDH为内参,用SYBR Green试剂盒进行扩增,结果采用2-ΔΔCt法进行相对定量分析。
1.2.4 活细胞钙成像将3组细胞种植于玻底培养皿中培养24 h,取1 mL Fluo-4AM工作液(Fluo-4母液5 μL用培养基稀释至1 mL)覆盖在细胞表面,37 ℃孵育30 min;在共聚焦显微镜下记录Fluo-4荧光信号及动态变化曲线。
1.2.5 免疫荧光染色NPCs及分化各阶段细胞用-20 ℃无水甲醇固定20 min,PBS漂洗3次,用5% BSA室温封闭1 h后,加入一抗(Nestin、CNPase、Olig2,稀释比例均为1 ∶400,购自武汉博士德公司),4 ℃过夜。PBS清洗3次后,加入对应的二抗,室温避光孵育1 h,然后加入DAPI进行细胞核染色,室温避光孵育20 min,洗涤后以50%甘油溶液封片。荧光染色细胞镜下随机选取10个视野/组测定。统计分析荧光阳性细胞的百分率和荧光信号的分布面积。
1.2.6 Western blot检测收集细胞样品裂解、离心提取蛋白,予以BCA蛋白定量后,进行SDS-PAGE凝胶电泳和转膜,用5%脱脂牛奶室温封闭1 h后,加入相应的一抗(AnxA6,1 ∶500,购自武汉博士德公司)4 ℃过夜,过夜后用TBST漂洗3次并加入对应的HRP IgG,室温孵育1 h后用TBST洗涤3次,最后经ECL液曝光并拍照留存。采用Image J软件进行灰度分析,以GAPDH作为内参,用目的蛋白与GAPDH的比值表示目的蛋白相对表达量。
1.3 统计学分析采用Graphpad Prism 7软件进行统计分析。计量资料以x±s表示,每组实验至少重复3次。组间差异采用t检验和卡方检验。检验水准α=0.05。
2 结果 2.1 大鼠NPCs的分离鉴定在无血清NPCs培养基中培养24 h后,观察到单个悬浮细胞和不规则悬浮细胞团。2~3 d后,可见呈悬浮生长的数目、大小形态不同的细胞球,具有强烈折射率且没有突起,5 d后可见大量细胞球(图 1A)即为神经球。免疫细胞荧光染色可见神经球内显示Nestin阳性信号(图 1B)。
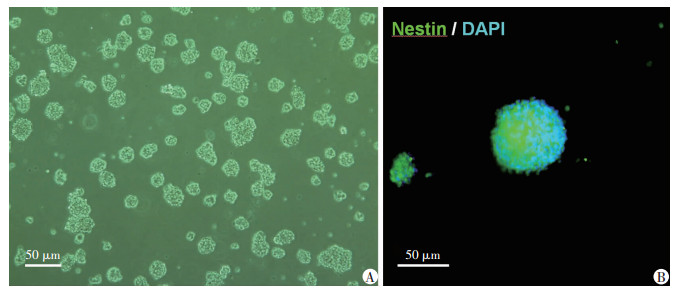
|
| A:体外培养5 d后见神经祖细胞呈球状悬浮生长;B:神经球内见Nestin荧光阳性信号 图 1 大鼠NPCs体外培养与鉴定 |
2.2 AnxA6过表达加快NPCs形态分化
NPCs分化3 d后,在对照组中,神经球细胞团贴壁生长,直径扩大,周边见较多有突起的细胞(图 2A)。AnxA6过表达组可见神经球周边分化细胞较多且多为>7分支突起的细胞;而AnxA6敲减组神经球周边分化细胞较少,胞体较大且突起及分支较少,多为<3分支(图 2B)。运用Western blot检测3组分化细胞中AnxA6蛋白表达,AnxA6过表达组AnxA6蛋白条带的光密度值显著高于对照组(P<0.01),AnxA6敲减组AnxA6蛋白条带较对照组减弱(P<0.05,图 2C、D)。

|
| A:NPCs分化3 d后,低倍镜(上)和高倍镜(下)显示3组细胞发育成熟形态;B:分化细胞中<3突起、4~6突起及>7突起的细胞所占百分率;C:Western blot检测各组AnxA6蛋白表达结果;D:Western blot检测各组AnxA6蛋白相对表达量 a:P<0.05, b:P<0.01,与对照组比较 图 2 AnxA6对NPCs形态分化的影响 |
2.3 AnxA6过表达诱导分化细胞内Ca2+自发性震荡
NPCs分化1 d后活细胞钙成像检测结果显示,在静息状态下,AnxA6过表达组中细胞内Ca2+信号呈现出较多的自发性震荡反应,且振荡活动的频率和幅度均较对照组细胞显著增强(P<0.01),相反,AnxA6敲减组相较于对照组,细胞内Ca2+信号的自发性振荡反应较少,钙振荡波形幅度明显低平(图 3A)。钙振荡峰值数以对照组均值800为对照,统计学分析显示AnxA6过表达组中幅度超过均值的钙反应分布率明显较多,AnxA6敲减组较对照组显著减少(P<0.01,图 3B)。提示AnxA6增多促使细胞钙应答功能更加活跃。

|
| A:活细胞钙成像检测静息状态下分化1 d后,各组细胞胞内[Ca2+]反应的动力变化曲线;B:各组细胞钙振荡的荧光峰度值的对比统计分析 a:P<0.01 图 3 AnxA6对分化细胞内[Ca2+]信号的影响 |
2.4 过表达AnxA6上调早期分化细胞中Olig2表达
免疫荧光结果显示AnxA6过表达组分化1 d细胞中Olig2荧光阳性细胞的百分率显著高于对照组,AnxA6敲减组百分率明显降低(P<0.05,图 4A、B)。同样,采用qRT-PCR检测NPCs分化1 d后细胞,结果显示:AnxA6过表达组分化细胞中OLs分化相关转录因子Olig2 mRNA的表达显著升高(P<0.01),反之,AnxA6敲减组Olig2 mRNA水平显著低于对照组(P<0.01);且AnxA6敲减组星形胶质细胞分化相关因子Hes1以及神经元分化相关因子Ascl1 mRNA水平显著高于对照组(P<0.05,图 4C)。提示AnxA6过表达促进NPCs向OLs定向分化。

|
|
a:P<0.05,b:P<0.01,与对照组比较 A:免疫荧光染色观察3组中NPCs分化1 d后Olig2阳性细胞;B:Olig2荧光阳性细胞的百分率统计;C:qRT-PCR分析3组NPCs分化早期胞内定向分化转录因子mRNA的表达差异 图 4 AnxA6对NPCs早期分化1 d细胞中转录因子表达的影响 |
2.5 过表达AnxA6上调CNPase,同时促进Vimentin、Fyn的mRNA表达
进一步采用免疫荧光检测NPCs分化3 d细胞中髓鞘标志物CNPase的表达,结果显示AnxA6过表达组细胞突起及分支中可见大量红色荧光信号分布,包绕胞体周边。相反,AnxA6敲减组细胞中CNPase阳性信号仅分布在胞体周边区域,阳性信号面积明显低于对照组(P<0.05,图 5A~C),提示AnxA6过表达诱导NPCs向OLs定向分化,且加快OLs髓鞘发育成熟进程,而AnxA6表达受抑制则显著减少NPCs向OLs的分化。
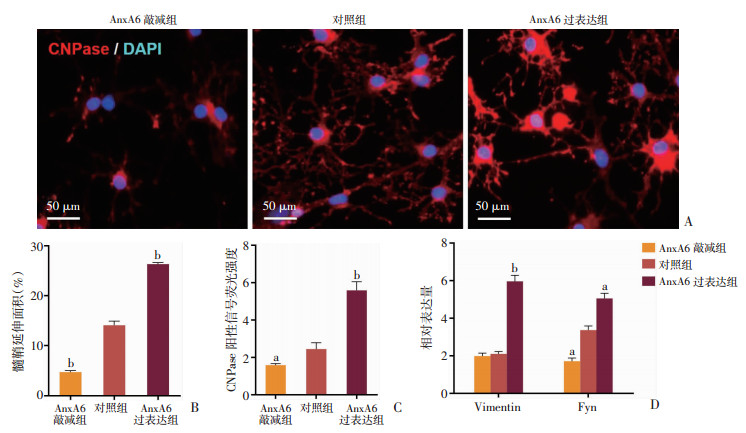
|
|
a:P<0.05, b:P<0.01,与对照组比较 A:分化3 d后3组细胞CNPase免疫荧光染色观察;B、C:3组CNPase阳性荧光信号的分布面积和荧光强度;D:qPCR检测3组分化3 d细胞中细胞骨架相关因子mRNA的表达差异 图 5 AnxA6对NPCs分化及髓鞘形成的影响 |
采用qRT-PCR检测3组细胞分化3 d后,结果显示AnxA6过表达组Vimentin和Fyn mRNA表达均明显增高(P<0.05);其中,Vimentin较对照组增加近3倍,而AnxA6敲减组较对照组未见明显差异;Fyn mRNA较对照组增加约0.6倍,而AnxA6敲减组较对照组减少约1倍。提示AnxA6的增多可能促进分化细胞中Vimentin、Fyn表达,与定向分化后OLs的突起发育成熟加快有关(图 5D)。
3 讨论AnxA6是近年发现的一个能与蛋白和受体相结合的膜联蛋白伴侣分子[1]。研究证实AnxA6能够通过招募相应分子调控细胞骨架稳定、突起延长,参与细胞的多种功能活动,如干细胞分化、细胞迁移等[7]。已有较多研究证实在NPCs分化过程中,常伴随着胞膜上相应受体的激活启动,是细胞命运决定的关键环节,这一调控过程需要标志性的转录因子的启动。新生儿脑白质软化症相关研究表明,在发育早期少突胶质前体细胞极易受缺血缺氧等氧化应激性因素的损伤,使定向分化为OLs能力受到抑制,该过程与转录因子Olig2表达降低密切相关[12],故转录因子Olig2表达高低可作为评价NPCs向OLs分化能力的指标。
本研究通过运用体外培养的AnxA6 CRISPER-Cas9基因敲减的NPCs以及AnxA6过表达的NPCs[13],探究AnxA6在定向OLs分化中的调控作用,结果显示过表达AnxA6后可使NPCs分化细胞中Olig2的mRNA表达增强,但AnxA6敲减组显示Olig2 mRNA表达量显著减少。提示AnxA6的表达可能参与NPCs定向OLs分化过程。另外,AnxA6敲减组中观察到星形胶质细胞分化相关转录因子Hes1[14]以及神经元分化相关因子Ascl[15]的mRNA表达增高,表明AnxA6的降低在减少NPCs向OLs分化的同时,可引发更多NPCs向星形胶质细胞以及神经元分化。故推测AnxA6可能是NPCs定向OLs分化过程中不可或缺的一环。AnxA6的减少可能作为一种应激性损伤因素,导致其相关转录因子表达增多,刺激星形胶质细胞以及神经元发生反应性变化,尤其是应激下星形胶质细胞常发生形态变大、数目增多等系列反应[16-17]。而Ascl1表达见于神经元分化启动等阶段,对后续神经元分化的影响及其相关具体机制有待进一步研究。
既往生物信息学研究结果显示,AnxA6蛋白中存在具有Ca2+结合相关的结构域[5]。有研究表明AnxA6与Ca2+结合后,能减少胞内蛋白的降解,从而表现出稳定胞内蛋白的作用,提示AnxA6作为分子伴侣必须与细胞内Ca2+结合才能引发下游信号转导和引起磷酸化反应[18-19]。本研究发现在静息状态下,AnxA6过表达组细胞内呈现出明显的自发性钙振荡,且振幅较强;而AnxA6敲减组钙振荡较弱。Fluo-4作为与Ca2+结合探针,钙振荡荧光信号越强,表明胞内Ca2+浓度越高,提示细胞功能更加活跃,Ca2+作为第2信使,进一步启动下游转录因子的表达[20]。有研究认为AnxA6与Ca2+结合后形成的复合物能使其本身构象发生变化,暴露疏水基团,后者作为与靶蛋白相互作用的位点能够招募一些小分子蛋白,参与膜表面一系列依赖于钙调蛋白的活动,包括囊泡运输、胞吐作用、信号传导、细胞分化、细胞凋亡[21]等。本实验也观察到AnxA6表达增强的同时,细胞中Vimentin、Fyn的表达较对照组均有显著提高,而AnxA6敲减组较对照组显著下降。对OLs的研究提示Vimentin、Fyn的表达与髓鞘膜形成以及髓鞘扩展有关[22-23],进一步提示AnxA6/Ca2+复合物可能增强与Fyn等的结合,加快了髓鞘的成熟。本研究采用CRISPR技术敲减AnxA6基因,观察到细胞分化成熟受阻,滞后于对照组和AnxA6过表达组,qRT-PCR检测结果显示转录因子Olig2表达显著低于对照组,提示敲减AnxA6基因可能导致蛋白构象中的疏水基团Ca2+结合区错构,从而失去加速NPCs分化功能。
综上,本研究观察在NPCs分化过程中过表达或敲减AnxA6后对其定向分化的影响,结果显示在增强AnxA6的表达后,OLs的分化比例较对照组有明显提高。本实验结果提示在NPCs的分化早期调控AnxA6的表达可促进其定向OLs分化,并能加快髓鞘的形成。本研究为寻找脑白质分化发育早期NPCs定向分化的新的调控靶点提供实验证据。但AnxA6是如何与其他基因或分子协同作用,相关机制尚不明确,需进一步深入研究。
| [1] |
CORNELY R, RENTERO C, ENRICH C, et al. Annexin A6 is an organizer of membrane microdomains to regulate receptor localization and signalling[J]. Iubmb Life, 2011, 63(11): 1009-1017. |
| [2] |
TEBAR F, GELABERT-BALDRICH M, HOQUE M, et al. Annexins and endosomal signaling[J]. Methods Enzymol, 2014, 535: 55-74. |
| [3] |
CHOW A, DAVIS A J, GAWLER D J. Identification of a novel protein complex containing annexin Ⅵ, Fyn, Pyk2, and the p120GAP C2 domain[J]. FEBS Lett, 2000, 469(1): 88-92. |
| [4] |
KOESE M, RENTERO C, KOTA B P, et al. Annexin A6 is a scaffold for PKCα to promote EGFR inactivation[J]. Oncogene, 2013, 32(23): 2858-2872. |
| [5] |
ZHOU Y B, XUE S H, CHEN Y Y, et al. Probing Ca2+-binding capability of viral proteins with the EF-hand motif by grafting approach[J]. Methods Mol Biol, 2013, 963: 37-53. |
| [6] |
CROISSANT C, GOUNOU C, BOUVET F, et al. Annexin-A6 in membrane repair of human skeletal muscle cell: a role in the cap subdomain[J]. Cells, 2020, 9(7): E1742. |
| [7] |
WU C Y, TANEYHILL L A. Annexin a6 modulates chick cranial neural crest cell emigration[J]. PLoS ONE, 2012, 7(9): e44903. |
| [8] |
MINASHIMA T, SMALL W, MOSS S E, et al. Intracellular modulation of signaling pathways by annexin A6 regulates terminal differentiation of chondrocytes[J]. J Biol Chem, 2012, 287(18): 14803-14815. |
| [9] |
GROCHOWSKI C, RADZIKOWSKA E, MACIEJEWSKI R. Neural stem cell therapy-Brief review[J]. Clin Neurol Neurosurg, 2018, 173: 8-14. |
| [10] |
FRAICHARD A, CHASSANDE O, BILBAUT G, et al. In vitro differentiation of embryonic stem cells into glial cells and functional neurons[J]. J Cell Sci, 1995, 108(Pt 10): 3181-3188. |
| [11] |
NESS J K, ROMANKO M J, ROTHSTEIN R P, et al. Perinatal hypoxia-ischemia induces apoptotic and excitotoxic death of periventricular white matter oligodendrocyte progenitors[J]. Dev Neurosci, 2001, 23(3): 203-208. |
| [12] |
MA T, LI B C, LE Y F, et al. Demyelination contributes to depression comorbidity in a rat model of chronic epilepsy via dysregulation of Olig2/LINGO-1 and disturbance of calcium homeostasis[J]. Exp Neurol, 2019, 321: 113034. |
| [13] |
PENA S A, IYENGAR R, ESHRAGHI R S, et al. Gene therapy for neurological disorders: challenges and recent advancements[J]. J Drug Target, 2020, 28(2): 111-128. |
| [14] |
HSIEH M C, PENG H Y, HO Y C, et al. Transcription repressor Hes1 contributes to neuropathic pain development by modifying CDK9/RNAPII-dependent spinal mGluR5 transcription[J]. Int J Mol Sci, 2019, 20(17): E4177. |
| [15] |
DENG M, XIE P, CHEN Z, et al. Mash-1 modified neural stem cells transplantation promotes neural stem cells differentiation into neurons to further improve locomotor functional recovery in spinal cord injury rats[J]. Gene, 2021, 781: 145528. |
| [16] |
PEKNY M, NILSSON M. Astrocyte activation and reactive gliosis[J]. Glia, 2005, 50(4): 427-434. |
| [17] |
PEKNY M, WILHELMSSON U, TATLISUMAK T, et al. Astrocyte activation and reactive gliosis-A new target in stroke?[J]. Neurosci Lett, 2019, 689: 45-55. |
| [18] |
MONASTYRSKAYA K, BABIYCHUK E B, HOSTETTLER A, et al. Plasma membrane-associated annexin A6 reduces Ca2+ entry by stabilizing the cortical actin cytoskeleton[J]. J Biol Chem, 2009, 284(25): 17227-17242. |
| [19] |
DEMONBREUN A R, FALLON K S, OOSTERBAAN C C, et al. Recombinant annexin A6 promotes membrane repair and protects against muscle injury[J]. J Clin Invest, 2019, 129(11): 4657-4670. |
| [20] |
PCHITSKAYA E, POPUGAEVA E, BEZPROZVANNY I. Calcium signaling and molecular mechanisms underlying neurodegenerative diseases[J]. Cell Calcium, 2018, 70: 87-94. |
| [21] |
HOQUE M, ELMAGHRABI Y A, KÖSE M, et al. Annexin A6 improves anti-migratory and anti-invasive properties of tyrosine kinase inhibitors in EGFR overexpressing human squamous epithelial cells[J]. FEBS J, 2020, 287(14): 2961-2978. |
| [22] |
O'MEARA R W, MICHALSKI J P, ANDERSON C, et al. Integrin-linked kinase regulates process extension in oligodendrocytes via control of actin cytoskeletal dynamics[J]. J Neurosci, 2013, 33(23): 9781-9793. |
| [23] |
MATRONE C, PETRILLO F, NASSO R, et al. Fyn tyrosine kinase as harmonizing factor in neuronal functions and dysfunctions[J]. Int J Mol Sci, 2020, 21(12): E4444. |




