前列腺增生、括约肌功能障碍、尿道狭窄等多种器质性或功能性病因引起的膀胱流出道压力增高常导致膀胱出口梗阻(bladder outlet obstruction,BOO)[1-2]。BOO可导致膀胱平滑肌出现代偿性肥厚增生,可在一定程度上增加逼尿肌收缩力。但是当梗阻因素持续存在时,膀胱平滑肌可发生重塑,引起膀胱收缩效率下降、膀胱过度活动等一系列病理生理学和尿动力学改变,导致尿频尿急等下尿路症状[3],在解除梗阻因素后仍然不能完全恢复。目前BOO所致膀胱平滑肌重塑的分子机制仍不明确,我们在前期的研究中发现热休克蛋白27(heat shock protein 27,HSP27)作为一种小分子应激蛋白,在急性尿潴留动物模型中呈现持续高表达和过磷酸化的改变,与膀胱收缩力改变有一定关联[4],但是具体机制及其在慢性梗阻所致平滑肌重塑中的作用尚不明了。RhoGTP酶家族作为参与多种信号转导通路的重要蛋白,可起到分子开关的作用,与细胞的收缩、运动、黏附等过程密切相关[5-6]。ras同源物家族成员A(ras homolog family member A,RhoA)作为RhoGTP酶家族成员,可通过多种途径调节肌动蛋白聚合活性,影响细胞内肌动蛋白丝的组装,在细胞骨架调控及平滑肌细胞收缩中发挥关键作用[7]。本研究观察HSP27与RhoA信号通路的关系以及对膀胱平滑肌肌动蛋白的影响,初步探讨HSP27在BOO后膀胱平滑肌重塑中的作用机制。
1 材料与方法 1.1 材料人原代膀胱平滑肌细胞(human bladder smooth muscle cells, HBSMC)购于赛百慷生物公司。30只雌性Sprague-Dawley大鼠,体质量220~260 g,购自陆军军医大学实验动物中心。
主要试剂与仪器:DMEM培养基(美国Corning公司),胎牛血清(美国Invitrogen公司),HSP27抗体(美国Abcam公司)、HSP27(phospho s82)抗体(美国Abcam公司)、RhoA抗体(美国CST公司)、GADPH抗体(美国Proteintech公司),透明质酸(瑞典Restylane公司),TRIzol(美国Sigma公司),HSP27过表达载体LV-013(上海懿贝瑞)、HSP27敲低载体LV-002(上海懿贝瑞),Hiscript QRT supermix for qPCR试剂盒(南京诺唯赞)、AceQ qPCR SYBR Green master mix(南京诺唯赞)、immobilon Western Chemiluminescent HRP Substrote(美国Millipore公司),G-actin/F-actin体外检测试剂盒(美国Cytoskeleton公司),Acti-stainTM488 Phalloidin(美国Cytoskeleton公司),细胞二氧化碳培养箱(日本SANYO公司),稳压电泳仪(上海天能),蛋白转膜仪(上海天能),5417R台式冷冻高速离心机(德国Eppendorf公司),qPCR仪器(美国ABI公司),化学发光成像系统(美国GE公司)。
1.2 方法 1.2.1 建立SD大鼠BOO模型将SD大鼠采用随机数字表法分为BOO组和对照组,每组15只。大鼠行戊巴比妥钠(50 mg/kg)腹腔注射麻醉,BOO组大鼠采用尿道周围注射透明质酸的方法模拟膀胱出口梗阻[8],对照组大鼠注射相同剂量生理盐水。饲养4周后处死所有实验大鼠,取出膀胱标本。
1.2.2 SD大鼠膀胱组织HE染色10%福尔马林固定大鼠膀胱标本后行石蜡包埋并切片。组织切片均行HE染色,镜下观察组织病理学变化。
1.2.3 Western blot检测大鼠膀胱组织中HSP27及RohA表达水平两组各取部分膀胱标本,剪碎,匀浆后转移至离心管中,12 000×g离心20 min后、收集上清。测定蛋白含量,配制样本,行SDS-PAGE电泳。电泳结束后,使用转移电泳装置,将蛋白转移到PVDF膜上。在PVDF膜上孵育HSP27一抗(稀释比1 ∶1 000)、RHOA一抗(稀释比1 ∶1 000),4 ℃过夜。TBST洗膜后加入羊抗兔IgG二抗(稀释比1 ∶3 000),室温下孵育1 h。行化学发光检测,记录结果。以GADPH为内参照。
1.2.4 人膀胱平滑肌细胞的体外培养与HSP27过表达和敲低模型构建构建HSP27过表达质粒载体LV-013-HSP27及敲低质粒载体LV-002-shRNAHSP27,获得目的质粒后利用HK293FT细胞进行病毒包装,4 500×g离心20 min,留取上清备用。按照标准细胞培养方法体外培养人膀胱平滑肌细胞。将处于对数生长期的膀胱平滑肌细胞进行胰酶消化,制成细胞悬液。将细胞悬液(细胞数为1 500~2 500)接种于96孔板中,37 ℃、5% CO2培养箱培养待细胞融合度达到20%~30%。24 h后,弃培养基,加入感染液,同时根据细胞MOI值,加入适量的病毒,对照组使用空病毒载体。感染18~20 h后,更换新制备的培养基。72 h后,显微镜下观察荧光及感染效率。
1.2.5 HSP27过表达和敲低模型的qPCR检测取慢病毒感染后的膀胱平滑肌细胞,根据TRIzol操作说明书进行总DNA抽提,根据Hiscript QRT supermix for qPCR试剂盒的步骤进行逆转录获得cDNA。配制反应体系,两步法进行qPCR检测及结果分析。
1.2.6 Western blot检测RhoA的表达从培养箱中取出各组细胞,按照蛋白提取试剂盒说明进行细胞总蛋白抽提。按照凝胶配制说明书配制分离胶及浓缩胶,胶凝固后,将各组蛋白样品上样,行SDS-PAGE电泳。电泳结束后,使用转移电泳装置,将蛋白转移到PVDF膜上。PVDF膜封闭后,加入HSP27一抗(稀释比1 ∶1 000)、RhoA一抗(稀释比1 ∶1 000),4 ℃过夜。TBST洗膜后加入羊抗兔IgG二抗(稀释比1 ∶3 000),室温下孵育1 h。使用化学发光成像仪进行化学发光检测。以GADPH为内参照。
1.2.7 Western blot检测肌动蛋白水平从培养箱中取出各组细胞,按照G-actin/F-actin体外检测试剂盒所提供的步骤裂解细胞并收集裂解产物。取100 μL裂解产物上清液,37 ℃下100 000×g离心1 h,以分离丝状肌动蛋白(filamentous-actin,F-actin)和球状肌动蛋白(globular-actin,G-actin)。将含G-actin的上清液收集到新的离心管中。向沉淀中加入F-actin解聚缓冲液。按照说明配制各组蛋白样本,进行SDS-PAGE电泳。电泳结束后,使用转移电泳装置,将蛋白转移到PVDF膜上。对PVDF进行封闭后,加入对应actin小鼠单克隆一抗(稀释比1 ∶1 000),室温孵育1 h。TBST洗膜后加入抗鼠Hrp二抗(稀释比1 ∶5 000),室温下孵育1 h。对膜进行化学发光检测。记录结果,计算F-actin/G-actin(F/G)比值。
1.2.8 F-actin荧光染色各组细胞融合至50%,4%甲醛溶液室温固定10 min。按照说明配制鬼笔环肽工作液,渗透缓冲液处理固定后的细胞。滴加200 μL FITC标记鬼笔环肽工作液,室温避光孵育30 min。滴加200 μL DAPI染核30 s,将盖玻片倒置在滴有防褪色液的载玻片上,指甲油封片。荧光显微镜下观察,选择FITC激发/发射滤片和DAPI激发/发射滤片。
1.3 统计学分析采用SPSS 13.0统计软件进行分析,数据以x±s表示。两组间比较采用Bonferroni t检验,P < 0.05表示差异有统计学意义。
2 结果 2.1 大鼠膀胱组织病理学变化与对照组相比,BOO组大鼠膀胱平滑肌层明显肥厚增生,肌束间结缔组织减少,膀胱黏膜层及浆膜层增厚(图 1)。
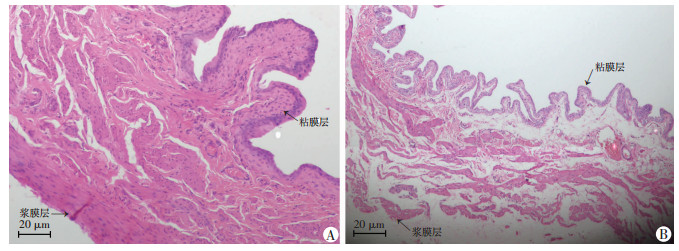
|
| A:BOO组;B:对照组 图 1 HE染色观察BOO组及对照组大鼠膀胱组织病理学变化 |
2.2 大鼠膀胱组织中HSP27及RhoA的表达
结果显示,与对照组相比,模拟膀胱出口梗阻4周后,BOO组大鼠膀胱平滑肌组织中HSP27及RhoA表达水平均明显增高(P < 0.05,图 2)。
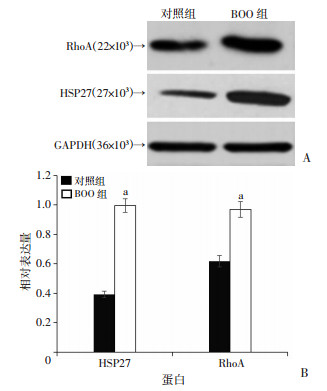
|
| A:Western blot检测结果;B:蛋白表达半定量分析 a: P < 0.05,与对照组比较 图 2 两组大鼠膀胱组织中HSP27及RhoA蛋白表达变化 |
2.3 人膀胱平滑肌细胞HSP27过表达及敲低模型建立
qPCR结果显示,与转染相应空载体的对照组相比,HSP27过表达组的HSP27 mRNA相对表达量显著增加(14 045.459±841.379, P < 0.001),HSP27敲低组的HSP27 mRNA相对表达量明显降低(0.176±0.001, P < 0.001),表明成功构建HSP27敲低及过表达模型。
2.4 HSP27过表达、敲低后HSP27、p-HSP27及RhoA的表达结果(图 3)显示,与对照组相比,HSP27过表达组HSP27、p-HSP27及RhoA表达水平均上调(P < 0.05),HSP27敲低组HSP27、p-HSP27及RhoA表达水平均下调(P < 0.05)。
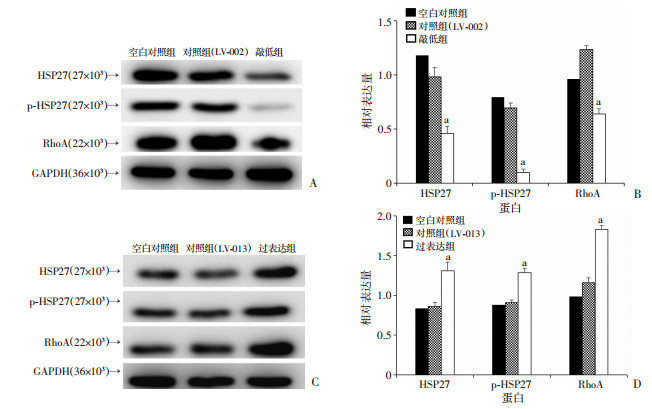
|
|
a: P < 0.05,与对应对照组及空白对照组比较 A: Western blot检测HSP27敲低组、对照组(转染LV-002空载体)及空白对照组HSP27、p-HSP27及RhoA蛋白表达;B:HSP27敲低组、对照组及空白对照组蛋白半定量分析;C:Western blot检测HSP27过表达组、对照组(转染LV-013空载体)及空白对照组HSP27、p-HSP27及RhoA蛋白表达;D:HSP27过表达组、对照组及空白对照组蛋白半定量分析 图 3 HSP27过表达及敲低后蛋白表达变化 |
2.5 HSP27过表达、敲低后细胞F-actin结构变化
鬼笔环肽染色结果(图 4)可见,HSP27敲低组平滑肌细胞内肌动蛋白丝含量较空白对照组和过表达组明显减少,荧光染色条索样结构模糊,细胞结构出现皱缩,排列较为紊乱,提示F-actin结构破坏;而HSP27过表达组F-actin含量明显增多且呈现肌动蛋白互相融合的表现,提示F-actin过度聚合增加。

|
| A:敲低组;B:空白对照组;C:过表达组 图 4 鬼笔环肽染色观察HSP27过表达、敲低后F-actin结构变化 (×400) |
2.6 HSP27过表达、敲低后F/G比值变化
结果(图 5)显示,与空白对照组相比,HSP27过表达组F-actin含量明显增高,F/G比值升高(P < 0.05),HSP27敲低组G-actin含量明显增高,F/G比值降低(P < 0.05)。
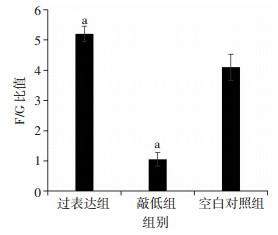
|
| a:P < 0.05,与空白对照组比较 图 5 HSP27过表达及敲低后F/G比值变化 |
3 讨论
膀胱的主要功能(储尿与参与排尿过程)有赖于膀胱平滑肌生理性的收缩与舒张。在膀胱充盈时,膀胱平滑肌舒张并维持一定张力,排尿时,膀胱平滑肌快速收缩将尿液排出膀胱。膀胱平滑肌细胞的收缩机制与其他平滑肌类似,在电生理信号的控制下,肌动蛋白与肌球蛋白相互作用,使细胞产生收缩运动。肌动蛋白丝排列在肌球蛋白丝周围,共同组成平滑肌细胞的收缩装置。肌动蛋白丝也可作为细胞骨架的一部分,维持细胞形态并参与细胞活动。在细胞内,G-actin以结合ATP的形式聚合为F-actin,F-actin也动态地解聚为G-actin[9]。这种形态间的动态转换是细胞骨架形成及重构的基础,参与细胞运动、胞质分裂、胞膜运输等多种细胞过程[10-11]。在平滑肌细胞受到收缩刺激时,细胞内的G-actin可聚合为F-actin,F/G比值较舒张状态下升高。抑制肌动蛋白聚合将使平滑肌细胞收缩性降低[12]。肌动蛋白聚合/解聚的动态变化对于平滑肌细胞收缩功能具有重要意义。
Rho GTP酶可在非活性GDP结合态和活性GTP结合态之间循环,通过多种信号通路在细胞收缩、运动、增殖、凋亡中发挥重要作用,与平滑肌相关疾病的发生发展有密切联系[13-14]。本研究发现HSP27过表达可导致RhoA表达水平升高,而干扰HSP27表达可引起RhoA表达降低,同时可观察到G-actin与F-actin水平的相应变化。既往研究表明RhoA可激活Diaphanous相关成蛋白(Diaphanous related formin,DRF)蛋白,其与肌动蛋白丝结合,抑制帽蛋白对肌动蛋白聚合的终止作用,促进肌动蛋白丝延长[15]。RhoA亦可通过下游ROCK通路激活LIMK酶,使肌动蛋白解聚因子cofilin磷酸化而失去活性,从而促进G-actin聚合为F-actin[16]。因此有理由推测HSP27可通过调控RhoA水平调节肌动蛋白聚合/解聚平衡。我们在之前的研究中发现膀胱出口梗阻时平滑肌细胞内HSP27持续升高,这将促进肌动蛋白丝的形成[4]。实际上,在对实验细胞进行鬼笔环肽染色后,也发现HSP27高表达的平滑肌细胞内肌动蛋白丝明显增加。然而与对照组相比,HSP27敲低组的肌动蛋白丝排列较为杂乱,结构也有明显改变。这种膀胱平滑肌肌动蛋白的变化,一方面可能与BOO初期膀胱平滑肌收缩力代偿性增强有关,另一方面也可能参与膀胱平滑肌肥厚及继发性逼尿肌过度活动的形成。在BOO模型大鼠膀胱平滑肌中,也可检测到HSP27及RhoA蛋白水平升高。因此,综合体外实验及动物实验的结果,可认为HSP27可能通过磷酸化调控RhoA水平,引起膀胱平滑肌细胞骨架及收缩功能改变,并可能在膀胱出口梗阻后膀胱平滑肌重塑过程中发挥作用。也有研究表明在膀胱平滑肌细胞中沉默Rac1(Rho GTP酶家族的另一成员),亦可促进肌动蛋白丝解聚,破坏细胞骨架结构,并促进细胞凋亡,可能与膀胱过度活跃或糖尿病相关的膀胱功能障碍有关[17],提示膀胱平滑肌结构与功能受到多种Rho GTP酶的调控。
下尿路梗阻导致的膀胱平滑肌重塑虽然可以代偿性增加逼尿肌收缩力,以对抗梗阻状态下的排尿阻力,但是其慢性危害不容忽视,尤其是在解除梗阻后逼尿肌过度活动的症状在临床上十分常见,包括尿频、尿急和急迫性尿失禁等,影响患者生活质量[18]。而目前临床上缺乏针对解除梗阻后膀胱平滑肌肥厚和重塑的治疗方法。因此,深入探讨膀胱重塑的分子机制,减轻逼尿肌过度活动所引起的下尿路症状是临床上亟需解决的问题。本研究探讨了HSP27对RhoA表达的影响,观察到HSP27的过表达和磷酸化增加可显著影响体外培养膀胱平滑肌细胞肌动蛋白结构,为下一步深入研究梗阻性膀胱平滑肌重塑的分子机制和临床治疗提供了新的切入点。
| [1] |
D'ANCONA C, HAYLEN B, OELKE M, et al. The International Continence Society (ICS) report on the terminology for adult male lower urinary tract and pelvic floor symptoms and dysfunction[J]. Neurourol Urodyn, 2019, 38(2): 433-477. |
| [2] |
FUSCO F, CRETA M, DE NUNZIO C, et al. Progressive bladder remodeling due to bladder outlet obstruction: a systematic review of morphological and molecular evidences in humans[J]. BMC Urol, 2018, 18(1): 15. |
| [3] |
KANNO Y, MITSUI T, KITTA T, et al. The inflammatory cytokine IL-1β is involved in bladder remodeling after bladder outlet obstruction in mice[J]. Neurourol Urodyn, 2016, 35(3): 377-381. |
| [4] |
王永权, 沈文浩, 邓建平, 等. 热休克蛋白27在大鼠急性尿潴留膀胱中的表达及意义[J]. 局解手术学杂志, 2011, 20(2): 124-126. WANG Y Q, SHEN W H, DENG J P, et al. Expressions and significances of heat shock protein 27 in bladders of rats with acute urinary retention[J]. J Reg Anat Oper Surg, 2011, 20(2): 124-126. |
| [5] |
NARUMIYA S, THUMKEO D. Rho signaling research: history, current status and future directions[J]. FEBS Lett, 2018, 592(11): 1763-1776. |
| [6] |
ROTTNER K, FAIX J, BOGDAN S, et al. Actin assembly mechanisms at a glance[J]. J Cell Sci, 2017, 130(20): 3427-3435. |
| [7] |
LEE S H, DOMINGUEZ R. Regulation of actin cytoskeleton dynamics in cells[J]. Mol Cells, 2010, 29(4): 311-325. |
| [8] |
WANG Y Q, XIONG Z Y, GONG W, et al. Urethral orifice hyaluronic acid injections: a novel animal model of bladder outlet obstruction[J]. BMC Urol, 2015, 15: 8. |
| [9] |
RIDLEY A J. Rho GTPases and actin dynamics in membrane protrusions and vesicle trafficking[J]. Trends Cell Biol, 2006, 16(10): 522-529. |
| [10] |
SCHAKS M, GIANNONE G, ROTTNER K. Actin dynamics in cell migration[J]. Essays Biochem, 2019, 63(5): 483-495. |
| [11] |
BLANCHOIN L, BOUJEMAA-PATERSKI R, SYKES C, et al. Actin dynamics, architecture, and mechanics in cell motility[J]. Physiol Rev, 2014, 94(1): 235-263. |
| [12] |
TANG D D. Critical role of actin-associated proteins in smooth muscle contraction, cell proliferation, airway hyperresponsiveness and airway remodeling[J]. Respir Res, 2015, 16: 134. |
| [13] |
ZHANG Y, SARADNA A, RATAN R, et al. RhoA/Rho-kinases in asthma: from pathogenesis to therapeutic targets[J]. Clin Transl Immunology, 2020, 9(5): e01134. |
| [14] |
STRASSHEIM D, GERASIMOVSKAYA E, IRWIN D, et al. RhoGTPase in vascular disease[J]. Cell, 2019, 8(6): 551. |
| [15] |
HIGASHIDA C, KIUCHI T, AKIBA Y, et al. F- and G-actin homeostasis regulates mechanosensitive actin nucleation by formins[J]. Nat Cell Biol, 2013, 15(4): 395-405. |
| [16] |
DUAN X, ZHANG Y, CHEN K L, et al. The small GTPase RhoA regulates the LIMK1/2-cofilin pathway to modulate cytoskeletal dynamics in oocyte meiosis[J]. J Cell Physiol, 2018, 233(8): 6088-6097. |
| [17] |
WANG R X, YU Q F, WANG X L, et al. Rac1 silencing, NSC23766 and EHT1864 reduce growth and actin organization of bladder smooth muscle cells[J]. Life Sci, 2020, 261: 118468. |
| [18] |
OH M M, CHOI H, PARK M G, et al. Is there a correlation between the presence of idiopathic detrusor overactivity and the degree of bladder outlet obstruction?[J]. Urology, 2011, 77(1): 167-170. |




