非酒精性脂肪肝病(non-alcoholic fatty liver disease,NAFLD)是由饮食、遗传因素和胰岛素抵抗等引起的多项代谢功能障碍综合性肝病,截至2019年,我国NAFLD的发病率接近30%,发病人数逐年增加,且呈现年轻化趋势[1]。NAFLD会导致肝硬化、肝癌,并会诱发心血管疾病,显著增加全因死亡风险,由于NAFLD发病机制的复杂性,以及存在众多复杂的并发症,NAFLD至今尚无有效的治疗药物,NAFLD的防治已成为我国公共卫生领域的一项重要任务和研究课题。高脂饮食是导致NAFLD发生发展的重要原因,而其中又涉及众多因子的调控,特别是炎症因子IL-6、IL-1β和TNF-α等的过表达和NLRP3炎症小体的过度激活会推动NAFLD的发生和演化[2]。
NAFLD的发生、发展与膳食因素关系密切。茶黄素(theaflavins,TFs)是存在于红茶中的一种天然活性成分,在干红茶中的含量一般为0.3%~1.2%。目前,从红茶中分离纯化的茶黄素类化合物(TFs)已有20多种,这些化合物与TF具有相近的化学结构和生物活性,其中以茶黄素-3, 3′-双没食子酸酯(theaflavin-3, 3′-digallate,TFDG)含量最高,生物活性也最强[3-4]。研究表明,TFs具有抗氧化、抑菌、抗炎等生物学活性[5],但少见TFs对高脂饮食诱导肝损伤及NAFLD发生的影响作用的相关报道。本研究以高脂饮食诱导小鼠肝损伤为实验模型,观察TFDG膳食干预对肝功指标、组织细胞形态和炎症反应的影响,同时探讨相关分子作用机制,旨在为探讨通过膳食途径防治NAFLD提供科学依据。
1 材料与方法 1.1 材料 1.1.1 实验动物6周龄雄性SPF级C57BL/6小鼠40只,购于北京华阜康生物科技股份有限公司[许可证号:SCXK (京) 2019-0008],体质量(20±4)g。实验动物饲养和操作均遵照西南大学实验动物福利伦理规范进行,小鼠饲养于SPF级独立通气笼盒中,每笼5只,仪器压差20 Pa,温度(24.0±0.5)℃,相对湿度50%~70%,昼夜光照节律,自由饮水,水质为Ⅲ级水,3次/周更换垫料,定期对笼具及水瓶进行消毒。本实验经过西南大学实验动物伦理审查委员会批准(2019-0082)。
1.1.2 分组及处理小鼠适应喂养1周后,分为4组:正常对照组(NC)、模型对照组(MC)、TFDG干预组(TF5和TF10),每组10只。NC组喂食普通饲料,以生理盐水灌胃,其余3组喂食高脂饲料,其中MC组以生理盐水灌胃,TF5和TF10组分别以5 mg/kg和10 mg/kg TFDG溶液灌胃,持续12周。
1.1.3 动物饲料普通饲料由北京华阜康生物科技股份有限公司提供,具体配方:玉米淀粉、麦芽糖糊精、奶粉、玉米油、无水奶油、纤维素、酪蛋白、蛋氨酸、矿物质混合物、维生素混合物。蛋白质含量约22%,总脂肪含量约5%,水分含量约9%,粗纤维含量约2%,灰分约5%,赖氨酸含量≥1.7%,蛋氨酸+胱氨酸≥1.1%,总钙≥1.2%,钙磷比为1.56∶1;蛋白质供能比24.0%,脂肪供能比12.5%,碳水化合物供能比63.5%。高脂饲料:对普通饲料添加15%的猪油和0.25%的胆固醇,蛋白质供能比16.9%,脂肪供能比40.0%,碳水化合物供能比43.1%。
1.1.4 试剂茶黄素-3, 3′-双没食子酸酯购于上海源叶生物科技有限公司;总甘油三酯(TG)、总胆固醇(TC)、谷丙转氨酶(ALT)和谷草转氨酶(AST)检测试剂盒购于南京建成生物工程研究所;IL-6、IL-1β和TNF-α ELISA检测试剂盒、一抗NLRP3、caspase-1、IL-1β和β-actin、二抗、DAB显色试剂盒、RNAeasyTM动物miRNA抽提试剂盒、BeyoFastTM SYBR Green One-Step qRT-PCR Kit、胰酶和胶原酶均购于上海碧云天生物技术研究所,miR-223寡核苷酸抑制物(inhibitor)及阴性对照序列(anti-miR-NC)购自上海吉玛公司,Lipofectamine 2000转染试剂为Invitrogen产品,RPMI1640培养基、胎牛血清(FBS)为Gibco产品。
1.2 指标测定 1.2.1 肝指数动物分组处理12周后,禁食过夜,以20 g/L戊巴比妥钠(按照1 mL/kg)麻醉,采用脊椎脱臼法处死小鼠,立即摘取小鼠肝脏组织并称量肝脏湿重,之后一部分放入-80 ℃冰箱中备用,另一部分置于4%多聚甲醛溶液中固定。肝指数=肝质量/体质量(mg/g)。
1.2.2 肝脏切片病理观察取出在多聚甲醛中固定的肝组织,脱水,包埋在新鲜石蜡中,采用石蜡切片机切片(5 μm),经脱蜡后,苏木精染色液浸泡5 min,双蒸水洗涤1 min,1%盐酸酒精分化30 s,1% Na2HPO4·12H2O溶液返蓝1 s,1%伊红染色液浸泡3 min,梯度酒精脱水,中性树胶封片,于显微镜下观察肝组织形态学方面的改变。
1.2.3 血清ALT和AST水平检测腹主动脉取血,置于取血管中,静置2 h后,3 000 r/min,离心20 min,取上层血清,置-80 ℃冰箱备用。取各组血清,按照试剂盒操作说明采用全自动生化分析仪测定,检测温度37 ℃,检测波长340 nm,延迟时间60 s,监测时间120 s。
1.2.4 肝组织TG和TC含量测定取肝组织0.1 g,加入0.9 mL异丙醇中,匀浆,室温放置24 h,3 000 r/min,离心10 min,提取上清液,按照试剂盒操作说明采用全自动生化分析仪测定,检测温度37 ℃,检测波长510 nm,测定光密度值D(510)。TG或TC含量=D样/D校×校准品浓度÷样本品蛋白浓度。
1.2.5 肝组织IL-1β、IL-6和TNF-α水平测定取各组肝组织200 mg,放入生理盐水研磨制成10%组织匀浆,4 ℃下3 000 r/min, 离心10 min后取上清液,严格按ELISA试剂盒说明书步骤操作,采用酶标仪检测450 nm处的光密度值D(450),以标准品绘制标准曲线,测定炎症因子IL-1β、IL-6及TNF-α的含量。
1.2.6 NLRP3、caspase-1和IL-1β蛋白表达水平检测取肝组织约50 mg置于EP管内,加入500 μL的RIPA裂解液(其中含1%体积的PMSF),冰上充分裂解10 min,于4 ℃,12 000 r/min,离心后取上清。BCA法测蛋白浓度,计算各样品上样体积,每孔上样量为20 μL,采用12% SDS-PAGE胶进行电泳,半干性转膜法转膜,5%脱脂奶粉封闭2 h;分别加入一抗NLRP3、caspase-1、IL-1β和β-actin(均1∶1 000稀释),4 ℃孵育过夜,TBST缓冲液洗膜3次,加入二抗(1∶2 000),室温孵育1 h,洗膜3次后,DAB显色,采用VILBER FUSION FX7成像系统拍照,利用Quantity One软件进行条带分析。
1.2.7 qRT-PCR检测使用RNAeasyTM动物miRNA抽提试剂盒提取肝脏组织总miRNA,使用BeyoFastTM SYBR Green One-Step qRT-PCR Kit进行qRT-PCR,以U6作为内参,严格按照试剂盒操作说明进行。反转录:50 ℃ 20 min,预变性:95 ℃ 2 min,PCR:95 ℃ 15 s,60 ℃ 30 s,40个循环。引物序列由GenScript生物技术公司(南京)设计并合成。反应结束后,对结果进行熔解曲线分析,利用2-ΔΔCt方法计算miR-223相对表达量,公式如下:ΔΔCt=ΔCt实验组-ΔCt对照组,ΔCt=Ct(目标基因)-Ct(内参)。引物序列为:miR-223正向5′-TGGTGGACCTGACCTGCCGT-3′,反向5′-CAATGCCAGCCCCAGCGTCA-3′;U6正向5′-CTCGCTTCGGCAGCACA-3′,反向5′-AACGCTTCACGAATTTGCGT-3′。
1.2.8 肝细胞分离培养C57BL/6小鼠麻醉后,在无菌条件下切开腹腔,取肝剪碎。选用RPMI1640培养基添加10%胎牛血清(FBS),用胶原酶和胰蛋白酶(1∶1混合培液中)消化肝组织20 min,过滤,离心,培养液洗涤2次。细胞悬浮后接种至24孔板,5% CO2,37 ℃培养4 h,弃去未贴壁细胞,台盼蓝检测细胞存活率>90%,分组处理细胞。
1.2.9 细胞转染和处理细胞按2×105/孔接种到24孔培养板,置培养箱孵育过夜;待细胞融合度为60%~70%,利用Lipofectamine 2000转染试剂(Lipo 2000)进行转染。按转染说明书,将无血清培养液与inhibitor、anti-miR-NC混合后室温静置5 min(A液),将Lipo 2000与无血清培养液充分混合(B液);A液与B液充分混匀后室温静置20 min,按每孔1 μg inhibitor+2 μL Lipo 2000的比例加至培养板孔,转染6 h弃上清液更换正常培养液,并继续培养48 h。将未转染细胞和转染细胞均分为对照组(NC)、高脂模型组(MC)和TFDG干预组(TF10),MC组以200 μmol/L棕榈酸处理细胞24 h,TF10组以200 μmol/L棕榈酸+10 μmol/L TFDG联合处理24 h,NC组以溶剂对照。
1.3 统计学分析实验数据用x±s表示,采用SPSS 18.0统计分析软件进行处理,多组间比较采用单因素方差分析,两组间比较采用LSD-t检验,检验水准α=0.05。
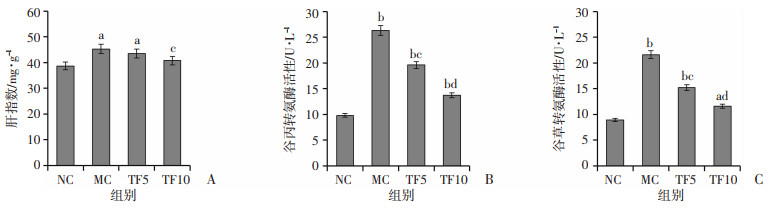
2 结果 2.1 TFDG膳食干预对高脂饮食小鼠肝功指标的影响肝指数结果(图 1A)表明,MC组小鼠肝指数较NC组明显增高(P < 0.05),同时生化检测结果(图 1B、C)显示,与NC组比较,MC组小鼠血清ALT和AST水平均显著升高(P < 0.01),反映出高脂饮食诱发小鼠肝损伤;与MC组相比,TF10组肝指数显著降低(P < 0.05),且TF5组和TF10组AST和ALT水平均显著降低(P < 0.05,P < 0.01),表明TFDG膳食干预可有效减轻高脂饮食造成的肝损伤。
|
|
a: P < 0.05, b: P < 0.01, 与NC组比较;c: P < 0.05, d: P < 0.01, 与MC组比较 A: 肝指数测定结果;B: 血清谷丙转氨酶活性水平;C: 血清谷草转氨酶活性水平 图 1 TFDG膳食干预对高脂饮食小鼠肝功指标的影响 |
2.2 TFDG膳食干预对高脂饮食小鼠肝组织病理形态的影响
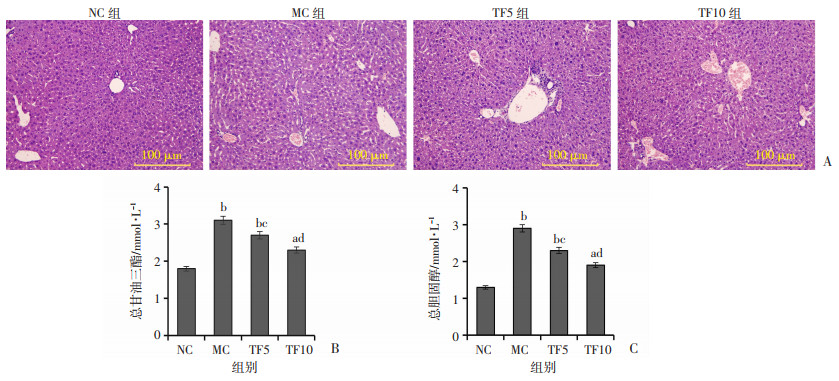
肝脏组织切片病理学观察结果(图 2A)表明,NC组肝细胞大小一致,细胞核居中,基本无脂滴形成,无空泡脂肪变性现象;MC组肝细胞发生明显改变,细胞大小不一,且出现大量脂滴;与MC组相比,TF5组和TF10组细胞内脂滴有所减少。检测肝组织TG和TC含量(图 2B、C)也表明,MC组肝组织TG和TC均显著升高(P < 0.01),TFDG膳食干预可有效降低肝组织TG和TC的水平(P < 0.05,P < 0.01)。
|
|
a: P < 0.05, b: P < 0.01, 与NC组比较;c: P < 0.05, d: P < 0.01, 与MC组比较 A: HE染色观察肝组织病理学变化;B: 肝组织匀浆总甘油三酯(TG)含量;C: 肝组织匀浆总胆固醇(TC)含量 图 2 TFDG膳食干预对高脂饮食诱导小鼠肝组织病理改变的影响 |
2.3 TFDG膳食干预对高脂饮食小鼠肝脏炎症反应的影响
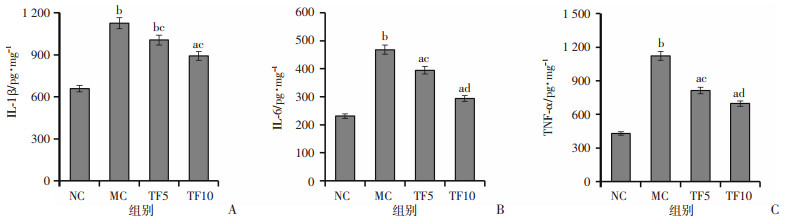
肝组织炎症因子的检测结果(图 3)显示,MC组小鼠IL-1β、IL-6和TNF-α的水平较NC组均显著升高(P < 0.01),表明高脂饮食可显著诱发小鼠肝脏炎症反应。与MC组相比,TF5组和TF10组小鼠以上炎症因子的水平均显著降低(P < 0.05,P < 0.01),表明TFDG膳食干预可有效抑制高脂饮食诱发的肝脏炎症反应。
|
|
a: P < 0.05, b: P < 0.01, 与NC组比较;c: P < 0.05, d: P < 0.01, 与MC组比较 A: 肝组织IL-1β水平;B: 肝组织IL-6水平;C: 肝组织TNF-α水平 图 3 TFDG膳食干预对高脂饮食小鼠肝脏炎症因子水平的影响 |
2.4 TFDG对高脂饮食小鼠肝组织NLRP3炎症通路的影响
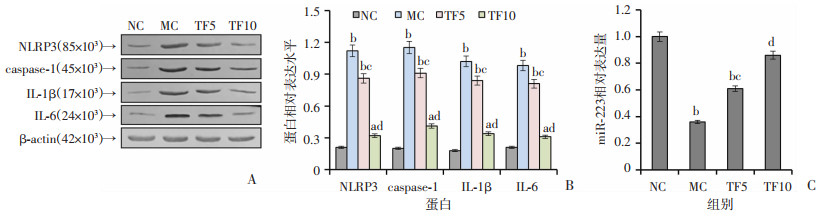
Western blot检测各组小鼠肝组织中NLRP3炎症通路蛋白的表达状况,结果(图 4A、B)显示,MC组小鼠肝组织中NLRP3的表达水平明显升高(P < 0.01),且caspase-1、IL-1β和IL-6的表达均显著增高(P < 0.01),反映出NLRP3炎症通路上调;与MC组相比,TFDG干预组(TF5和TF10)NLRP3的表达水平显著降低(P < 0.05,P < 0.01),同时caspase-1、IL-1β和IL-6的释放水平均显著下降(P < 0.05,P < 0.01),表明TFDG干预可有效抑制高脂饮食诱导的肝组织NLRP3炎症通路的激活。
|
|
a: P < 0.05, b: P < 0.01, 与NC组比较;c: P < 0.05, d: P < 0.01, 与MC组比较 A: Western blot检测肝组织蛋白表达;B: 半定量分析; C:qRT-PCR检测结果 图 4 TFDG对高脂饮食小鼠肝组织NLRP3炎症通路及miR-223表达的影响 |
2.5 miR-223对TFDG抑制高脂诱导肝细胞炎症反应的影响
miR-223是负性调控NLRP3表达的重要miRNA,qRT-PCR检测结果(图 4C)表明,MC组小鼠肝组织中miR-223的表达水平明显下降(P < 0.01),TFDG干预可抑制高脂饮食诱导的miR-223表达下降(P < 0.05,P < 0.01)。体外培养小鼠肝细胞,并以miR-223寡核苷酸抑制物(inhibitor)及阴性对照序列(anti-miR-NC)转染细胞,观察miR-223对TFDG抑制高脂诱导肝细胞炎症反应的影响。qRT-PCR检测结果(图 5A)表明,高脂条件下(MC)肝细胞miR-223表达显著降低(P < 0.01),TFDG干预(10 μmol/L)可显著上调miR-223表达(P < 0.01);细胞转染inhibitor后,各组miR-223表达均显著降低(P < 0.01,P < 0.05),可有效阻断TFDG对miR-223表达的影响。炎症因子水平检测(图 5B、C)结果显示,对于未转染细胞,高脂条件下(MC)炎症因子水平显著上升(P < 0.01),TFDG干预(TF10)可显著降低炎症因子水平(P < 0.05);细胞转染miR-223 inhibitor后,TFDG对炎症反应的抑制作用显著降低(P < 0.05)。

|
|
a: P < 0.05, b: P < 0.01, 与NC组比较;c: P < 0.05, d: P < 0.01, 与MC组比较;e: P < 0.05, f: P < 0.01, 与anti-miR-NC细胞的相应组比较 A: qRT-PCR检测miR-223表达;B: IL-1β水平;C: IL-6水平 图 5 miR-223对TFDG抑制高脂诱导肝细胞炎症反应的影响 |
3 讨论
非酒精性脂肪肝病(non-alcoholic fatty liver disease,NAFLD)是一种无过量饮酒史、除酒精和其他明确肝损害因素以外的原因所致的肝细胞内脂肪堆积,以脂质蓄积和弥漫性肝细胞脂肪变性为主要特征的一种临床病理综合征[6]。NAFLD除了可导致各种肝脏疾病外,还与代谢综合征、2型糖尿病、动脉粥样硬化性血管疾病以及肿瘤等疾病的高发密切相关,NAFLD严重影响居民健康,对NAFLD的防治研究十分重要。
本研究结果显示,红茶中的TFDG可有效减轻高脂饮食诱导的肝损伤和炎症反应,有助于抑制NAFLD的发生、发展。这提示适量饮用红茶摄入茶黄素,对于不良饮食诱导的NAFLD可能具有较好的预防作用,其效果值得进一步关注和研究。
NAFLD的发病与膳食营养因素关系极为密切,高热量、高脂肪、高血糖负荷的饮食都会促进NAFLD的发生,并推动NAFLD的不断演化,探讨通过膳食途径防治NAFLD具有十分重要的现实意义。朱国英等[7]通过对ω-3多不饱和脂肪酸联合膳食营养干预对NAFLD患者的影响研究发现,ω-3多不饱和脂肪酸联合膳食营养较单纯膳食营养更能改善NAFLD的症状、肝功能、血脂、胰岛素抵抗及部分肝组织病理变化。文献[8]报道,膳食补充维生素E可改善NAFLD患者的肝功指标,与单纯使用吡格列酮相比,联合使用维生素E会大大提高治疗效果,能够节约用药成本,提高健康效益。本研究表明,红茶中的茶黄素对于防治高脂饮食诱发的炎症反应具有一定作用,提示茶黄素对减轻高脂饮食诱发的NAFLD有潜在功效。
炎症反应在众多疾病发生演化过程中扮演重要角色,其对NAFLD的推动作用十分重要。在NAFLD患者肝脏组织中,可观察到肝实质和间质细胞中有大量淋巴细胞、单核巨噬细胞等浸润现象,并会释放出多种炎症因子如IL-6、IL-8、TNF-α、TGF-β等[9]。特别是在肥胖人群中,NAFLD患者脂肪变性程度加重,伴随着促炎因子水平升高和抗炎因子水平降低。IL-1β、IL-6、TNF-α等炎症因子是机体发生慢性炎症的早期标志物,在NAFLD患者中发挥促炎作用,显著损伤肝细胞,进而推动NAFLD的发展。IL-1β是具有多效性功能的免疫细胞因子,可诱导多种促炎因子基因的表达,显著增加三酰甘油的积累和脂肪酸合成酶的表达,并可增加诱导脂肪性肝炎和纤维化程度,此外还能通过抑制过氧化物酶体增殖物激活受体-α和增强TNF-α,诱导肝细胞死亡,从而在NAFLD的发展中发挥作用[10]。IL-6是由单核细胞、淋巴细胞、巨噬细胞等产生的细胞因子,参与机体的免疫调节和脂质代谢,IL-6的高表达通常与肥胖和胰岛素抵抗相关,相比正常人群,IL-6在NAFLD患者中水平更高[11],且与炎症反应水平呈正相关。TNF-α具有多种生物学效应,参与调节机体的免疫反应、炎症反应和脂质代谢等过程,是导致肝脏损伤的重要细胞因子[12]。本研究结果显示,TFDG膳食干预可显著降低IL-1β、IL-6和TNF-α的水平,表明TFDG可有效抑制高脂饮食诱发的肝脏炎症反应,抑制NAFLD的发生、发展。
NLRP3炎症小体是一种多蛋白复合物,由NLRP3受体蛋白、凋亡相关斑点蛋白(ASC)和天冬氨酸蛋白酶-1(caspase-1)三部分组成[13]。NLRP3炎症小体激活后,募集相关炎症因子,使自身寡聚化,引起caspase-1自我剪切、活化,进而剪切裂解和释放成熟的IL-1β、IL-18,从而进一步加剧炎症反应[14]。NLRP3炎症小体过度激活,会导致IL-1β、IL-18等细胞因子大量释放,所引起的炎症瀑布式反应会对机体产生严重损害,因此对NLRP3炎症小体的激活必须严格的控制和调节。有研究表明,NAFLD患者NLRP3及其相关组分表达明显增加,使用药物抑制NLRP3表达后会减轻肝脏脂肪变性、肝细胞炎症和肝纤维化[15]。同时研究表明,在NAFLD小鼠模型和人类患者中,NLRP3及其相关因子1L-1β表达水平异常,通过基因敲除或使用药物抑制NLRP3炎症小体表达,可明显降低NAFLD小鼠肝纤维化的风险[16]。可见,NLRP3/IL-1β炎症通路的激活会加速NAFLD的进展,而抑制此炎症通路可减轻NAFLD炎症反应。
微RNA(microRNA,miRNA)是备受关注的一类非编码小分子RNA,miRNA可通过与靶mRNA特异性结合,从而抑制靶基因的转录后表达。有研究表明,miR-223的异常表达与肝脏炎症损伤、肝细胞癌密切相关[17],进一步的研究显示,miR-223对NLRP3蛋白表达发挥重要的负性调控机制,可显著下调NLRP3的表达并抑制NLRP3/IL-1β炎症通路[18]。本研究发现,TFDG在体内、体外均可显著上调高脂条件下肝细胞miR-223的表达,并抑制高脂条件下NLRP3/IL-1β炎症通路的激活,以miR-223寡核苷酸抑制物阻断TFDG对miR-223表达的影响后,其对炎症反应的抑制作用明显降低,显示出miR-223在TFDG抑制高脂诱导肝细胞炎症反应中发挥重要作用,TFDG可能通过上调miR-223抑制NLRP3/IL-1β炎症通路,这可能是其保护肝脏的重要作用机制,有待进一步深入探讨。
| [1] |
LI J, ZOU B, YEO Y H, et al. Prevalence, incidence, and outcome of non-alcoholic fatty liver disease in Asia, 1999-2019: a systematic review and meta-analysis[J]. Lancet Gastroenterol Hepatol, 2019, 4(5): 389-398. |
| [2] |
LEBEAUPIN C, VALLÉE D, HAZARI Y, et al. Endoplasmic Reticulum stress signalling and the pathogenesis of non-alcoholic fatty liver disease[J]. J Hepatol, 2018, 69(4): 927-947. |
| [3] |
TAKEMOTO M, TAKEMOTO H. Synthesis of theaflavins and their functions[J]. Molecules, 2018, 23(4): 918. |
| [4] |
PEREIRA-CARO G, MORENO-ROJAS J M, BRINDANI N, et al. Bioavailability of black tea theaflavins: absorption, metabolism, and colonic catabolism[J]. J Agric Food Chem, 2017, 65(26): 5365-5374. |
| [5] |
HE H F. Research progress on theaflavins: efficacy, formation, and preparation[J]. Food Nutr Res, 2017, 61(1): 1344521. |
| [6] |
冯巩, 贺娜, 王菊宁, 等. 非酒精性脂肪性肝病的流行病学与血清无创诊断研究进展[J]. 中华肝脏病杂志, 2018, 26(6): 476-480. FENG G, HE N, WANG J N, et al. Advances in epidemiology and serum markers for the noninvasive diagnosis of nonalcoholic fatty liver disease[J]. Chin J Hepatol, 2018, 26(6): 476-480. |
| [7] |
朱国英, 黄东平, 黄建伟, 等. ω-3多不饱和脂肪酸联合膳食营养对非酒精性脂肪性肝病患者的影响[J]. 同济大学学报(医学版), 2017, 38(2): 79-83. ZHU G Y, HUANG D P, HUANG J W, et al. Effectiveness of combined Omega-3 polyunsaturated fatty acids with dietary nutrition in patients with non-alcoholic fatty liver disease[J]. J Tongji Univ Med Sci, 2017, 38(2): 79-83. |
| [8] |
MAHADY S E, WONG G, CRAIG J C, et al. Pioglitazone and vitamin E for nonalcoholic steatohepatitis: a cost utility analysis[J]. Hepatology, 2012, 56(6): 2172-2179. |
| [9] |
陈洁, 陈佳良, 肖琨珉, 等. 炎症因子与非酒精性脂肪性肝病关系研究进展[J]. 医学综述, 2019, 25(15): 2949-2954. CHEN J, CHEN J L, XIAO K M, et al. Research advances in relationship between nonalcoholic fatty liver disease and inflammatory factors[J]. Med Recapitul, 2019, 25(15): 2949-2954. |
| [10] |
MEHAL W Z. The inflammasome in liver injury and non-alcoholic fatty liver disease[J]. Dig Dis, 2014, 32(5): 507-515. |
| [11] |
王晓晓, 饶慧瑛, 刘峰. 非酒精性脂肪性肝病发病机制研究进展: 聚焦"巨噬细胞及其分子机制"[J]. 医学综述, 2019, 25(15): 2929-2934. WANG X X, RAO H Y, LIU F. Research progress in pathogenesis of nonalcoholic fatty liver disease-focusing on "macrophages and related molecular mechanisms"[J]. Med Recapitul, 2019, 25(15): 2929-2934. |
| [12] |
KAKINO S, OHKI T, NAKAYAMA H, et al. Pivotal role of TNF-α in the development and progression of nonalcoholic fatty liver disease in a murine model[J]. Horm Metab Res, 2018, 50(1): 80-87. |
| [13] |
王子媛, 郑涛, 陈黎, 等. NLRP3炎症小体在非酒精性脂肪性肝病中作用的研究进展[J]. 山东医药, 2021, 61(10): 84-87. WANG Z Y, ZHENG T, CHEN L, et al. Advances in the study of the role of NLRP3 inflammatory cartilage in non-alcoholic fatty liver disease[J]. Shandong Med J, 2021, 61(10): 84-87. |
| [14] |
HAMARSHEH S, ZEISER R. NLRP3 inflammasome activation in cancer: a double-edged sword[J]. Front Immunol, 2020, 11: 1444. |
| [15] |
WAN X, XU C, YU C, et al. Role of NLRP3 inflammasome in the progression of NAFLD to NASH[J]. Can J Gastroenterol Hepatol, 2016, 2016: 6489012. |
| [16] |
邓涛, 龚建平, 何堃. NLRP3基因敲除对非酒精性脂肪性肝炎小鼠的影响[J]. 山东医药, 2019, 59(1): 1-4. DENG T, GONG J P, HE K. Effect of knockout of NLRP3 gene on non-alcoholic steatohepatitis mice[J]. Shandong Med J, 2019, 59(1): 1-4. |
| [17] |
JEFFRIES J, ZHOU W, HSU A Y, et al. miRNA-223 at the crossroads of inflammation and cancer[J]. Cancer Lett, 2019, 451: 136-141. |
| [18] |
NEUDECKER V, HANEKLAUS M, JENSEN O, et al. Myeloid-derived miR-223 regulates intestinal inflammation via repression of the NLRP3 inflammasome[J]. J Exp Med, 2017, 214(6): 1737-1752. |




