重症急性胰腺炎(severe acute pancreatitis,SAP)是一种与多器官功能障碍相关的炎症性疾病,病死率可达6%~8%[1],是世界范围内的严重健康问题。因此,开发新的生物标志物以尽早识别重症患者,并采取积极治疗阻止病情进展,对改善SAP患者的临床结果具有重要意义。目前认为炎性细胞浸润是急性胰腺炎发生发展的关键因素。可溶性尿激酶型纤溶酶原激活物受体(soluble urokinase-type plasminogen activator receptor,suPAR)是新进研究热点的炎性因子之一,多项研究表明,血浆suPAR水平在多种危重疾病中显著升高,如脓毒症、恶性肿瘤、急性肝功能衰竭等,并与疾病的严重程度及预后密切相关[2-4]。而关于suPAR在急性胰腺炎中的作用,目前尚不明确。因此,本研究通过分析急性胰腺炎患者血浆suPAR水平与病情严重程度的关系,探讨其对SAP的预测价值。
1 资料与方法 1.1 研究对象选取我科2021年3月1日至6月1日收治的103例急性胰腺炎患者进行前瞻性队列研究。其中男性63例,女性40例,年龄27~80(47.2±13.9)岁。纳入标准:①发病48 h内入院;③年龄在18~80岁;②遵照2013年《中国急性胰腺炎诊治指南》诊断标准[5],即符合下列3项特征中的2项即可:与急性胰腺炎相符合的腹痛;血清淀粉酶和/或脂肪酶活性至少高于正常值上限3倍;腹部影像学检查符合急性胰腺炎影像学改变。排除标准:①慢性胰腺炎或慢性胰腺炎急性发作;②合并严重肝、肾、呼吸、心血管系统疾病、自身免疫性疾病及恶性肿瘤;③1个月内使用过非甾体抗炎药或长期使用类固醇及其他免疫调节剂。根据2012年新亚特兰大急性胰腺炎分类标准[6],将伴有持续器官功能衰竭(≥48 h)的急性胰腺炎患者纳入SAP组,其余急性胰腺炎患者纳入非重症急性胰腺炎(non severe acute pancreatitis,NSAP)组。另选取同期的健康体检者30例作为对照组,其中男性16例,女性14例,年龄31~81(49.4±14.7)岁。本研究由陆军军医大学第一附属医院伦理委员会批准,伦理审批号(KY2021009)。所有参与者签署知情同意书。
1.2 样本采集和指标观测采集急性胰腺炎患者入院即刻外周静脉血2 mL,高速离心后取血浆,保存在低温恒温冰箱(-80 ℃)中直至测定。采用酶联免疫吸附试验检测患者血浆中的suPAR浓度。同时记录患者临床信息,包括年龄、性别、身体质量指数(body mass index,BMI)、急性胰腺炎病因及入院当天各项实验室指标,包括①血常规:白细胞计数(white blood cell, WBC)、中性粒细胞计数(neutrophil,NEUT)、血红蛋白(hemoglobin,HGB);②血生化:谷草转氨酶(aspartate transaminase,AST)、总胆红素(total bilirubin,TBil)、白蛋白(albumin,ALB)、血肌酐(serum creatinine,SCr)、血尿素氮(blood urea nitrogen, BUN)、血清钙(calcium,Ca2+);③炎性指标:降钙素原(procalcitonin,PCT)、白介素-6(interleukin-6,IL-6)、C-反应蛋白(C-reactive protein, CRP);④凝血功能:D-二聚体。根据检验检查结果和临床指标计算急性生理学与慢性健康状况评分系统Ⅱ(acute physiology and chronic health evaluation, APACHEⅡ)评分和Ranson’s评分。对照组血浆样本保存及检测方法同急性胰腺炎患者,并记录其人口学特征(年龄和性别)。
1.3 统计学分析符合正态分布的计量资料采用x±s表示,偏态分布的采用M(P25,P75)表示,计数资料以频数与百分比表示。计量资料呈正态分布的,两组间比较采用t检验,多组间比较采用方差分析;非正态分布的两组间比较采用Mann-Whitney U检验,多组间比较采用Kruskal-Wallis检验。各指标的相关性采用Pearson相关分析。采用多因素Logistic回归分析SAP的独立预测因素。采用受试者工作特征曲线(receiver operating characteristic, ROC)评价各独立预测因素对SAP的预测价值。检验水准α=0.05。
2 结果 2.1 SAP组与NSAP组临床资料的比较两组研究对象的年龄、BMI、性别构成比差异无统计学意义。与NSAP组比较,SAP组AST、TBil、BUN、D-二聚体、PCT、CRP、IL-6水平明显升高,ALB、Ca2+水平显著降低,差异有统计学意义(P < 0.05)。SAP组APACHEⅡ评分及Ranson’s评分均显著高于NSAP组(P < 0.05,表 1)。
| 指标 | 重症急性胰腺炎组(n=23) | 非重症急性胰腺炎组(n=80) | t/Z/χ2 | P |
| 男性/例 | 15 | 48 | 0.205 | 0.651 |
| 年龄/岁 | 45.0±15.0 | 47.8±13.7 | 0.879 | 0.381 |
| BMI/kg·m-2 | 26.7±3.61 | 25.3±3.02 | -1.919 | 0.058 |
| 病因/例 | 1.773 | 0.813 | ||
| 胆源性 | 4 | 22 | ||
| 高三酰甘油血症性 | 12 | 43 | ||
| 酒精性 | 1 | 2 | ||
| 其他病因 | 6 | 13 | ||
| WBC/109·L-1 | 9.15(6.30, 12.26) | 9.35(6.08, 12.94) | 0.032 | 0.975 |
| NEUT/109·L-1 | 7.22(5.40, 11.10) | 7.69(4.72, 11.07) | 0.063 | 0.949 |
| HGB/g·L-1 | 110.0(94.0, 136.0) | 121.0(109.3, 134.8) | 1.247 | 0.212 |
| AST/U·L-1 | 38.5(25.3, 70.8) | 24.8(19.1, 33.3) | -3.156 | 0.002 |
| TBil/mmol·L-1 | 25.1(13.0, 38.2) | 15.6(12.8, 23.6) | -2.087 | 0.037 |
| BUN/mmol·L-1 | 4.90(2.73, 10.13) | 3.20(2.69, 4.30) | -2.439 | 0.015 |
| SCr/μmol·L-1 | 61.0(48.4, 101.0) | 56.8(46.1, 65.3) | -1.465 | 0.143 |
| ALB/g·L-1 | 27.4(24.5, 31.9) | 33.1(30.0, 36.3) | 3.477 | 0.001 |
| Ca2+/mmol·L-1 | 1.84±0.25 | 2.12±0.21 | 5.315 | 0.000 |
| D-二聚体/μg·mL-1 | 5.87(3.31, 8.34) | 1.78(0.90, 2.85) | -5.389 | 0.000 |
| PCT/ng·mL-1 | 3.20(0.81, 13.37) | 0.14(0.05, 0.58) | -5.643 | 0.000 |
| CRP/mg·L-1 | 163.0(79.3, 200.0) | 68.8(31.5, 129.4) | -3.861 | 0.000 |
| IL-6/pg·mL-1 | 94.3(52.4, 198.3) | 43.7(23.1, 88.3) | -3.235 | 0.001 |
| APACHE Ⅱ评分/分 | 12(8, 18) | 5(2, 8) | -5.240 | 0.000 |
| Ranson’s评分/分 | 2(1, 3) | 1(0, 2) | -5.846 | 0.000 |
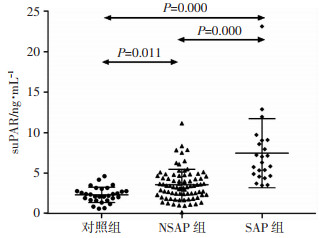
2.2 3组研究对象血浆suPAR水平及其比较
SAP、NSAP组与健康对照组3组间性别或年龄差异无统计学意义。SAP组患者入院血浆suPAR水平为(7.47±4.27)ng/mL,NSAP组为(3.57±1.91) ng/mL,均显著高于对照组(2.33±0.95) ng/mL。SAP组入院血浆suPAR水平较NSAP组明显升高。见图 1。
|
| 图 1 3组研究对象血浆suPAR水平及其比较 |
2.3 血浆suPAR水平与APACHEⅡ评分、Ranson’s评分及常用炎症指标的相关性
Pearson相关分析结果显示,血浆suPAR水平与APACHEⅡ评分(R=0.554,P=0.000)、Ranson’s评分(R=0.485,P=0.001)呈正相关。此外,我们还统计了血浆suPAR水平与临床常用炎症指标(WBC、NEUT、PCT、CRP、IL-6)的相关性,发现suPAR与PCT(R=0.504,P=0.000)、CRP(R=0.270,P=0.006)和IL-6(R=0.310,P=0.001)呈正相关,与WBC(R=0.103,P=0.302)、NEUT(R=0.02,P=0.856)未见相关性。
2.4 预测SAP的多因素Logistic回归分析采用逐步回归法,对上述SAP组与NSAP组差异具有统计学意义的10个临床指标(AST、TBil、BUN、D-二聚体、PCT、CRP、IL-6、ALB、Ca2+、suPAR)进行多因素Logistic回归分析,结果显示,suPAR、D-二聚体、Ca2+进入方程(P < 0.05),为SAP的独立预测因素。见表 2。
| 因素 | B | SE | OR | 95%CI |
| suPAR | 0.762 | 0.230 | 2.143 | 1.366~3.363 |
| D-二聚体 | 0.410 | 0.136 | 1.507 | 1.154~1.968 |
| Ca2+ | -6.184 | 1.889 | 0.002 | 0.000~0.084 |
| 常量 | 5.320 | 3.429 | 204.360 |
2.5 预测SAP的ROC曲线分析
将上述3个独立预测因素(suPAR、D-二聚体、Ca2+)纳入ROC曲线分析,结果如表 3所示。以最大约登指数对应的截断值4.32 ng/mL为临界值,suPAR预测SAP的曲线下面积(area under the curve,AUC)为0.869,其敏感性为87.0%,特异性为72.5%。而D-二聚体的AUC=0.870,取临界值为3.27 μg/mL时,其敏感性为78.3%,特异性为87.5%;Ca2+的AUC= 0.804,取临界值为2.00 mmol/L时,其敏感性为78.3%,特异性为75.0%。
| 因素 | AUC | P | 95%CI | 临界值 | 敏感性(%) | 特异性(%) |
| suPAR | 0.869 | <0.001 | 0.789~0.928 | 4.32 | 87.0 | 72.5 |
| D-二聚体 | 0.870 | <0.001 | 0.789~0.928 | 3.27 | 78.3 | 87.5 |
| Ca2+ | 0.804 | <0.001 | 0.715~0.876 | 2.00 | 78.3 | 75.0 |
3 讨论
SAP患者与NSAP患者临床预后差别较大。NSAP往往具有自限性,一般经过液体复苏、抑酶、止痛等处置,预后较好。而SAP的死亡率达6%~8%,往往需要更多的医疗支持,如重症监护、呼吸机及连续肾脏替代疗法的使用[7],因此,早期识别SAP对患者的管理及预后至关重要。现阶段,多个评分系统被用来评估急性胰腺炎的严重程度,如APACHE Ⅱ评分、Ranson’s评分[8]等。除了需兼顾颇多指标的各评分系统,单独的实验标志物也被尝试拿来评估急性胰腺炎的严重性,如PCT、CRP、D-二聚体[9-10]等指标,而本研究的目的是评估血浆suPAR水平对SAP的预测价值。
SuPAR是当机体受到炎症刺激和免疫激活时,尿激酶型纤溶酶原激活物受体(urokinase-type plasminogen activator receptor,uPAR)被蛋白酶剪切后形成的可溶性形式。UPAR主要表达在各种免疫活性细胞上,如巨噬细胞、中性粒细胞、活化的T淋巴细胞等,参与介导细胞迁移、黏附、分化、增殖等多种细胞功能,在机体免疫应答被激活后水平上调。suPAR存在于人的血液、尿液、脑脊液等多种体液中,昼夜浓度变化趋势不明显,且易于检测[11]。多项研究表明,血浆suPAR水平在多种危重疾病中显著升高,如脓毒症、恶性肿瘤、急性肝功能衰竭等,并与疾病的严重程度及预后密切相关。
本研究结果显示,急性胰腺炎患者入院血浆suPAR水平显著高于健康人群,SAP患者血浆suPAR水平显著高于NSAP患者。同时,血浆suPAR水平与APACHE Ⅱ评分、Ranson’s评分呈正相关,提示血浆suPAR水平与胰腺炎患者病情严重程度密切相关。其可能的原因是,血浆suPAR作为一种非特异性炎症标志物,其血浆水平反映了机体炎症激活的程度,在急性胰腺炎发病过程中表达增加,而SAP中炎症激活的发生发展更为强烈,因此SAP患者的血浆suPAR水平要显著高于NSAP组及对照组。此外,过度产生的suPAR可能通过增强纤溶酶原激活信号通路,促进细胞粘附、迁移和增殖进程,放大炎症级联反应,进一步诱导患者器官功能衰竭,加重胰腺炎的严重程度。
我们进一步探讨了suPAR与临床常规炎症标志物的相关性,结果显示,suPAR仅与PCT有着较好的相关性,与CRP、IL-6呈低度相关,与WBC及NEUT未发现相关性。GUSTAFSSON等[12]检测了27例脓毒症患者的血浆suPAR,发现其与PCT、CRP、IL-6相关性均较弱。考虑到既往的报道中,suPAR在恶性肿瘤、重度肝硬化等危重疾病中同样表达升高,提示suPAR反映的可能是免疫系统的普遍激活,而不是具体的病原体感染过程。
进一步的多因素Logistic回归分析显示,suPAR、D-二聚体和Ca2+为SAP的独立预测因素。孔浩等[10]、LIU等[13]的研究发现,D-二聚体、Ca2+水平与胰腺炎病情严重程度相关,本研究结果同样证实了这一点。SuPAR预测SAP的AUC为0.869,稍低于D-二聚体(AUC=0.870),而高于Ca2+(AUC=0.804),证明在已有研究较多的标志物之外,suPAR可以作为一种新的急性胰腺炎严重程度分层的独立标志物。
急性胰腺炎患者血浆suPAR水平增高的具体来源尚需进一步探讨。GUSSEN等[14]通过对87例重症监护室的危重患者的研究发现,提出中性粒细胞可能是危重病患者血浆suPAR的主要来源。类风湿性关节炎的患者血浆中升高的suPAR可能同样来源于活化的中性粒细胞[15]。然而,KOCH等[4]通过对肝硬化患者的研究指出,“非典型”单核细胞是肝硬化患者中血浆suPAR的主要细胞来源,与之对应的是,HAHM等[16]报道了未成熟的髓细胞是慢性肾病中血浆suPAR过度产生的主要来源,而过度产生的suPAR促进了蛋白尿肾病的发展。但本研究并未发现suPAR水平与中性粒细胞计数的相关性,分析其原因,首先急性胰腺炎作为一种炎症性疾病,多种免疫活性细胞参与其中,其血浆suPAR具体细胞来源尚不明确。其次,suPAR主要来源于免疫活性细胞表面uPAR的裂解,其血浆水平可能主要受uPAR裂解程度而非细胞数目的影响。最后,中性粒细胞的分布可分为循环池和边缘池,中性粒细胞计数仅反映了其循环池中的水平。进一步的基础研究有待开展,探讨影响uPAR激活或suPAR释放过程有可能作为一种新的(例如以中性粒细胞或单核细胞为靶点)治疗来改善SAP患者的病程。
本研究存在的不足之处:首先,只是单中心的研究,病例数尤其是SAP患者偏少。其次,未动态监测急性胰腺炎患者的血浆suPAR水平,对其动态规律缺乏研究和阐释。在后续的研究中,大样本、多中心的临床试验有待进一步开展,急性胰腺炎患者血浆suPAR水平的动态规律及其具体来源有待进一步研究。
总之,血浆suPAR水平与急性胰腺炎患者病情严重程度相关,对预测SAP具有重要价值,提示suPAR有可能成为急性胰腺炎患者入院时一种新的严重程度分层的标志物。
| [1] |
朱文艺, 杜珊珊, 何佳霖, 等. 不同营养支持途径补充谷氨酰胺对重症急性胰腺炎患者血清蛋白水平的叠加效应[J]. 第三军医大学学报, 2016, 38(3): 284-287. ZHU W Y, DU S S, HE J L, et al. Superimposed effect of glutamine supplementation by different pathways on serum albumin in severe acute pancreatitis patients[J]. J Third Mil Med Univ, 2016, 38(3): 284-287. |
| [2] |
HUANG Q R, XIONG H Y, YAN P J, et al. The diagnostic and prognostic value of suPAR in patients with sepsis: a systematic review and meta-analysis[J]. Shock, 2020, 53(4): 416-425. |
| [3] |
LIU K L, FAN J H, WU J. Prognostic role of circulating soluble uPAR in various cancers: a systematic review and meta-analysis[J]. Clin Lab, 2017, 63(5): 871-880. |
| [4] |
KOCH A, ZIMMERMANN H W, GASSLER N, et al. Clinical relevance and cellular source of elevated soluble urokinase plasminogen activator receptor (suPAR) in acute liver failure[J]. Liver Int, 2014, 34(9): 1330-1339. |
| [5] |
王兴鹏, 李兆申, 袁耀宗, 等. 中国急性胰腺炎诊治指南(2013年, 上海)[J]. 胃肠病学, 2013, 18(7): 428-433. WANG X P, LI Z S, YUAN Y Z, et al. Guidelines for diagnosis and treatment of acute pancreatitis in China (2013, Shanghai)[J]. Chin J Gastroenterol, 2013, 18(7): 428-433. |
| [6] |
BANKS P A, BOLLEN T L, DERVENIS C, et al. Classification of acute pancreatitis—2012: revision of the Atlanta classification and definitions by international consensus[J]. Gut, 2013, 62(1): 102-111. |
| [7] |
杜奕奇, 陈其奎, 李宏宇, 等. 中国急性胰腺炎诊治指南(2019年, 沈阳)[J]. 临床肝胆病杂志, 2019, 35(12): 2706-2711. DU Y Q, CHEN Q K, LI H Y, et al. Chinese guidelines for the management of acute pancreatitis (Shenyang, 2019)[J]. J Clin Hepatol, 2019, 35(12): 2706-2711. |
| [8] |
周圆圆, 杨丽, 廖忠莉, 等. BISAP与Ranson's评分对急性胰腺炎患者预后评估的比较[J]. 第三军医大学学报, 2012, 34(7): 658-661. ZHOU Y Y, YANG L, LIAO Z L, et al. BISAP score vs Ranson's criteria in predicting outcomes of acute pancreatitis[J]. J Third Mil Med Univ, 2012, 34(7): 658-661. |
| [9] |
徐益萍, 骆方军, 郑军, 等. 重症急性胰腺炎患者血清降钙素原与C-反应蛋白测定的临床价值[J]. 中华医院感染学杂志, 2017, 27(5): 1089-1092. XU Y P, LUO F J, ZHENG J, et al. Clinical value of serum procalcitonin and C-reactive protein in diagnosis of patients with severe acute pancreatitis[J]. Chin J Nosocomiol, 2017, 27(5): 1089-1092. |
| [10] |
孔浩, 丁震, 朱先超, 等. 急性胰腺炎患者血浆D-二聚体变化与病情相关性研究[J]. 中华内科杂志, 2007(12): 1011-1013. KONG H, DING Z, ZHU X C, et al. Serum D-dimer changes and prognostic implication in acute pancreatitis[J]. Chin J Intern Med, 2007(12): 1011-1013. |
| [11] |
THUNØ M, MACHO B, EUGEN-OLSEN J. suPAR: the molecular crystal ball[J]. Dis Markers, 2009, 27(3): 157-172. |
| [12] |
GUSTAFSSON A, LJUNGGREN L, BODELSSON M, et al. The prognostic value of suPAR compared to other inflammatory markers in patients with severe sepsis[J]. Biomark Insights, 2012, 7: 39-44. |
| [13] |
LIU B, LI D, HU X, et al. The predictive value of serum calcium for acute pancreatitis with persistent organ failure[J]. Am J Emerg Med, 2018, 36(4): 726-727. |
| [14] |
GUSSEN H, HOHLSTEIN P, BARTNECK M, et al. Neutrophils are a main source of circulating suPAR predicting outcome in critical illness[J]. J Intensive Care, 2019, 7: 26. |
| [15] |
PLIYEV B K, MENSHIKOV M Y. Release of the soluble urokinase-type plasminogen activator receptor (suPAR) by activated neutrophils in rheumatoid arthritis[J]. Inflammation, 2010, 33(1): 1-9. |
| [16] |
HAHM E, WEI C, FERNANDEZ I, et al. Bone marrow-derived immature myeloid cells are a main source of circulating suPAR contributing to proteinuric kidney disease[J]. Nat Med, 2017, 23(1): 100-106. |




