膀胱癌是泌尿系统常见的恶性肿瘤[1]。对于晚期膀胱癌患者以及膀胱根治性切除术患者的辅助化疗与新辅助化疗,顺铂是一线化疗药物。但由于部分患者出现对顺铂耐药,总体预后较差,化疗有效率在35%~60%[2]。目前认为,耐药是导致膀胱癌预后不良的主要因素,针对化疗耐药的膀胱癌患者,迫切需要发展新的治疗方案。
耐药的相关机制主要包括减少癌细胞中的药物积累、增强抗凋亡能力以及过度表达某些多重耐药蛋白,如ATP结合盒(ABC)转运体[3]。有证据表明,癌细胞的大多数抗药行为与线粒体密切相关。靶向线粒体也已被证明是对抗不同类型耐药癌细胞的有效策略[4]。然而,线粒体靶向治疗在耐药膀胱癌中的效果尚不清楚。近年来,一种兼具线粒体和肿瘤靶向性的近红外荧光染料IR-780被广泛观察和研究,并且其在顺铂耐药的肺癌模型中显示出卓越的肿瘤抑制效应[5]。本研究在成功建立稳定的膀胱癌耐药顺铂细胞株(T24/DDP)的基础上,探究IR-780对T24/DDP细胞的杀伤作用,为发展新的耐药膀胱癌治疗方案提供理论依据。
1 材料与方法 1.1 材料与试剂IR-780、MitoSOX购自Sigma公司(美国);CCK-8试剂盒购自Dojindo Kumamoto公司(日本);RPMI1640培养基购自Gibco公司(美国);胎牛血清、胰酶购自HyClone公司(美国);青链霉素、Mitotracker Green购自碧云天公司(中国);阿霉素、吉西他滨购自阿拉丁公司(中国);凋亡检测试剂盒购自BD Biosciences公司(美国);O.C.T购自Sakura公司(日本)。
1.2 实验方法 1.2.1 T24/DDP细胞的建立取对数生长期的T24细胞在体外采用浓度梯度法逐步递增顺铂(DDP)浓度,经过12个月成功诱导出顺铂耐药的膀胱癌细胞株(T24/DDP)。通过倒置相差显微镜观察T24、T24/DDP细胞形态差异,CCK-8法测定T24/DDP细胞对DDP的耐药指数,并绘制生长曲线反映其增殖能力。
1.2.2 细胞活力测定将T24/DPP细胞以3×103/孔接种于96孔板中,分别予以不同浓度(2.5、5.0、7.5、10.0、15.0、20.0 μmol/L)的IR-780、阿霉素、吉西他滨进行处理,48 h后使用CCK-8试剂盒检测各孔在450 nm波长的光密度值[D(450)],并计算细胞活力。
1.2.3 细胞划痕实验为了解IR-780对于细胞侵袭力的影响,将T24/DPP细胞接种于6孔板内,当细胞融合达到90%以上时,用200 μL无菌枪头在6孔板底部各作1条垂直均一的划痕,PBS清洗后分别加入含有不同浓度(0、5、10、15 μmol/L)IR-780的培养基1 mL孵育,并分别于划痕0、6、12、24 h对划痕部位进行拍照分析。
1.2.4 实验动物及分组选取6~8周龄雄性裸鼠,体质量18~20 g,购自陆军军医大学实验动物中心,饲养于陆军军医大学火箭军医学教研室的SPF动物房。所有实验和动物护理程序获得陆军军医大学实验动物中心动物保护和使用委员会的批准。为构建异种移植瘤动物模型,将生长至70%的T24/DDP细胞悬浮在PBS中,每只小鼠皮下植入1×107个细胞。荷瘤成功后,将小鼠完全随机化分为3组:对照组、阿霉素组和IR-780组,分别予以PBS(5 mg/kg)、阿霉素(5 mg/kg)、IR-780(5 mg/kg)腹腔注射,隔天1次。每3天测定肿瘤体积大小,于荷瘤后18 d处死小鼠后,取肿瘤组织进行称量。
1.2.5 近红外成像为明确IR-780在体内的肿瘤靶向分布,建立T24/DDP皮下移植瘤裸鼠模型,单次腹腔注射1 mg/kg的IR-780,24 h后麻醉裸鼠,采用活体成像系统进行裸鼠的近红外活体成像,所用激发波长770 nm,发射波长830 nm。随后,颈椎脱臼法处死裸鼠后,分离肿瘤及重要内脏器官,进行近红外成像。切除部分肿瘤组织及肌肉组织,使用O.C.T包埋冰冻后进行冰冻切片,以Hoechst 33342标记细胞核,使用共聚焦荧光显微镜观察IR-780在肿瘤组织和肌肉组织内的分布情况。IR-780进入肿瘤细胞后,主要在线粒体中聚集[6]。为了明确IR-780在肿瘤细胞中的亚细胞器定位,将T24/DPP细胞接种于共聚焦小皿内,待细胞贴壁后以100 nmol/L Mitotracker Green避光孵育30 min标记线粒体,随后10 μmol/L IR-780孵育30 min,通过荧光共定位明确IR-780是否分布于T24/DPP细胞的线粒体中。
1.2.6 流式细胞术为检测IR-780对T24/DPP细胞凋亡以及线粒体氧化应激的影响,将细胞以1.5×105/孔接种于6孔板中,待细胞贴壁后,以0、5、10 μmol/L的IR-780处理24 h,随后弃去培养基,胰酶消化收集细胞。加入7-AAD及Annexin V,以C6流式细胞仪检测细胞凋亡。同样浓度梯度IR-780处理细胞后,加入MitoSOX 5 μmol/L孵育30 min,流式细胞仪检测细胞线粒体活性氧水平。
1.3 统计学分析采用SPSS 25.0统计软件,数据以 x±s表示,计量资料采用单因素方差分析,两组间均数比较采用t检验。P < 0.05表示差异有统计学意义。
2 结果 2.1 IR-780对顺铂耐药膀胱癌细胞的杀伤效应分别于亲本膀胱癌细胞(T24)和顺铂耐药膀胱癌细胞(T24/DDP)中加入不同浓度的IR-780,于48 h后用CCK-8法检测细胞活性。IR-780对两种细胞均呈现出浓度依赖性的细胞毒作用,且IR-780在同等浓度下对T24和T24/DDP细胞的生长抑制程度基本相同(图 1A),提示IR-780对耐药膀胱癌细胞具有良好的抗增殖作用。为比较IR-780与临床上膀胱癌常用化疗药物阿霉素和吉西他滨对T24/DDP细胞的抗癌效应,将一定浓度的3种药物分别作用T24/DDP细胞,48 h后对其活性进行检测。结果显示,阿霉素和吉西他滨对T24/DPP的抗肿瘤作用随着浓度的增加并没有显著增强,而IR-780有效地抑制了T24/DDP癌细胞增殖活性,并且在20 μmol/L时对癌细胞的抑制率达83.93%(图 1B)。进一步细胞划痕实验表明,IR-780可显著减慢顺铂耐药膀胱癌细胞的迁移速度(图 1C)。表明IR-780在较高浓度下具有较强的体外抗肿瘤作用,特别是对顺铂耐药的癌细胞有明显的抑制作用。
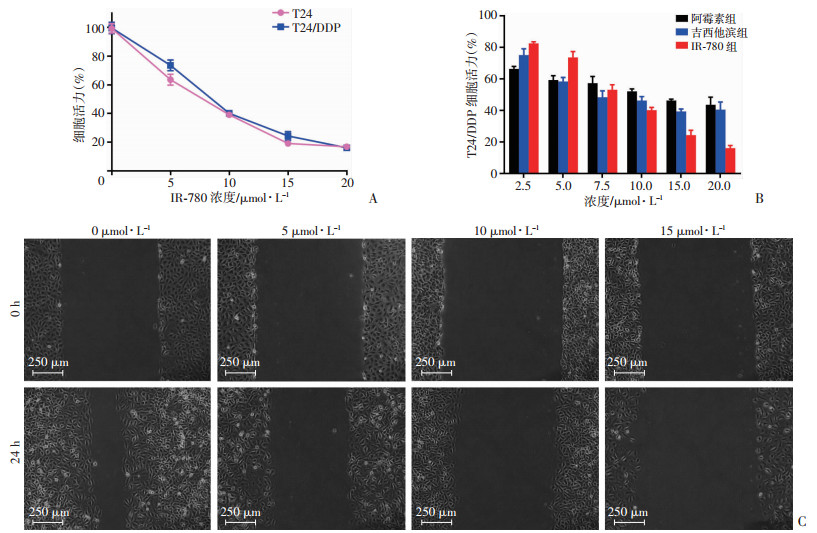
|
| A:不同浓度IR-780对T24、T24/DDP细胞增殖活性的影响;B:不同浓度IR-780、阿霉素、吉西他滨对T24/DDP细胞存活率的影响;C:细胞划痕实验观察不同浓度IR-780对T24/DDP细胞迁移的影响 图 1 IR-780体外抗肿瘤作用 |
2.2 体内实验观测IR-780对顺铂耐药膀胱癌细胞的杀伤效应
将T24/DDP细胞接种于裸鼠皮下,构建小鼠荷瘤模型。各组小鼠移植瘤体积检测结果显示,IR-780组的抗肿瘤效果明显高于对照组和阿霉素组(P < 0.05,图 2A、B)。各组处理18 d后处死小鼠,肿瘤质量检测结果也显示IR-780对顺铂耐药的膀胱癌具有较强的抑瘤能力(P < 0.05,图 2C)。
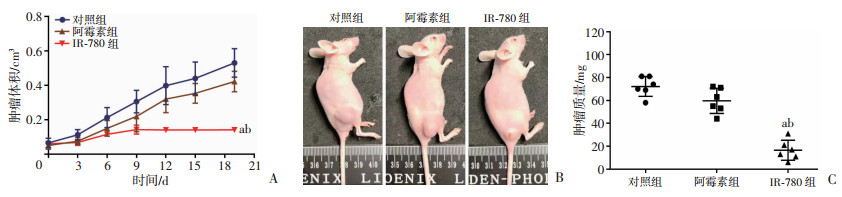
|
|
a: P < 0.05,与对照组比较;b: P < 0.05,与阿霉素组比较 A:各组肿瘤体积变化;B:各组小鼠及肿瘤大体观;C:各组小鼠移植瘤质量变化 图 2 IR-780体内抗肿瘤作用 |
2.3 IR-780对顺铂耐药膀胱癌的靶向作用
建立T24/DDP皮下移植瘤裸鼠模型,单次腹腔注射1 mg/kg的IR-780后进行近红外荧光成像,结果见图 3A、B,注射IR-780后可清晰地观察到移植瘤的强烈荧光信号,背景干扰荧光较低。通过共聚焦显微镜对肿瘤标本进行组织病理学观察,证实IR-780在肿瘤中的积聚(图 3C)。进一步比较IR-780在T24(亲本)和T24/DDP(耐药)细胞中的荧光强度,结果显示,T24/DDP细胞的近红外荧光强度高于亲本T24细胞(图 3D)。表明IR-780对顺铂耐药的膀胱癌细胞具有确切的靶向特性。
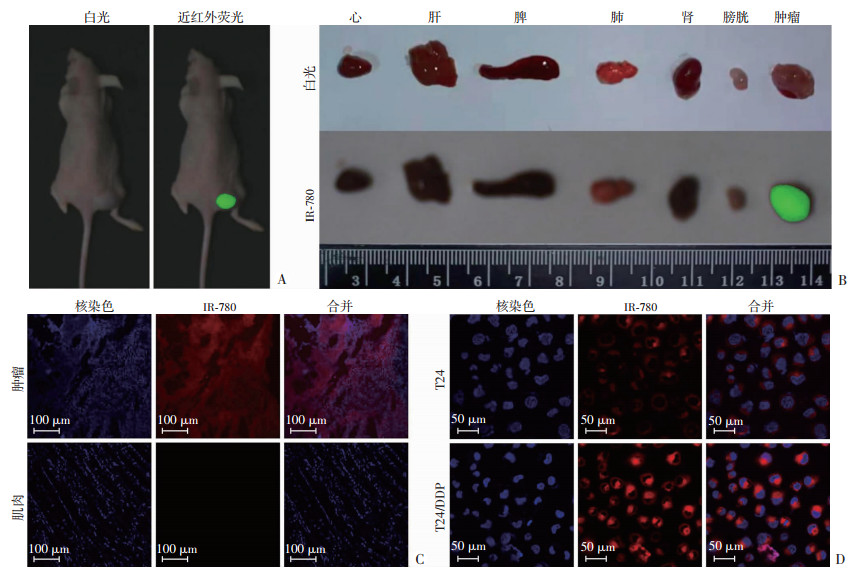
|
| A:T24/DDP荷瘤小鼠近红外荧光成像;B:移植瘤和重要脏器近红外荧光成像;C:共聚焦显微镜观察B图肿瘤切片图像;D:共聚焦显微镜观察IR-780在T24和T24/DDP癌细胞中的表达 图 3 IR-780对顺铂耐药膀胱癌的靶向特性 |
2.4 IR-780对顺铂耐药膀胱癌的杀伤机制
将线粒体荧光探针Mitotracker Green和IR-780在共聚焦显微镜下共定位后发现,IR-780的红色荧光能够和Mitotracker Green绿色荧光重合(图 4A),进一步证实IR-780能够靶向T24/DDP癌细胞线粒体。线粒体是活性氧(ROS)的主要来源,ROS的产生增加可能作用于线粒体上的通透性转换孔复合体,从而诱导线粒体的通透性转换。采用MitoSOX荧光探针对经IR-780处理后T24/DDP细胞中线粒体活性氧进行检测。结果显示,10 μmol/L IR-780处理后,T24/DDP细胞线粒体ROS生成明显增加(P < 0.05,图 4B)。此外,10 μmol/L IR-780作用24 h后,细胞凋亡率接近20%,而对照组凋亡率仅为1%(P < 0.01,图 4C),提示IR-780能显著诱导T24/DDP细胞凋亡。表明IR-780倾向于在耐药膀胱癌细胞的线粒体内积聚,增加线粒体ROS的产生,诱导癌细胞凋亡。
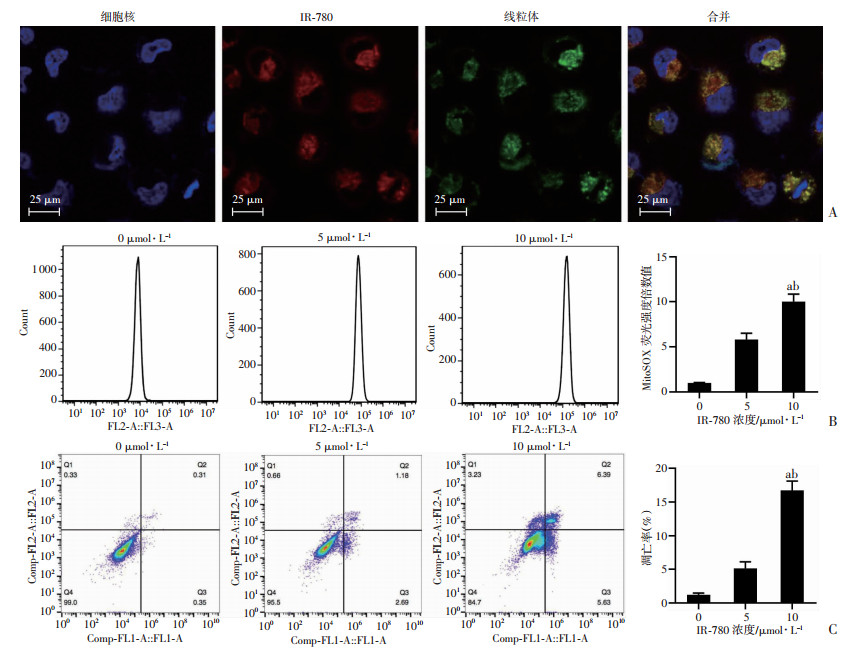
|
|
a: P < 0.01, 与0 μmol/L IR-780组比较;b: P < 0.01, 与5 μmol/L IR-780组比较 A:共聚焦显微镜观察IR-780与线粒体荧光探针Mitotraker green在T24/DDP膀胱癌细胞中的共定位;B:流式细胞术检测不同浓度IR-780处理T24/DDP细胞24 h后线粒体ROS生成情况;C:流式细胞术检测不同浓度IR-780处理T24/DDP细胞24 h后细胞凋亡率 图 4 IR-780对T24/DDP细胞线粒体的影响 |
3 讨论
当前,手术联合术后化疗为膀胱癌临床治疗的主要策略。然而,膀胱癌的复发特性使其治疗变得更加困难。耐药是膀胱癌化疗后复发的主要原因之一,迄今为止,临床上尚未出现有效的治疗方法来对抗膀胱癌的复发及耐药[7]。线粒体的生物合成、能量转化和信号转导在肿瘤发生、发展中起着至关重要的作用[8-9]。靶向肿瘤细胞内线粒体可能为肿瘤靶向治疗提供新的策略,特别是对更依赖线粒体的耐药癌细胞[10-11]。靶向线粒体和调节ROS已被证明是对抗不同类型耐药癌细胞的有效策略。伊利司莫是一种线粒体靶向化合物,可以通过破坏氧化呼吸链导致顺铂耐药黑色素瘤细胞死亡[12]。研究显示,以线粒体为靶点的药物F16与抗肿瘤药物共价连接所形成的纳米粒子,可通过对多种线粒体成分的协同作用有效杀死耐药癌细胞[13]。鱼藤酮是线粒体复合体Ⅰ抑制剂,可以通过增加阿霉素耐药肿瘤细胞活性氧的生成来诱导其凋亡[14]。但由于这些药物较低的肿瘤靶向性限制了其进一步的临床应用。
IR-780是史春梦课题组前期研究发现的同时具有肿瘤靶向和线粒体靶向特性的七甲川花菁类近红外荧光小分子[15-16]。相关研究显示IR-780能够靶向顺铂耐药的肺癌细胞,并且在高剂量条件下显示出较强的抑制肿瘤生长的能力[5]。本研究将IR-780作用于顺铂耐药的膀胱癌细胞,观察IR-780对其肿瘤的杀伤效应。结果表明:在体内实验中,IR-780能够靶向蓄积于肿瘤组织,抑制肿瘤生长。在体外实验中,IR-780呈剂量依赖性抑制顺铂耐药膀胱癌细胞的生长,随着药物浓度的增加,IR-780对癌细胞生长的抑制程度明显强于其他两种化疗药物,提示IR-780可能不受细胞驱动耐药的影响。进一步研究显示,IR-780能够与线粒体靶向荧光探针Mitotracker Green绿色荧光重合,证实IR-780对顺铂耐药膀胱癌细胞的线粒体靶向特性,并可导致线粒体ROS的大量产生,诱导癌细胞发生凋亡。目前大量研究证实癌细胞线粒体所产生的ATP有助于药物外排泵的过度表达,增强癌细胞的药物抵抗[17-18]。因此,我们推测IR-780对耐药膀胱癌细胞的杀伤效应可能是通过破坏癌细胞线粒体的结构和功能来实现的。
目前认为癌细胞耐药的原因主要包括肿瘤内药物蓄积减少、细胞解毒能力和抗凋亡能力增强[19]。在实体瘤中,降低细胞内药物浓度的方法,如增加药物外排、减少内流似乎是主要的耐药机制。史春梦课题组早期报道近红外荧光染料IR-780能够被包括肝癌、肺癌在内的多种癌细胞优先摄取,并且证实细胞表面外排转运体ABCs未参与IR-780的外排[16],不会因为其耐药外排而降低癌细胞内的药物浓度。有趣的是,本研究发现T24/DDP细胞较亲本T24细胞对IR-780有更强的选择性摄取能力,为IR-780在耐药膀胱癌中发挥抗癌效应奠定了基础,但其具体的发生机制尚不清楚。有研究显示,耐药癌细胞较非耐药癌细胞有着更高的线粒体质量和线粒体膜电位,高度极化的线粒体膜可能是亲脂性阳离子在线粒体靶向中发挥作用的关键因素[20]。
综上所述,本研究证实IR-780可以靶向顺铂耐药的膀胱癌细胞,通过作用线粒体产生活性氧,可明显促进T24/DDP细胞凋亡,并显著抑制荷瘤小鼠肿瘤的生长,为顺铂耐药膀胱癌的线粒体靶向治疗提供新的思路。
| [1] |
SIEGEL R L, MILLER K D, FUCHS H E, et al. Cancer statistics, 2021[J]. CA Cancer J Clin, 2021, 71(1): 7-33. |
| [2] |
SANLI O, DOBRUCH J, KNOWLES M A, et al. Bladder cancer[J]. Nat Rev Dis Primers, 2017, 3(1): 1-19. |
| [3] |
ASSARAF Y G, BROZOVIC A, GONÇALVES A C, et al. The multi-factorial nature of clinical multidrug resistance in cancer[J]. Drug Resist Updat, 2019, 46: 100645. |
| [4] |
CUI Q, WANG J Q, ASSARAF Y G, et al. Modulating ROS to overcome multidrug resistance in cancer[J]. Drug Resist Updat, 2018, 41: 1-25. |
| [5] |
WANG Y, LIU T, ZHANG E L, et al. Preferential accumulation of the near infrared heptamethine dye IR-780 in the mitochondria of drug-resistant lung cancer cells[J]. Biomaterials, 2014, 35(13): 4116-4124. |
| [6] |
UTHAMAN S, MATHEW A P, PARK H J, et al. IR 780-loaded hyaluronic acid micelles for enhanced tumor-targeted photothermal therapy[J]. Carbohydr Polym, 2018, 181: 1-9. |
| [7] |
MOLLAEI M, HASSAN Z M, KHORSHIDI F, et al. Chemotherapeutic drugs: cell death- and resistance-related signaling pathways. Are they really as smart as the tumor cells?[J]. Transl Oncol, 2021, 14(5): 101056. |
| [8] |
ZONG W X, RABINOWITZ J D, WHITE E. Mitochondria and cancer[J]. Mol Cell, 2016, 61(5): 667-676. |
| [9] |
VYAS S, ZAGANJOR E, HAIGIS M C. Mitochondria and cancer[J]. Cell, 2016, 166(3): 555-566. |
| [10] |
SHI Y F, LIM S K, LIANG Q R, et al. Gboxin is an oxidative phosphorylation inhibitor that targets glioblastoma[J]. Nature, 2019, 567(7748): 341-346. |
| [11] |
MOLINA J R, SUN Y T, PROTOPOPOVA M, et al. An inhibitor of oxidative phosphorylation exploits cancer vulnerability[J]. Nat Med, 2018, 24(7): 1036-1046. |
| [12] |
CIERLITZA M, CHAUVISTRÉ H, BOGESKI I, et al. Mitochondrial oxidative stress as a novel therapeutic target to overcome intrinsic drug resistance in melanoma cell subpopulations[J]. Exp Dermatol, 2015, 24(2): 155-157. |
| [13] |
PENG Y B, ZHAO Z L, LIU T, et al. A multi-mitochondrial anticancer agent that selectively kills cancer cells and overcomes drug resistance[J]. Chem Med Chem, 2017, 12(3): 250-256. |
| [14] |
WU L, ZHAO J Y, CAO K X, et al. Oxidative phosphorylation activation is an important characteristic of DOX resistance in hepatocellular carcinoma cells[J]. Cell Commun Signal, 2018, 16(1): 6. |
| [15] |
ZHANG C, LIU T, SU Y P, et al. A near-infrared fluorescent heptamethine indocyanine dye with preferential tumor accumulation for in vivo imaging[J]. Biomaterials, 2010, 31(25): 6612-6617. |
| [16] |
ZHANG E L, LUO S L, TAN X, et al. Mechanistic study of IR-780 dye as a potential tumor targeting and drug delivery agent[J]. Biomaterials, 2014, 35(2): 771-778. |
| [17] |
ZHITOMIRSKY B, FARBER H, ASSARAF Y G. LysoTracker and MitoTracker Red are transport substrates of P-glycoprotein: implications for anticancer drug design evading multidrug resistance[J]. J Cell Mol Med, 2018, 22(4): 2131-2141. |
| [18] |
WANG H, GAO Z, LIU X Y, et al. Targeted production of reactive oxygen species in mitochondria to overcome cancer drug resistance[J]. Nat Commun, 2018, 9(1): 562. |
| [19] |
HOUSMAN G, BYLER S, HEERBOTH S, et al. Drug resistance in cancer: an overview[J]. Cancers (Basel), 2014, 6(3): 1769-1792. |
| [20] |
KORSHUNOVA G A, SHISHKINA A V, SKULACHEV M V. Design, synthesis, and some aspects of the biological activity of mitochondria-targeted antioxidants[J]. Biochemistry (Mosc), 2017, 82(7): 760-777. |




