2. 402460 重庆,重庆市荣昌中医院泌尿外科;
3. 402760 重庆,重庆市璧山中医院泌尿外科
2. Department of Urology, Rongchang Hospital of Traditional Chinese Medicine, Chongqing, 402460;
3. Department of Urology, Bishan Hospital of Traditional Chinese Medicine, Chongqing, 402760, China
膀胱癌是泌尿系统常见恶性肿瘤之一[1-2]。尽管目前各类新型治疗手段不断呈现,膀胱癌预后仍无明显改善,其原因可能是膀胱癌恶性进展机制尚不清楚[3]。膀胱癌所处肿瘤微环境(tumor microenvironment, TME)可能对其发生、发展起至关重要的作用。TME由癌组织、细胞间质、微血管等组成,由于肿瘤细胞特定的生长方式及新生血管的不适配,导致其往往处于饥饿、炎症及缺氧等微环境中,内环境的变化可能会诱导肿瘤细胞坏死、凋亡,但也可能促进膀胱癌恶性进程[4]。
自噬作为真核细胞一种保守的细胞代谢方式,在应对诸如缺氧、饥饿等环境时,细胞可通过这一途径维持细胞稳态以应对外界压力[5-6]。自噬可区分为巨自噬、微自噬以及分子伴侣介导的自噬。在饥饿微环境下,多种癌细胞可通过激活巨自噬(后文称自噬)调节细胞能量代谢或转录调节等途径,促进癌细胞的恶性生长,但在膀胱癌中其机制尚不清楚[7-8]。
YAP1(Yes-associated protein 1)蛋白是Hippo通路下游的核心效应蛋白,由于DNA结合区域的结构缺失,其无法作为转录因子与DNA相结合,但YAP1的异常表达以及去磷酸化可帮助YAP1蛋白的入核,促进相关癌基因的转录增加,激活癌细胞的恶性进程如增殖、侵袭及减少凋亡等发生[9-10]。研究表明膀胱癌中YAP1与膀胱癌的恶性进展密切相关,然而YAP1调控膀胱癌恶性进展作用的机理仍十分复杂,YAP1与自噬的调控关系在膀胱癌中尚不清楚[11]。因此,本实验探究饥饿微环境对自噬及YAP1蛋白的影响,以及二者对膀胱癌细胞增殖能力的影响,利用生物信息学方法分析YAP1与自噬相关基因MAP1LC3B(LC3B)表达量,并对膀胱癌患者无病生存期进行预测,希望探寻出膀胱癌进展过程中YAP1蛋白与自噬的作用。
1 材料与方法 1.1 材料人膀胱癌T24细胞株购自美国模式培养物集成库(American Type Culture Collection,ATCC);RPMI1640培养基购自美国HyClone公司;汉克斯平衡盐溶液(HBSS,PYG0079)购自博士德生物公司;胎牛血清购自美国Gibco公司;氯喹(chloroquine, CQ)购自美国Sigma公司;兔抗人LC3B(L7543)购自Sigma公司;兔抗人P62(ab56416)、YAP1(ab52771)蛋白购自Abcam公司;引物及小干扰RNA均由成都擎科生物公司合成,YAP1引物序列及siRNA序列见表 1;显影发光液购自美国Millipore公司;凝胶成像仪购自法国Fusion FX公司,酶标仪购自美国Themo公司;流式细胞仪购自美国Becton Dickinson公司;CCK-8购自北京碧云天生物技术研究所。
| 基因 | 序列(5′→3′) | 种属 |
| 引物 | ||
| YAP1 | 上游:CCGTTTCCCAGACTACCTT | 智人 |
| 下游:TTGGCATCAGCTCCTCTC | ||
| β-actin | 上游:AGAAAATCTGGCACCACACCT | 智人 |
| 下游:GATAGACAGCCTGGATAGCA | ||
| si-RNA | ||
| YAP1-siRNA-1 | 上游:GCAUCUUCGACAGUCUUCUTT | 智人 |
| 下游:AGAAGACUGUCGAAGAUGCTT | ||
| YAP1-siRNA-2 | 上游:UGUUGUUGUCUGAUCGUUGUGAU | 智人 |
| 下游:AUCACAACGAUCAGACAACAACA | ||
| YAP1-siRNA-3 | 上游:GUCCUCCUUUGAGAUCCCUGA | 智人 |
| 下游:UCAGGGAUCUCAAAGGAGGAC |
1.2 资料收集
选用并下载癌症基因组图谱数据库(the Cancer Genome Atlas, TCGA)中402名膀胱癌患者的数据,均有明确临床病理特征及完整随访资料;余生物信息学资料均下载自Oncomine (www.oncomine.org)及GeneMANIA (http://www.genemania.org)网站。
1.3 方法 1.3.1 细胞培养膀胱癌T24细胞用含10%胎牛血清的RPMI1640细胞培养基培养。分为2组:正常组细胞在37 ℃及5%CO2气体环境中常规传代培养。饥饿组细胞正常培养生长至70%~80%,培养基换用不含血清的HBSS处理6 h模拟膀胱癌细胞所处饥饿微环境[12],再进行后续实验。
CQ是一种选择性自噬晚期抑制剂,不影响自噬小体的形成,而通过干预自噬体与溶酶体的结合,破坏晚期自噬流从而干预自噬相关蛋白降解。正常组和饥饿组分别加用CQ处理,CQ处理组选择三蒸水为溶剂,工作浓度为20 μmol/L,处理时间均不小于6 h。
1.3.2 细胞增殖能力检测CCK-8实验:取处于对数生长期的不同处理组细胞,包括正常组、正常+CQ组、饥饿组、饥饿+CQ组、正常+siYAP1组、饥饿+siYAP1组等,常规消化计数,以5 000/孔接种于96孔板上,各孔终体积均为100 μL。按试剂盒说明书,在不同时间点包括0、24、48、72 h时,向各孔加入CCK-8试剂10 μL,静置1 h后利用酶标仪测得波长450 nm处各孔光密度值[D(450)],以反映各组细胞活性,各组实验重复3次,取均值。克隆形成实验:取处于对数生长期的不同处理组细胞常规消化计数,以500/孔接种于6孔板上,常规培养约1周后,用多聚甲醛固定后结晶紫溶液染色,各组实验重复3次,取均值。
1.3.3 荧光定量PCR检测目的基因表达量参照TRIzol试剂说明书操作提取细胞或组织总RNA,鉴定RNA浓度及纯度后,逆转录成cDNA。采用RT-PCR试剂盒,ABI Prism7500型荧光定量PCR仪中扩增,以内参β-actin进行标准化,采用2-△△Ct法计算基因的相对表达量。
1.3.4 Western blot检测蛋白表达量取不同处理组生长对数期细胞,提取总蛋白后利用12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(Sodium Dodecyl Sulfate-polyacrylamide Gelelectrophoresis,SDS-PAGE)分离目的蛋白,电转至聚偏二氟乙烯膜后脱脂牛奶或BSA封闭,4 ℃下一抗孵育过夜后TBST洗膜,二抗室温孵育1 h后滴加化学发光液进行曝光显影,β-actin作为参照,计算蛋白相对表达量。
1.3.5 免疫荧光染色检测LC3B蛋白表达T24细胞接种于共聚焦皿,待贴壁后进行相应处理。不同处理组依次加入多聚甲醛溶液固定,0.1% Tirton X-100通透细胞膜,山羊血清封闭,加入兔抗人LC3B抗体(1∶100稀释)4 ℃过夜后,羊抗兔荧光二抗488(1 ∶100稀释),避光条件下孵育1 h,DAPI染核30 min,PBS冲洗后滴加抗荧光淬灭剂,共聚焦荧光显微镜下观察并拍照。
1.3.6 细胞转染将T24细胞接种于6孔板中,待融合生长至70%~80%后进行转染,包括转染阴性空载对照组和3个不同序列siYAP1小干扰RNA,siRNA设计及合成技术均由成都擎科生物公司提供。
1.3.7 生存曲线绘制对TCGA下载的402例膀胱癌患者YAP1和LC3B表达水平与临床资料进行多因素Cox分析后,建立以YAP1和LC3B高表达为危险因素的风险模型,每个个体风险值计算方式为风险值(risk score)=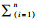
利用GeneMANIA(http://www.genemania.org)网站预测YAP1基因与LC3B基因可能互作或参与调控的相关蛋白,并构建蛋白互作网络,列出互作可能性最高的前20位基因。
1.4 统计学分析采用SPSS 22.0统计软件包进行数据分析。实验数据以x±s表示,计量资料多组间比较采用单因素方差分析,组间比较采用t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 饥饿微环境可诱导膀胱癌细胞增殖能力增强CCK-8及克隆形成实验结果显示,膀胱癌细胞株T24饥饿处理后增殖能力较正常组显著提升(P < 0.05,图 1A、B)。利用FACS检测T24细胞周期变化及凋亡情况,结果显示,经饥饿处理后进入S期的膀胱癌细胞较正常T24细胞显著增加(正常组38.02% vs饥饿组51.73%,图 1C),而落入G1期的细胞明显减少(正常组48.39% vs饥饿组33.15%),证明饥饿微环境促进更多的癌细胞由G1期进入S期;而两组细胞凋亡差异无统计学意义(图 1D),进一步说明饥饿处理后的膀胱癌细胞生长是通过增殖能力增加而非减少凋亡实现的。

|
|
a:P < 0.05,b:P < 0.01,与正常组比较 A:两组克隆形成情况(左)及克隆形成数分析(右);B:CCK-8实验检测两组细胞活性;C:流式细胞术检测两组细胞周期分布(左)及占比情况(右);D:流式细胞术检测两组细胞凋亡(左)及凋亡率分析(右) 图 1 饥饿微环境可诱导膀胱癌T24细胞增殖能力增强 |
2.2 饥饿诱导自噬促进膀胱癌细胞增殖
利用免疫荧光检测T24细胞LC3B在胞质内形成自噬小体的程度。共聚焦显微镜观察结果显示,饥饿处理后的T24细胞胞质内LC3B点状浓聚显著增加(图 2A),提示自噬小体的形成增多。同时,Western blot检测自噬相关标志物P62及LC3B-Ⅱ/Ⅰ的表达变化,其结果也印证饥饿处理后自噬水平上升(图 2B)。利用CQ抑制饥饿诱导的自噬,Western blot结果证实在加用CQ后无论正常组或饥饿组膀胱癌细胞自噬相关标志产物P62及LC3B-Ⅱ/Ⅰ比值均较未用CQ处理组出现上升(图 2B、C),证明CQ可以抑制晚期自噬流。CCK-8实验发现在抑制饥饿诱导的自噬后,膀胱癌细胞增殖能力明显下降,而在正常组中加用CQ并没有引起细胞增殖能力的抑制(图 2D)。以上结果证明饥饿微环境所诱导的自噬是促进膀胱癌细胞增殖能力增加的重要因素。同时,Western blot检测增殖及凋亡相关蛋白表达,发现在饥饿处理后膀胱癌细胞凋亡相关蛋白Bax及Bcl-2未见明显变化,而增殖相关蛋白Cyclin D1明显上升,抑制自噬后Cyclin D1表达量相对减少(图 2C),由此推测饥饿处理诱导的自噬促进膀胱癌细胞增殖能力的增强而非凋亡减少。
|
|
1:正常组;2:正常+CQ组;3:饥饿组;4:饥饿+CQ组;a:P < 0.05,与正常组比较;b:P < 0.05,c:P < 0.01,与饥饿组比较 A:免疫荧光观察两组细胞内LC3B表达及浓聚情况;B:各组细胞不同蛋白的表达;C:各组蛋白相对表达量(左)及LC3BⅡ/Ⅰ比值(右)分析;D:各组细胞不同时间细胞活性 图 2 饥饿诱导自噬促进膀胱癌细胞增殖 |
2.3 饥饿诱导YAP1蛋白调控自噬
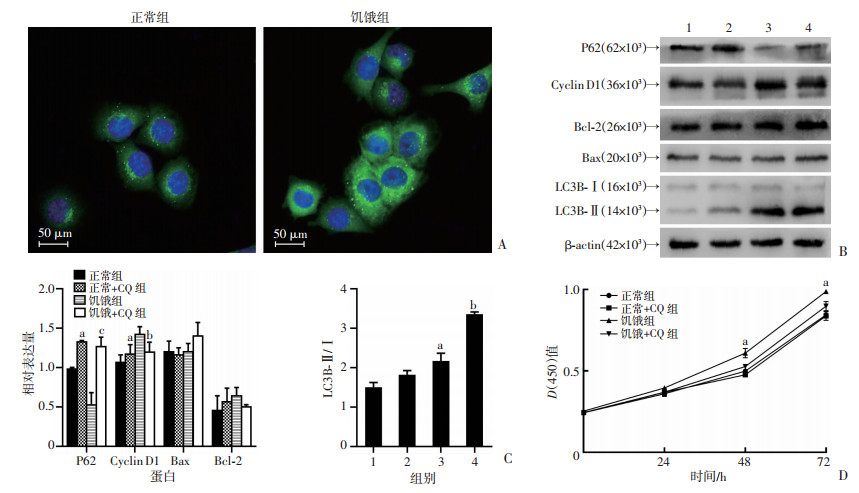
Western blot检测结果显示,饥饿处理后YAP1蛋白表达显著增加,而磷酸化水平呈现明显的降低,CQ处理后其表达量及磷酸化并未出现明显变化(图 3A)。这提示自噬水平的升高可能是膀胱癌细胞在饥饿状态下受到YAP1异常高表达所导致的结果。为进一步证实我们的猜想,利用siRNA敲低YAP1蛋白在T24细胞株中的表达,并在转录及翻译水平均证实序列1的沉默效能最高(图 3B、C),故选择序列1作为后续siRNA。在沉默YAP1后,饥饿组自噬水平受到明显抑制,而正常组沉默YAP1也可一定程度下调自噬水平(P < 0.05,图 3D)。

|
| A:各组细胞总蛋白中YAP1及磷酸化YAP1蛋白相对表达量 1:正常组;2:正常+CQ组;3:饥饿组;4:饥饿+CQ组;a:P < 0.01,与正常组比较;B、C:分别为qPCR(B)和Western blot(C)验证siRNA转染后YAP1敲低效率 1:T24-NC;2:T24-siYAP1;3:T24-siYAP2;4:T24-siYAP3;a:P < 0.01,与T24-NC比较;D:各组细胞总蛋白中YAP1、磷酸化YAP1及自噬相关蛋白相对表达量 1:正常组;2:正常+siYAP1组;3:饥饿组;4:饥饿+siYAP1组;a:P < 0.05,与正常组比较;b:P < 0.05,c:P < 0.01,与饥饿组比较 图 3 饥饿诱导YAP1蛋白调控自噬 |
2.4 饥饿诱导YAP1蛋白表达增强并促进膀胱癌细胞增殖
为验证饥饿处理是否通过上调了YAP1蛋白表达水平及磷酸化水平从而促进自噬引起膀胱癌细胞增殖能力的增加,分别利用siRNA及自噬抑制剂CQ作为自噬启动前或启动时的阻断剂。免疫荧光可观察到饥饿处理的T24细胞在沉默YAP1后,其胞质内LC3B浓聚受到显著抑制(图 4A)。在蛋白水平上可以看到饥饿处理并联合siYAP1后的膀胱癌细胞自噬水平明显下降,且YAP1蛋白由于本身翻译受到抑制,其磷酸化水平也显著下降,但CQ并未对YAP1的异常表达及磷酸化的减少产生显著影响(图 4B)。而在YAP1及自噬被抑制后,饥饿处理不再能够促进膀胱癌细胞的增殖能力增加。这在CCK-8及克隆形成实验中都得到了印证(图 4C、D)。
|
|
1:正常组;2:饥饿组;3:饥饿+siYAP1组;4:饥饿+CQ组;a:P < 0.05,b:P < 0.01,与正常组比较;c:P < 0.05,d:P < 0.01,与饥饿组比较 A:免疫荧光显示T24细胞内LC3表达及浓聚情况;B:Western blot检测细胞中各蛋白表达及半定量分析;C:各组细胞在不同时间点T24细胞活性;D:各组细胞克隆形成实验及定量分析 图 4 饥饿诱导YAP1蛋白表达增强并促进膀胱癌细胞增殖 |
2.5 YAP1蛋白与临床预后
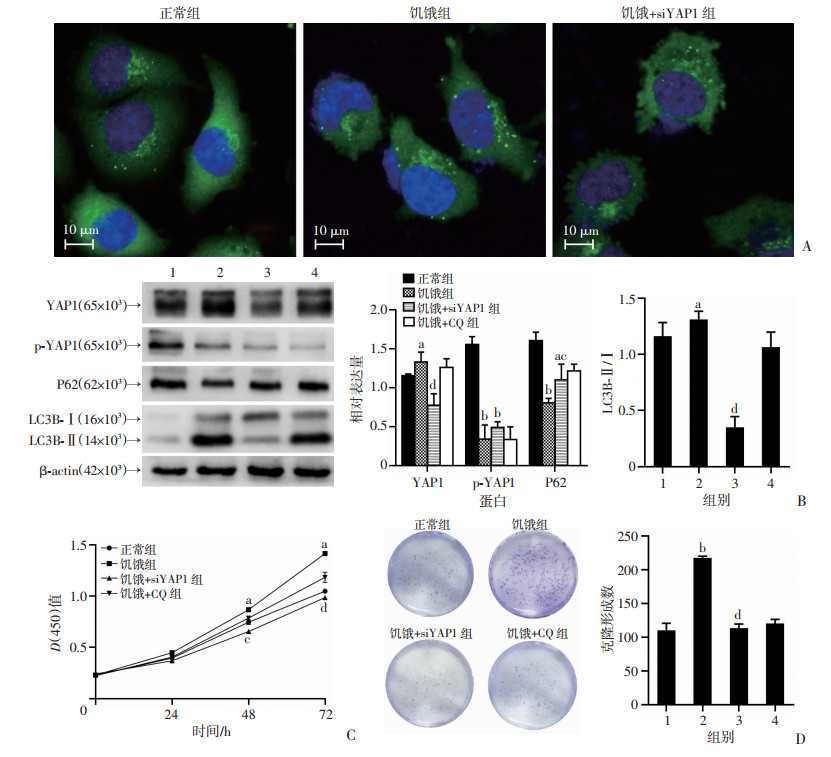
利用Oncomine(https://www.oncomine.org/)网站数据进行YAP1的泛癌表达量分析,结果显示YAP1基因在膀胱癌中表达水平高于其他癌症(图 5A),而且相较于恶性程度更低的浅表型膀胱癌,肌层浸润性膀胱癌患者组织中YAP1的表达量更高(图 5B)。下载TCGA数据库中402例膀胱癌患者转录组数据及临床相关信息,通过对患者YAP1和LC3B基因的表达进行多因素Cox回归分析后,建立以YAP1和LC3B高表达为危险因素的风险模型,模型公式为风险值(risk score)=0.028 824 167 978 055 5×YAP1表达量+0.141 685 903 296 273×LC3B表达量,所得总和取中位值后将患者分为高风险和低风险两组,进一步对高低风险组患者的预后进行分析发现,尽管在肿瘤预后总体生存率(OS)上两组患者并未出现明显差异(P>0.05,图 5C),但在疾病无进展生存期(PFS)上高风险组却明显短于低表达组(图 5D)。利用GeneMANIA预测YAP1基因与LC3B基因可能互作或参与调控的相关蛋白,并构建蛋白互作网络以及列出互作可能性最高的前20位基因(图 5E)。以上结果提示YAP1是一个与癌症发生、发展密切相关的癌基因,其在膀胱癌的进展过程晚期起到了促癌的作用,而YAP1和LC3B基因的高表达可能预示着患者无进展生存期相对较短,与前期实验发现YAP1促进自噬从而调控膀胱癌恶性增殖的结果是相印证的。
|
| A:泛癌中YAP1基因表达情况 在膀胱癌中表达更高;B:Oncomine数据库中不同浸润深度膀胱癌组织与YAP1表达情况 随着浸润深度的增加YAP1表达水平更高;C:来自TCGA数据库402例膀胱癌患者依据YAP1和LC3B的表达差异及所占权重分为高危组与低危组(划分界限为表达量中位值);D:依据YAP1和LC3B表达所构建风险模型的不同风险患者无病生存率(DFS);E:蛋白互作网络分析(PPI)预测YAP1与LC3B相互调控可能的作用蛋白 图 5 YAP1蛋白与膀胱癌患者临床及预后的关系 |
3 讨论
目前膀胱癌恶性进展机制仍不清楚。本研究针对可能影响膀胱癌恶性进展的饥饿微环境进行模拟,发现膀胱癌细胞增殖能力明显增强。由此深入探究饥饿微环境对膀胱癌恶性增殖的促进作用。
膀胱癌的发生、发展与所处肿瘤微环境有着密不可分的联系,癌细胞过度生长与新生血管形成不足,可引起乏血供导致癌细胞处于缺氧、饥饿等微环境中[14]。癌细胞利用多种方式来应对这一不利于生长的环境,不仅利用代谢重编程、上皮间质转化(epithelial-mesenchymal transition,EMT)、上调自噬水平等方式增强其生存能力,还利用微环境中不同细胞在压力下异常生成的缺氧诱导因子、乳酸以及各类外泌体所包含信号因子等促进癌细胞的增殖、侵袭转移以及免疫逃逸等[15-16]。自噬作为细胞进化出的一种分解代谢过程,在晚期进展过程中表现出促癌效应。在应对微环境所产生不利于生长的压力时,癌细胞可通过异常增强的自噬增加非必需分子、蛋白以及细胞器的降解,维持细胞内环境的稳态并促进癌细胞的存活与生长[17]。目前对饥饿微环境诱导膀胱癌细胞自噬的研究尚少,这一效应如何影响膀胱癌细胞恶性生长尚不清楚。在乳腺癌、肝癌等癌症中饥饿诱导自噬对癌细胞恶性进展的促进作用已有一定研究。乳腺癌细胞经葡萄糖饥饿诱导后可出现mTORC1的异常活化,引起自噬水平上调和AKT信号通路增强,促进乳腺癌细胞生长[18]。肝癌细胞在饥饿诱导后自噬水平上调,可通过Wnt/β-catenin信号通路诱导MCT1的高表达,从而促进肝癌细胞的转移[19]。饥饿诱导子宫内膜癌细胞中去乙酰化酶的过表达可正向调控自噬,通过LC3乙酰化的减少从而引起癌细胞增殖能力的增加[20]。本研究结果显示,饥饿微环境可诱导细胞自噬水平的上调,促进膀胱癌细胞增殖,利用自噬抑制剂阻断自噬流后其增殖能力得到明显的抑制,流式细胞实验及Western blot结果表明饥饿处理所引起增殖能力改变是通过影响膀胱癌细胞生长周期的变化而非凋亡水平改变,可能是饥饿诱导的膀胱癌细胞G1期缩短,使更多的细胞从G1期转变至S期,促进癌细胞周期变化及细胞增殖。
Hippo信号通路是经典的细胞增殖及分化的调控通路,在癌症发生、发展中也起着重要作用[21]。YAP1蛋白是Hippo通路下游的核心效应蛋白,在多种癌症中均发现其异常表达与癌症进展密切相关,例如在乳腺癌中YAP1可通过直接与锌指蛋白1(ZEB1)相结合的方式诱导乳腺癌细胞EMT,促进乳腺癌的转移发生[22];而在胰腺癌中,WDR3的过表达可通过激活YAP1的异常表达促进胰腺癌的恶性进展发生[23]。在膀胱癌中,YAP1也受到广泛关注,LI等[24]发现TME中葡萄糖的含量与膀胱癌转移有明显相关性,进一步探究后发现微环境中葡萄糖含量可以调控膀胱癌细胞EMT发生,机制可能与YAP1过表达相关。尽管自噬与YAP1的调控关系在膀胱癌中尚不清楚,但有研究发现肝癌细胞中lncRNA ATB可通过上调YAP1过表达从而介导自噬水平增强[25]。PAVEL等[26]研究发现相较于正常细胞,癌细胞恶性生长以及转移的发生可能与解除细胞接触抑制的作用相关,YAP1核转位与细胞向恶性生长转变有着显著的相关性,YAP1/自噬轴的形成在其中起到至关重要作用。因此,本研究在膀胱癌中利用饥饿模型发现自噬明显增强,同时发现YAP1异常过表达,在利用siRNA成功敲低YAP1表达水平后,自噬水平被抑制,具体表现在自噬相关蛋白改变减少以及LC3B浓聚的减弱,同时膀胱癌细胞增殖能力也被抑制。通过生物信息学发掘,发现YAP1在膀胱癌组织中的表达水平高于其他癌组织,且随着膀胱癌的进展,YAP1的表达逐渐上升,提示YAP1过表达与膀胱癌进展相关联。同时通过构建YAP1和LC3B基因表达量的风险模型,发现二者的过表达与临床预后密切相关。
综上,本研究初步证实在饥饿诱导下膀胱癌细胞可通过异常表达并活化YAP1蛋白,诱导细胞自噬水平的增强,从而促进癌细胞增殖能力增加。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. |
| [2] |
贺海蓉, 李莉, 冯敖梓, 等. 1990-2017年全球膀胱癌发病率和死亡率的研究[J]. 中国循证医学杂志, 2020, 20(11): 1257-1265. HE H R, LI L, FENG A Z, et al. The incidence and mortality of global bladder cancer from 1990 to 2017[J]. Chin J Evid Based Med, 2020, 20(11): 1257-1265. |
| [3] |
YIN M, JOSHI M, MEIJER R P, et al. Neoadjuvant chemotherapy for muscle-invasive bladder cancer: a systematic review and two-step meta-analysis[J]. Oncologist, 2016, 21(6): 708-715. |
| [4] |
LI F P, TENG H L, LIU M D, et al. Prognostic value of immune-related genes in the tumor microenvironment of bladder cancer[J]. Front Oncol, 2020, 10: 1302. |
| [5] |
RYBSTEIN M D, BRAVO-SAN PEDRO J M, KROEMER G, et al. The autophagic network and cancer[J]. Nat Cell Biol, 2018, 20(3): 243-251. |
| [6] |
DE DUVE C, WATTIAUX R. Functions of lysosomes[J]. Annu Rev Physiol, 1966, 28(1): 435-492. |
| [7] |
MENG Q, XU J, LIANG C, et al. GPx1 is involved in the induction of protective autophagy in pancreatic cancer cells in response to glucose deprivation[J]. Cell Death Dis, 2018, 9(12): 1187. |
| [8] |
SUN X, SHU Y H, XU M T, et al. ANXA6 suppresses the tumorigenesis of cervical cancer through autophagy induction[J]. Clin Transl Med, 2020, 10(6): e208. |
| [9] |
TAO J Y, CALVISI D F, RANGANATHAN S, et al. Activation of β-catenin and Yap1 in human hepatoblastoma and induction of hepatocarcinogenesis in mice[J]. Gastroenterology, 2014, 147(3): 690-701. |
| [10] |
FERNANDEZ-L A, SQUATRITO M, NORTHCOTT P, et al. Oncogenic YAP promotes radioresistance and genomic instability in medulloblastoma through IGF2-mediated Akt activation[J]. Oncogene, 2012, 31(15): 1923-1937. |
| [11] |
XU M X, GU M, ZHOU J, et al. Interaction of YAP1 and mTOR promotes bladder cancer progression[J]. Int J Oncol, 2020, 56(1): 232-242. |
| [12] |
TONG H, YIN H, HOSSAIN M A, et al. Starvation-induced autophagy promotes the invasion and migration of human bladder cancer cells via TGF-β1/Smad3-mediated epithelial-mesenchymal transition activation[J]. J Cell Biochem, 2019, 120(4): 5118-5127. |
| [13] |
ZHANG J X, SONG W, CHEN Z H, et al. Prognostic and predictive value of a microRNA signature in stage Ⅱ colon cancer: a microRNA expression analysis[J]. Lancet Oncol, 2013, 14(13): 1295-1306. |
| [14] |
WANG L Y, HUO M F, CHEN Y, et al. Tumor microenvironment-enabled nanotherapy[J]. Adv Healthc Mater, 2018, 7(8): e1701156. |
| [15] |
SATIJA S, KAUR H, TAMBUWALA M M, et al. Hypoxia-inducible factor (HIF): fuel for cancer progression[J]. Curr Mol Pharmacol, 2021, 14(3): 321-332. |
| [16] |
WU S J, KUANG H X, KE J, et al. Metabolic reprogramming induces immune cell dysfunction in the tumor microenvironment of multiple myeloma[J]. Front Oncol, 2020, 10: 591342. |
| [17] |
D'SOUZA L, BHATTACHARYA D. Plasma cells: You are what You eat[J]. Immunol Rev, 2019, 288(1): 161-177. |
| [18] |
CHEN Y Q, WEI H J, LIU F, et al. Hyperactivation of mammalian target of rapamycin complex 1 (mTORC1) promotes breast cancer progression through enhancing glucose starvation-induced autophagy and Akt signaling[J]. J Biol Chem, 2014, 289(2): 1164-1173. |
| [19] |
FAN Q, YANG L, ZHANG X D, et al. Autophagy promotes metastasis and glycolysis by upregulating MCT1 expression and Wnt/β-catenin signaling pathway activation in hepatocellular carcinoma cells[J]. J Exp Clin Cancer Res, 2018, 37(1): 9. |
| [20] |
HUANG S, LI Y, SHENG G H, et al. Sirtuin 1 promotes autophagy and proliferation of endometrial cancer cells by reducing acetylation level of LC3[J]. Cell Biol Int, 2021, 45(5): 1050-1059. |
| [21] |
PATEL S H, CAMARGO F D, YIMLAMAI D. Hippo signaling in the liver regulates organ size, cell fate, and carcinogenesis[J]. Gastroenterology, 2017, 152(3): 533-545. |
| [22] |
LEHMANN W, MOSSMANN D, KLEEMANN J, et al. ZEB1 turns into a transcriptional activator by interacting with YAP1 in aggressive cancer types[J]. Nat Commun, 2016, 7: 10498. |
| [23] |
SU W J, ZHU S K, CHEN K, et al. Overexpressed WDR3 induces the activation of Hippo pathway by interacting with GATA4 in pancreatic cancer[J]. J Exp Clin Cancer Res, 2021, 40(1): 88. |
| [24] |
LI S, ZHU H, CHEN H D, et al. Glucose promotes epithelial-mesenchymal transitions in bladder cancer by regulating the functions of YAP1 and TAZ[J]. J Cell Mol Med, 2020, 24(18): 10391-10401. |
| [25] |
WANG C Z, YAN G X, DONG D S, et al. LncRNA-ATB promotes autophagy by activating Yes-associated protein and inducing autophagy-related protein 5 expression in hepatocellular carcinoma[J]. World J Gastroenterol, 2019, 25(35): 5310-5322. |
| [26] |
PAVEL M, RENNA M, PARK S J, et al. Contact inhibition controls cell survival and proliferation via YAP/TAZ-autophagy axis[J]. Nat Commun, 2018, 9(1): 2961. |




