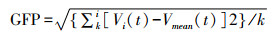静息态脑电微状态是头皮多通道脑电信号地形图在一定时间内保持的一种相对稳定的状态[1],它包含了大脑在静息状态下的大量活动信息。因其相对稳定的特性,脑电微状态的各种参数,如持续时间、频率、覆盖率和转换率等可以被量化,通过数类微状态的特点能够解释整个大脑活动,探索宏观尺度脑网络的功能映射[2]。脑电微状态不仅具备高时间分辨率特征,还能提供一定的空间信息,是目前研究脑功能网络、探索精神神经疾病脑机制的有效指标之一。有研究发现,大脑静息态脑电信号中存在4类微状态(A、B、C、D),不同微状态类型对应不同的脑网络区域及功能[3-5]。微状态A和B是大脑默认网络(default model network,DMN)的重要组成部分,微状态A与前扣带回、左侧岛叶和枕叶皮层活动密切相关,受视觉刺激影响;微状态B与后扣带回、右侧岛叶和颞叶皮层活动相关,受听觉及言语刺激影响;微状态C可能与楔前叶激活相关,并反映中央后回和枕叶皮层的活动,在不同脑网络中起到桥接的作用;微状态D与大脑认知控制和注意功能有关,常在反刍思维或思维障碍中发现[6-7]。
在精神分裂症、痴呆症和阿尔茨海默症等精神神经疾病中,脑电微状态的存在特征及其作为生物标记的价值已经得到了许多证据支持[2, 7]。抑郁症作为常见的情感障碍之一,影响着全球约3亿人的身心健康[8],至今尚未找到用于预警和诊断的客观生物标记, 仍只能依靠临床医生参照《精神疾病诊断与统计手册(Diagnostic and Statistical Manual of Mental Disorders, DSM)》或国际疾病分类(International Classification of Diseases, ICD)制定的症状标准,其客观性和科学性亟待提升。
目前抑郁症脑电微状态的研究较少,现有研究以比较抑郁症患者和正常个体的脑电微状态差异为主[9-11],尚未找到脑电微状态随抑郁程度变化的特点。分析不同抑郁程度个体的脑电微状态特征有利于探寻抑郁症的客观生物标记,进一步了解抑郁症发生发展的脑机制并促进抑郁症的识别和诊断。抑郁自评量表(Self-Rating Depression Scale, SDS)作为一种比较成熟的抑郁症状筛查方法[12],在群体测验中显示出良好的信效度[13-15],能有效地划分个体的不同抑郁程度。因此,本研究拟采用SDS作为分类依据,探索不同抑郁程度个体的静息态脑电微状态特征,为探索抑郁症脑机制,确立客观生物标记提供科学依据。
1 对象与方法 1.1 研究对象本研究按照便利抽样,2020年7-10月在重庆市内公开招募健康志愿者139名作为研究对象。纳入标准:18~40岁,男女不限,知情同意,近1个月未服用任何精神药物,头皮无外伤,无大面积疤痕;排除标准:认知损伤或认知障碍患者;患有重大或慢性器质性疾病等。本研究经陆军军医大学医学伦理委员会审批通过(2020年第029-01)。139名研究对象中,由于1名男性未提前告知抑郁症患病史,8人脑电数据质量不合格,1人缺失问卷信息,最终纳入129人,年龄(21.65±2.71)岁。其中男性60人,年龄(21.92±3.06)岁,女性69人,年龄(21.42±2.37)岁。一般情况见表 1。
| 项目 | 选项 | 数据 |
| 性别 | 男 | 60(46.51) |
| 女 | 69(53.49) | |
| 年龄 | ≤18岁 | 4(3.1) |
| >18~25岁 | 111(86.0) | |
| >25~30岁 | 12(9.3) | |
| >30岁 | 2(1.6) | |
| 受教育程度 | 高中或中专 | 6(4.6) |
| 本科或大专 | 102(79.1) | |
| 硕士及以上 | 21(16.3) | |
| 独生子女 | 是 | 49(38.0) |
| 否 | 80(62.0) | |
| 家庭结构 | 双亲 | 106(82.2) |
| 单亲 | 22(17.0) | |
| 其他 | 1(0.8) | |
| 家庭环境 | 强制型 | 18(14.0) |
| 放任型 | 27(20.9) | |
| 溺爱型 | 4(3.1) | |
| 民主型 | 80(62.0) | |
| 人际交往 | 有3个以上好友 | 114(88.4) |
| 有1~2个好友 | 15(11.6) | |
| 10岁前长期不跟父母居住 | 是 | 31(24.0) |
| 否 | 98(76.0) | |
| 亲属精神疾病史 | 有 | 10(7.8) |
| 无 | 119(92.2) |
1.2 方法 1.2.1 调查工具 1.2.1.1 一般人口学问卷
自编量表,包括性别、年龄、家庭结构、是否独生子女、受教育程度、家庭环境、人际交往等信息。
1.2.1.2 SDS由王征宇等[16]编修,共20个条目, 包括10个反向条目,每个条目按照likert 1~4分计分,标准分=条目总分×1.25的整数部分。标准分 < 53分的健康志愿者纳入无抑郁组,53~62分的纳入轻度抑郁组,63~72分为中度抑郁,≥73分则为重度抑郁,因此得分≥63分的个体均纳入中重度抑郁组。
1.2.1.3 调查方法及质量控制采用现场调查,由统一培训的心理专业人员负责问卷发放和回收,剔除数据缺失>25%的问卷。最终发放问卷139份,回收139份,回收率100%。剔除不合格问卷1份,有效问卷为138份,有效率99.28%。
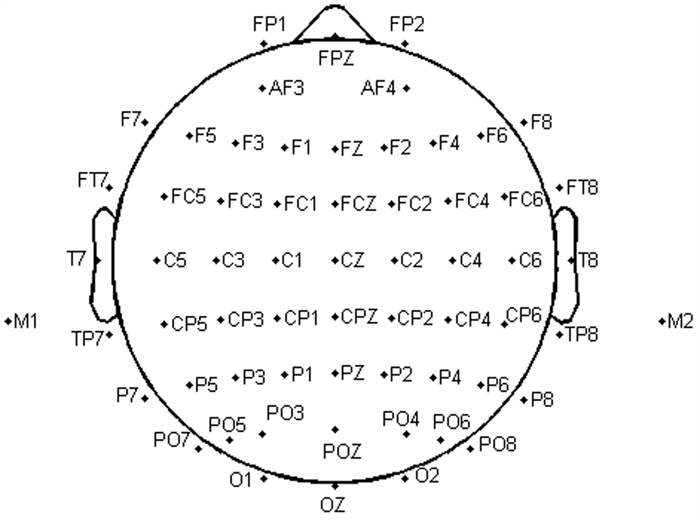
1.2.2 静息态脑电图采集及数据处理 1.2.2.1 脑电图采集采用Neuroscan脑电记录仪、SynAmps2放大器及Curry7.0软件进行脑电图数据采集和记录。参考国际10-20系统为电极放置标准拓展放置64导电极,双侧乳突作为参考电极(M1/M2), 同步记录水平(HEOG) 和垂直(VEOG) 眼电信号,采集研究对象在静息状态下的64导脑电图, 电极位置分布见图 1(CB1/CB2电极未在图中显示)。采样率为1 000 Hz,头皮平均电阻 < 10 kΩ,连续采集8 min脑电图数据(睁眼状态)。研究对象保持清醒,在清洁头皮后放松地坐在试验座椅上,并调节至舒适坐姿,尽可能放松,自然平视电脑屏幕,屏幕与研究对象距离为20 cm,显示屏为黑色,研究对象需要尽量减少眨眼次数并保持头部和身体基本不动。
|
| 电极名称根据脑解剖部位命名,FP、AF为前额区,F为额叶区,T为颞叶区,C为中央区,P为顶叶区,O为枕叶区; Z代表大脑中线,如FPZ、FCZ、CZ、CPZ、PZ、POZ、OZ等,可用于定位; 通常用奇数表示左半球电极,偶数表示右半球电极 图 1 按照国际10-20系统的64导脑电图电极位置 |
1.2.2.2 数据预处理
使用MATLAB和EEGLAB等软件对数据进行预处理,带通滤波2~20 Hz,每段长度为2 s,去除M1/M2/CB1/CB2电极并进行全脑平均参考,剔除坏段,插值坏导,最终电极数为60,利用独立成分分析(independent components analysis, ICA)去除眨眼、眼漂等伪迹并去除极端值(±75 μV)。经过预处理后,数据长度>300 s的脑电数据纳入脑电微状态分析。
1.2.2.3 微状态分析采用瞬时全局电势能量谱(global field power, GFP)来描述不同时刻点全局脑电信号的变化,计算方法[17]为:
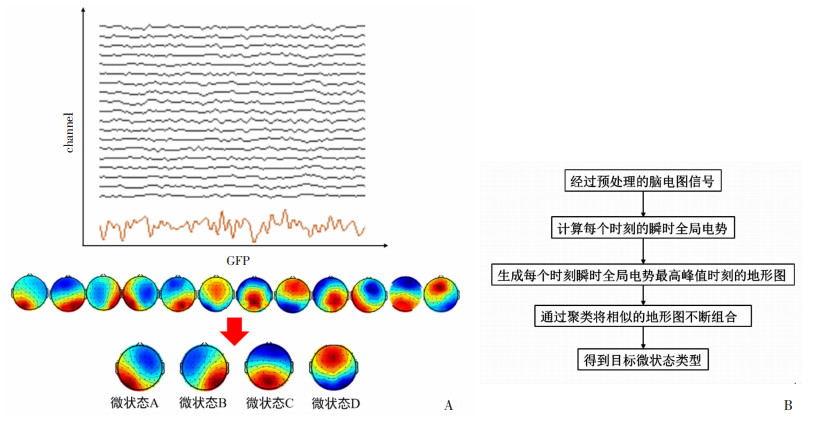
本研究仅采用GFP瞬时峰值处的地形图,利用原子聚类算法(atomize and agglomerate hierarchical clustering, AAHC)并参照KOENIG等[18]提出的4种经典微状态类型进行分析。微状态类别及聚类过程见图 2。各类微状态参数包括:持续时间,频率,覆盖率及转换率等。持续时间指每类微状态在单位时间内维持稳定的平均时长(ms),频率指每类微状态在单位时间内出现的平均次数(Hz),覆盖率指每类微状态总时间占单位时间的百分比,转换率指单位时间内不同微状态相互转换的次数占总转换次数的百分比。
|
| 图 2 静息态脑电微状态类别(A)及聚类过程(B) |
1.3 统计学分析
采用SPSS 24.0软件对问卷计量资料进行频率和均值分析。脑电图数据在经过预处理和微状态分析后,得到的各类计量参数采用SPSS24.0软件进行方差分析和LSD多重检验等,比较组间和组内各类微状态持续时间、频率和覆盖率的差异,采用多重比较分析微状态转换率差异,探索脑电微状态参数在组间和组内的特征(若方差不齐则采用非参数检验)。设置检验水准α=0.05。
2 结果 2.1 SDS评分情况SDS测查结果显示:存在抑郁症状的研究对象共22人,抑郁症状检出率为17.05%。129名研究对象得分在25~76分之间,平均(42.91±9.94)分。其中107人(82.9%)不存在抑郁症状(无抑郁组),22人存在抑郁症状,包括18人(14.0%)存在轻度抑郁症状(轻度抑郁组),3人(2.3%)存在中度抑郁症状、1人(0.8%)存在重度抑郁症状(中重度抑郁组)。抑郁得分不受性别、年龄、家庭结构、是否独生子女及受教育程度等人口学因素影响,差异无统计学意义(P>0.05)。
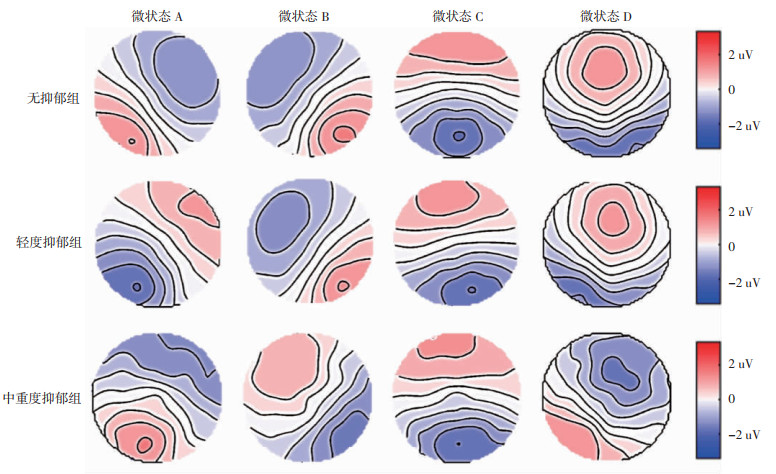
2.2 静息态脑电微状态特点静息态脑电微状态聚类为A、B、C、D四类,脑全局瞬时高电势分别位于A(右前额叶和左后枕叶)、B(左前额叶和右后枕叶)、C(前额叶和后枕叶)、D(顶叶)。总体来看,四类微状态对脑电活动的全局解释方差在63.74%~81.75%,全局解释方差(global explan-ation variance, GEV)为76.49%。其中,无抑郁组平均GEV为76.42%,轻度抑郁组平均GEV为75.72%,中重度抑郁平均GEV为77.78%,三者差异无统计学意义(P=0.24)。脑电微状态组水平如图 3所示。
|
| 图 3 静息态脑电微状态组水平(无极性) |
2.2.1 不同抑郁程度个体脑电微状态持续时间、频率及覆盖率特点
各组脑电微状态的基本参数如持续时间、频率和覆盖率如表 2所示。
| 指标 | 微状态类别 | 无抑郁组(n=107) | 轻度抑郁组(n=18) | 中重度抑郁组(n=4) | F | P |
| 持续时间/ms | A | 67.91±7.94 | 60.13±4.47 | 65.63±7.02 | 8.22 | 0.00 |
| B | 62.73±5.34 | 61.03±4.72 | 63.07±5.29 | 0.84 | 0.44 | |
| C | 63.76±10.68 | 65.72±5.68 | 64.50±2.89 | 0.30 | 0.74 | |
| D | 61.67±5.92 | 64.20±6.68 | 61.77±11.90 | 1.27 | 0.28 | |
| 频率/Hz | A | 4.18±0.61 | 3.86±0.45 | 4.27±0.80 | 2.28 | 0.11 |
| B | 3.87±0.43 | 3.94±0.52 | 4.01±0.46 | 0.35 | 0.71 | |
| C | 3.81±0.48 | 4.14±0.42 | 3.84±0.67 | 3.70 | 0.03 | |
| D | 3.91±0.51 | 4.16±0.43 | 3.70±0.48 | 2.33 | 0.10 | |
| 覆盖率(%) | A | 28.02±5.58 | 22.98±3.19 | 27.77±7.04 | 16.78 | 0.00 |
| B | 24.03±3.29 | 23.79±3.76 | 24.99±3.26 | 0.21 | 0.81 | |
| C | 24.28±4.70 | 26.86±3.60 | 24.38±3.89 | 2.48 | 0.09 | |
| D | 23.90±4.30 | 26.34±4.36 | 22.86±6.73 | 2.58 | 0.08 |
分别对每组脑电微状态参数进行方差分析(方差不齐则行非参数检验),发现无抑郁组脑电微状态A持续时间最长(P < 0.001),微状态D持续时间最短(P=0.049),微状态B和C之间无明显差异(P=0.33),见图 4。无抑郁组和中重度抑郁组脑电微状态A出现频率均高于其他三类微状态(P < 0.001)。轻度抑郁组各类微状态的出现频率无显著差异(P>0.05)。轻度抑郁组微状态A、B覆盖率少于微状态C和D,微状态A、B和微状态C、D之间无明显差异(P>0.05)。无抑郁组和中重度抑郁组微状态A覆盖率最高(P < 0.001),其余三类无明显差异(P>0.05)。
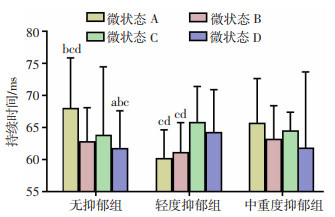
|
| a: P < 0.05, 与微状态A比较; b: P < 0.05, 与微状态B比较; c: P < 0.05, 与微状态C比较; d: P < 0.05, 与微状态D比较 图 4 不同抑郁程度组内脑电微状态持续时间比较 |
对三组脑电微状态进行组间比较发现,轻度抑郁组微状态A的平均持续时间低于无抑郁组和中重度抑郁组(P < 0.001),后两者差异无统计学意义。不同抑郁程度的三组之间,脑电微状态B、C、D的平均持续时间无显著差异(P>0.05)。同时,轻度抑郁组微状态A的覆盖率低于无抑郁组和中重度抑郁组(P < 0.001)。
2.2.2 不同抑郁程度个体脑电微状态转换特点不同类型微状态之间的转换率存在差异(P < 0.05)。其中,无抑郁组微状态A与C相互转换率高于轻度抑郁组和中重度抑郁组(P < 0.05),后两者差异无统计学意义;轻度抑郁组微状态C与D相互转换率高于无抑郁组和中重度抑郁组(P < 0.05),后两者差异无统计学意义(P>0.05),见图 5A。
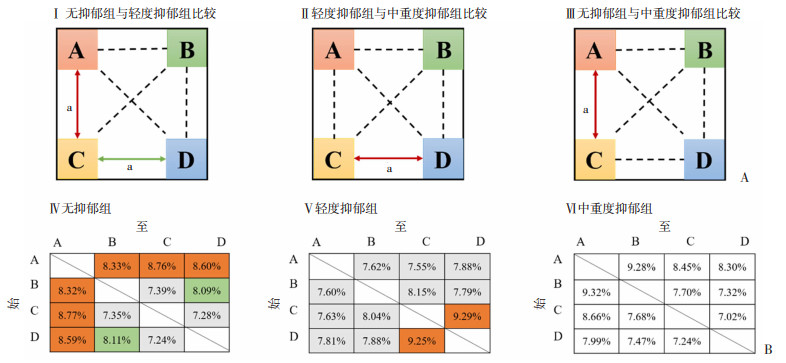
|
| A: 不同抑郁程度组间微状态转换差异红色箭头代表转换率增加,绿色箭头代表转换率减少;a:P < 0.05;B: 微状态相互转换概率值转换率从高到低分别是橙色-绿色-灰色(P < 0.05),同一颜色概率值之间差异无统计学意义 图 5 脑电微状态转换率 |
组内比较发现,无抑郁组中微状态A和B、A和C、A和D相互转换率最高,其次为微状态B和D相互转换率,微状态B和C、微状态C和D相互转换率最低(P < 0.05)。轻度抑郁组微状态C和D相互转换率高于其他类型微状态相互转换率(P < 0.05)。中重度抑郁组各类微状态之间转换率差异无统计学意义(P>0.05),见图 5B。
3 讨论近年来,越来越多的证据支持脑电微状态的存在,认为个体脑电微状态是可靠且唯一的生物信号[19],可用于探索神经精神疾病的特征表现和神经发生发展机制,并已在精神分裂症、阿尔茨海默症中得到了初步验证[20-21]。
3.1 脑电微状态与传统频谱分析的区别和联系本研究对不同抑郁程度个体的静息态脑电信号进行比较,发现脑电微状态在不同抑郁程度个体中的存在形式及特征。此前,对抑郁症脑电微状态的研究多集中在健康个体与临床确诊患者之间的比较,很少有直接在健康群体中开展与抑郁症状相联系的脑电微状态研究。本研究通过在健康志愿者当中筛查抑郁症状,对存在不同程度抑郁症状的健康个体的脑电微状态特征进行研究,寻找抑郁症早期诊断和识别的电生理指标,是对以往抑郁症脑电微状态研究领域的补充和完善,另一方面也从临床前期佐证了脑电微状态与抑郁症状之间可能存在的联系。因此,静息态脑电微状态特征在抑郁症或抑郁状态的早期诊断中有一定价值。
与经典的脑电频谱分析相比较,脑电微状态在呈现主要时间信息的同时也增加了对大脑电活动空间信息的展现。经典的脑电图包括α波(8~13 Hz)、β波(14~30 Hz)、θ波(4~7 Hz)、δ波(1~3 Hz)等不同频率的波段信号,以往研究通过对单频率脑电信号进行分析,如α波额叶不对称性、不同频段相对功率和绝对功率等来探索脑电信号与抑郁症的联系[22-24],但单一频段脑电特征特异性较差[22],很难作为疾病的生物标记。脑电微状态分析通常保留2~20 Hz的脑电信号,从整体上描述脑电信号的变化和位置特异性,包含了全部的α、θ波和大部分的β、δ波。此外,脑电微状态取决其皮层内来源[25],微状态空间信息主要来源于α波。
3.2 脑电微状态在不同抑郁程度个体中的特征在本研究中,我们主要得到了两组脑电微状态特征指标,一是脑电微状态A的持续时间存在“U型”的变化趋势,即无抑郁组脑电微状态A持续时间最长,轻度抑郁组微状态A持续时间有所降低,中重度抑郁组微状态A持续时间较轻度抑郁组有所增加,但与无抑郁组差异不显著。这提示微状态A持续时间在抑郁发展过程中可能存在规律的变化特征,持续时间首次减少提示出现抑郁症状,持续时间回升提示着抑郁程度加重,微状态A持续时间可能是抑郁发生发展的预警信号,与此前研究[26]结果存在部分相似性:存在抑郁症状但未确诊抑郁症个体的微状态A持续时间与抑郁得分呈负相关,即随着抑郁得分增加,微状态A持续时间减少。MURPHY等[9]研究结果表明重症抑郁症患者微状态A持续时间高于健康群体和临床治愈群体,与本研究结果不一致,可能提示脑电微状态A持续时间在抑郁症临床前期和临床期的特征表现有所不同,微状态A持续时间可能只是临床前期的状态特征。
研究得到的另一组脑电微状态特征是,不同抑郁程度个体的不同微状态类型之间转换率存在差异,无抑郁组微状态A和C的转换率高于抑郁症状组;随着抑郁程度加重,微状态C和D的转换率呈现出“倒U”型曲线特征。
脑电微状态不同类型之间的相互转换可能是调节疾病和健康状态的功能机制[27]。在无抑郁组中,微状态A向其他类型转换率最高,脑电微状态A和C的相互转换率高于抑郁组,这与以往研究中抑郁症患者微状态A和C之间存在高转换率[9]的结果恰好相反。微状态A主要反映前扣带回、左侧岛叶和枕叶皮层电活动,与应激密切相关[28],因此微状态A向其他微状态转换的过程一定程度上可以反映出个体处理外界刺激的心理过程,提示外界刺激可能经由与微状态A密切相关的脑区加工后分配到各个系统进行处理,但当出现抑郁症状时,微状态A与微状态C的转换率降低,意味着从额顶叶部分到楔前叶的连接和功能激活减少[9],提示微状态A和C相关脑区功能的正常激活可能是维持机体正常状态的内在机制。
在持续时间未见明显差异的情况下,轻度抑郁组微状态C和微状态D的相互转换率高于无抑郁组和中重度抑郁组,提示这可能是早期抑郁症状发生发展的关键特征。脑电微状态C来源于楔前叶、双侧颞叶和外侧颞中回, 和大脑控制网络、默认网络的激活有关,是自我体验系统的一部分[4]。而微状态D来源于额顶控制网络[29],多与背侧注意网络相关,反映注意和认知控制功能,二者的频繁转换提示这些脑网络功能不断被激活和切换。STRIK等[30]发现存在抑郁的个体注意功能损伤会导致脑电微状态无法稳定维持或提早终止,表现为出现频率增加、持续时间无变化甚至有减少的趋势。这和本研究结果比较接近,提示微状态C和D转换率增加可能反映出抑郁症状早期个体注意功能损伤,大脑控制、默认和注意网络的功能激活不稳定,可能是抑郁症状出现的早期信号。但随着抑郁程度进一步加重,微状态C和D的转换率降低,我们推测这与楔前叶损伤有关。此前研究已经发现在重度抑郁症患者和重度抑郁症缓解期个体中均存在楔前叶的解剖结构异常[31-32],提示抑郁症对楔前叶的损伤可能是不可逆的。由此我们推测,微状态C和D在个体无抑郁症状时的低转换率是维持个体正常功能的机制。出现轻度抑郁症状后,楔前叶功能激活进行代偿导致微状态C和D转换率出现一过性增加,但随着症状不断加重,楔前叶产生实质性损伤,微状态C随之减少,控制和默认网络与注意网络的连接受阻导致微状态C和D的转换率下降,微状态C和D的转换率变化可能反映了抑郁症状的发展过程。
3.3 质量控制与研究局限本研究中,健康志愿者抑郁症状检出率为17.05%,与以往研究基本一致[33-34]。考虑到脑电信号容易受到环境和个体脑功能活动的影响,研究结果容易产生偏差,因此,本研究在试验设计、数据采集及分析处理当中都对数据质量控制有所考量。静息态脑电数据在时间尺度上同质性较好,在数据采集过程中,试验室温度、噪音及试验操作都经过标准化处理,如保持试验室温度为28 ℃,房外悬挂指示牌,减少人员走动、保证健康志愿者精神状态良好后采集脑电数据,数据处理流程规范统一等。因此,研究得到的数据同质性较好,能够比较真实地反映不同抑郁程度与脑电微状态之间的联系,静息态脑电数据聚类得到A、B、C、D四类微状态对脑电信号的全局解释方差达到76.49%,较好地解释了大脑整体电生理活动,能够与国内外大多数脑电微状态研究进行比较。
本研究的局限有以下几个方面:首先,研究对象选择偏倚,健康志愿者中存在抑郁症状的个体比例较少,存在中重度抑郁症状的个体仅有4例,这是影响本研究结果的普适性和稳定性的因素之一。研究并未纳入临床确诊的抑郁症患者,抑郁程度高低仅由SDS评价,因此,脑电微状态特征可能与个体近期心理状态密切相关,状态特征更加适用于抑郁症临床前期的筛查,尚不能够应用于临床诊疗。如果要作为临床确诊的生物标记,还需要纳入临床确诊患者甚至临床治愈后的个体加以比较和验证。本研究结果仅在小样本群体中得到,有待未来进行多中心扩大样本研究进行验证。其次,一些研究者提出微状态A和D[6],微状态B和C[30]的转换率也与抑郁症相关,尤其是微状态B与自传体记忆损伤相关是抑郁症的脑机制特点之一,本研究未得出相似的结论,这可能与研究范式有关。本研究仅采集了睁眼状态下的静息态脑电信号,未涉及计算、工作记忆等认知任务,也未与闭眼采集的数据进行对比。脑电微状态作为大脑电活动的宏观集合,可能随个体状态和时间而发生变化,有学者[9]认为对个体进行脑电微状态的追踪研究才是更可靠的探索稳定生物标记的方法。此外,关于脑电微状态的分类问题,目前大多数脑电微状态研究都将大脑电活动对应为A、B、C、D四类微状态,但XU等[35]发现,如果将脑电微状态划分为7类(A~G), 则恰好对应大脑活动7个子网络。如何划分最优的微状态类别是未来研究尚需进一步探索和验证的方向。
综上所述,本研究尝试用便携、经济、无创的脑电图技术结合微状态分析来识别和筛查抑郁症状,探寻关键可靠的客观生物标记,发现微状态A的持续时间改变、微状态A和C、微状态C和D的转换率变化在抑郁症状的早期识别可能具备提示和预警的作用,对当前主要依靠临床症状和医师经验的抑郁症诊疗模式提供了一种有价值的辅助诊断方法。未来脑电微状态有望借助人工智能算法深入探索抑郁症神经发生机制,甚至可能作为诊疗方案制定的依据,为提高抑郁症早期识别和诊断率,提升治疗干预手段有效性和改善抑郁症患者预后提供新途径。
| [1] |
LEHMANN D, OZAKI H, PAL I. EEG alpha map series: brain micro-states by space-oriented adaptive segmentation[J]. Electroencephalogr Clin Neurophysiol, 1987, 67(3): 271-288. |
| [2] |
MICHEL C M, KOENIG T. EEG microstates as a tool for studying the temporal dynamics of whole-brain neuronal networks: a review[J]. Neuroimage, 2018, 180(Pt B): 577-593. |
| [3] |
VELLANTE F, FERRI F, BARONI G, et al. Euthymic bipolar disorder patients and EEG microstates: a neural signature of their abnormal self experience?[J]. J Affect Disord, 2020, 272: 326-334. |
| [4] |
BRÉCHET L, BRUNET D, BIROT G, et al. Capturing the spatiotemporal dynamics of self-generated, task-initiated thoughts with EEG and fMRI[J]. Neuroimage, 2019, 194: 82-92. |
| [5] |
CUSTO A, VAN DE VILLE D, WELLS W M, et al. Electroencephalographic resting-state networks: source localization of microstates[J]. Brain Connect, 2017, 7(10): 671-682. |
| [6] |
KAISER R H, ANDREWS-HANNA J R, WAGER T D, et al. Large-scale network dysfunction in major depressive disorder: a meta-analysis of resting-state functional connectivity[J]. JAMA Psychiatry, 2015, 72(6): 603-611. |
| [7] |
KHANNA A, PASCUAL-LEONE A, MICHEL C M, et al. Microstates in resting-state EEG: current status and future directions[J]. Neurosci Biobehav Rev, 2015, 49: 105-113. |
| [8] |
GBD 2017 Disease and Injury Incidence and Prevalence Collaborators. Global, regional, and national incidence, prevalence, and years lived with disability for 354 diseases and injuries for 195 countries and territories, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017[J]. Lancet, 2018, 392(10159): 1789-1858. |
| [9] |
MURPHY M, WHITTON A E, DECCY S, et al. Abnormalities in electroencephalographic microstates are state and trait markers of major depressive disorder[J]. Neuropsychopharmacology, 2020, 45(12): 2030-2037. |
| [10] |
DAMBORSKÁ A, TOMESCU M I, HONZÍRKOVÁ E, et al. EEG resting-state large-scale brain network dynamics are related to depressive symptoms[J]. Front Psychiatry, 2019, 10: 548. |
| [11] |
DAMBORSKÁ A, PIGUET C, AUBRY J M, et al. Altered electroencephalographic resting-state large-scale brain network dynamics in euthymic bipolar disorder patients[J]. Front Psychiatry, 2019, 10: 826. |
| [12] |
STUART A L, PASCO J A, JACKA F N, et al. Comparison of self-report and structured clinical interview in the identification of depression[J]. Compr Psychiatry, 2014, 55(4): 866-869. |
| [13] |
田银娣, 王怡恺, 李静, 等. 焦虑和抑郁量表在肝硬化患者临床应用中的信效度评价[J]. 实用肝脏病杂志, 2019, 22(1): 105-108. TIAN Y D, WANG Y K, LI J, et al. Evaluation of reliability and validity of self-rating anxiety scale and self-rating depression scale in patients with liver cirrhosis[J]. J Pract Hepatol, 2019, 22(1): 105-108. |
| [14] |
孙振晓, 刘化学, 焦林瑛, 等. 医院焦虑抑郁量表的信度及效度研究[J]. 中华临床医师杂志(电子版), 2017, 11(2): 198-201. SUN Z X, LIU H X, JIAO L Y, et al. Reliability and validity of hospital anxiety and depression scale[J]. Chin J Clin Electron Ed, 2017, 11(2): 198-201. |
| [15] |
茆广绪, 杜振芳, 叶炜杰, 等. 基于结构方程模型的家庭支持、抑郁对围绝经期妇女生活质量的影响[J]. 中国卫生统计, 2016, 33(3): 396-399. MAO G X, DU Z F, YE W J, et al. The structural equation modeling analysis of the quality of life's influencing factors among perimenopause women[J]. Chin J Heal Stat, 2016, 33(3): 396-399. |
| [16] |
王征宇, 迟玉芬. 抑郁自评量表(SDS)[J]. 上海精神医学, 1984(2): 71-72. WANG Z Y, CHI Y F. Self-rating depression scale (SDS)[J]. Shanghai Arch Psychiatry, 1984(2): 71-72. |
| [17] |
KHANNA A, PASCUAL-LEONE A, FARZAN F. Reliability of resting-state microstate features inelectroencephalo-graphy[J]. PLoS ONE, 2014, 9(12): e114163. |
| [18] |
KOENIG T, LEHMANN D, MERLO M C, et al. A deviant EEG brain microstate in acute, neuroleptic-naive schizophrenics at rest[J]. Eur Arch Psychiatry Clin Neurosci, 1999, 249(4): 205-211. |
| [19] |
LIU J Y, XU J, ZOU G Y, et al. Reliability and individual specificity of EEG microstate characteristics[J]. Brain Topogr, 2020, 33(4): 438-449. |
| [20] |
STRIK W K, CHIARAMONTI R, MUSCAS G C, et al. Decreased EEG microstate duration and anteriorisation of the brain electrical fields in mild and moderate dementia of the Alzheimer type[J]. Psychiatry Res, 1997, 75(3): 183-191. |
| [21] |
STEVENS A, LUTZENBERGER W, BARTELS D M, et al. Increased duration and altered topography of EEG microstates during cognitive tasks in chronic schizophrenia[J]. Psychiatry Res, 1997, 66(1): 45-57. |
| [22] |
NEWSON J J, THIAGARAJAN T C. EEG frequency bands in psychiatric disorders: a review of resting state studies[J]. Front Hum Neurosci, 2018, 12: 521. |
| [23] |
DELL'ACQUA C, GHIASI S, MESSEROTTI BENVENUTI S, et al. Increased functional connectivity within alpha and Theta frequency bands in dysphoria: a resting-state EEG study[J]. J Affect Disord, 2021, 281: 199-207. |
| [24] |
MOHAMMADI Y, MORADI M H. Prediction of depression severity scores based on functional connectivity and complexity of the EEG signal[J]. Clin EEG Neurosci, 2021, 52(1): 52-60. |
| [25] |
MILZ P, PASCUAL-MARQUI R D, ACHERMANN P, et al. The EEG microstate topography is predominantly determined by intracortical sources in the alpha band[J]. Neuroimage, 2017, 162: 353-361. |
| [26] |
GSCHWIND M, HARDMEIER M, VAN DE VILLE D, et al. Fluctuations of spontaneous EEG topographies predict disease state in relapsing-remitting multiple sclerosis[J]. Neuroimage Clin, 2016, 12: 466-477. |
| [27] |
MILZ P, FABER P L, LEHMANN D, et al. The functional significance of EEG microstates: Associations with modalities of thinking[J]. Neuroimage, 2016, 125: 643-656. |
| [28] |
KADIER N, STEIN M, KOENIG T. EEG microstates and psychosocial stress during an exchange year[J]. Brain Topogr, 2021, 34(2): 117-120. |
| [29] |
PTAK R, SCHNIDER A, FELLRATH J. The dorsal frontoparietal network: a core system for emulated action[J]. Trends Cogn Sci, 2017, 21(8): 589-599. |
| [30] |
STRIK W K, DIERKS T, BECKER T, et al. Larger topographical variance and decreased duration of brain electric micro-states in depression[J]. J Neural Transm Gen Sect, 1995, 99(1/2/3): 213-222. |
| [31] |
ZHANG Y, YU C, ZHOU Y, et al. Decreased gyrification in major depressive disorder[J]. Neuroreport, 2009, 20(4): 378-380. |
| [32] |
ZHANG S, LI C S. Functional connectivity mapping of the humanprecuneus by resting state fMRI[J]. Neuroimage, 2012, 59(4): 3548-3562. |
| [33] |
罗敏, 姜旸, 刘照月, 等. 新型冠状病毒流行下普通民众焦虑抑郁调查分析[J]. 中华灾害救援医学, 2020, 8(9): 481-484. LUO M, JIANG Y, LIU Z Y, et al. Anxiety and depression analysis of the general public people during the COVID-19[J]. Chin J Disaster Med, 2020, 8(9): 481-484. |
| [34] |
马慧, 杨超, 刘娜, 等. 大学生抑郁症状与人格特征及应对方式的关系研究[J]. 中国健康教育, 2019, 35(2): 179-181, 191. MA H, YANG C, LIU N, et al. Study on the relationships of depressive symptoms with personality traits and coping styles of undergraduates[J]. Chin J Heal Educ, 2019, 35(2): 179-181, 191. |
| [35] |
XU J, PAN Y, ZHOU S, et al. EEG microstates are correlated with brain functional networks during slow-wave sleep[J]. Neuroimage, 2020, 215: 116786. |