心肌梗死(myocardial infarction,MI)后心肌重构被认为是心力衰竭发生的基础,同时心肌纤维化在心肌重构和心力衰竭的发生发展中起着重要作用[1-2]。心肌纤维化是一种与多种心血管疾病相关的主要病理性疾病,其特征是心脏成纤维细胞转化为肌成纤维细胞,后者合成并分泌大量富含胶原的细胞外基质(extracellular matrix,ECM)[3]。过量的ECM沉积导致心脏僵硬、心室顺应性减弱、心功能不全,最终导致心力衰竭。由于涉及的细胞类型和信号途径的复杂性,目前缺乏有效的治疗方法来抑制或逆转心肌纤维化[4]。因此,了解心肌纤维化的机制和开发新疗法至关重要。Runt相关转录因子3(Runt-related transcription factor 3,Runx3)是哺乳动物Runt结构域转录因子家族的成员,位于人类染色体1p36.1上[5]。最初,Runx3被认为是一种肿瘤抑制因子,可以抑制血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达,减少直肠癌的血管生成、生长和转移[6]。Runx3是人内皮细胞Notch的直接靶基因,是TGF-β信号通路的下游效应子,在血管生成、细胞迁移和侵袭中起重要作用[7]。最近的研究表明Runx3在心肌肥厚过程中发挥了关键作用[8],但其在病理性心肌纤维化中的作用尚不清楚。本研究分析了Runx3对MI后心肌纤维化的作用,并采用体内和体外研究观察Runx3在心脏成纤维细胞分化、Ⅰ型胶原(collagen Ⅰ, ColⅠ)合成和增殖中的作用。
1 材料与方法 1.1 小鼠MI模型建立从上海杰思捷实验动物有限公司采购了6~8周龄野生C57BL/6J雄性小鼠[生产许可证:SCXK(沪)2018-0004]。将小鼠置于无病原体屏障设施中(光/暗循环12 h;温度20~24 ℃;湿度55%~60%),可自由获得无菌食物和水。将小鼠分为假手术组(Sham组)和MI 7、14、28 d组,每组6只。MI组小鼠腹腔注射戊巴比妥钠(60 mg/kg)麻醉,用25号气管导管插管,然后用小动物呼吸机通气(120次/min);在左胸骨缘3~4肋间肌横切口显露心脏,在左心房与左心室交界处下方1.0~2.0 mm处用8-0缝线永久结扎左冠状动脉,分别在MI后7、14、28 d处死小鼠。假手术小鼠接受类似的手术,但未结扎左冠状动脉。
1.2 Runx3在小鼠体内的敲除为了确定Runx3的抑制是否能够预防心肌梗死后的心肌纤维化,给Sham组(Sham+si-Runx3组、Sham+si-NC组)和MI组(MI 28 d+si-Runx3组、MI 28 d+ si-NC组)小鼠尾静脉分别注射Runx3小干扰RNA(si-Runx3,序列为5′-GTGGACTTGAATGGAACAA-3′)或阴性对照siRNA(si-NC)(广东Ribobio公司),每组8只。si-Runx3组小鼠注射si-Runx3(5 nmol溶于1 mL生理盐水中),1周连续注射3次;si-NC组小鼠注射阴性si-NC,1周连续注射3次。1周后,小鼠建立MI模型,每周连续注射siRNA 3次,直至MI后28 d处死。
1.3 超声心动图评价心功能用1.5%~2%异氟醚吸入麻醉小鼠,并使用vevo2100成像系统(加拿大Visualsonics公司)分析心功能。通过30 mHz换能器进行M型记录,评价左心室功能。超声心动图参数包括舒张末期左室内径(decreased left ventricular end-diastolic diameter,LVIDd)、收缩期左室内径(decreased left ventricular,LVIDs)、射血分数(ejection fraction,EF)、缩短分数(shortened fraction,FS)和心输出量(cardiac output,CO)。
1.4 免疫组织化学分析取小鼠心肌梗死组织在4%多聚甲醛中固定过夜。标本包埋于石蜡中,切片4 μm。采用标准程序进行免疫组化。脱蜡、复水和封闭后,将载玻片与主要单克隆抗体抗Ki67(1 ∶200,英国Abcam公司)在4 ℃下培养过夜,再与辣根标记的二级抗体(1 ∶100,北京中杉金桥生物技术有限公司)和DAB试剂反应。在光学显微镜下观察切片。对于每张切片,随机选择5个放大倍数为100倍的视野并拍照。用Image J软件分析阳性染色。
1.5 免疫荧光染色将心脏冷冻在OCT复合物中,切至8 μm纵切面。切片解冻,用4%甲醛溶液固定,用0.1%Triton X-100处理。用10%山羊血清封闭载玻片,分别与小鼠抗α-SMA(1 ∶200,英国Abcam公司)和兔抗Runx3(1 ∶50,美国Millipore公司)抗体在4 ℃孵育过夜。二级抗体为Alexa Fluor-594山羊抗兔IgG和Alexa Fluor-488山羊抗兔IgG(1 ∶200,英国Abcam公司),细胞核用DAPI染色(美国Sigma-Aldrich公司)。采用DMLB荧光显微镜(德国Leica公司)拍摄图像。
1.6 小鼠心脏成纤维细胞的分离培养参照文献[9]的方法,从C57BL/6幼鼠中分离心脏成纤维细胞。将左心室切成小块,在37 ℃下用胰蛋白酶/EDTA(美国Gibco公司)消化。将细胞悬浮液离心,重新悬浮并放置2 h。贴壁细胞为波形蛋白阳性表达的心脏成纤维细胞。心脏成纤维细胞接种在含15%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的DMEM培养液中。第1~3代用于本实验。
1.7 siRNA转染心脏成纤维细胞心脏成纤维细胞生长约50%时,使用FECTTM转染试剂盒(广东Ribobio公司)转染si-Runx3或si-NC(50 nmol)。转染24 h后,细胞暴露于10 ng/mL TGF-β1(美国R & D Systems公司)。观察TGF-β1以不同浓度和刺激时间对细胞中Runx3蛋白影响。
1.8 5-乙炔基-2′-脱氧尿苷(EdU)增殖实验使用Cell LightTM EdU Apollo©488体外成像试剂盒(广东Ribobio公司)检测细胞增殖。将转染siRNA和TGF-β1刺激的心脏成纤维细胞以1.5×105 /mL接种于24孔培养板上。1%胎牛血清孵育24 h后,弃去培养基,加入100 μL EdU混合溶液(10 μmol/L)并培养24 h。细胞在PBS中洗涤,在4%福尔马林中固定10 min,随后用1×Apollo©染色反应液(100 μL/孔)染色30 min。再加入1×Hochest33342(100 μL/孔)染色30 min以显示细胞核。细胞内EdU(红)和Hochest 33342(蓝核)荧光图像用DMLB荧光显微镜拍摄。
1.9 Western blot检测冷冻小鼠心脏组织和培养的原代心脏成纤维细胞在含有蛋白酶抑制剂混合物(德国Roche公司)的RIPA缓冲液(上海Beyotime公司)中溶解。裂解液在12 000 r/min离心10 min以去除所有细胞碎片,并使用BCA蛋白质分析试剂盒(上海Beyotime公司) 测定上清液蛋白质浓度。将β-巯基乙醇和负载染料添加到样品中,然后在99 ℃加热10 min。在转移到PVDF膜之前,使用10%~12%的凝胶通过SDS-PAGE分离蛋白质。用以下一级抗体孵育细胞膜:Runx3(1 ∶1 000)、α-SMA(1 ∶1 000)、ColⅠ(1 ∶1 000,英国Abcam公司)、TGF-β(1 ∶1 000,英国Abcam公司)和GAPDH(1 ∶5 000,美国Sigma-Aldrich公司)在4 ℃下过夜。然后将PVDF膜与HRP二级抗体一起孵育,通过SuperSignal West Pico化学发光底物(美国PIERCE公司)和凝胶记录系统(美国Bio-Rad公司)对条带进行可视化。
1.10 统计学分析采用SPSS 22.0统计软件。数据以x±s表示,采用未配对学生t检验测量各组间的差异。采用单因素方差分析和Tukey Kramer事后分析比较多组间的差异。P < 0.05表示差异有统计学意义。
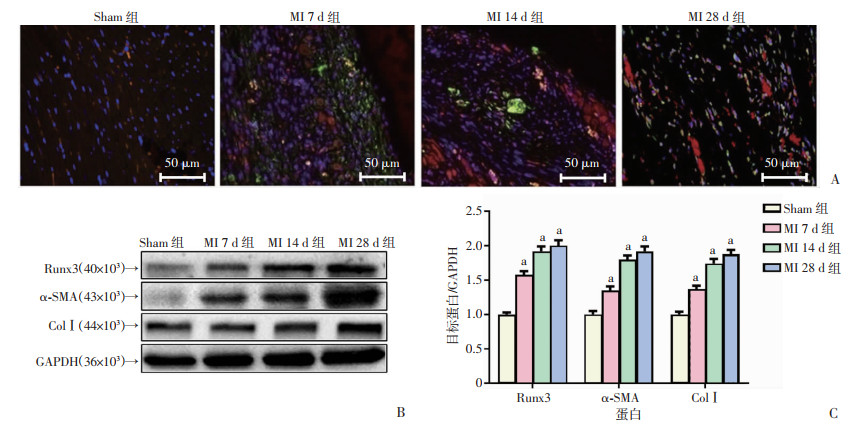
2 结果 2.1 MI后心肌纤维化过程中Runx3表达上调免疫荧光染色显示,随着MI时间的延长,小鼠纤维化区域Runx3表达上调,Runx3和α-SMA共定位(图 1A)。同样,Western blot结果显示,MI后14、28 d,Runx3表达逐渐增加,同时α-SMA和ColⅠ表达上调(图 1B)。
|
| A:免疫荧光染色观察各组小鼠心肌梗死区Runx3(红色)、α-SMA(绿色)和DAPI(蓝色)定位;B、C:Western blot检测各组小鼠心脏中Runx3、α-SMA和ColⅠ的水平及半定量分析(n=6, x±s) a:P < 0.05,与Sham组比较 图 1 MI后心肌纤维化过程中Runx3表达上调 |
2.2 Runx3基因敲除可减轻心肌纤维化、改善心功能
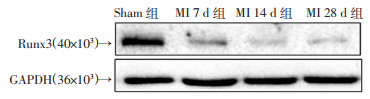
为了进一步阐明Runx3在心肌纤维化和功能中的重要作用,研究用Runx3小干扰RNA(si-Runx3)抑制小鼠MI前Runx3的表达,Western blot检测Runx3基因敲除效率。结果显示注射si-Runx3显著抑制MI后7、14、28 d心脏中Runx3的上调(图 2)。超声心动图检查结果显示,MI后28 d,与注射si-NC小鼠相比,注射si-Runx3小鼠左心室EF、FS、CO均上调(P < 0.05),而LVIDd和LVIDs下调(P < 0.05)。Sham组注射si-NC和si-Runx3的小鼠心功能差异无统计学意义(表 1)。
|
| 图 2 Western blot法检测注射si-Runx3后MI小鼠7、14、28 d后Runx3蛋白水平 |
| 指标 | Sham组 | MI 28 d组 | |||
| si-NC | si-Runx3 | si-NC | si-Runx3 | ||
| EF(%) | 75.32±0.98 | 74.85±1.03 | 27.78±1.08a | 46.46±2.13b | |
| FS(%) | 43.96±1.55 | 43.18±1.79 | 12.29±0.55a | 20.29±1.29b | |
| LVIDd/mm | 3.42±0.21 | 3.10±0.13 | 4.89±0.04a | 4.02±0.05b | |
| LVIDs/mm | 2.36±0.05 | 2.29±0.06 | 4.14±0.05a | 3.07±0.05b | |
| CO/mL·min-1 | 22.06±1.56 | 21.79±0.63 | 9.54±0.79a | 17.28±2.19b | |
| a:P < 0.05,与Sham si-NC组比较;b:P < 0.05,与MI 28 d si-NC组比较 | |||||
2.3 Runx3在体内诱导心脏成纤维细胞分化、增殖
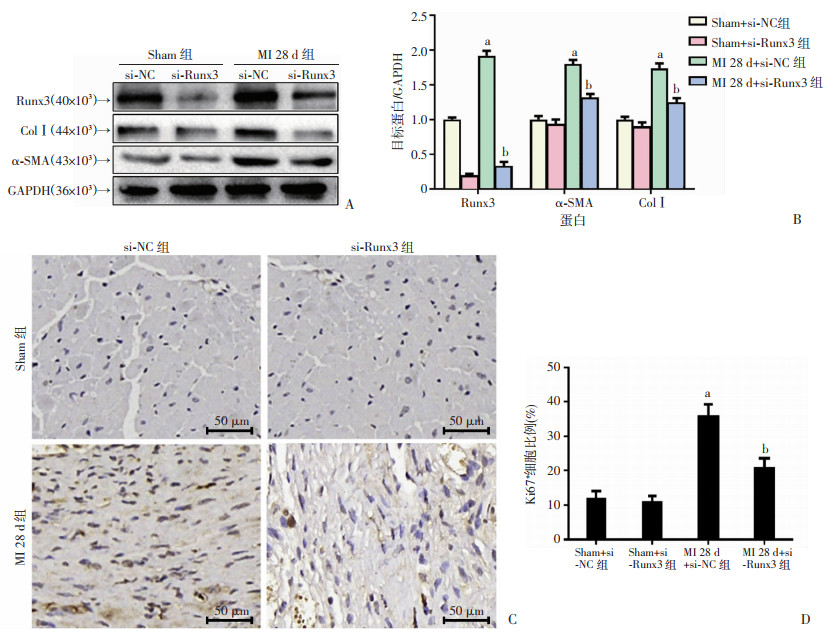
为了确定Runx3是否是心脏成纤维细胞分化所必需的,研究分析了MI后Runx3基因敲除小鼠的分化标志物。MI后28 d,与Sham组相比,si-NC组小鼠心脏组织Runx3、α-SMA和ColⅠ表达上调。然而,MI诱导的Runx3、α-SMA和ColⅠ被si-Runx3阻断(图 3A、B)。心脏成纤维细胞的增殖是心肌纤维化的重要机制。MI后si-NC小鼠心脏ki67阳性细胞显著升高。用si-Runx3处理小鼠,MI诱导ki67阳性细胞的作用减弱(图 3C、D)。
|
|
a:P < 0.05,与Sham+si-NC组比较;b:P < 0.05,与MI+28 d+si-NC组比较 A、B:Western blot检测注射si-NC和si-Runx3的小鼠心脏组织中Runx3、α-SMA和ColⅠ蛋白的水平及半定量分析;C、D:免疫组织化学分析注射si-NC和si-Runx3的小鼠心脏组织中Ki67阳性细胞及定量分析。 图 3 Runx3在体内诱导心脏成纤维细胞增殖(n=6,x±s) |
2.4 Runx3调控心脏成纤维细胞ColⅠ合成和增殖
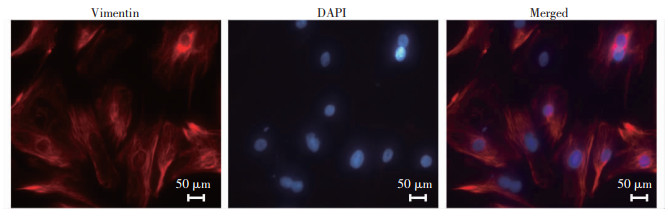
从1~3 d龄的C57BL/6小鼠获得的心脏成纤维细胞中波形蛋白呈阳性(图 4)。MI诱导的小鼠中TGF-β1蛋白水平升高,并在MI后28 d保持显著升高(图 5A)。TGF-β1以浓度和时间依赖性方式上调Runx3蛋白表达,在24 h和10 ng/mL的刺激下升高显著(图 5B~E)。研究还观察到α-SMA和ColⅠ的表达也有类似的诱导作用。进一步确定Runx3是否是心脏成纤维细胞对TGF-β1的纤维化反应的关键调节因子。Western blot结果显示,TGF-β1诱导培养的心脏成纤维细胞中α-SMA的表达,并且这种作用通过Runx3缺失而减弱。Runx3基因敲除不仅抑制心脏成纤维细胞的分化,而且减少了ColⅠ的合成(图 5F、G)。此外,EdU染色结果显示,TGF-β1诱导培养的心脏成纤维细胞显著增殖,并且这种作用通过Runx3基因敲除而减弱(图 5H、I)。这些数据表明Runx3有助于心脏成纤维细胞的ColⅠ合成和增殖。
|
| 图 4 免疫荧光观察波形蛋白(心脏成纤维细胞的标志物,红色)和DAPI(蓝色)鉴定培养分离的原代心脏成纤维细胞 |
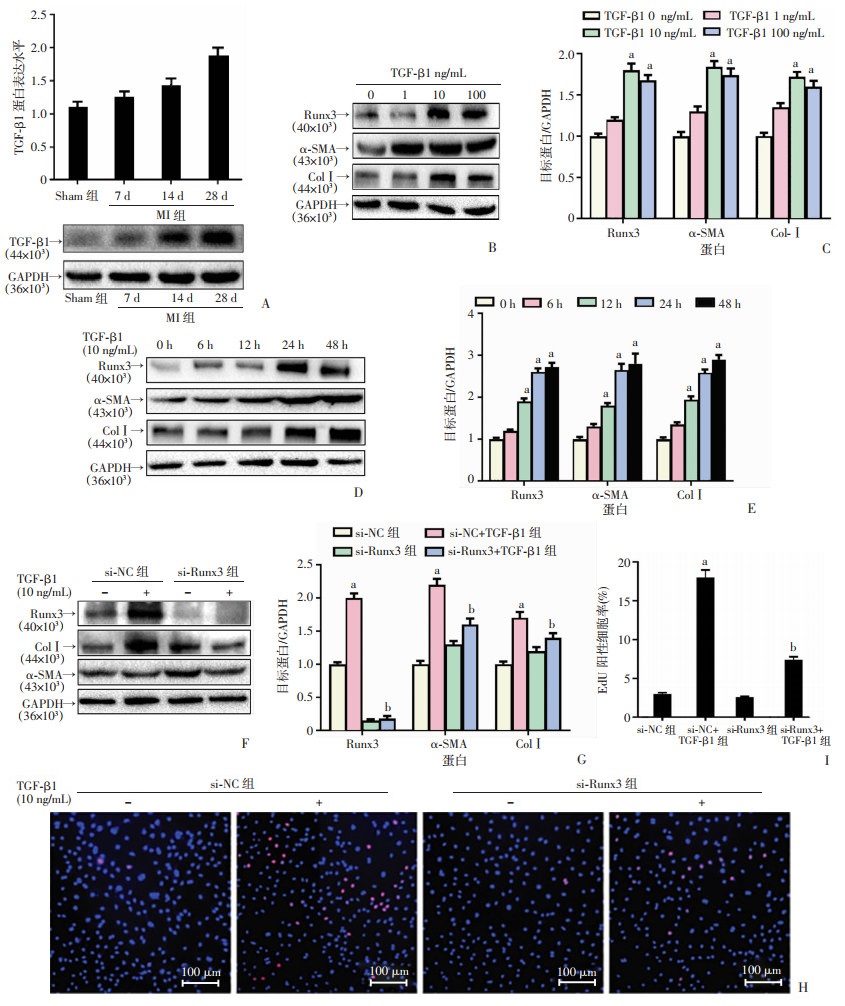
|
| A:MI小鼠7、14、28 d后心肌组织中TGF-β1蛋白表达a:P < 0.05,与Sham组比较;B~E:分别为不同浓度及不同时间TGF-β1刺激心脏成纤维细胞后Runx3、α-SMA和ColⅠ蛋白的表达a:P < 0.05,与0 ng/mL或0 h比较;F、G:TGF-β1刺激转染si-NC组和si-Runx3组的心脏成纤维细胞中Runx3、α-SMA和ColⅠ的蛋白水平a:P < 0.05,与si-NC组比较;b:P < 0.05,与si-NC+TGF-β1组比较;H、I:EdU染色分析TGF-β1刺激转染si-NC组和si-Runx3组的心脏成纤维细胞增殖及阳性细胞分析蓝点代表细胞核;红点代表增殖细胞;a:P < 0.05,与si-NC组比较;b:P < 0.05,与si-NC+TGF-β1组比较 图 5 Runx3调控心脏成纤维细胞Ⅰ型胶原合成和增殖 |
3 讨论
心肌纤维化是MI后病理性心脏重构最重要的机制[10-11]。MI后心肌纤维化的进展是一个级联反应,由炎症浸润(小鼠3~5 d的炎症期)开始,随后是肉芽化和成熟阶段,在此阶段,心脏成纤维细胞在随后的几天内分化、增殖、迁移和沉积胶原[12]。Runx3是Runx家族的成员,调节各种发展过程,在心血管系统中高度表达[13]。最初,在一些骨肉瘤和乳腺癌患者中报道了异常的Runx3表达,并且被认为是肿瘤进展的早期事件,表明该基因在许多类型的癌症中起作用[14-15]。最近研究证实,miR-17-5b是一种抗心肌纤维化的保护因子,发现其靶向抑制Runx3[16]。本研究显示,在小鼠MI模型中,随着缺血时间的延长和心肌纤维化的加重,Runx3的表达逐渐增加。
为了研究Runx3在心肌纤维化中的作用,研究通过尾静脉注射si-Runx3制备了Runx3全基因敲除小鼠。结果观察到抑制Runx3表达可显著减轻MI后不利的心肌纤维化和改善心功能,提示Runx3可能是MI后心肌重塑和纤维化的关键调节因子。此外,下调Runx3可减轻MI后心肌纤维化的发展,提示Runx3可能是一个潜在的治疗靶点。已有研究发现,心脏成纤维细胞分化是心肌纤维化的主要病理机制[2]。在小鼠MI模型中,随着α-SMA和ColⅠ表达的升高,梗死区Runx3表达显著上调。值得注意的是,Runx3下调抑制了心脏成纤维细胞的分化和ColⅠ的沉积。MI后心肌纤维化中TGF-β1信号转导介导心脏成纤维细胞分化。Runx3是TGF-β信号通路的下游效应器,在血管生成、细胞迁移和侵袭中起着关键作用[17]。本研究还发现Runx3基因敲除降低了TGF-β1诱导的心脏成纤维细胞分化。
在促进心肌纤维化进展的各种关键纤维化途径中,心脏成纤维细胞的增殖是其主要机制[18]。研究发现,心脏成纤维细胞在心脏纤维化过程中过度增殖,并伴有细胞外基质蛋白的净积累,而通过抑制TGF-β1诱导的心脏成纤维细胞增殖可减轻心肌纤维化[19]。本研究发现,MI后28 d,纤维化的小鼠心脏中Ki67阳性细胞的数量增加。在MI后心肌纤维化小鼠模型中,Runx3缺失显著抑制Ki67阳性细胞数的增加。与体内研究结果一致,Runx3基因敲除可显著抑制TGF-β1刺激的心脏成纤维细胞增殖。这些结果表明,Runx3参与调控心脏成纤维细胞增殖,然而具体Runx3通过什么途径参与调节心脏成纤维细胞增殖仍有待进一步研究。
综上所述,Runx3是MI后心肌纤维化的一个新调节因子,参与心脏成纤维细胞分化和增殖。因此,靶向Runx3可能是预防MI后心肌纤维化的潜在治疗策略。
| [1] |
陶逸菁, 夏智丽, 高程洁, 等. 急性心肌梗死再血管化成功后预测左心室重构相关生物标志物的分析[J]. 上海交通大学学报(医学版), 2019, 39(1): 60-64. TAO Y J, XIA Z L, GAO C J, et al. Analysis of biomarkers for predicting left ventricular remodeling after successful revascularization of acute myocardial infarction[J]. J Shanghai Jiaotong Univ (Med Sci), 2019, 39(1): 60-64. |
| [2] |
孙润民, 王琼英, 齐苗苗, 等. 急性心肌梗死后心力衰竭预测因素的研究进展[J]. 中华心血管病杂志, 2019, 47(11): 923-926. SUN R M, WANG Q Y, QI M M, et al. Research progress on the prediction of heart failure post acute myocardial infarction: clinical feature, risk score and biomarkers[J]. Chin J Cardiol, 2019, 47(11): 923-926. |
| [3] |
吴学平, 李志宏, 王新艳, 等. 心肌梗死后心脏修复与心肌细胞再生的研究进展[J]. 中国动脉硬化杂志, 2019, 27(10): 899-904. WU X P, LI Z H, WANG X Y, et al. Recent advances in cardiac repair and regeneration after myocardial infarction[J]. Chin J Arterioscler, 2019, 27(10): 899-904. |
| [4] |
郑海清, 应苗法, 顾胜龙, 等. 心肌纤维化的信号转导机制及新型抑制剂的研究进展[J]. 中国细胞生物学学报, 2019, 41(2): 268-274. ZHENG H Q, YING M F, GU S L, et al. Molecular signaling mechanism behind myocardial fibrosis and advances in novel inhibitors[J]. Chin J Cell Biol, 2019, 41(2): 268-274. |
| [5] |
LEE S H, HYEON D Y, YOON S H, et al. RUNX3 methylation drives hypoxia-induced cell proliferation and antiapoptosis in early tumorigenesis[J]. Cell Death Differ, 2021, 28(4): 1251-1269. |
| [6] |
KIM B R, KANG M H, KIM J L, et al. RUNX3 inhibits the metastasis and angiogenesis of colorectal cancer[J]. Oncol Rep, 2016, 36(5): 2601-2608. |
| [7] |
ZHENG K, YU J, CHEN Z, et al. Ethanol promotes alcohol-related colorectal cancer metastasis via the TGF-β/RUNX3/Snail axis by inducing TGF-β1 upregulation and RUNX3 cytoplasmic mislocalization[J]. EBioMedicine, 2019, 50: 224-237. |
| [8] |
LIU Y H, ZOU J, LI B G, et al. RUNX3 modulates hypoxia-induced endothelial-to-mesenchymal transition of human cardiac microvascular endothelial cells[J]. Int J Mol Med, 2017, 40(1): 65-74. |
| [9] |
TAO L, BEI Y, CHEN P, et al. Crucial role of miR-433 in regulating cardiac fibrosis[J]. Theranostics, 2016, 6(12): 2068-2083. |
| [10] |
陈羽斐, 沈伟, 施海明. 急性心肌梗死逆向加速动脉硬化进程的机制研究进展[J]. 中华医学杂志, 2019, 99(1): 72-74. CHEN Y F, SHEN W, SHI H M. Research progress on Mechanism of reverse acceleration of atherosclerosis in acute myocardial infarction[J]. Natl Med J China, 2019, 99(1): 72-74. |
| [11] |
蓝庆肃, 韩冰, 彭瑜, 等. 骨膜蛋白与梗死后心肌纤维化的相关性研究进展[J]. 临床心血管病杂志, 2020, 36(12): 1154-1158. LAN Q S, HAN B, PENG Y, et al. Advanced progress of the relationship between periostin and post-infraction myocardial fibrosis[J]. J Clin Cardiol, 2020, 36(12): 1154-1158. |
| [12] |
TALMAN V, RUSKOAHO H. Cardiac fibrosis in myocardial infarction-from repair and remodeling toregeneration[J]. Cell Tissue Res, 2016, 365(3): 563-581. |
| [13] |
XIAO Z, TIAN Y, JIA Y, et al. RUNX3 inhibits the invasion and migration of esophageal squamous cell carcinoma by reversing the epithelial-mesenchymal transition through TGF-β/Smad signaling[J]. Oncol Rep, 2020, 43(4): 1289-1299. |
| [14] |
左银龙, 周易, 黄珍谷, 等. runx3对人骨肉瘤143B细胞增殖、迁移和侵袭的影响及机制[J]. 南昌大学学报(医学版), 2020, 60(5): 22-27, 33. ZUO Y L, ZHOU Y, HUANG Z G, et al. Effects of Runx3 on proliferation, migration and invasion and its possible mechanism in human 143B osteosarcoma cells[J]. J Nanchang Univ (Med Sci), 2020, 60(5): 22-27, 33. |
| [15] |
BAI X D, HAN G H, LIU Y, et al. MiRNA-20a-5p promotes the growth of triple-negative breast cancer cells through targeting RUNX3[J]. Biomed Pharmacother, 2018, 103: 1482-1489. |
| [16] |
ZHANG Y, WANG S, LAI Q, et al. Cancer-associated fibroblasts-derived exosomal miR-17-5p promotes colorectal cancer aggressive phenotype by initiating a RUNX3/MYC/TGF-β1 positive feedback loop[J]. Cancer Lett, 2020, 491: 22-35. |
| [17] |
SHI L, LIU B Y, WANG X, et al. RUNX3-dependent oxidative epithelial-to-mesenchymal transition in methamphetamine-induced chronic lung injury[J]. Cell Stress Chaperones, 2020, 25(5): 793-802. |
| [18] |
HUANG S, CHEN B, SU Y, et al. Distinct roles of myofibroblast-specific Smad2 and Smad3 signaling in repair and remodeling of the infarcted heart[J]. J Mol Cell Cardiol, 2019, 132: 84-97. |
| [19] |
WANG L, JIANG P, HE Y, et al. A novel mechanism of Smads/miR-675/TGFβR1 axis modulating the proliferation and remodeling of mouse cardiac fibroblasts[J]. J Cell Physiol, 2019, 234(11): 20275-20285. |




