2. 518110 广东 深圳,深圳市龙华区中心医院心血管内科;
3. 421001 湖南 衡阳,南华大学附属南华医院心血管内科
2. Department of Cardiology, Shenzhen Longhua District Central Hospital, Shenzhen, Guangdong Province, 518110;
3. Department of Cardiology, Nanhua Hospital Affiliated to University of South China, Hengyang, Hunan Province, 421001, China
尿毒症心肌病是尿毒症患者晚期由于高容量负荷、尿毒症毒素及内环境紊乱等造成的特异性心肌病病变。其典型特征是慢性肾脏病患者出现心脏舒张功能障碍、左心室肥厚和心肌纤维化,可明显增加终末期肾衰患者的病死率,其病理机制比较复杂,而心肌纤维化是其中关键环节[1-2]。心肌纤维化指的是心肌组织中胶原纤维沉积过多或成分发生改变,从而降低心室壁的顺应性最终可诱发心功能下降[3-4],已有研究发现改善心肌纤维化有助于改善心血管病预后[5-7];然而目前尚未发现抗心肌纤维化的针对性治疗策略。
硫化氢(H2S)是一种新近被发现的内源性气体信号分子,近期研究表明其可通过抗炎、抗凋亡、抗氧化应激等对心血管系统有明确的保护作用[8]。而AP39[即10-oxo-10-(4-(3-thioxo-3H-1, 2-dithiol5yl))]是由SZCZESNY等[9]发明的一种靶向线粒体的稳定的H2S供体,能在氧化应激状态下保护线粒体DNA、线粒体氧化呼吸链的完整性和细胞活力,也能减轻高糖所导致的细胞毒性。有研究显示AP39可减轻缺血再灌注对心脏、肾脏和大脑的损伤,减轻其所致的线粒体ROS的产生[10];并能够延缓内皮细胞衰老[11],也能改善小鼠心脏移植后心肌纤维化[12];但AP39是否能延缓尿毒症所致的大鼠心肌纤维化尚不清楚。
线粒体自噬是一种选择性的自噬,其通过降解细胞内受损或衰老的线粒体维持线粒体稳态及细胞内环境稳态,对线粒体质量和数量的控制有着重要的意义[13]。有研究显示激活PINK1/Parkin介导的线粒体自噬可延缓糖尿病心肌纤维化[14],而且外源性H2S供体硫氢化钠(sodinm hydrosnlfide, NaHS)能通过激活PINK1/Parkin所介导的线粒体自噬改善线粒体稳态,进一步改善高糖所致的大鼠主动脉内皮损伤[15]。前期本课题组也证实NaHS能改善尿毒症大鼠的心肌纤维化[16],但目前PINK1/Parkin介导的线粒体自噬是否参与尿毒症大鼠心肌纤维化发生机制尚不清楚。故本研究拟探讨线粒体靶向性H2S供体AP39是否通过调控PINK1/Parkin介导的线粒体自噬延缓尿毒症大鼠心肌纤维化。
1 材料与方法 1.1 试剂与仪器所有抗体购自Proteintech公司(美国),5×loading buffer、RIPA裂解液购自上海碧云天生物技术有限公司,蛋白酶抑制剂、ECL显影液购自沈阳万类生物科技有限公司,PVDF膜购自Millipore公司(美国),AP39购自APExBIO公司(美国)。恒温箱购自北京六一仪器厂,切片刀购自徕卡有限公司(Leica, 美国),切片机购自浙江金华益迪试验器材有限公司,包埋机购自常州中威电子仪器有限公司,精密PH计购自上海仪电科学仪器股份有限公司,显微镜购自中国厦门Motic实业集团有限公司,石蜡、中性树胶购自美国Sigma公司,Masson染色试剂盒购自Wellbio公司(中国江苏)。
1.2 动物模型建立8周龄雄性SD大鼠40只(购自南华大学实验动物学部),饲养于SPF级环境,12 h交替灯光环境和黑夜环境。根据文献尿毒性心肌病造模方法[17],5% 水合氯醛0.06 mL/kg腹腔注射入大鼠体内麻醉大鼠后,常规固定大鼠于手术操作台、备皮、消毒铺巾;首先取大鼠左侧腹部切口1 cm左右,逐层分离后取出左肾并结扎肾动、静脉,待整个肾脏颜色变成深紫色后表示肾脏已停止血供,此时切除左肾,然后常规缝合组织及皮肤,继续喂养。1周后,同样进行上述操作结扎右肾上下两端各1/3,待两端肾脏变成深紫色后将肾脏轻轻还纳入腹腔,缝合后继续饲养。
1.3 实验动物分组大鼠按随机数字表法分成4组:假手术组(Sham组,仅肾脏游离,不结扎及切除肾脏,术后腹腔注射同等体积的生理盐水)、UCM组(尿毒症心肌病模型组,结扎及切除肾脏,仅保留1/6肾脏功能,术后腹腔注射同等体积的生理盐水)、UCM+AP39组(模型组动物术后予以100 nmol/kg·d AP39腹腔注射[10, 18],1次/d,共4周)、AP39对照组(Sham组大鼠予以100 nmol/kg·d AP39腹腔注射,1次/d,共4周),每组10只。当UCM+AP39组大鼠和AP39组大鼠给予AP39腹腔注射时间满4周后,经5%水合氯醛腹腔注射0.06 mL/kg麻醉大鼠后,完成超声检测,之后通过大静脉抽血进行血生化检测,最后摘除心脏,一部分甲醛固定后用于Masson染色及免疫组化检测,一部分直接冻存于-80 ℃冰箱用于Western blot检测。
1.4 血生化检测处死大鼠前抽取血液后离心机离心(4 000 r/min,10 min),取上清,然后用全自动血清自动生物化学仪(Beck-man CX7,美国)检测血清肌酐值(Scr)和尿素氮(BUN)。
1.5 心脏超声检测腹腔注射AP39大鼠治疗4周后,经5%水合氯醛0.06 mL/kg腹腔注射麻醉大鼠,固定于检测台上,用脱毛膏涂抹胸部皮肤进行脱毛,采用M型超声检测左心室的运动情况并记录各组大鼠的左心室缩短分数(left ventricular fractional shortening, LVFS)值,评价各组大鼠的心功能变化。
1.6 Masson染色取甲醛固定的心室肌组织,浓度梯度酒精脱水,石蜡包埋、切片、脱蜡至水化,核染液染色后流动水冲洗,再次滴加浆染液染色,流动水冲洗,最后滴加复染液无水乙醇冲洗,再次梯度酒精脱水,待吹干、透明、封片后在100倍显微镜下观察并拍照,每个切片随机选3个视野并用Image J软件进行分析,计算组织胶原体积分数(collagen volume fraction, CVF)。
1.7 免疫组化检测取上述石蜡包埋后脱蜡至水化,然后进行抗原修复,封闭,孵育胶原蛋白Ⅲ(Collagen Ⅲ, ColⅢ)一抗(1 ∶100)过夜(4 ℃),次日经漂洗后孵二抗、漂洗、显色,再次复染、返蓝、脱水,最后中性树胶封片并于100倍显微镜下观察。每个切片随机选取3个视野,用Image J图像分析软件对Masson染色图片及免疫组化进行分析,计算染色部分面积与整个视野面积的比值(IOD/area)。
1.8 Western blot检测从-80 ℃冰箱取出心脏组织待冰融化,称量0.1 g心肌组织后加入900 μL RIPA裂解液和9 μL蛋白酶抑制剂,于冰上充分研磨后离心取上清液,定量、煮沸。每次取20 μg蛋白样品上样、电泳、转膜、封闭后于4 ℃孵育一抗(稀释比例1 ∶1 000)过夜,次日TBST洗膜后孵育二抗(稀释比例1 ∶5 000)1 h,再次漂洗PVDF膜后均匀洒上ECL显影液,于显影仪下显影,用Image J分析蛋白条带灰度值,以GAPDH为内参。
1.9 统计学方法采用SPSS 25.0统计软件,数据以x±s表示,各组间总体比较采用单因素方差分析,各组间两两比较采用最小显著性差异分析法(LSD)。P < 0.05为差异具有统计学意义。
2 结果 2.1 各组大鼠血生化指标的变化如表 1所示,与Sham组相比,UCM组大鼠血液中的肌酐值和尿素氮水平明显升高(P < 0.05),而UCM+AP39组明显下降(P < 0.05),结果提示AP39可减轻尿毒症大鼠体内的毒素水平。
| 组别 | 肌酐值 | 尿素氮 |
| Sham组 | 31.75±1.65 | 11.21±0.84 |
| UCM组 | 72.11±2.42a | 19.62±1.23a |
| UCM+AP39组 | 61.50±3.13b | 14.65±1.28b |
| AP39组 | 33.00±1.92 | 11.08±0.80 |
| a: P < 0.05, 与Sham组比较;b: P < 0.05, 与UCM组比较 | ||
2.2 各组大鼠心功能的变化
如表 2及图 1所示,与Sham组相比,UCM组大鼠的LVFS值明显下降(P < 0.05),而UCM+AP39组大鼠的LVFS值明显上升(P < 0.05),结果提示AP39可以改善尿毒症心肌病大鼠的心功能。
| 组别 | LVFS |
| Sham组 | 49.25±3.51 |
| UCM组 | 41.70±2.45a |
| UCM+AP39组 | 48.66±5.30b |
| AP39组 | 48.43±3.92 |
| a: P < 0.05,与Sham组比较;b: P < 0.05,与UCM组比较 | |
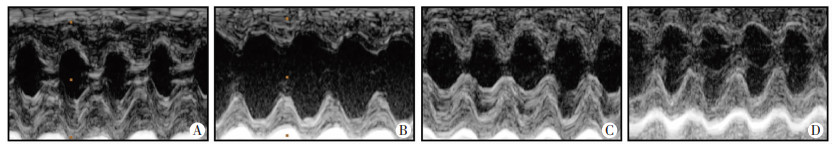
|
| A: Sham组;B:UCM组;C:UCM+AP39组;D:AP39组 图 1 各组大鼠心功能超声图像表现 |
2.3 各组大鼠心肌间质组织胶原沉积及Col Ⅲ的变化
如图 2、3所示,与Sham组相比,UCM组大鼠中心肌间质胶原纤维沉积量(蓝染部分)及Col Ⅲ(棕色部分)量明显增多(P < 0.05),且心肌组织排列紊乱;而UCM+AP39组心肌间质胶原沉积量及Col Ⅲ明显减少(P < 0.05),提示AP39可以改善尿毒症心肌病大鼠的心肌纤维化。
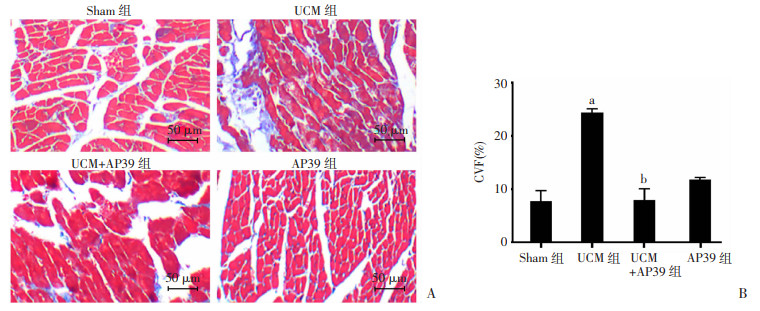
|
| A: Masson染色观察各组心肌纤维化;B:纤维化面积统计a: P < 0.05,与Sham组比较;b: P < 0.05,与UCM组比较 图 2 AP39对尿毒症心肌病大鼠心肌组织中胶原纤维沉积量的影响(n=8, x±s) |
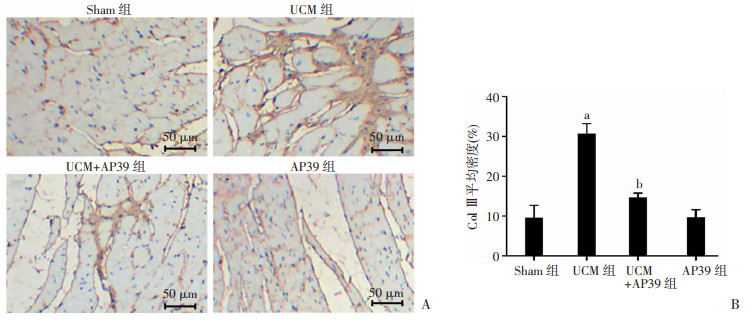
|
| A: 免疫组化观察各组Col Ⅲ沉积量的变化;B:各组Col Ⅲ平均密度统计a: P < 0.05,与Sham组比较;b: P < 0.05,与UCM组比较 图 3 AP39对尿毒症心肌病大鼠心肌组织中Col Ⅲ表达的影响(n=8, x±s) |
2.4 各组大鼠心肌组织中PINK1、Parkin、Atg5、LC3Ⅱ/Ⅰ、Beclin1和P62的蛋白表达水平
如图 4所示,与Sham组相比,UCM组大鼠心肌组织PINK1、Parkin、Atg5、LC3Ⅱ/Ⅰ和Beclin1的蛋白表达水平明显下降(P < 0.05),P62蛋白表达水平明显上升(P < 0.05)。与UCM组大鼠相比,UCM+AP39组大鼠心肌组织PINK1、Parkin、Atg5、LC3Ⅱ/Ⅰ、Beclin1的蛋白表达水平明显上调(P < 0.05),P62蛋白表达水平明显下调(P < 0.05),结果提示AP39可以上调尿毒症大鼠心肌组织的线粒体自噬水平。
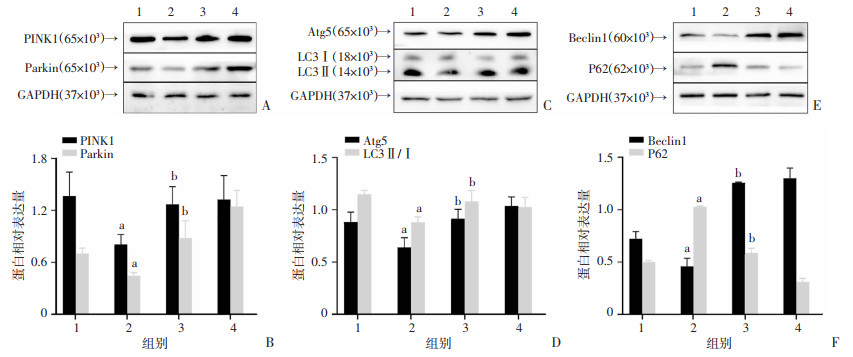
|
|
1: Sham组; 2: UCM组; 3: UCM+AP39组; 4: AP39组a: P < 0.05, 与Sham组比较;b: P < 0.05, 与UCM组比较 A、C、E:Western blot检测心肌组织中蛋白的表达;B、D、E:半定量分析 图 4 AP39对尿毒症心肌病大鼠心肌组织中线粒体自噬相关蛋白表达的影响(n=8, x±s) |
3 讨论
尿毒症心肌病是尿毒症晚期的主要并发症之一,也是尿毒症患者死亡的主要原因,其病理特征包括心肌间质纤维化、心肌细胞肥大变性和心室重塑等[19]。而在我们前期研究中已发现H2S能有效改善高同型半胱酸血症所致的大鼠心肌纤维化[20];也有研究表明H2S缓释剂供体GYY4137能明显缓解高血压和血管紧张素Ⅱ(Ang Ⅱ)所致的大鼠心肌纤维化[21]。同样,本研究也发现AP39能改善尿毒症大鼠心肌纤维化。
在5/6肾脏切除所致尿毒症心肌病大鼠的模型中,发现线粒体活性氧(ROS)生成和促炎症因子水平明显增加,从而导致线粒体功能障碍。而PINK1/Parkin介导的线粒体自噬的激活有助于保护线粒体免受ROS、炎症、Ca2+超载等的损伤;并且清除过度损伤的线粒体,维持线粒体的质量水平与功能的正常,从而维持细胞内的稳态,进一步改善心肌损伤和心肌纤维化[22-23]。也有研究发现Ang Ⅱ所诱发小鼠心肌纤维化模型中,PINK1/Parkin介导的线粒体自噬水平明显上调[24],并且Beclin1所依赖的自噬可改善脓毒血症所诱发的心肌功能障碍及纤维化,其机制可能是通过上调PINK1/Parkin所介导的线粒体自噬[25]。另一方面,PINK1基因敲除小鼠中,发现线粒体凋亡数目增多,ROS水平增加,从而线粒体功能损伤,进一步促进心肌细胞肥大和心肌纤维化[26]。本研究也发现尿毒症大鼠伴随明显的心肌纤维化,同时心肌组织中PINK1/Parking所介导的线粒体自噬水平明显下调,由此合理推导尿毒症心肌纤维化的发生与PINK1/Parin所介导的线粒体自噬明显相关,并且线粒体自噬很可能成为延缓尿毒症心肌病进展的干预靶点。
H2S作为一种新发现的内源性气体信号分子,具有很强的抗氧化能力,目前已发现其具有心肌保护作用,但机制并不十分清楚。有研究显示在db/db高糖高脂小鼠模型中,外源性H2S供体NaHS能通过硫巯基化修饰USP8从而促进与Parkin蛋白的相互作用,上调线粒体自噬水平,进一步改善线粒体功能,减少ROS的产生,从而改善心肌细胞损伤,延缓糖尿病心肌病的进展[27]。并且NaHS能有效改善高糖高脂所导致的大鼠主动脉内皮细胞损伤,其机制是通过上调线粒体自噬水平,减少线粒体ROS水平从而减少细胞凋亡[15]。本研究发现AP39同样可以改善尿毒症心肌纤维化,并且同时也可改善心功能。为进一步探讨其是否通过PINK1/Parkin介导的线粒体自噬改善尿毒症心肌纤维化,本研究观察各组大鼠心肌组织中线粒体自噬通路蛋白PINK1、Parkin和自噬相关蛋白Atg5、LC3Ⅱ/Ⅰ、Beclin1和P62的变化,结果发现AP39能明显上调尿毒症大鼠心肌组织中PINK1/Parkin介导的线粒体自噬水平。由此推测AP39改善尿毒症所致的心肌纤维化,其机制可能是通过激活PINK1/Parkin介导的线粒体自噬,进而维持并改善尿毒症损伤应激性下的心肌细胞稳态。
综上所述,本研究发现线粒体靶向性H2S供体AP39能有效改善尿毒症大鼠心肌纤维化,其机制可能是通过上调PINK1/Parkin介导的线粒体自噬,该发现有望为尿毒症心肌病的治疗提供新的靶点和潜在药物成分。
| [1] |
GARIKAPATI K, GOH D, KHANNA S, et al. Uraemic cardiomyopathy: a review of current literature[J]. Clin Med Insights Cardiol, 2021, 15: 1179546821998347. |
| [2] |
谢莹, 查艳, 林鑫, 等. 曲美他嗪联合左卡尼汀治疗尿毒症心肌病的疗效观察[J]. 中国临床新医学, 2019, 12(12): 1283-1286. XIE Y, ZHA Y, LIN X, et al. Clinical effects of trimetazidine combined with L-carnitine on treatment of uremic cardiomyopathy[J]. Chin J New Clin Med, 2019, 12(12): 1283-1286. |
| [3] |
张召才. 心肌纤维化的研究进展[J]. 临床心血管病杂志, 2004, 20(1): 58-60. ZHANG Z C. Research progress of myocardial fibrosis[J]. J Clin Cardiol, 2004, 20(1): 58-60. |
| [4] |
MEAGHER P B, LEE X A, LEE J, et al. Cardiac fibrosis: key role of integrins in cardiac homeostasis and remodeling[J]. Cells, 2021, 10(4): 770. |
| [5] |
CHEN L, WU Y T, GU X Y, et al. Magnolol, a natural aldehyde dehydrogenase-2 agonist, inhibits the proliferation and collagen synthesis of cardiac fibroblasts[J]. Bioorg Med Chem Lett, 2021, 43: 128045. |
| [6] |
YUN W J, QIAN L, YUAN R Q, et al. Periplocymarin protects against myocardial fibrosis induced by β-adrenergic activation in mice[J]. Biomedecine Pharmacother, 2021, 139: 111562. |
| [7] |
LI Y L, LIU M J, SONG X, et al. Exogenous hydrogen sulfide ameliorates diabetic myocardial fibrosis by inhibiting cell aging through SIRT6/AMPK autophagy[J]. Front Pharmacol, 2020, 11: 1150. |
| [8] |
徐明星, 刘文秀, 梁雨亭, 等. 硫化氢在心血管疾病中的研究进展[J]. 中国现代医学杂志, 2020, 30(21): 34-38. XU M X, LIU W X, LIANG Y T, et al. Recent research of H2S and autophagy in cardiovascular diseases[J]. China J Mod Med, 2020, 30(21): 34-38. |
| [9] |
SZCZESNY B, MÓDIS K, YANAGI K, et al. AP39, a novel mitochondria-targeted hydrogen sulfide donor, stimulates cellular bioenergetics, exerts cytoprotective effects and protects against the loss of mitochondrial DNA integrity in oxidatively stressed endothelial cells in vitro[J]. Nitric Oxide, 2014, 41: 120-130. |
| [10] |
KARWI Q G, BORNBAUM J, BOENGLER K, et al. AP39, a mitochondria-targeting hydrogen sulfide (H2S) donor, protects against myocardial reperfusion injury independently of salvage kinase signalling[J]. Br J Pharmacol, 2017, 174(4): 287-301. |
| [11] |
LATORRE E, TORREGROSSA R, WOOD M E, et al. Mitochondria-targeted hydrogen sulfide attenuates endothelial senescence by selective induction of splicing factors HNRNPD and SRSF2[J]. Aging (Albany NY), 2018, 10(7): 1666-1681. |
| [12] |
ZHU C L, SU Y L, JURIASINGANI S, et al. Supplementing preservation solution with mitochondria-targeted H2S donor AP39 protects cardiac grafts from prolonged cold ischemia-reperfusion injury in heart transplantation[J]. Am J Transplant, 2019, 19(11): 3139-3148. |
| [13] |
张妍, 刘昉. 线粒体动力学和线粒体自噬与心血管疾病的研究进展[J]. 中国心血管病研究, 2021(2): 169-174. ZHANG Y, LIU F. Relation of mitochondrial dynamics and mitochondrial autophagy with cardiovascular disease[J]. Chin J Cardiovasc Res, 2021(2): 169-174. |
| [14] |
YU W J, GAO B L, LI N, et al. Sirt3 deficiency exacerbates diabetic cardiac dysfunction: Role of Foxo3A-Parkin-mediated mitophagy[J]. Biochim Biophys Acta Mol Basis Dis, 2017, 1863(8): 1973-1983. |
| [15] |
LIU N, WU J C, ZHANG L X, et al. Hydrogen Sulphide modulating mitochondrial morphology to promote mitophagy in endothelial cells under high-glucose and high-palmitate[J]. J Cell Mol Med, 2017, 21(12): 3190-3203. |
| [16] |
梁彪. 硫化氢调控JAK2/STAT3通路抑制细胞凋亡改善尿毒症大鼠心肌纤维化[D]. 衡阳: 南华大学, 2018. LIANG B. Hydrogen sulfide alleviates myocardial fibrosis in rats with uremia through the inhibition of apoptosis by regulating JAK2/STAT3 signaling pathway[D]. Hengyang: University of South China, 2018. |
| [17] |
ZHAO G, ZHAO H, TU L, et al. Effects and mechanism of irbesartan on tubulointerstitial fibrosis in 5/6 nephrectomized rats[J]. Huazhong Keji Daxue Xuebao Yixue Yingdewen Ban, 2010, 30(1): 48-54. |
| [18] |
WEPLER M, MERZ T, WACHTER U, et al. The mitochondria-targeted H2S-donor AP39 in a murine model of combined hemorrhagic shock and blunt chest trauma[J]. Shock, 2019, 52(2): 230-239. |
| [19] |
蒲玲. 尿毒症心肌病的诊断与治疗研究进展[J]. 疑难病杂志, 2020, 19(3): 302-306. PU L. Research progress in diagnosis and treatment of uremic cardiomyopathy[J]. Chin J Difficult Complicat Cases, 2020, 19(3): 302-306. |
| [20] |
易嘉莉, 聂连桂, 李亚灵, 等. 外源性硫化氢调节TGF-β1/smad7信号通路改善高同型半胱氨酸血症所致的大鼠心肌纤维化[J]. 重庆医科大学学报, 2021, 46(2): 151-155. YI J L, NIE L G, LI Y L, et al. Exogenous hydrogen sulfide alleviates hyperhomocysteinemia-induced myocardial fibrosis in rats by regulating TGF-β1/Smad7 signaling pathway[J]. J Chongqing Med Univ, 2021, 46(2): 151-155. |
| [21] |
MENG G L, ZHU J B, XIAO Y J, et al. Hydrogen sulfide donor GYY4137 protects against myocardial fibrosis[J]. Oxid Med Cell Longev, 2015, 2015: 691070. |
| [22] |
GORTAN CAPPELLARI G, SEMOLIC A, RUOZI G, et al. Unacylated ghrelin normalizes skeletal muscle oxidative stress and prevents muscle catabolism by enhancing tissue mitophagy in experimental chronic kidney disease[J]. FASEB J, 2017, 31(12): 5159-5171. |
| [23] |
HUO S Q, SHI W, MA H Y, et al. Alleviation of inflammation and oxidative stress in pressure overload-induced cardiac remodeling and heart failure via IL-6/STAT3 inhibition by raloxifene[J]. Oxid Med Cell Longev, 2021, 2021: 6699054. |
| [24] |
FAN G, CHEN M J, WEI J. Involvement of phosphatase and tensin homolog-induced putative kinase 1/Parkin-mediated autophagy in angiotensin Ⅱ-induced cardiac hypertrophy in C57BL/6 mice[J]. J Int Med Res, 2020, 48(5): 300060519896143. |
| [25] |
SUN Y X, YAO X, ZHANG Q J, et al. Beclin-1-dependent autophagy protects the heart during Sepsis[J]. Circulation, 2018, 138(20): 2247-2262. |
| [26] |
BILLIA F, HAUCK L, KONECNY F, et al. PTEN-inducible kinase 1 (PINK1)/Park6 is indispensable for normal heart function[J]. Proc Natl Acad Sci USA, 2011, 108(23): 9572-9577. |
| [27] |
SUN Y, LU F H, YU X J, et al. Exogenous H2S promoted USP8 sulfhydration to regulate mitophagy in the hearts of db/db mice[J]. Aging Dis, 2020, 11(2): 269-285. |




