2. 841000 新疆维吾尔自治区 库尔勒,解放军951医院心肾呼吸科
2. Department of Heart, Kidney and Respiratory Diseases, No.951 Hospital of PLA, Korla, Xinjiang Uygur Autonomous Region, 841000, China
肝纤维化(hepatic fibrosis,HF)是因肝内结缔组织长期发生异常病理、生理改变所致,HF病程持续发展便形成肝硬化。HF是多种肝病发展为肝硬化,甚至肝癌的病理学基础。多种细胞因子参与HF,其中结缔组织生长因子(connective tissue growth factor,CTGF)在HF组织中明显高表达[1],在HF的发生发展过程中发挥重要作用[2-4],而该作用主要是通过CTGF/整合素α5(integrin alpha 5,Itgα5)通路予以实现的[5]。HF时,肝内过度增生的细胞外基质(extracellular matrix,ECM) 参与了HF的形成及肝内组织的重构[6]。1型胶原(Collagen type 1,Col1a1)是HF时ECM的主要成分。活化、增生的肝星状细胞(hepatic stellate cells,HSCs)通过分泌ECM,尤其是Col1a1成为肝内ECM的主要来源[7-8]。已有的HF治疗措施包括基因疗法、生物制剂及化学药物等,但其疗效均不显著。近些年,传统中药对肝病的临床应用已显现其明显优势。其中鳖甲煎丸(turtle shell pills,TSP)已发挥其良好的HF防治作用[9],但因其药方中的部分味药获取困难, 并有一定毒副作用,使其临床应用普遍受限。本团队去除TSP中不易获取与具有毒副作用的味药,适当添加对肝病具有防治作用的味药,配伍成鳖甲煎改良方(novel turtle shell decoction,NTSD)。前期研究证实,NTSD能阻抑肝星状细胞T6(hepatic stellate cell T6,HSCT6)的生长[10],对大鼠HF具一定的抑制作用[10-12]。但其机制尚不清楚。因此,本研究采用自行煎制的NTSD处理HSCT6,并检测其对下调CTGF/Itgα5对肝星状细胞T6的周期变化、细胞凋亡及Col1a1表达的影响,为探明NTSD的抗HF作用机制奠定实验基础。
1 材料与方法 1.1 材料自行煎制的NTSD;TSP购自武汉中联药业集团股份有限公司;细胞株HSCT6购自中国科学院昆明细胞库;Real time-PCR试剂盒购自大连宝生物公司;CTGF、Itgα5及Col1a1抗体购自美国Abcam公司;引物合成于上海捷瑞公司。
1.2 方法 1.2.1 NTSD的制备参照前期研究[10]进行NTSD(含生药量0.71 g/mL)的制备。
1.2.2 NTSD对HSCT6细胞周期、凋亡的影响参照前期研究[10]检测NTSD对HSCT6周期、凋亡的影响,将NTSD处理常规培养的HSCT6(密度:1×106/mL) 作为实验(NTSD)组,未处理及TSP处理的HSCT6分别作为正常对照与阳性对照(TSP)组。收集处理48 h的各组HSCT6与正常对照HSCT6,添加4 ℃预冷的PBS,离心5 min(1 000 r/min),0.5 mL PBS重悬各组HSCT6,计数细胞,各管细胞加人4 ℃预冷的80%乙醇4.5 mL后放置48 h,细胞浓度约为(1×104~2×106)/管,PI染色,FCM检测各组HSCT6周期变化。激发波长(encitation wave length, Ex)=488 nm,发射波长(emission wavelength, Em)=530 nm。Multicycle software软件分析各组HSCT6检测结果。实验至少重复3次。
分别收集与计数经TSP、NTSD处理48 h的各组HSCT6与正常对照HSCT6。分别取各组HSCT6悬液100 μL(约5万~10万个),添加约195 μL缓冲液与5 μL Annexin V-FITC混匀,室温孵育12 min(避光),离心6 min(1 000×g)。各HSCT6样本添加195 μL缓冲液与PI液10 μL混匀。流式细胞仪(FCM)检测、分析各细胞样本凋亡变化情况。实验至少重复3次。
1.2.3 荧光免疫细胞化学检测NTSD对HSCT6细胞CTGF、Itgα5及Col1a1蛋白表达的影响采用不同稀释度的抗体,参照前期研究检测方法[13],采用荧光免疫细胞化学检测NTSD对HSCT6细胞CTGF、Itgα5及Col1a1蛋白表达的影响。各抗体的稀释度分别为:CTGF(1 ∶400)、Itgα5(1 ∶300)与Col1a1(1 ∶450)。实验至少重复3次。
1.2.4 定量PCR检测NTSD对HSCT6 CTGF、Itgα5及Col1a1 mRNA水平的影响分别设计、合成大鼠CTGF、Itgα5及Col1a1 mRNA的定量PCR检测引物(表 1)。按1.2.2分组,各组HSCT6总RNA为模板,定量PCR分别检测其CTGF、Itgα5及Col1a1 mRNA的表达变化,以GAPDH为内参。至少重复实验3次。
| 基因 | 序列(3’-5’) | Tm | 产物大小/bp |
| CTGF | 上游:GGCGAATGAAACTCCCAGTC | 56.02 | 200 |
| 下游:GCAGCCAGAAAGCTCAAACT | 56.12 | ||
| Itgα5 | 上游:TGGACCAAGACGGCTACAAT | 56.03 | 173 |
| 下游:GGCAGAGCCAAAGAAGTCTG | 55.93 | ||
| Col1a1 | 上游:CCCTGCTGGAGAAGAAGGAA | 56.01 | 187 |
| 下游:AGGAGAACCTTTGGGACCAG | 55.91 | ||
| GAPDH | 上游:TCAAGAAGGTGGTGAAGCAG | 59.01 | 111 |
| 下游:AGGTGGAAGAATGGGAGTTG | 58.99 |
1.2.5 Western blot检测NTSD对HSCT6细胞CTGF、Itgα5与Col1a1蛋白表达的影响
按1.2.2分组,将各组HSCT6总蛋白转至PVDF膜,分别浸入含CTGF (1 ∶600)、Itgα5一抗(1 ∶700)与Col1a1一抗(1 ∶550)的封闭液中,4~8 ℃过夜孵育,分别添加相应二抗,室温孵育2.5 h,同化学发光底物结合约11 min,GAPDH作内参。至少重复3次实验。
1.3 统计学分析采用SPSS 22.0统计软件进行组间数据的单因素方差与独立样本t检验分析,结果以x±s表示,P < 0.05表示差异有统计学意义。
2 结果 2.1 NTSD对HSCT6周期变化和细胞凋亡的影响FCM检测结果显示(图 1),与正常对照组HSCT6比较,TSP与NTSD组细胞S期均显著增加,但以NTSD组的增加最为显著,差异具有统计学意义(P < 0.01)。结果提示,NTSD处理的HSCT6细胞被阻滞于S期。

|
| A:正常对照组;B:TSP组;C:NTSD组 图 1 FCM检测MTSD对HSCT6细胞周期的影响 |
与正常对照组(未见凋亡)比较,TSP与NTSD组细胞其凋亡率(早期与晚期)均显著增加,但以NTSD组的增加最为显著,差异具有统计学意义(P < 0.01,图 2)。结果提示,NTSD可诱导HSCT6细胞凋亡。
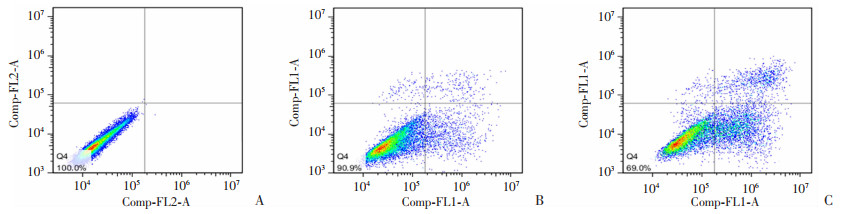
|
| A:正常对照组;B:TSP组;C:NTSD组 图 2 FCM检测NTSD对HSCT6细胞凋亡的影响 |
2.2 NTSD对HSCT6细胞的CTGF、Itgα5及Col1a1蛋白表达的影响
荧光免疫细胞化学检测结果显示,与正常对照组比较,TSP与NTSD组的HSCT6中的CTGF、Itgα5及Col1a1均明显降低,而以NTSD组的HSCT6中的CTGF、Itgα5及Col1a1的降低最为明显,其在各组HSCT6中的表达强弱程度依次为正常对照组>TSP组>NTSD组(图 3)。结果提示,NTSD阻抑HSCT6生长机制之一可能因NTSD下调细胞的CTGF、Itgα5与Col1a1蛋白表达所致。
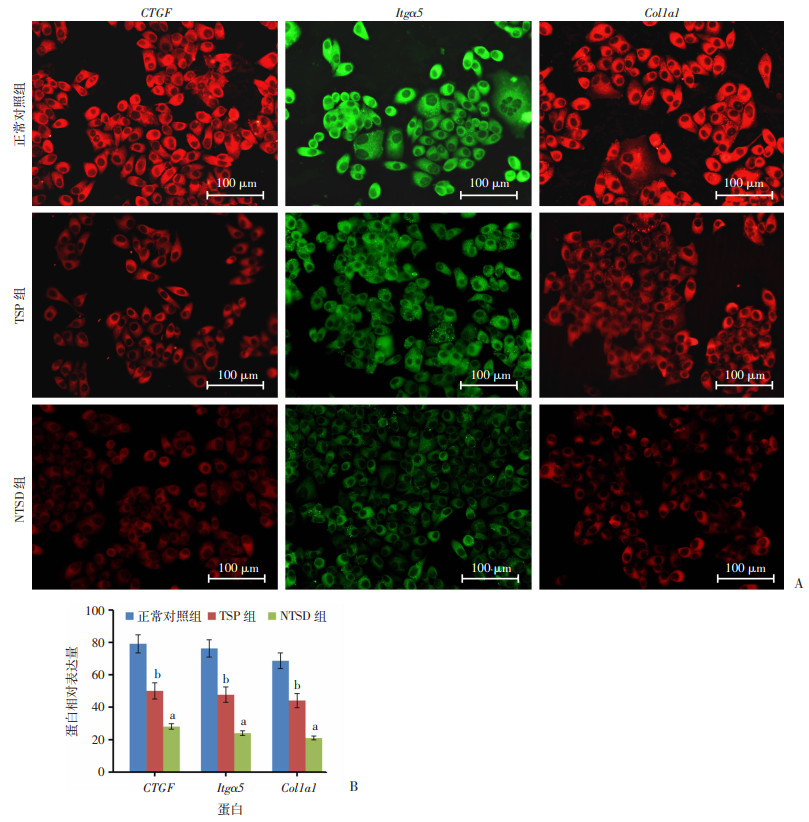
|
| A:免疫荧光细胞化学检测结果; B:定量分析结果(n=3, x±s) a: P < 0.05,b:P < 0.01,与正常对照组比较 图 3 免疫荧光细胞化学检测各组HSCT6细胞CTGF、Itgα5及Col1a1表达 |
2.3 NTSD对HSCT6细胞CTGF、Itgα5及Col1a1的mRNA表达的影响
定量PCR检测表明(图 4),与正常对照组比较,经TSP与NTSD分别处理的HSCT6细胞中CTGF、Itgα5及Col1a1的mRNA表达均显著下调,其中经NTSD处理的HSCT6细胞中CTGF、Itgα5及Col1a1 mRNA表达下调最为明显,差异具有统计学意义(P < 0.01)。结果提示,NTSD抑制HSCT6细胞生长的机制之一可能与NTSD下调其CTGF、Itgα5及Col1a1的mRNA表达紧密相关。
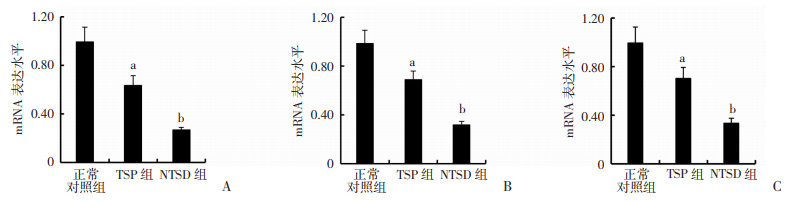
|
| A:CTGF; B:Itgα5; C:Col1a1 a: P < 0.05,b:P < 0.01,与正常对照组比较 图 4 定量PCR检测NTSD对HSCT6细胞的CTGF、Itgα5及Col1a1 mRNA表达的影响(n=3, x±s) |
2.4 NTSD对HSCT6细胞CTGF、Itgα5及Col1a1蛋白表达的影响
Western blot检测结果显示(图 5A),与正常对照组比较,经TSP与NTSD分别处理的HSCT6细胞中CTGF、Itgα5及Col1a1蛋白表达均显著下调,其中经NTSD处理的HSCT6细胞中CTGF、Itgα5及Col1a1蛋白表达下调最为明显,差异具有统计学意义(P < 0.01)(图 5B)。结果提示,NTSD抑制HSCT6细胞生长的机制之一可能与NTSD下调其CTGF、Itgα5及Col1a1蛋白表达密切相关。
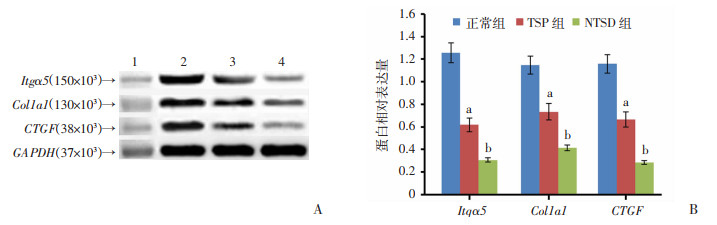
|
| A:Western blot检测结果1:标准;2:正常对照组; 3:TSP组; 4:NTSD组;B:定量分析结果(n=3, x±s) a: P < 0.05,b:P < 0.01,与正常对照组比较 图 5 NTSD对HSCT6细胞的CTGF、Itgα5及Col1a1蛋白表达的影响 |
3 讨论
肝内结缔组织长期过度增生致HF形成。HF是多种肝病发展为肝硬化,甚至肝癌的共同途径[14-15]。HF为病理学概念,属“胁痛”“臌胀”等范畴。传统中药对其有一定抑制和逆转作用。TSP由阿胶、鳖甲胶等多味药构成,有活血化瘀、软坚散结及益气健脾之功效,对肝炎、肝硬化的疗效较为可靠[9]。但因其味药过多,部分味药难以获得或毒副作用明显,限制了其普遍的临床应用。正气虚者不应长久使用TSP,因其扶正之力明显不足。因此,本团队多年对TSP行不断优化,推陈出NTSD。去除TSP恋邪气、气味厚重与易伤正气的15味药,保留其软坚散结、活血化瘀等效用的8味药,添加扶正祛邪、益气健脾的黄芪与茯苓等多味药,其中,茵陈可入肝经,属引经药,能保肝利胆,故而改良成NTSD。前期研究结果提示,NTSD可通过阻抑HSCs的生长,进而抑制HF,以发挥其保肝利胆之功效[10-12]。但其机制尚不清楚。
急、慢性肝损伤修复过程中, HSCs转化为肌成纤维细胞样细胞(Muscle fibroblast like cell,MFC),分泌大量ECM, 尤其Col1a1,沉积于Disse腔内, 致肝窦内皮细胞间隙狭窄, 促使HF发生发展。Col1a1是HF及肝硬化时ECM的主要成分,过度增生的ECM参与了HF的形成和肝内组织的重塑[16]。大量ECM,尤其Col1a1的合成与降解失衡是HF发生发展的重要环节[17]。Col1a1的表达多寡是检测HF强弱的重要指标。因此,抑制HSC生长、诱导其凋亡、减少ECM、尤其减少Col1a1等的生成应是治疗HF的有效策略,寻找可将HSC作为靶点,影响其生物学行为的药物可能是防治HF的新手段[17]。为此,本研究选取HSCT6作为干预靶标,采用NTSD作为影响其生物学行为的药物。免疫荧光细胞化学、定量PCR和Western blot检测结果表明,NTSD可明显下调Col1a1基因及其编码蛋白的表达。SMITH-CORTINEZ等[17]证实,羟化酶拮抗剂可在mRNA与蛋白水平下调Col1a1的表达,以发挥其阻抑肝星状细胞生长的作用。我们的实验结果与文献报道基本相符。
多种细胞因子参与HF病程,其中CTGF在HF组织中表达明显增加[1]。CTGF是重要的致HF细胞因子,是HF的“总开关”[3]。CTGF属CCN家族的最早成员(CTGF、Cyr61及nov)之一,也称CCN2,富含半胱氨酸,由349个氨基酸残基组成。CTGF可由HSCs合成、分泌,可调节肝细胞,尤其可调节HSCs的增殖、分化、黏附与迁移等生物学行为,可直接促使ECM的合成、分泌,在HF的发生发展过程中发挥重要作用[1-4, 18],而该重要作用主要是通过CTGF/整合素通路,尤其是CTGF/Itgα5通路予以实现的[5]。可见让CTGF的表达下调,阻抑HSC的活化和生长将有利于削弱HF的发生发展。本研究采用NTSD干预HSCT6细胞,免疫荧光细胞化学、定量PCR和Western blot检测结果显示,被干预的HSCT6细胞,其CTGF、Itgα5、Col1a1基因及其编码蛋白均得明显下调。FCM检测结果显示,NTSD可将HSCT6阻滞于S细胞周期,并诱导其凋亡。这些结果提示,NTSD抑制HF的机制之一可能与通过影响CTGF/Itgα5信号通路进而阻抑HSC的生长密切相关。
综上所述,NTSD可通过下调CTGF、Itgα5,干预CTGF/Itgα5信号通路,从而将HSCT6阻滞于S细胞周期,诱导其凋亡,并影响其Col1a1的表达,以抑制其生长。本研究仅从细胞水平进行了初步探讨,其动物水平或临床实验效果是否理想,需进一步研究予以证实。
| [1] |
CHEN W, LI Y, HSU C T, et al. Connective tissue growth factor in hepatocytes is elevated by carbon tetrachloride via STAT3 activation[J]. Mol Med Rep, 2020, 21(3): 1390-1398. |
| [2] |
SEO H Y, LEE S H, LEE J H, et al. Src inhibition attenuates liver fibrosis by preventing hepatic stellate cell activation and decreasing connective tissue growth factor[J]. Cell, 2020, 9(3): 558. |
| [3] |
SEO H Y, JUNG Y A, LEE S H, et al. Kahweol decreases hepatic fibrosis by inhibiting the expression of connective tissue growth factor via the transforming growth factor-beta signal- ing pathway[J]. Oncotarget, 2017, 8(50): 87086-87094. |
| [4] |
VERBEKE L, MANNAERTS I, SCHIERWAGEN R, et al. FXR agonist obeticholic acid reduces hepatic inflammation and fibrosis in a rat model of toxic cirrhosis[J]. Sci Rep, 2016, 6: 33453. |
| [5] |
PI L, ROBINSON P M, JORGENSEN M, et al. Connective tissue growth factor and integrin αvβ6: a new pair of regulators critical for ductular reaction and biliary fibrosis in mice[J]. Hepatology, 2015, 61(2): 678-691. |
| [6] |
KIM J, KANG W, KANG S H, et al. Proline-rich tyrosine kinase 2 mediates transforming growth factor-beta-induced hepatic stellate cell activation and liver fibrosis[J]. Sci Rep, 2020, 10(1): 21018. |
| [7] |
MU M, ZUO S, WU R M, et al. Ferulic acid attenuates liver fibrosis and hepatic stellate cell activation via inhibition of TGF-β/Smad signaling pathway[J]. Drug Des Devel Ther, 2018, 12: 4107-4115. |
| [8] |
CHENG Q, LI C, YANG C F, et al. Methyl ferulic acid attenuates liver fibrosis and hepatic stellate cell activation through the TGF-β1/Smad and NOX4/ROS pathways[J]. Chem Biol Interact, 2019, 299: 131-139. |
| [9] |
彭涛. 鳖甲煎丸在肝癌治疗中的临床应用[J]. 中西医结合肝病杂志, 2020, 30(6): 481-483. PENG T. Clinical application of turtle shell pills in the treatment of liver cancer[J]. Chin J Integr Tradit West Med Liver Dis, 2020, 30(6): 481-483. |
| [10] |
BAI G P, YAN G H, WANG G J, et al. Anti-hepatic fibrosis effects of a novel turtle shell decoction by inhibiting hepatic stellate cell proliferation and blocking TGF-β1/Smad signaling pathway in rats[J]. Oncol Rep, 2016, 36(5): 2902-2910. |
| [11] |
艾志波, 张荣华, 闫国和, 等. 鳖甲煎改良方对大鼠肝纤维化的作用及其机制研究[J]. 第三军医大学学报, 2011, 33(3): 274-277. AI Z B, ZHANG R H, YAN G H, et al. Effect of modified turtle shell decoction on hepatic fibrosis in rats and its mechanism[J]. J Third Mil Med Univ, 2011, 33(3): 274-277. |
| [12] |
艾志波, 张荣华, 闫国和. 鳖甲煎改良方对大鼠肝纤维化的防治作用[J]. 世界华人消化杂志, 2011, 19(1): 13-18. AI Z B, ZHANG R H, YAN G H, et al. A modified recipe of turtle shell decoction reduces experimental hepatic fibrosis in rats[J]. World Chin J Dig, 2011, 19(1): 13-18. |
| [13] |
柏干苹, 张荣华, 闫国和, 等. 鳖甲煎改良方对肝星状细胞生长及TGFβ1、Smad3与Smad7表达的影响[J]. 免疫学杂志, 2017, 33(9): 777-782. BAI G P, ZHANG R H, YAN G H, et al. The effect of modified turtle shell decoction on the expression of TGFβ1, Smad3 and Smad7 in rat hepatic stellate cell[J]. Immunol J, 2017, 33(9): 777-782. |
| [14] |
TSUCHIDA T, LEE Y A, FUJIWARA N, et al. A simple diet- and chemical-induced murine NASH model with rapid progression of steatohepatitis, fibrosis and liver cancer[J]. J Hepatol, 2018, 69(2): 385-395. |
| [15] |
AFFO S, YU L X, SCHWABE R F. The role of cancer-associated fibroblasts and fibrosis in liver cancer[J]. Annu Rev Pathol, 2017, 12: 153-186. |
| [16] |
MALDONADO H, HAGOOD J S. Cooperative signaling between integrins and growth factor receptors in fibrosis[J]. J Mol Med (Berl), 2021, 99(2): 213-224. |
| [17] |
SMITH-CORTINEZ N, FAGUNDES R R, GOMEZ V, et al. Collagen release by human hepatic stellate cells requires vitamin C and is efficiently blocked by hydroxylase inhibition[J]. FASEB J, 2021, 35(2): e21219. |
| [18] |
YU B, JIN G N, MA M, et al. Taurocholate induces connective tissue growth factor expression in hepatocytes through ERK-YAP signaling[J]. Cell Physiol Biochem, 2018, 50(5): 1711-1725. |




