膀胱癌是常见的泌尿系肿瘤之一,根据肿瘤组织浸润的程度不同,膀胱癌被分为非肌层浸润性膀胱癌(non muscle invasive bladder cancer,NMIBC)和肌层浸润性膀胱癌(muscle invasive bladder cancer,MIBC)[1]。尽管近年来在经尿道膀胱肿瘤切除术或膀胱灌注化疗等方面取得了进步,但约30%的NMIBC患者最终将发展为MIBC,对于MIBC而言,大约50%的患者在行根治性膀胱切除术后会局部或全身复发,甚至死于该病[2-3]。此外,病理1期合并组织学3级的NMIBC(T1G3)和原位癌(carcinoma in situ,CIS)更倾向于侵袭和转移[4]。研究表明,45%~65%的MIBC患者可观察到CIS的发生,而CIS的存在大大增加了NMIBC发展为MIBC的风险[5]。基于这一复杂的过程,膀胱癌治疗的主要临床问题在于为患者在正确的时间选择最合适的治疗方法,临床上无法准确判断是否早期行根治性膀胱切除术(对于NMIBC患者)或新辅助/辅助化疗(对于MIBC患者)来改善患者的总体生存率。几十年来,很少有预后生物标志物可帮助临床医生为患者的治疗提供精准的决策。因此,了解从NMIBC转变为MIBC的潜在机制至关重要,这将为膀胱癌的治疗方式选择提供有力的帮助。
3-羟甲基戊二酰辅酶A合酶2(3-hydroxy-3-methylglytaryl-CoA synthetase 2, HMGCS2)是酮体生成途径中的限速酶,可导致产生包括β-羟基丁酸酯在内的酮体[6]。HMGCS2的表达和活性受多种转录因子和翻译后修饰的调控,且与多种肿瘤的发生、发展有着紧密的关系[7-8]。研究表明,在雌激素受体阴性的乳腺癌和激素高分泌型的乳腺癌中HMGCS2的表达水平增加[9];HMGCS2的高表达可导致直肠癌对放化疗的敏感性下降[10]。有趣的是,在结肠癌细胞中HMGCS2的表达能被c-Myc抑制,而c-Myc的表达被Wnt/β-catenin途径激活[11];此外,对食管鳞状细胞癌、肝细胞癌和前列腺癌的研究也表明,与非肿瘤组织相比,HMGCS2的表达水平在肿瘤组织中显著降低[12-14]。由此可见,HMGCS2在不同类型肿瘤中发挥着不同的作用。但HMGCS2在膀胱癌中的作用尚不清楚。因此,本研究通过生物信息学的方法分析HMGCS2在膀胱癌中的表达及其相关的生物学功能,并利用免疫组化的方法对其表达水平进行验证,同时结合临床样本及其随访数据对HMGCS2的预后效能进行检测,旨在为膀胱癌的临床诊治提供潜在的靶点。
1 材料与方法 1.1 基因表达数据下载与差异表达基因的筛选3个膀胱癌数据集(GSE83586、GSE120736、GSE128959)的基因表达数据从Gene Expression Omnibus(GEO)数据库中(https://www.ncbi.nlm.nih.gov/geo/)下载,使用GEO2R分析肌层浸润性膀胱癌(T2、T3、T4)与非肌层浸润性膀胱癌(Tis、Ta、T1)中有显著差异表达的基因(筛选标准:log FC的绝对值>1,P < 0.05),用韦恩图(bioinformatics.psb.ugent.be/webtools/Venn) 筛选3个数据集的公共差异基因,并根据公共差异基因在3个数据集的表达情况使用Heatmapper(http://www.heatmapper.ca/expression/)绘制热图。
1.2 生存分析利用GEPIA数据库[15](http://gepia.cancer-pku.cn/index.html)对筛选的公共差异表达基因进行生存分析。
1.3 基因共表达分析使用UALCAN数据库[16](http://ualcan.path.uab.edu/analysis.html)筛选与HMGCS2的表达有显著相关性的基因。
1.4 功能富集分析使用Metascape数据库[17](https://metascape.org/gp/index.html#/main/step1)对HMGCS2及其表达相关的基因集进行GO、KEGG等功能富集分析。
1.5 临床病例资料收集本研究得到湖南省肿瘤医院伦理委员会审批(2016-0008),收集2010年1-12月就诊于本院的膀胱癌患者的临床病理资料,包括年龄、性别、病理T分期、组织学分级。纳入标准:患者均接受过根治性膀胱切除术、经尿道膀胱肿块切除术或膀胱部分切除的手术,术后病理检查确诊为膀胱癌;排除标准:有远处转移的患者;有心血管、内分泌、呼吸系统等其他严重影响寿命的疾病患者。患者的临床病理资料通过医院中心电子病历管理系统获取,并录入相应的信息采集表格。肿瘤T分期依据膀胱癌2017版TNM分期(UICC),组织学分级依据膀胱癌WHO 2016版分级法。共纳入127例患者,其中86例为非肌层浸润性膀胱癌(其中低度恶性潜能尿路上皮乳头状瘤33例、低级别尿路上皮癌24例、高级别尿路上皮癌20例、膀胱原位癌9例),41例为肌层浸润性膀胱癌。定义组织学Ⅰ级(G1)和Ⅱ级(G2)为高分化肿瘤,组织学Ⅲ级(G3)为低分化肿瘤。术后对127名患者进行随访,每3个月1次,随访时间为120个月。
1.6 免疫组化染色及评分对以上127例患者的石蜡切片进行免疫组化染色,采用S-P法,依照试剂盒说明书进行操作,一抗HMGCS2抗体4 ℃过夜(1 ∶200)。免疫组化评分使用阳性肿瘤细胞比例与染色强度评分的乘积进行计算,具体方法见文献[18]。
1.7 统计学分析采用SPSS 19.0统计软件进行分析,基因表达的差异分析采用t检验,HMGCS2表达水平与临床病理特征的相关性分析采用卡方检验,生存分析使用Cox回归法,P < 0.05为差异有统计学意义。
2 结果 2.1 非肌层浸润性膀胱癌和肌层浸润性膀胱癌的差异表达基因纳入的3个数据集(GSE83586、GSE120736、GSE128959)中包含41个肌层浸润性膀胱癌组织和55个非肌层浸润性膀胱癌组织。使用GEO2R在线分析工具,分别从GSE83586、GSE120736、GSE128959中筛选出14、151和69个差异表达基因。其中,GSE83586包含5个上调基因和9个下调基因;GSE120736包含43个上调基因和108个下调基因;GSE128959包含8个上调基因和61个下调基因(图 1A);韦恩图(图 1B)显示SULF1、MT2A、SLC14A、CYP4B1、HMGCS2为3个数据集中的共有差异基因;各个样本的表达热图(图 1C)显示,与非肌层浸润性膀胱癌相比,SULF1(8.90±1.19 vs 7.91±0.58, P < 0.05)、MT2A(10.38±1.24 vs 9.38±1.04,P < 0.05)在肌层浸润性膀胱癌中相对高表达,而SLC14A (10.00±1.67 vs 11.61±1.17, P < 0.05)、CYP4B1(10.21±1.07 vs 11.52±1.12,P < 0.05)、HMGCS2(7.42±1.51 vs 9.38±2.78,P < 0.05)表达下调。
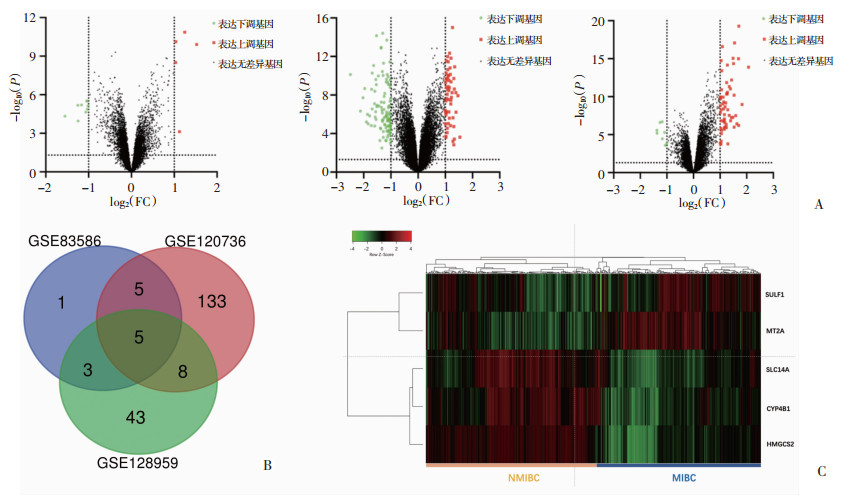
|
| A:火山图筛选3个独立的GEO数据库中具有显著表达差异基因(表达差异倍数 > 2且调整后P < 0.05) 从左到右分别为GSE83586、GSE120736、GSE128959;B:韦恩图确认3个数据库中公共差异基因;C:热图显示5个公共差异基因在GEO数据库样本中的表达情况 图 1 GEO数据库筛选差异表达基因 |
2.2 差异基因在GEPIA数据库中的生存分析
利用GEPIA数据库分别对上述5个差异基因进行Kaplain-Meier生存分析。2个基因(HMGCS2、SULF1)的表达水平对患者总体生存期有明显影响(P < 0.05),其中,HMGCS2高表达的膀胱癌患者总体生存率较高(风险比HR=0.6,P=0.028),而SULF1高表达的膀胱癌患者总体生存率相对较低(HR=0.04,P=0.038,图 2A);此外,1个基因(HMGCS2)的高表达显示相对高的疾病无进展生存率(HR=0.59,P=0.036,图 2B)。表明,HMGCS2可能是膀胱癌的潜在预后指标。
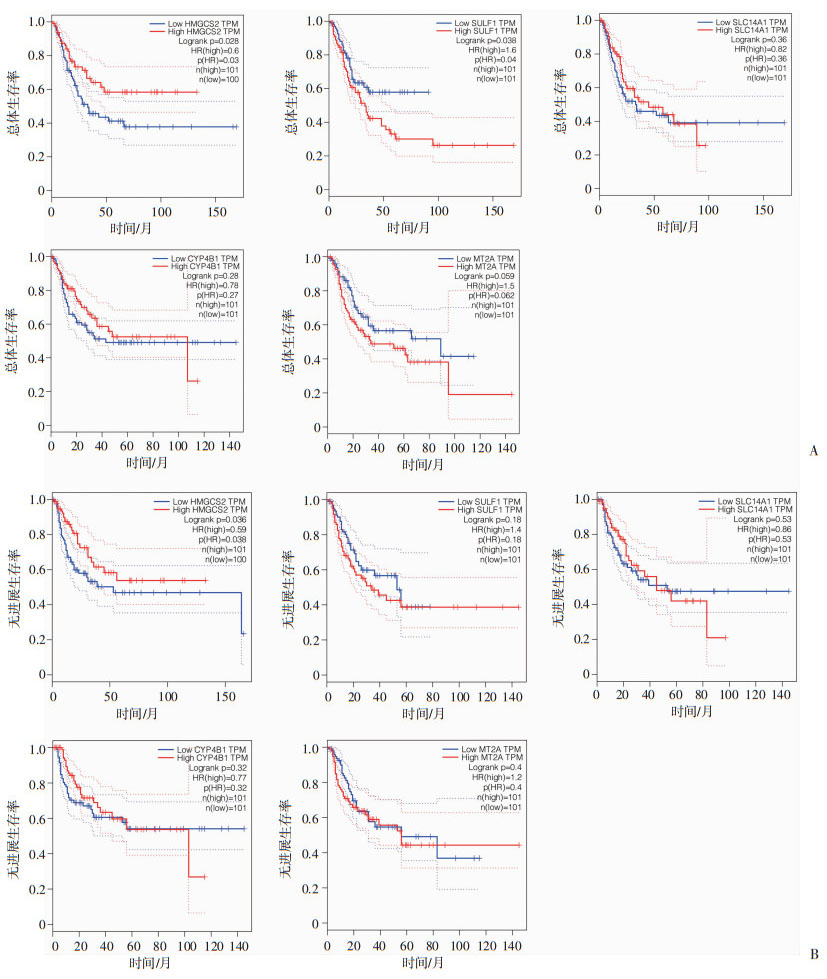
|
| A:各差异基因表达水平(上左:HMGCS2,上中:SULF1,上右:SLC14A1,下左:CYP4B1,下右:MT2A)对膀胱癌患者总体生存期的影响;B:各差异基因表达水平(上左:HMGCS2,上中:SULF1,上右:SLC14A1,下左:CYP4B1,下右:MT2A)对膀胱癌患者无进展生存期的影响 图 2 Kaplan-Meier分析各差异基因对膀胱癌患者预后的影响 |
2.3 HMGCS2及其共表达基因的功能富集分析
使用UALCAN在线数据库(http://ualcan.path.uab.edu/)探索与HMGCS2表达相关性较高的基因,发现69个基因与HMGCS2的表达呈正相关(表 1)。采用Metascape在线数据库中的GO、KEGG等功能及通路富集工具预测HMGCS2及其共表达基因集的生物学功能。在前10个富集分析中,GO富集分析表明HMGCS2与脂肪组织的发育,对从粗面内质网到顺式高尔基体的囊泡靶向运输、糖基化、凋亡过程中半胱氨酸型内肽酶活性的正调控,高尔基体的构成及含蛋白质的复合物分解有关(图 3A)。KEGG通路富集分析显示该基因集与铂类药物的化疗耐药有关(图 3B)。同时,使用Metascape在线数据库进行蛋白质-蛋白质相互作用(PPI)富集分析,图 3C显示从PPI网络中提取3个最重要的MCODE成分,并将每个MCODE成分分别应用于途径和过程富集分析,结果表明,该基因的生物学功能参与mTOR信号通路转导。
| 基因 | 与HMGCS2表达的相关系数 | 基因 | 与HMGCS2表达的相关系数 | |
| WARS2 | 0.86 | TMEM219 | 0.35 | |
| PHGDH | 0.85 | DGCR14 | 0.35 | |
| SEC22B | 0.83 | GSTT1 | 0.35 | |
| C22orf29 | 0.80 | TRMT2A | 0.35 | |
| C3orf42 | 0.57 | CDIPT | 0.35 | |
| C1orf152 | 0.53 | TCTA | 0.34 | |
| SLC25A1 | 0.51 | ARVCF | 0.34 | |
| OVGP1 | 0.51 | GNR2 | 0.34 | |
| TBX1 | 0.50 | TFIP11 | 0.34 | |
| SHISA5 | 0.50 | LRP5 | 0.34 | |
| ZDHHC8 | 0.49 | ACAA1 | 0.34 | |
| LOC728989 | 0.49 | MAPK1 | 0.33 | |
| KRTAP5-9 | 0.48 | ZNF785 | 0.33 | |
| UBE2L3 | 0.47 | DGCR8 | 0.33 | |
| KRTAP5-8 | 0.47 | MMP19 | 0.33 | |
| ZNF697 | 0.45 | DGCR6L | 0.32 | |
| C22orf39 | 0.43 | PPM1F | 0.32 | |
| BID | 0.42 | WNT8B | 0.32 | |
| C22orf25 | 0.42 | CMTM6 | 0.32 | |
| BCL2L13 | 0.42 | MICAL3 | 0.32 | |
| COMT | 0.41 | RRN3P3 | 0.32 | |
| SORL1 | 0.40 | FBRS | 0.32 | |
| TRAK1 | 0.40 | ZC3H12B | 0.31 | |
| LOC200030 | 0.40 | YPEL3 | 0.31 | |
| PPIL2 | 0.40 | GORASP1 | 0.31 | |
| LOC728875 | 0.40 | PIGZ | 0.31 | |
| DGCR2 | 0.39 | NAPA | 0.30 | |
| CABIN1 | 0.38 | C1orf213 | 0.3 | |
| ATP6V1E1 | 0.37 | ZNF600 | 0.30 | |
| CECR5 | 0.37 | ST3GAL1 | 0.30 | |
| BNIPL | 0.36 | KLHL29 | 0.30 | |
| LOC388692 | 0.36 | HIRA | 0.30 | |
| C3orf62 | 0.36 | TPRN | 0.30 | |
| LRP5L | 0.36 | ZNF74 | 0.3 | |
| LOC644165 | 0.36 |
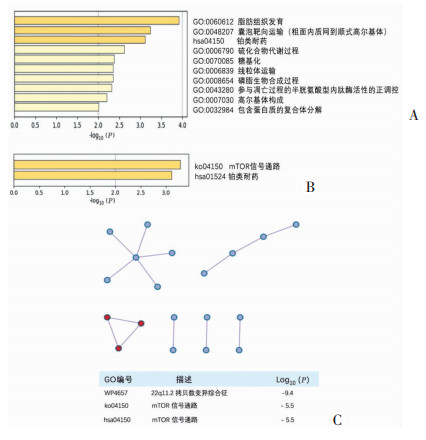
|
| A:GO功能富集分析;B:KEGG通路功能富集分析;C:蛋白与蛋白交互网络图(PPI) 图 3 HMGCS2及与其表达相关基因的功能富集分析 |
2.4 HMGCS2与临床病理特征的相关性
采用免疫组织化学染色检测收集的临床石蜡切片中HMGCS2的蛋白表达水平(图 4)。127例膀胱癌患者中HMGCS2相对高表达82例,低表达45例。HMGCS2的表达水平与病理T分期(P < 0.001)、组织学分级(P=0.006)、患者存活状态(P < 0.001)及患者疾病无进展生存状态(P < 0.001)显著相关,而与患者的年龄(P=0.296)、性别(P=0.389)及BMI(P=0.360)之间未见明显差异(表 2)。单因素Cox回归分析表明,HMGCS2与患者的总体生存率及疾病无进展生存率显著相关(OS:风险比HR=0.104, P < 0.001;DFS:HR=0.155, P < 0.001);多因素Cox回归分析显示,HMGCS2是评估膀胱癌患者预后风险的独立预测因子(OS:HR= 0.181, P < 0.001;DFS:HR=0.312, P < 0.001),见表 3、4。
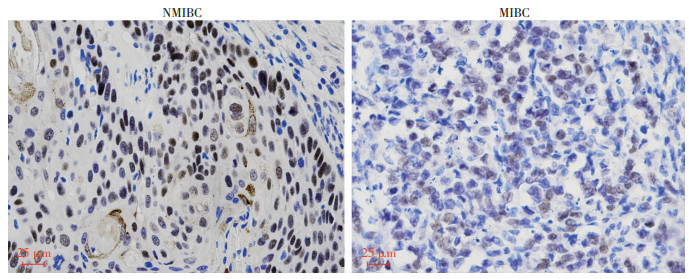
|
| 图 4 免疫组化染色检测HMGCS2在非肌层浸润性膀胱癌(NMIBC)和肌层浸润性膀胱癌(MIBC)中的表达 (S-P) |
| 临床病理特征 | 例数(%) | HMGCS2 | P值 | |
| 低表达(n=45) | 高表达(n=82) | |||
| 年龄/岁 | 0.296 | |||
| ≥ 60 | 74 (58.3) | 29 | 45 | |
| < 60 | 53 (41.7) | 16 | 37 | |
| 性别 | 0.389 | |||
| 男 | 63 (49.6) | 20 | 43 | |
| 女 | 64 (50.4) | 25 | 39 | |
| BMI/kg·m-2 | 0.360 | |||
| ≤24 | 52 (40.9) | 16 | 36 | |
| > 24 | 75 (59.1) | 29 | 46 | |
| T分期 | < 0.001 | |||
| 非肌层浸润性膀胱癌 | 86 (67.7) | 14 | 72 | |
| 肌层浸润性膀胱癌 | 41 (32.3) | 31 | 10 | |
| 组织学分级 | 0.006 | |||
| 低分化 | 45 (35.4) | 23 | 22 | |
| 高分化 | 82 (64.6) | 22 | 60 | |
| 患者存活状态 | < 0.001 | |||
| 存活 | 70 (55.1) | 5 | 65 | |
| 死亡 | 57 (44.9) | 40 | 17 | |
| 疾病进展状态 | < 0.001 | |||
| 无进展 | 63 (49.6) | 5 | 58 | |
| 进展 | 64 (50.4) | 40 | 24 | |
| 临床病理特征 | 单因素分析 | 多因素分析 | |||||
| 风险比 | 95% 置信区间 | P值 | 风险比 | 95% 置信区间 | P值 | ||
| 年龄 | 1.380 | 0.805~2.364 | 0.241 | - | - | - | |
| 性别 | 1.047 | 0.623~1.760 | 0.863 | - | - | - | |
| BMI | 1.319 | 0.773~2.249 | 0.309 | - | - | - | |
| T分期 | 7.856 | 4.464~13.828 | < 0.001 | 2.372 | 1.087~5.171 | 0.030 | |
| 组织学分级 | 4.793 | 2.756~8.337 | < 0.001 | 2.040 | 1.014~4.102 | 0.046 | |
| HMGCS2 | 0.104 | 0.058~0.187 | < 0.001 | 0.181 | 0.092~0.335 | < 0.001 | |
| 临床病理特征 | 单因素分析 | 多因素分析 | |||||
| 风险比 | 95% 置信区间 | P值 | 风险比 | 95% 置信区间 | P值 | ||
| 年龄 | 1.486 | 0.891~2.478 | 0.129 | - | - | - | |
| 性别 | 1.071 | 0.656~1.749 | 0.783 | - | - | - | |
| BMI | 1.408 | 0.849~2.337 | 0.185 | - | - | - | |
| T分期 | 7.889 | 4.592~13.552 | < 0.001 | 2.364 | 1.117~5.002 | 0.024 | |
| 组织学分级 | 5.959 | 3.481~10.200 | < 0.001 | 2.681 | 1.365~5.263 | 0.004 | |
| HMGCS2 | 0.155 | 0.092~0.260 | < 0.001 | 0.312 | 0.168~0.577 | < 0.001 | |
3 讨论
肌层浸润性膀胱癌是一种异质性较强的恶性肿瘤,其不良预后一直是临床上难以解决的问题[19-20]。本研究从3个独立的GEO数据库发现HMGCS2在肌层浸润性膀胱癌和非肌层浸润性膀胱癌之间具有显著的表达差异性,并通过GEPIA数据库的生存分析确认HMGCS2的表达水平与膀胱癌患者总体生存期和疾病无进展生存期显著相关;同时,免疫组化实验结果也表明HMGCS2在肌层浸润性膀胱癌中的表达较非肌层浸润性膀胱癌显著降低,并与膀胱癌T分期及组织学分级有关,同时,高表达HMGCS2的膀胱癌患者临床预后相对较好。SARAON等[12]发现前列腺癌中HMGCS2显著低表达,并且其表达水平与患者的Gleason评分、病理学分级及预后相关。在肝细胞癌组织中HMGCS2的表达水平也明显下调,低水平的HMGCS2表达与患者高级别的组织学分级和临床分期显著相关,并通过增强c-Myc/cyclin D1和EMT的信号传导以及抑制Caspase依赖性的凋亡途径来促进细胞增殖,细胞迁移的发生[21]。此外,HMGCS2表达下调也是食管鳞状上皮癌和结肠癌预后不良的一个危险因素[11, 13]。因此,我们推测低表达的HMGCS2可能促进膀胱癌由非肌层浸润性膀胱癌向肌层浸润性膀胱癌的进展,导致患者预后不良。
相比于低度恶性的肿瘤,恶性程度较高的肿瘤有着更为特殊的能量代谢方式[22]。HMGCS2是酮体生成途径中的一种限速酶,参与肿瘤细胞的代谢重编程[7, 23]。当HMGCS2表达降低时,酮体生成减少,极大地提高了肿瘤细胞对于体内能量的使用率,促进了肿瘤的转移及进展[22, 24]。本研究表明,HMGCS2及其相关基因集可能涉及许多酯类代谢的生物学过程,包括脂肪组织的形成、高尔基体的构建、脂肪的囊泡运输等。因此,我们推测HMGCS2可能通过影响膀胱癌的能量代谢进而加速了膀胱癌的进展。
肌层浸润性膀胱癌对铂类药物的化疗敏感性是影响膀胱癌患者预后状况的重要因素[25]。本研究数据表明HMGCS2及其相关基因集可能参与了肿瘤细胞对于铂类药物化疗敏感性的影响。前期的研究表明HMGCS2可通过mTOR通路参与β样淀粉前体蛋白的自噬降解[26],WANG等[27]则发现HMGCS2与mTOR信号通路共同参与肠上皮细胞的分化,以维持肠道稳定。此外,线粒体同源簇颗粒通过调控HMGCS2的翻译参与生酮作用,进而抑制mTORC1激活和线粒体合成代谢途径,并促进线粒体更新[28]。最近的研究也表明了mTOR信号通路的激活会导致肿瘤细胞对铂类化疗药物的不敏感[29-30]。因此,我们推测HMGCS2在肌层浸润性膀胱癌中的低表达激活了mTOR,进而增强了肿瘤细胞对铂类药物的化疗不敏感。
本研究表明HMGCS2可能参与凋亡途径中半胱氨酸型内肽酶活性的调控。肿瘤的发生大多数与细胞增殖异常或者凋亡失常有关[31-32]。SIEWIN ′ SKI等[33]在浆液性卵巢癌和子宫内膜间质瘤的细胞表面观察到高表达的半胱氨酸型内肽酶抑制物。XIONG等[34]通过对与FKBP相关的lncRNA-mRNA复合体进行生物信息学分析,发现这些复合体在肿瘤中显著高表达并参与凋亡过程中对半胱氨酸型内肽酶的负调控,表明肿瘤细胞能通过限制半胱氨酸型内肽酶的活性抑制细胞凋亡进而促进肿瘤进展。因此,我们推测低表达的HMGCS2可能减弱了半胱氨酸型内肽酶对细胞凋亡的促进作用,从而促进膀胱癌的进展。
总之,本研究表明HMGCS2在肌层浸润性膀胱癌中低表达,其低水平的表达状态与膀胱癌患者高级别的T分期,低分化的肿瘤组织及患者的不良预后相关;生物学功能的分析表明,HMGCS2可能参与肿瘤细胞的脂质代谢,并与铂类化疗不敏感以及肿瘤细胞内mTOR通路的激活有关。
| [1] |
韩苏军, 张思维, 陈万青, 等. 中国膀胱癌发病现状及流行趋势分析[J]. 癌症进展, 2013, 11(1): 89-95. HAN S J, ZHANG S W, CHEN W Q, et al. Analysis of the current status and epidemic trend of bladder cancer in China[J]. Cancer Prog, 2013, 11(1): 89-95. |
| [2] |
DEL GIUDICE F D, PECORARO M, VARGAS H A, et al. Systematic review and meta-analysis of vesical imaging-reporting and data system (VI-RADS) inter-observer reliability: an added value for muscle invasive bladder cancer detection[J]. Cancers, 2020, 12(10): 2994. |
| [3] |
HURLE R, CASALE P, LAZZERI M, et al. En bloc re-resection of high-risk NMIBC after en bloc resection: results of a multicenter observational study[J]. World J Urol, 2020, 38(3): 703-708. |
| [4] |
ATTA M A, KOTB A F, SHARAFELDEEN M, et al. The value of extended good quality transurethral resection of bladder tumour in the treatment of the newly diagnosed bladder cancer[J]. Arab J Urol, 2017, 15(1): 60-63. |
| [5] |
LIU W, TIAN J H, ZHANG S, et al. The utilization status of neoadjuvant chemotherapy in muscle-invasive bladder cancer: a systematic review and meta-analysis[J]. Minerva Urol Nephrol, 2021, 73(2): 144-153. |
| [6] |
KIM J T, LI C, WEISS H L, et al. Regulation of ketogenic enzyme HMGCS2 by wnt/β-catenin/PPARγ pathway in intestinal cells[J]. Cells, 2019, 8(9): E1106. |
| [7] |
GRABACKA M, PIERZCHALSKA M, DEAN M, et al. Regulation of ketone body metabolism and the role of PPARα[J]. Int J Mol Sci, 2016, 17(12): E2093. |
| [8] |
NEWMAN J C, VERDIN E. Ketone bodies as signaling metabolites[J]. Trends Endocrinol Metab, 2014, 25(1): 42-52. |
| [9] |
GROMOV P, ESPINOZA J A, TALMAN M L, et al. FABP7 and HMGCS2 are novel protein markers for apocrine differentiation categorizing apocrine carcinoma of the breast[J]. PLoS ONE, 2014, 9(11): e112024. |
| [10] |
LEE Y E, HE H L, SHIUE Y L, et al. The prognostic impact of lipid biosynthesis-associated markers, HSD17B2 and HMGCS2, in rectal cancer treated with neoadjuvant concurrent chemoradiotherapy[J]. Tumour Biol, 2015, 36(10): 7675-7683. |
| [11] |
CAMARERO N, MASCARÓ C, MAYORDOMO C, et al. Ketogenic HMGCS2 is a c-Myc target gene expressed in differentiated cells of human colonic epithelium and down-regulated in colon cancer[J]. Mol Cancer Res, 2006, 4(9): 645-653. |
| [12] |
SARAON P, CRETU D, MUSRAP N, et al. Quantitative proteomics reveals that enzymes of the ketogenic pathway are associated with prostate cancer progression[J]. Mol Cell Proteomics, 2013, 12(6): 1589-1601. |
| [13] |
TANG H, WU Y, QIN Y, et al. Predictive significance of HMGCS2 for prognosis in resected Chinese esophageal squamous cell carcinoma patients[J]. Onco Targets Ther, 2017, 10: 2553-2560. |
| [14] |
SU S G, YANG M, ZHANG M F, et al. miR-107-mediated decrease of HMGCS2 indicates poor outcomes and promotes cell migration in hepatocellular carcinoma[J]. Int J Biochem Cell Biol, 2017, 91(Pt A): 53-59. |
| [15] |
TANG Z, LI C, KANG B, et al. GEPIA: a web server for cancer and normal gene expression profiling and interactive analyses[J]. Nucleic Acids Res, 2017, 45(w1): W98-W102. |
| [16] |
CHANDRASHEKAR D S, BASHEL B, BALASUBRA-MANYA S A H, et al. UALCAN: a portal for facilitating tumor subgroup gene expression and survival analyses[J]. Neoplasia, 2017, 19(8): 649-658. |
| [17] |
ZHOU Y Y, ZHOU B, PACHE L, et al. Metascape provides a biologist-oriented resource for the analysis of systems-level datasets[J]. Nat Commun, 2019, 10(1): 1523. |
| [18] |
朱帅, 许镇州, 薛蕾, 等. Adnp在膀胱尿路上皮癌组织中的表达及其临床意义[J]. 中国肿瘤生物治疗杂志, 2019, 26(11): 1214-1221. ZHU S, XU Z Z, XUE L, et al. Expression of Adnp in bladder urothelial carcinoma and its clinical significance[J]. Chin J Cancer Biother, 2019, 26(11): 1214-1221. |
| [19] |
余昆, 代林, 刘胜, 等. 膀胱部分切除术与根治性全膀胱切除术治疗局限性肌层浸润性膀胱癌的临床分析[J]. 第三军医大学学报, 2018, 40(2): 169-175. YU K, DAI L, LIU S, et al. Clinical analysis of partial cystectomy and radical total cystectomy in the treatment of localized myometrial invasive bladder cancer[J]. J Third Mil Med Univ, 2018, 40(2): 169-175. |
| [20] |
王猛, 滕晓东. 肌层浸润性膀胱癌的分子分型研究进展[J]. 中华病理学杂志, 2017, 46(6): 439-442. WANG M, TENG X D. Research progress in molecular classification of muscular invasive bladder cancer[J]. Chin J Pathol, 2017, 46(6): 439-442. |
| [21] |
WANG Y H, LIU C L, CHIU W C, et al. HMGCS2 mediates ketone production and regulates the proliferation and metastasis of hepatocellular carcinoma[J]. Cancers, 2019, 11(12): 1876. |
| [22] |
PAVLOVA N N, THOMPSON C B. The emerging hallmarks of cancer metabolism[J]. Cell Metab, 2016, 23(1): 27-47. |
| [23] |
GRABACKA M M, WILK A, ANTONCZYK A, et al. Fenofibrate induces ketone body production in melanoma and glioblastoma cells[J]. Front Endocrinol (Lausanne), 2016, 7: 5. |
| [24] |
PUCHALSKA P, CRAWFORD P A. Multi-dimensional roles of ketone bodies in fuel metabolism, signaling, and therapeutics[J]. Cell Metab, 2017, 25(2): 262-284. |
| [25] |
王坤, 段鑫鑫, 姚欣. 肌层浸润性膀胱癌的精准新辅助化疗进展研究[J]. 中国肿瘤临床, 2020, 47(22): 1168-1170. WANG K, DUAN X X, YAO X. Advances in precision neoadjuvant chemotherapy for muscular invasive bladder cancer[J]. Chin J Clin Oncol, 2020, 47(22): 1168-1170. |
| [26] |
HU L T, ZHU B L, LAI Y J, et al. HMGCS2 promotes autophagic degradation of the amyloid-β precursor protein through ketone body-mediated mechanisms[J]. Biochem Biophys Res Commun, 2017, 486(2): 492-498. |
| [27] |
WANG Q D, ZHOU Y N, RYCHAHOU P, et al. Ketogenesis contributes to intestinal cell differentiation[J]. Cell Death Differ, 2017, 24(3): 458-468. |
| [28] |
PLA-MARTÍN D, SCHATTON D, WIEDERSTEIN J L, et al. CLUH granules coordinate translation of mitochondrial proteins with mTORC1 signaling and mitophagy[J]. EMBO J, 2020, 39(9): e102731. |
| [29] |
BAIZE N, MONNET I, GREILLIER L, et al. Second-line treatments of small-cell lung cancers[J]. Expert Rev Anticancer Ther, 2017, 17(11): 1033-1043. |
| [30] |
KUMAR S, KUMAR A, SHAH P P, et al. MicroRNA signature of Cis-platin resistant vs. Cis-platin sensitive ovarian cancer cell lines[J]. J Ovarian Res, 2011, 4(1): 17. |
| [31] |
朱西, 罗生军, 蒋立, 等. Nprl2与膀胱癌患者临床病理特征的相关性及对膀胱癌细胞凋亡的影响[J]. 第三军医大学学报, 2021, 43(5): 432-437. ZHU X, LUO S J, JIANG L, et al. Correlation of Nprl2 with clinicopathological characteristics of bladder cancer patients and its effect on bladder cancer cell apoptosis[J]. J Third Mil Med Univ, 2021, 43(5): 432-437. |
| [32] |
赵阳, 葛雷, 单中杰. lncRNA HULC在膀胱癌组织中的表达及其对5637细胞恶性生物学行为的影响[J]. 中国肿瘤生物治疗杂志, 2021, 28(1): 60-66. ZHAO Y, GE L, SHAN Z J. The expression of lncRNA HULC in bladder cancer and its effect on the malignant biological behavior of 5637 cells[J]. Chin J Cancer Biother, 2021, 28(1): 60-66. |
| [33] |
SIEWIŃSKI M, SALEH Y, POPIELA A, et al. Expression of high molecular weight cysteine proteinase inhibitor in ovarian cancer tissues: regulation of cathepsin B expression by placental CPI[J]. Biol Chem, 2003, 384(7): 1103-1107. |
| [34] |
XIONG H C, CHEN Z H, CHEN W J, et al. FKBP-related ncRNA-mRNA axis in breast cancer[J]. Genomics, 2020, 112(6): 4595-4607. |




