妊娠滋养细胞肿瘤(gestational trophoblastic neoplasia,GTN)是一组由子宫胎盘部位滋养层细胞异常增殖引起的妇科恶性肿瘤,组织学上包括侵袭性葡萄胎、绒毛膜癌、胎盘部位滋养细胞肿瘤(placenta site trophoblastic tumor,PSTT)、上皮样滋养细胞肿瘤(epithelioid trophoblastic tumor, ETT)和非典型胎盘部位结节(atypical placental site nodule,APSN)。因GTN特殊的生物学行为,其诊断不依赖病理及影像学证据,人绒毛膜促性腺激素(human chorionic gonadotropin,hCG)异常升高是主要诊断依据及预后观察指标[1]。GTN的治疗以化疗为主、手术及放疗为辅,因其对化疗非常敏感,治愈率可达90%~100%。现临床上广泛施行的国际妇产科联合会(International Federation of Gynecology and Obstetrics,FIGO)预后评分系统通过8个临床病理因素将GTN患者划分为低危组及高危组进行分层管理,但多项临床研究表明,以此标准进行分层的低危患者中25%~30%对推荐的单药化疗出现耐药,需更换为多药化疗[2]。这导致疗程数增加,带来更多的化疗副反应,对于患者及其家属造成心理负担,不利于疾病的预后,同时耐药及复发是患者的主要死亡原因。有学者建议将评分系统进行更为细致地分层或对GTN进行动态评分,但目前尚无定论[3]。因此,寻找其他可能影响GTN患者预后的因素进行患者分流,以此指导临床工作,进行个体化精准治疗,降低耐药及复发率是目前研究工作的要点。
目前认为,肿瘤作为一种持续未被解决的慢性炎症状态,因增殖过快致组织相对缺血缺氧,发生大量细胞死亡,释放炎症信号,招募中性粒细胞、淋巴细胞、巨噬细胞、肥大细胞等多种炎症细胞浸润,多数晚期肿瘤患者外周血中性粒细胞数量增多[4]。中性粒细胞与淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)作为一种炎症指标可反映机体炎症状态,与卵巢癌预后密切相关[5]。
同时,恶性肿瘤患者多存在凝血及纤溶系统功能障碍。研究表明,如果血小板计数超过400×109/L,宫颈癌患者死亡的相对风险增加1.5倍[6];肺癌患者中血小板水平升高与肿瘤分期及转移有关(P < 0.05)[7]。D-二聚体是临床上血液高凝状态和血栓形成的主要标志, 其升高与宫颈癌、子宫内膜癌及卵巢癌等不良预后相关,与肿瘤分期也明显相关[8],D-二聚体升高在一定程度上反映了肿瘤的恶性程度。
GTN作为一种恶性肿瘤,淋巴细胞与血小板比值(platelet to lymphocyte ratio,PLR)、NLR及D-二聚体对其可能同样存在预测不良预后的价值,因GTN的低发病率及良好预后,目前关于这方面的研究较少,鉴于此,本研究旨在分析PLR、NLR及D-二聚体与GTN患者血hCG转阴时间的相关性,并验证临床病理因素对GTN患者的预后价值,初步探讨炎症指标及D-二聚体与GTN的关系。
1 资料与方法 1.1 一般资料选取2011年2月至2020年12月本院收治的GTN住院患者共97例,平均年龄34(14~55)岁,均符合2000 FIGO诊断标准[9],为侵袭性葡萄胎及绒毛膜癌患者。所有患者进行完整病史询问、妇科检查、血hCG测定、盆腔B超或MRI、胸部平片或CT检查、头颅CT或MRI检查等。纳入标准:①初治患者,资料完整,经治疗hCG转阴者;②既往未行预防性化疗及手术。排除标准:①PSTT、ETT、APSN及非妊娠滋养细胞肿瘤者;②各种原因延误化疗者;③合并休克、血液系统疾病、急性感染性疾病、自身免疫性疾病、严重外伤、妊娠、其他恶性肿瘤及重要脏器功能损害者;④治疗前1个月内及治疗过程中使用阿司匹林、肝素及激素类等影响凝血功能的药物者;⑤合并深静脉血栓、肺栓塞、主动脉夹层、冠心病等容易导致D-二聚体水平增高的疾病者。本研究通过本院伦理委员会审批(2021-241),所有患者知情同意。
1.2 方法通过电子病历系统收集97例患者的临床资料,包括年龄、前次妊娠性质、距前次妊娠终止时间、肿瘤转移情况、化疗方案、治疗前血hCG值,并收集治疗前(包括初始手术或化疗)1周内血常规及凝血象,计算其NLR及PLR。根据2000 FIGO预后评分系统对患者进行评分:<7分为低危,7~12分的Ⅱ期及Ⅲ期患者为高危,≥13分及一线化疗耐药或广泛转移的Ⅳ期患者为极高危。以年龄≥40岁、距前次妊娠时间≥7个月为分组依据。
hCG转阴时间定义为从患者开始治疗至血hCG首次降至正常水平的时间间隔(d)。我院hCG正常值标准为0~5 IU/L,D-二聚体正常值为0~0.55 mg/L,淋巴细胞计数正常值为(1.01~3.20)×109/L,中性粒细胞计数正常值为(1.80~6.30)×109/L,血小板计数正常值为(101~320)×109/L。
1.3 化疗方案低危GTN患者首选甲氨蝶呤(MTX)单药8日疗法,具体方法:MTX 1 mg/kg,第1、3、5、7天肌肉注射,亚叶酸钙10 mg/m2第2、4、6、8天肌肉注射,间隔2周。目前国际上对于GTN化疗耐药的定义尚无一致看法,我院将化疗1个疗程后血清hCG水平下降<10%甚至上升,或影像学检查提示肿瘤病灶不缩小或增大或出现新的病灶视为耐药。美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)最新指南对于耐药及复发的低危患者使用EMA-CO方案的治愈率达100%,我院一线MTX耐药者均调整为EMA-CO多药化疗。具体方案:依托泊苷100 mg/m2,第1~2天静滴;放线菌素D 0.5 mg/kg,第1~2天静滴;MTX 300 mg/m2,第1天静滴;亚叶酸钙15 mg肌肉注射,每12小时1次,共4次,MTX给药后24 h用药;环磷酰胺600 mg/m2,第8天静滴,长春新碱1 mg/m2,第8天静滴。转移性肿瘤、FIGO评分≥7分及治疗前hCG≥10 000 IU/L者,初始直接使用EMA-CO多药化疗方案。
1.4 观察指标每个疗程化疗前监测血hCG,计算其转阴时间,以各影响因素作为分组依据,统计分析血hCG转阴时间与各因素的相关性及危险度。
1.5 统计学分析采用SPSS 25.0统计软件进行分析。计数资料用频数[例(%)]表示,组间比较采用χ2检验;计量资料正态分布的用 x±s表示,非正态分布的用中位数M(P25,P75)表示,组间比较采用t检验及Mann-Whitney U检验;单因素分析采用Kaplan-Meier, 对有关系的变量进一步采用COX回归分析,计算其危险度(HR),并绘制Kaplan-Meier曲线。检验水准α=0. 05。
2 结果 2.1 临床情况97例患者的临床资料见表 1。患者年龄为14~55岁,中位年龄34岁。距前次妊娠终止时间为46 d至16年。治疗前血hCG 16.40~3 381 940.00 IU/L,中位数26 760.36 IU/L。FIGO评分为1~15,低危者63例,高危及极高危者分别为29例和5例,其中低危组中39.7%(25/63)发生转移,高危组82.8%(24/29)发生转移,极高危组100.0%(5/5)发生转移,除低危组中1例为Ⅱ期阴道转移外,其余均为Ⅲ期肺转移。低危组中13例采用MTX单药化疗,其中54.0%(7/13) 的患者因hCG下降不满意更换为EMA-CO方案继续化疗,经多药化疗1~4个疗程后均转阴。转阴时总疗程数为1~22,中位数为4。20例患者在hCG转阴前行全子宫切除术。患者血hCG转阴时间为17~505 d,中位时间64(46, 86) d。治疗前D-二聚体为0.07~16.83 mg/L,中位数0.38 mg/L;中性粒细胞绝对值(3.8±1.42)×109/L, 淋巴细胞绝对值(1.65±0.50)×109/L,血小板计数(220.65±65.84)×109/L。NLR中位数2.29,PLR中位数为134.72,以此为分组依据。
| 变量 | 例(%) |
| 年龄/岁 | |
| <40 | 56(58) |
| ≥40 | 41(42) |
| 前次妊娠性质 | |
| 葡萄胎 | 71(73) |
| 流产 | 17(18) |
| 足月孕 | 9(9) |
| 距前次妊娠终止时间/月 | |
| <7 | 74(76) |
| ≥7 | 23(24) |
| 治疗前hCG/IU·L-1 | |
| <10 000 | 39(40) |
| ≥10 000 | 58(60) |
| 转移性病灶 | |
| 无 | 48(49) |
| 有 | 49(51) |
| FIGO评分 | |
| 低危 | 63(65) |
| 高危 | 29(30) |
| 极高危 | 5(5) |
| 化疗方案 | |
| MTX | 6(6) |
| EMA-CO | 84(87) |
| MTX转EMA-CO | 7(7) |
| 治疗前NLR | |
| <2.29 | 48(49) |
| ≥2.29 | 49(51) |
| 治疗前PLR | |
| <134.72 | 49(51) |
| ≥134.72 | 48(49) |
| 治疗前D-二聚体/mg·L-1 | |
| <0.55 | 62(64) |
| ≥0.55 | 35(36) |
2.2 临床因素与NLR、PLR及D-二聚体的关系
治疗前D-二聚体升高与年龄(P < 0.001)、距前次妊娠终止时间(P=0.019)及治疗前PLR(P=0.048)相关;NLR与化疗方案(P=0.005)及PLR(P < 0.001)相关;PLR与前次妊娠性质(P=0.005)相关。此外,治疗前D-二聚体(P < 0.001)、NLR(P=0.005)、PLR(P=0.021)均与FIGO评分显著相关,见表 2。
| 变量 | D-二聚体 | NLR | PLR | ||||||||
| 正常组(n=62) | 升高组(n=35) | P值 | <2.29组(n=48) | ≥2.29组(n=49) | P值 | <134.72组(n=49) | ≥134.72组(n=48) | P值 | |||
| 年龄/岁 | < 0.001 | 0.176 | 0.906 | ||||||||
| <40 | 44 | 12 | 31 | 25 | 28 | 28 | |||||
| ≥40 | 18 | 23 | 17 | 24 | 21 | 20 | |||||
| 前次妊娠性质 | 0.126 | 0.05 | 0.005 | ||||||||
| 葡萄胎 | 47 | 24 | 40 | 31 | 43 | 28 | |||||
| 流产 | 12 | 5 | 4 | 13 | 4 | 13 | |||||
| 足月孕 | 5 | 6 | 4 | 5 | 2 | 7 | |||||
| 距前次妊娠终止时间/月 | 0.019 | 0.106 | 0.291 | ||||||||
| <7 | 52 | 22 | 40 | 34 | 41 | 36 | |||||
| ≥7 | 10 | 13 | 8 | 15 | 8 | 12 | |||||
| 治疗前hCG/IU·L-1 | 0.079 | 0.125 | 0.172 | ||||||||
| <10 000 | 29 | 10 | 23 | 16 | 23 | 16 | |||||
| ≥10 000 | 33 | 25 | 25 | 33 | 26 | 32 | |||||
| 转移性病灶 | 0.160 | 0.084 | 0.127 | ||||||||
| 无 | 34 | 14 | 28 | 20 | 28 | 20 | |||||
| 有 | 28 | 21 | 20 | 29 | 21 | 28 | |||||
| FIGO评分 | < 0.001 | 0.005 | 0.021 | ||||||||
| 低危 | 48 | 15 | 38 | 25 | 37 | 26 | |||||
| 高危 | 14 | 15 | 10 | 19 | 12 | 17 | |||||
| 极高危 | 0 | 5 | 0 | 5 | 0 | 5 | |||||
| 化疗方案 | 0.140 | 0.024 | 0.655 | ||||||||
| MTX | 6 | 0 | 5 | 1 | 4 | 2 | |||||
| EMA-CO | 51 | 33 | 37 | 47 | 41 | 43 | |||||
| MTX转EMA-CO | 5 | 2 | 6 | 1 | 4 | 3 | |||||
| 治疗前NLR | 0.068 | ||||||||||
| <2.29 | 35 | 13 | - | - | - | - | - | - | |||
| ≥2.29 | 27 | 22 | |||||||||
| 治疗前PLR | 0.048 | < 0.001 | |||||||||
| <134.72 | 36 | 13 | 35 | 14 | - | - | - | ||||
| ≥134.72 | 26 | 22 | 13 | 35 | |||||||
| 转阴时间/d[M(P25,P75)] | 59(42, 69) | 75(64, 102) | < 0.001a | 58(42,66) | 75(58,94) | 0.001a | 59(43,69) | 69(57,99) | 0.004a | ||
| a: Mann-Whitney U检验 | |||||||||||
2.3 相关性分析
Kaplan-Meier单因素分析结果显示,前次妊娠性质、距前次妊娠时间、FIGO评分、化疗方案、治疗前D-二聚体、治疗前hCG、NLR及PLR与GTN患者hCG转阴时间相关,见表 3。将相关因素进一步进行COX多因素分析并计算其HR,结果表明FIGO评分高危(HR=12.368)、极高危(HR=4.205)、治疗前hCG≥10 000 IU/L(HR=2.582)、治疗前NLR≥2.29(HR=1.675)、EMA-CO方案化疗(HR=6.183)、MTX转EMA-CO方案化疗(HR=4.472)是延长hCG转阴时间的独立危险因素,同时发现距前次妊娠的时间≥7个月(HR=0.409)是缩短hCG转阴时间的保护因素,见表 4。以FIGO分值为x轴,转阴时间为y轴绘制线性曲线,如图 1所示,FIGO评分每增加1分,血hCG转阴时间增加约6.5 d。
| 临床变量 | n | 转阴时间/d | Log-rank P值 |
| 年龄/岁 | |||
| < 40 | 56 | 64(46,78) | 0.779 |
| ≥40 | 41 | 64(49,87) | |
| 前次妊娠性质 | |||
| 葡萄胎 | 71 | 61(44,73) | < 0.001 |
| 流产 | 17 | 69(46,107) | |
| 足月孕 | 9 | 94(77,134) | |
| 距前次妊娠的时间/月 | |||
| < 7 | 74 | 63(46,75) | 0.046 |
| ≥7 | 23 | 69(48,96) | |
| 转移灶有无 | |||
| 无 | 48 | 62(42,75) | 0.093 |
| 有 | 49 | 65(57,88) | |
| FIGO评分 | |||
| 低危 | 63 | 57(42,67) | < 0.001 |
| 高危 | 29 | 77(64,99) | |
| 极高危 | 5 | 135(122,265) | |
| 化疗方案 | |||
| MTX | 6 | 41(32,54) | 0.001 |
| EMA-CO | 84 | 65(47,86) | |
| MTX转EMA-CO | 7 | 66(61,89) | |
| 治疗前D-二聚体/mg·L-1 | |||
| < 0.55 | 63 | 59(42,69) | < 0.001 |
| ≥0.55 | 35 | 75(64,102) | |
| 治疗前hCG/IU·L-1 | |||
| < 10 000 | 39 | 43(36,61) | < 0.001 |
| ≥10 000 | 58 | 71(63,94) | |
| 治疗前NLR | |||
| < 2.29 | 48 | 58(42,66) | < 0.001 |
| ≥2.29 | 49 | 75(58,94) | |
| 治疗前PLR | |||
| < 134.72 | 49 | 59(43,69) | < 0.001 |
| ≥134.72 | 48 | 69(57,99) |
| 临床因素 | Wald | HR(95%CI) | P值 |
| 前次妊娠性质 | |||
| 葡萄胎 | 2.902 | 1 | 0.234 |
| 流产 | 2.529 | 2.094(0.842~5.205) | 0.112 |
| 足月孕 | 0.309 | 1.285(0.531~3.110) | 0.578 |
| FIGO评分 | |||
| 低危 | 13.830 | 1 | 0.001 |
| 高危 | 11.458 | 12.368(2.883~53.059) | 0.001 |
| 极高危 | 5.022 | 4.205(1.197~14.765) | 0.025 |
| 治疗前D-二聚体升高 | 3.674 | 1.629(0.989~2.682) | 0.055 |
| 治疗前hCG≥10 000 IU/L | 15.246 | 2.582(1.604~4.157) | < 0.001 |
| 治疗前NLR≥2.29 | 4.276 | 1.675(1.027~2.731) | 0.039 |
| 治疗前PLR≥134.72 | 0.003 | 0.986(0.581~1.674) | 0.959 |
| 化疗方案 | |||
| MTX | 12.433 | 1 | 0.002 |
| EMA-CO | 8.571 | 6.183(1.826~20.936) | 0.003 |
| MTX转EMA-CO | 11.406 | 4.472(1.875~10.664) | 0.001 |
| 距前次妊娠的时间≥7个月 | 6.522 | 0.409(0.206~0.812) | 0.011 |
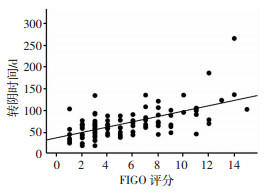
|
| 图 1 FIGO评分与血HCG转阴时间的线性曲线分析 |
2.4 EMA-CO方案分层分析
因纳入患者的化疗方案不同,多数初次治疗方案为EMA-CO,为减少不同化疗方案造成的差异,将EMA-CO方案亚组进行单因素及多因素分析,结果显示FIGO评分高危(HR=7.759)、极高危(HR=3.633),治疗前hCG≥10 000 IU/L(HR=2.535)及治疗前NLR≥2.29(HR=2.29)是延长该亚组患者hCG转阴时间的独立危险因素,见表 5。通过亚组的Kaplan-Meier曲线分析,结果显示FIGO评分高危及极高危者、治疗前hCG≥10 000 IU/L者和治疗前NLR≥2.29者的血hCG转阴时间均长于FIGO评分低危者、治疗前hCG<10 000 IU/L者和治疗前NLR<2.29者(P < 0.05,图 2)。
| 变量 | Log-rank P | Wald | HR(95%CI) | P值 |
| 年龄≥40岁 | 0.628 | - | - | - |
| 前次妊娠性质 | ||||
| 葡萄胎 | < 0.001 | 1.779 | 1 | 0.411 |
| 流产 | 1.733 | 1.841(0.742~4.567) | 0.188 | |
| 足月孕 | 0.542 | 1.405(0.568~3.478) | 0.462 | |
| 有转移病灶 | 0.116 | - | - | - |
| FIGO评分 | ||||
| 低危 | < 0.001 | 9.536 | 1 | 0.008 |
| 高危 | 7.911 | 7.759(1.861~32.347) | 0.005 | |
| 极高危 | 3.633 | 3.428(0.966~12.166) | 0.057 | |
| 治疗前D-二聚体≥0.55 mg/L | < 0.001 | 0.231 | 1.334(0.802~2.221) | 0.267 |
| 治疗前hCG≥10 000 IU/L | < 0.001 | 12.888 | 2.535(1.526~4.212) | < 0.001 |
| 治疗前NLR≥2.29 | < 0.001 | 4.284 | 1.704(1.029~2.821) | 0.038 |
| 治疗前PLR≥134.72 | < 0.001 | 0.001 | 0.992(0.564~1.744) | 0.978 |
| 距前次妊娠的时间≥7个月 | 0.061 | - | - | - |

|
| A:FIGO评分;B:治疗前血hCG;C:治疗前NLR 图 2 不同亚组COX回归分析的Kaplan-Meier曲线 |
3 讨论
GTN是一组不常见的女性生殖系统肿瘤,因其肿瘤血管脆弱,故转移发生早且易出血,肺是最常见的转移部位。因PSTT、ETT及APSN与绒毛膜癌及侵袭性葡萄胎的组织来源不同,前三者更倾向于淋巴转移,hCG升高常不显著,化疗耐药率高,常需手术切除病灶[10],故本研究未纳入。本研究发现高FIGO评分、治疗前hCG高水平、NLR升高及使用多药化疗是导致GTN患者血hCG转阴时间延长的独立危险因素,证实了炎症指标NLR与GTN患者不良预后之间的关系。
本研究对FIGO评分与血hCG转阴时间的关系进行了线性统计分析,发现评分每增加1分,转阴时间平均增加约6.5 d,证实了现行FIGO评分系统的可靠性。BANACH等[11]在对46例低危GTN患者的研究后,认为初始β-hCG>6 000 IU/L时即应考虑首选EMA-CO方案;2018 NCCN指南建议将5~6分列为中危组,因其高单药耐药率推荐首选多药化疗。本研究中低危患者的单药耐药率达53.85%(7/13),我院对于存在高危因素的患者,初始治疗均采用多药化疗且未发生耐药,这反映出以FIGO预后评分建议低危患者进行单药化疗的确存在相对高耐药率的问题。尽管存在争议,FIGO评分目前仍然是GTN诊断、预后评估的统一标准。
hCG是由胎盘部位滋养层细胞分泌的一种糖蛋白激素,可反映GTN肿瘤细胞的消长及活跃性。本研究发现治疗前hCG≥10 000 IU/L者转阴时间明显高于hCG<10 000 IU/L者(71 d vs 43 d,P < 0.05),相对于肿瘤大小、转移灶数目等同样反映肿瘤负荷的影像学指标,hCG值检测更便捷,且更加灵敏。研究表明,至少需要105个滋养细胞工作24 h才能产生可检测的1 IU hCG[9]。然而外周血hCG是一组不同分子的混合体,主要包括规则hCG、高糖基化hCG(hyperglycosylated hCG,hCG-H)、游离β亚单位hCG(β-hCG)及垂体源性hCG等,其中hCG-H及β-hCG与恶性滋养细胞的增殖、侵袭转移能力相关[12]。目前我院的检测指标包括总hCG及β-hCG,暂未进行包括hCG-H在内的其他类型检测,但总hCG及β-hCG变化趋势对于治疗效果已十分敏感,对监测随访有重要指导意义。在对疾病机制进行不断深入研究的同时,若临床工作及相应硬件措施能逐渐跟上最新研究的成果,同时考虑实用性、经济效益等多方面因素,更精准地进行患者管理应是未来医学发展的一个目标。
作为一种炎症指标,NLR升高表明中性粒细胞相对增多而淋巴细胞相对减少,大量研究已明确前者具有促进肿瘤发展的作用,而后者体现了机体的抗肿瘤免疫效能[13]。本研究以NLR中位数2.29为分组依据,通过统计分析证实了NLR是影响GTN患者血hCG转阴时间的独立危险因素的假设,NLR≥2.29者比NLR<2.29者平均hCG转阴时间延长17 d。SECKIN等[14]对63例卵巢良恶性肿瘤研究发现NLR对恶性卵巢肿瘤预测的最佳临界值为2.47;GUZEL等[15]在GTN与良性妊娠滋养细胞疾病患者之间比较,发现前者NLR明显高于后者[(6.43±4.31) vs (3.38±1.92),P < 0.05]。中性粒细胞在不同环境中存在功能的转变[4, 16-17]。在恶性肿瘤中,中性粒细胞大致包括低密度中性粒细胞(low density neutrophil,LDNs)、高密度中性粒细胞(high density neutrophil,HDNs)、肿瘤相关的中性粒细胞(tumor-associated neutrophils,TANs)及多态核中性粒细胞骨髓类衍生的抑制细胞(polymorphonucear myeloid derived suppressor cells,PMN-MDSCs),其中循环HDNs、N1表型TANs具有细胞毒性,抑制肿瘤发展;而LDNs、N2表型TANs及PMN-MDSCs具有亲肿瘤能力,促进肿瘤发展。由此可见,中性粒细胞具有抗肿瘤和亲肿瘤的双重能力。其抗肿瘤作用包括直接接触及产生各种酶类间接杀死肿瘤细胞、通过产生多种趋化因子等增强机体肿瘤免疫。其亲肿瘤作用包括产生炎症介质、形成中性粒细胞外陷阱、招募其他免疫细胞并转化其为亲肿瘤型、表达程序性细胞死亡受体-1(PD-1)的配体(PD-L1)抑制T细胞的功能等。PD-L1在包括非小细胞肺癌、结肠直肠癌、肾细胞癌及黑色素瘤等多种实体肿瘤中均有表达,在人类胚胎组织也发现了PD-L1的强烈表达,其作用在于保护胚胎免受母体免疫系统的杀灭,从而维持妊娠。研究表明,GTN中合体滋养细胞高表达PD-L1,而中间滋养细胞肿瘤不表达,表明二者存在不同的逃避机体免疫监视的途径,这可能与侵袭性葡萄胎及绒癌与中间型滋养细胞肿瘤的不同生物学特性有关[18]。针对PD-1/PDL-1的免疫抑制剂的使用能够增强宿主抗肿瘤免疫,在治疗期间,NLR中度下降的患者生存期最长,而NLR的显著下降或增加与生存率较短有关[13]。
从表 3可以发现,初始EMA-CO治疗及MTX耐药者较初始MTX化疗敏感者hCG转阴时间明显延长,多药化疗对血hCG转阴时间的影响并非药物本身所致,而是反应病情的严重程度及耐药的情况。使用多药化疗往往是高预后评分、转移性肿瘤、病灶体积较大、转移灶较多的患者,提示肿瘤负荷大,体内肿瘤细胞的消亡需要更长时间,表现为更长的hCG转阴时间。
恶性肿瘤患者血液多处于高凝状态,这与肿瘤细胞释放组织因子诱导炎症反应、损伤血管内皮细胞及活化血小板等导致机体凝血纤溶系统障碍有关,血小板激活后可释放生长因子促血管生成、保护肿瘤细胞逃脱机体抗肿瘤免疫、促进肿瘤细胞黏附及稳定肿瘤基质等[19]。D-二聚体是交联纤维蛋白的降解产物,正常人血浆中D-二聚体含量甚微。YU等[20]发现,大于60%的恶性肿瘤患者存在D-二聚体的升高。但在本研究中仅8.2%的患者血小板大于参考值,D-二聚体升高者仅占36.0%,远低于文献报道数据,且多因素分析未发现两者与hCG转阴时间之间存在相关性,这可能与本研究纳入人数较少及平均年龄偏小有关。同时未发现两者及NLR与肿瘤分期存在相关性,这与研究发现的炎症及高凝状态促进肿瘤转移的结论不符,可能是因为GTN转移发生早,炎症及凝血障碍在其发生、发展中作用并不突出,MAGNUS等[19]发现凝血系统的激活在晚期癌症更常见,由此本研究推测对于发展缓慢、体内持续时间较长的实体肿瘤类型,如宫颈癌、结直肠癌等,长时间的炎症刺激导致的凝血障碍对肿瘤的发展起着更显著的作用。
本研究得出距前次妊娠终止的时间≥7个月是缩短hCG转阴时间的保护因素的结论,这与多数文献结论相反[21]。分析数据发现,纳入病例中距前次妊娠终止的时间≥7个月者均首选EMA-CO方案化疗,且均未出现耐药,预后良好,对EMA-CO亚组进行相关性分析后未发现距前次妊娠终止的时间与hCG转阴时间之间存在相关性,这可能是由于治疗方式的单一性引起的偏差,为减小这一偏差需扩大样本量、进行多中心研究,纳入不同治疗方案的病例。
肿瘤分期与hCG转阴时间之间未发现相关性,与本院前期研究结果一致[22],可能与本研究纳入人群98%均为Ⅲ期肺转移有关。不同于宫颈、子宫及卵巢等妇科常见恶性肿瘤,肺转移在GTN尤其是绒癌中是早期事件,转移发生早且多发,但肺转移在FIGO预后评分系统中不计分值,且足疗程而有效的化疗对肺转移灶效果显著,这与本研究结果一致,表明肺转移并不是影响GTN患者预后的重要因素。以往对于胸片结果阳性患者需进一步完善胸部CT以协助诊断,而CT定义的胸部微转移(直径<1 cm)与胸片定义的肺转移相比,并不影响治疗结果,也不应影响分期、评分及化疗方案的选择[3],通过阅读纳入研究患者的胸部CT影像, 我们发现90%以上患者肺部转移灶虽多发但最大径均<1 cm,由此可推测未发生出血、感染及呼吸道梗阻损害等并发症的微小肺转移灶对GTN患者预后并无显著影响。
本研究为回顾性研究,纳入病例为单一中心,样本量较少,可能导致结果偏倚,且无健康者和良性疾病对照,未初步探索NLR在GTN预后评估中的最佳截断值。随后需要大规模的、多中心的研究数据来验证结果的可靠性,初步确定一最佳截断值并纳入前瞻性的研究,扩大数据量探索NLR、PLR及D-二聚体与GTN患者复发及耐药之间的关系,进一步深入探讨炎症在GTN中可能的作用机制。
综上所述,本研究通过分析PLR、NLR、D-二聚体及临床因素与GTN患者血hCG转阴时间的关系,旨在探寻可能影响GTN患者预后的因素,结果显示高FIGO评分、治疗前hCG高水平、治疗前NLR升高及使用多药化疗是GTN患者血hCG转阴时间延长的独立危险因素,在恶性肿瘤领域再次验证炎症指标NLR的价值,作为一项方便、实用且经济的实验室指标,NLR对临床工作可能具有更多潜在价值。
| [1] |
AZNAB M, NANKALI A, DAEICHIN S. Determination of clinical process and response rate to treatment in patients with gestational trophoblastic neoplasia (GTN) with low and high risk and evaluation of their first pregnancy outcome[J]. Int J Hematol Oncol Stem Cell Res, 2018, 12(4): 291-297. |
| [2] |
BATTI R, MOKRANI A, RACHDI H, et al. Gestational trophoblastic neoplasia: experience at Salah Azaiez Institute[J]. Pan Afr Med J, 2019, 33: 121. |
| [3] |
BRAGA A, MORA P, DE MELO A C, et al. Challenges in the diagnosis and treatment of gestational trophoblastic neoplasia worldwide[J]. World J Clin Oncol, 2019, 10(2): 28-37. |
| [4] |
WU L, SAXENA S, SINGH R K. Neutrophils in the tumor microenvironment[J]. Adv Exp Med Biol, 2020, 1224: 1-20. |
| [5] |
LI Z, HONG N, ROBERTSON M, et al. Preoperative red cell distribution width and neutrophil-to-lymphocyte ratio predict survival in patients with epithelial ovarian cancer[J]. Sci Rep, 2017, 7: 43001. |
| [6] |
VAHID DASTJERDI M, AHMARI S, ALIPOUR S, et al. The comparison of plasma D-dimer levels in benign and malignant tumors of cervix, ovary and uterus[J]. Int J Hematol Oncol Stem Cell Res, 2015, 9(3): 107-111. |
| [7] |
YANG L, DONG H, LI Z, et al. Correlation between circulating tumor cells and D-D and platelet in patients with pulmonary malignancies[J]. Oncol Lett, 2018, 15(2): 2169-2172. |
| [8] |
XU L, HE F, WANG H, et al. A high plasma D-dimer level predicts poor prognosis in gynecological tumors in East Asia area: a systematic review and meta-analysis[J]. Oncotarget, 2017, 8(31): 51551-51558. |
| [9] |
SOPER J T. Gestational trophoblastic disease: current evaluation and management[J]. Obstet Gynecol, 2021, 137(2): 355-370. |
| [10] |
SUPRASERT P, SIRIAREE S, MANOPUNYA M. Outcomes of metastatic gestational trophoblastic neoplasia: fourteen year experience from a northern Thailand tertiary care center[J]. Asian Pac J Cancer Prev, 2016, 17(3): 1357-1362. |
| [11] |
BANACH P, ZABOROWSKI M P, IZYCKA N, et al. The value of an initial drop in human Chorionic gonadotropin levels in predicting a response to methotrexate in women with low-risk gestational trophoblastic neoplasia[J]. Ginekologia Polska, 2019, 90(3): 141-147. |
| [12] |
IBETO L, ANTONOPOULOS A, GRASSI P, et al. Insights into the hyperglycosylation of human chorionic gonadotropin revealed by glycomics analysis[J]. PLoS ONE, 2020, 15(2): e0228507. |
| [13] |
LI M, SPAKOWICZ D, BURKART J, et al. Change in neutrophil to lymphocyte ratio during immunotherapy treatment is a non-linear predictor of patient outcomes in advanced cancers[J]. J Cancer Res Clin Oncol, 2019, 145(10): 2541-2546. |
| [14] |
SECKIN K D, KARSLı M F, YUCEL B, et al. The utility of tumor markers and neutrophil lymphocyte ratio in patients with an intraoperative diagnosis of mucinous borderline ovarian tumor[J]. Eur J Obstet Gynecol Reprod Biol, 2016, 196: 60-63. |
| [15] |
GUZEL A I, KOKANALI M K, ERKILINC S, et al. Predictive role of the neutrophil lymphocyte ratio for invasion with gestational trophoblastic disease[J]. Asian Pac J Cancer Prev, 2014, 15(10): 4203-4206. |
| [16] |
SHAUL M E, FRIDLENDER Z G. Cancer-related circulating and tumor-associated neutrophils-subtypes, sources and function[J]. Febs J, 2018, 285(23): 4316-4342. |
| [17] |
MUKAIDA N, SASAKI S I, BABA T. Two-faced roles of tumor-associated neutrophils in cancer development and progression[J]. Int J Mol Sci, 2020, 21(10): 3457. |
| [18] |
VERAS E, KURMAN R J, WANG T L, et al. PD-L1 expression in human placentas and gestational trophoblastic diseases[J]. Int J Gynecol Pathol, 2017, 36(2): 146-153. |
| [19] |
MAGNUS N, GARNIER D, MEEHAN B, et al. Tissue factor expression provokes escape from tumor dormancy and leads to genomic alterations[J]. Proc Natl Acad Sci USA, 2014, 111(9): 3544-3549. |
| [20] |
YU J, LI D, LEI D, et al. Tumor-specific D-dimer concentration ranges and influencing factors: a cross-sectional study[J]. PLoS ONE, 2016, 11(11): e0165390. |
| [21] |
朱烨, 周璘, 雷月, 等. 低危型妊娠滋养细胞肿瘤血β-HCG下降时间的影响因素分析[J]. 实用妇产科杂志, 2016, 32(11): 834-838. ZHU Y, ZHOU L, LEI Y, et al. Prognostic factors associated with HCG regression time in postmolar gestational trophoblastic neoplasia patients[J]. J Prac Obste Gynecol, 2016, 32(11): 834-838. |
| [22] |
胡静. 妊娠滋养细胞肿瘤血hCG转阴时间的相关因素分析[D]. 重庆: 重庆医科大学, 2020. HU J. Clinical factors associated with time to HCG remission in patients with gestational trophoblastic neoplasia[D]. Chongqing: Chongqing Medical University, 2020. |




