最新的癌症统计资料显示,乳腺癌已成为美国女性发病率首位的癌症,其发病率在女性中高达30%,已成为全世界女性死亡的第二大癌症[1]。预计到2050年,全世界女性乳腺癌患者将达到320万[2]。乳腺癌的发生、发展与参与调控乳腺癌细胞生长、凋亡的基因异常表达紧密相关,靶向治疗乳腺癌已经成为目前的研究热点[3]。根据激素和生长因子受体的表达,乳腺癌可以分为4种主要类型,其中大约70%的乳腺癌病例被归类为HR+(雌激素受体阳性ER+和/或孕激素受体阳性PR+)[4]。目前,对调控ER+乳腺癌细胞增殖、凋亡作用的相关癌基因认识仍然不完全,探究乳腺癌增殖、凋亡的新靶点有利于改善乳腺癌治疗方式以及预测预后。
血清和糖皮质激素诱导激酶3(serum- and glucocorticoid-regulated kinase 3,SGK3)是属于AGC蛋白激酶的SGK之一,与磷脂酰肌醇3激酶(phosphatidylinositol 3-kinase,PI3K)下游的AKT发挥平行作用,并称作是“第二个AKT蛋白”。已证明SGK3与某些癌症的发生、发展有关[5-6]。在大多数癌症中,PI3K/AKT/mTOR信号通路均异常激活,并被认为是癌症治疗的潜在靶标[7]。AKT是PI3K介导的著名效应靶标,可调控细胞生长、增殖、分化、凋亡、存活和葡萄糖代谢等功能[8],而同样是PI3K下游关键分子的SGK3,其研究很少。为进一步理解SGK3在乳腺癌中的作用,本研究以SGK3为研究对象,采用MTT、平板克隆实验、流式细胞术、Western blot技术,初步确定SGK3对ER+乳腺癌细胞增殖及凋亡的影响,并运用生物信息学分析其表达与乳腺癌患者生存以及预后的关系。
1 材料与方法 1.1 材料 1.1.1 细胞人乳腺癌细胞MCF-7、T47D购于ATCC公司。
1.1.2 主要试剂RPMI1640培养基、DMEM培养基购于Gibco公司;胎牛血清购于美国Procell公司;OPTI-MEM无血清培养基、RNAiMAX购于Thermo Fisher公司;Annexin-FITC细胞凋亡检测试剂盒、MTT试剂(编号:ST316)购于碧云天公司(货号:C1062L);PBS、TBS均购于Biosharp公司;封闭专用脱脂奶粉购于北京普利莱基因技术有限公司;兔抗人SGK3(货号:8156S)、Bax(货号:2772S)、Bcl-2单克隆抗体(4223S)、PARP(9532S)、Cleaved-PARP(5625S)单克隆抗体购于美国Cell Signaling Technology(CST)公司;β-actin(SC-47778)单克隆抗体购于美国Santa Cruz Biotechnology公司;辣根过氧化物酶标记的山羊抗兔IgG(编号:ZB-2301)、辣根过氧化物酶标记的山羊抗鼠IgG(编号:ZB-2305)均购于中国中杉金桥公司;Doxycycline(DOX)药物(货号:631311)购于美国Clonetech公司;小干扰RNA购于南京晶百生物科技有限公司。SGK3干扰序列见表 1。
| 序号 | 序列(5′→3′) |
| siNC | UUCUCCGAACGUGUCACGUTT |
| siSGK3#1 | CGAUGAACACAGAGAGAAATT |
| siSGK3#2 | GGGAAGAAGUGAAUGGUUUTT |
| siSGK3#3 | UGUCAAAGUGUUACAGAAATT |
1.2 方法 1.2.1 Tet-On-SGK3质粒构建
利用反转录病毒表达系统,制备用于SGK3诱导表达的pRetroX-Tight-Pur-SGK3质粒,用PCR扩增SGK3基因5′-ATTGCGGCCGCCACCATGCAAAGAGATCACACCATGGAC-3′和5′-CCTTCAGAAGACTTATTTTTGTGAACGCGTGCCCG-TGCC-3′。PCR产物经消化后通过NotⅠ和MluⅠ位点进行亚克隆,所有插入片段经DNA测序验证。
1.2.2 MCF-7-Tet-On-SGK3和T47D-Tet-On-SGK3细胞构建使用Retro-X-Tet-On Advanced诱导表达系统来建立四环素诱导的双稳态RetroX-Tet。在293T细胞与反转录病毒表达载体pCMV-GP(gag-pol表达载体) 瞬时共转染(pRetroX-Tet-On Advanced载体),用于表达四环素控制的反式激活子rtTA-Advanced或pRetroX-Tight-Pur-SGK3载体,用于在诱导反应启动子PTight下表达SGK3,并包膜Lipofectamine 2000表达载体(pVSV-G)。转染后8~10 h,将含有DNA和Lipofectamine 2000的培养基替换为10 mL新鲜的完全培养基,并在收集粗病毒上清液之前将细胞连续培养48~72 h。将上清液短暂离心并等分,-80 ℃保存备用。
将MCF-7、T47D细胞接种与6孔板,用RetroX-Tet-On Advanced病毒库存感染细胞。简而言之,除去培养基,向每个孔中加入1 mL病毒原液,并添加Polybrene至终浓度4 μg/mL。感染后24 h,将细胞在含有600 μg/mL G418的新鲜完全培养基中培养约2周。每2天更换1次选择性培养基。G418筛选2周后,合并G418抗性克隆,并进一步用RetroX-Tight-Pur-SGK3病毒感染。感染后24 h,将细胞在含有2 μg/mL嘌呤霉素的培养基中培养4~5 d。使用有限稀释法分离单个MCF-7-Tet-On-SGK3、T47D-Tet-On-SGK3细胞克隆。
1.2.3 TCGA数据库分析通过基因表达谱交互分析(gene expression profiling interactive analysis,GEPIA)[9]工具对TCGA数据库中SGK3基因进行分析,包括:组织差异表达、患者生存分析。筛选设定条件为:①表达模块,选择SGK3及Match TCGA normal data;②生存分析模块,生存图表(survival plots)选择SGK3,总生存期(overall survival,OS)及无病生存期(disease free survival,DFS)。
1.2.4 MTT检测过表达SGK3对细胞增殖的影响取对数生长期的细胞,96孔板每个孔加入180 μL(约含4 000个细胞)细胞悬液,实验组(DOX+)在重悬细胞的同时加入终浓度为250 ng/mL的DOX以诱导SGK3过表达,放置于37 ℃、5%CO2培养箱中培养1、2、3、4、5、6、7 d后,取出培养板,每孔加入20 μL MTT工作液,于37 ℃细胞培养箱孵育4 h。吸弃上清,每孔加入150 μL DMSO,摇床孵育10 min,置于酶标仪上(检测波长为570 nm)测定其光密度值D(570)。
1.2.5 克隆形成实验检测细胞增殖取对数生长期的细胞,在6孔板中每孔加入细胞悬液2 mL(约500个细胞),其中实验组(DOX+)加入终浓度为250 ng/mL的DOX,放置于37 ℃、5%CO2培养箱中培养14 d左右,取出6孔板,吸净上清,用PBS洗涤后加入4%多聚甲醛固定30 min后,加入结晶紫染料染色,并用Image J统计软件进行计数。
1.2.6 流式检测细胞凋亡取对数生长期的细胞,加入DOX诱导48 h后,收集细胞,将细胞重悬于PBS溶液中,离心后弃上清,加入195 μL Annexin V-FITC重悬细胞,加入5 μL Annexin V-FITC和10 μL的碘化丙啶染色液,室温孵育10 min,随后上机检测各组细胞凋亡比例。
1.2.7 小干扰RNA转染目的细胞以敲低SGK3按照说明书将siRNA配置终浓度为20 μmol/L的工作液,用50 μL Opti-MEM稀释1.25 μL siRNA得到A溶液,用50 μL Opti-MEM稀释1.0 μL Lipofectamine 2000得到B溶液,将A、B溶液分别吹打混匀后在室温孵育5 min后, 将其混匀至同一EP管孵育20 min。将细胞铺于6孔板,待目的细胞汇合度达30%~50%时,将细胞上清吸净后换为无血清培养基,将A、B混合液加入6孔板内,放于细胞培养箱继续培养6~8 h,换液,48 h后收集细胞进行检测。
1.2.8 MTT检测敲低SGK3对细胞增殖影响取对数生长期的细胞,96孔板每个孔加入180 μL(含有约4 000个细胞)细胞悬液,每孔加入1 μL RNAiMAX、0.25 μL siNC(对照组)或0.25 μL siSGK3#3(实验组)放置于37 ℃、5%CO2培养箱中培养1、3、5 d后,取出培养板,每孔加入20 μL MTT工作液,于37 ℃孵育4 h。吸弃上清,每孔加入150 μL DMSO,摇床孵育10 min,置于酶标仪上(检测波长为570 nm)测定其光密度值D(570)。
1.2.9 Western blot法检测细胞中相关蛋白质变化收集不同处理的细胞,加RIPA裂解液和磷酸酶抑制剂(PMSF)裂解细胞,提取总蛋白,在蛋白中添加5×Loading buffer混合煮沸10 min。采用SDS-PAGE法分离蛋白,恒压电转印至0.45 μm PVDF膜上,室温下用5%脱脂牛奶封闭2 h,一抗4 ℃过夜杂交,二抗于室温孵育2 h,TBST洗涤后采用ECL化学发光显影目的条带获得结果。最后通过Image J软件定量蛋白条带灰度值。
1.3 统计学分析利用Graphpad 8.0统计软件,两组数据间的比较采用独立样本t检验,多组数据比较采用单因素方差分析。P < 0.05为差异具有统计学意义。
2 结果 2.1 SGK3在乳腺癌组织中过表达,影响乳腺癌患者生存率采用GEPIA在线工具分析TCGA数据库的1 084例乳腺癌组织及492例正常组织。图 1A所示SGK3的mRNA水平在BRCA组织中显著上调,进一步分析SGK3 mRNA水平与BRCA患者OS及DFS的关系,按50%中位数样本分为SGK3高表达和低表达组。如图 1B、C所示,SGK3能够影响BRCA患者的生存期,与低表达BRCA患者相比,SGK3高表达患者的总生存期(OS)及无病生存期(DFS)缩短。
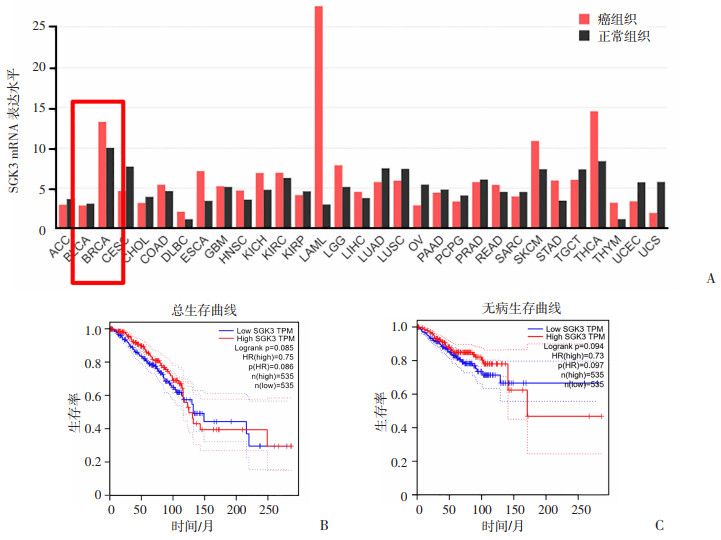
|
| A:SGK3表达分析,红色方框示乳腺浸润癌;B、C:SGK3对乳腺癌患者总生存期及无病生存期的影响 图 1 GEPIA中基于TCGA数据库分析SGK3基因在乳腺癌组织及正常组织的表达及生存情况 |
2.2 SGK3能够被DOX诱导
将MCF-7-Tet-On-SGK3和T47D-Tet-On-SGK3细胞添加不同浓度DOX诱导48 h后,Western blot检测结果显示:与对照组(DOX 0 ng/mL)比较,SGK3能够在较低浓度显著被诱导上调(P < 0.01,图 2)。因此,后续实验中DOX浓度为250 ng/mL。
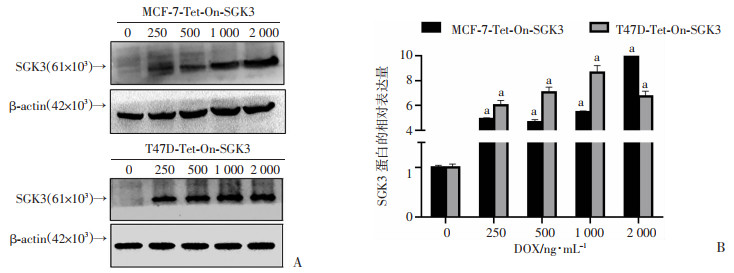
|
| A:Western blot检测不同浓度DOX诱导SGK3效率;B:半定量分析结果(n=3, x±s) a: P < 0.01,与0 ng/mL DOX比较 图 2 Western blot检测DOX诱导SGK3在MCF-7-Tet-On-SGK3、T47D-Tet-On-SGK3细胞中过表达 |
2.3 SGK3过表达能够促进MCF、T47D细胞增殖
过表达组(DOX+)添加DOX(250 ng/mL)以诱导SGK3过表达,诱导不同时间后,MTT法检测结果显示,相对于对照组(DOX-),过表达组细胞增殖能力明显增加(P < 0.01,P < 0.05, 图 3A、B)。平板克隆实验检测结果表明,在MCF-7、T47D细胞中过表达组相对于对照组的克隆形成能力明显增加(P < 0.01,P < 0.05,图 3C~E)。说明SGK3外源性过表达后促进了细胞增殖。
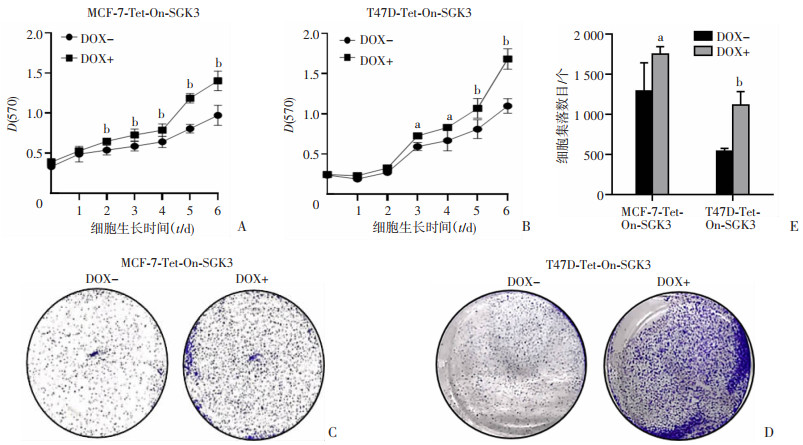
|
| DOX-:对照组;DOX+:过表达SGK3组; A、B:MCF-7-Tet-On-SGK3以及T47D-Tet-On-SGK3细胞生长曲线(n=3, x±s) a: P < 0.05,b:P < 0.01,与对照组比较;C:MCF-7-Tet-On-SGK3平板克隆实验;D:T47D-Tet-On-SGK3平板克隆实验;E:各组克隆细胞分析 a: P < 0.05,b:P < 0.01,与对照组比较 图 3 过表达SGK3对MCF-7、T47D细胞增殖能力的影响 |
2.4 SGK3过表达能够减少MCF-7、T47D细胞凋亡
MCF-7-Tet-On-SGK3、T47D-Tet-On-SGK3细胞分别添加DOX诱导SGK3过表达,采用流式细胞术检测过表达SGK3对细胞凋亡情况的影响,流式细胞仪检测结果显示:与对照组(DOX-)相比,过表达SGK3组(DOX+)能够明显减少MCF-7-Tet-On-SGK3、T47D-Tet-On-SGK3细胞凋亡比例(P < 0.01,图 4)。

|
|
DOX-:对照组;DOX+:过表达SGK3组
A、B:流式细胞术检测MCF-7-Tet-On-SGK3、T47D-Tet-On-SGK3细胞过表达SGK3后凋亡情况;C:各组凋亡率定量分析(n=3, x±s) a: P < 0.01,与对照组比较 图 4 过表达SGK3对MCF-7、T47D细胞凋亡的影响 |
2.5 SGK3过表达能够下调凋亡相关分子
使用DOX诱导SGK3过表达后,Western blot检测凋亡相关分子的变化。结果显示:与对照组(DOX-)比较,过表达SGK3后能够显著降低Bax、上调Bcl-2、下调Cleaved-PARP水平(P < 0.01,P < 0.05,图 5)。
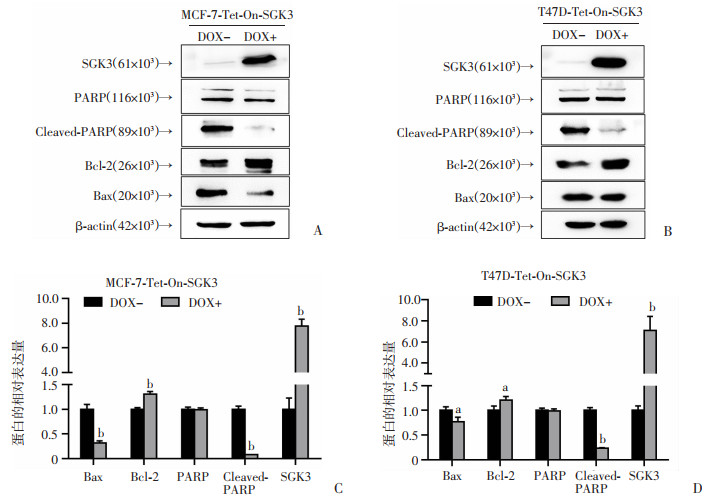
|
|
DOX-:对照组;DOX+:过表达SGK3组
A、B:Western blot检测在MCF-7以及T47D细胞过表达SGK3后凋亡相关蛋白分子的变化;C、D:半定量结果分析(n=3, x±s) a:P < 0.05,b:P < 0.01,与对照组比较 图 5 过表达SGK3对MCF-7、T47D细胞凋亡相关分子的影响 |
2.6 siRNA敲低SGK3蛋白水平
为了进一步验证SGK3的作用,设计了3对SGK3的小干扰片段,转染细胞72 h后收集蛋白,运用Western blot检测敲低SGK3效率,结果显示:与对照组(siNC)比较,3对siRNA片段均能够显著下调SGK3水平(P < 0.01,图 6),在后续实验中,均用siSGK3#3转染细胞以敲低SGK3。
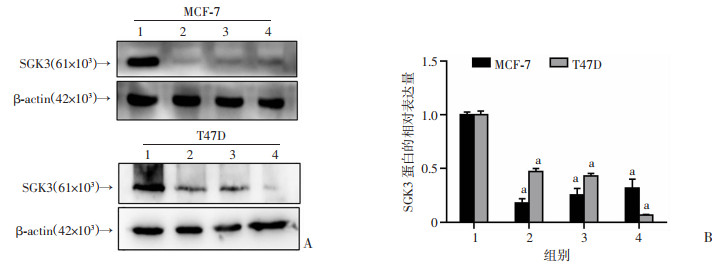
|
| 1: siNC; 2: siSGK3#1; 3: siSGK3#2; 4: siSGK3#3;A:Western blot检测不同siRNA片段敲低SGK3效率;B:半定量分析结果(n=3, x±s) a:P < 0.01,与siNC比较 图 6 Western blot检测siRNA敲低MCF-7、T47D细胞中SGK3的表达 |
2.7 siRNA敲低SGK3抑制细胞增殖活力
为了进一步确认SGK3对细胞增殖的影响,采用siRNA干扰技术敲低SGK3表达,并用MTT实验检测敲低SGK3对MCF-7细胞增殖的影响。结果显示,与对照组(siNC)比较,siSGK3敲减SGK3后能够明显抑制细胞增殖活力(P < 0.01,图 7)。
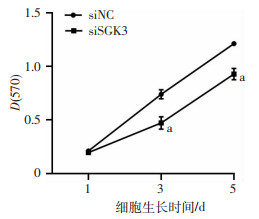
|
| siNC:对照组;siSGK3:实验组;a:P < 0.01,与对照组比较 图 7 敲低SGK3对MCF-7细胞生长的影响(n=3, x±s) |
2.8 siRNA敲低SGK3后能够促进MCF-7、T47D细胞凋亡
为了进一步确定SGK3影响乳腺癌细胞MCF-7、T47D凋亡,收集转染siNC、siSGK3 72 h的MCF-7和T47D细胞后,采用流式细胞术检测其凋亡水平。结果显示,与对照组(siNC)比较,siSGK3敲低SGK3后能够明显促进细胞凋亡(P < 0.05,图 8)。
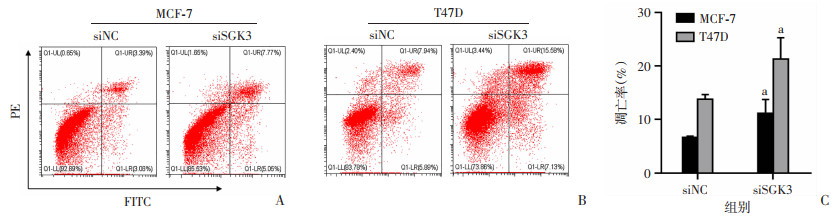
|
| siNC:对照组;siSGK3:实验组;A、B:流式细胞术检测结果;C:凋亡率定量分析(n=3, x±s) a:P < 0.05,与siNC比较 图 8 敲低SGK3对MCF-7、T47D细胞凋亡的影响 |
2.9 siRNA敲低SGK3后能够上调凋亡相关分子
为了进一步探究敲低SGK3促进细胞凋亡的机制,运用Western blot检测凋亡相关蛋白表达,结果显示,与对照组(siNC)比较,siSGK3敲低SGK3后能够显著上调凋亡蛋白Bax(P < 0.01)、下调Bcl-2(P < 0.01,P < 0.05)、上调Cleaved-PARP(P < 0.01,P < 0.05,图 9)。

|
| siNC:对照组;siSGK3:实验组;A、B:Western blot检测结果;C、D:蛋白半定量结果分析结果(n=3, x±s) a:P < 0.05,b:P < 0.01,与siNC比较 图 9 敲低SGK3对MCF-7、T47D细胞凋亡相关蛋白表达的影响 |
3 讨论
癌基因可以影响肿瘤患者的生存、预后,严重影响生活质量,大多数癌基因可以通过复杂的调控网络影响各种癌细胞的细胞表型,进而影响恶性肿瘤的发生发展。血清和糖皮质激素诱导激酶(SGK)是近年来新发现的PI3K下游分子,有研究发现,SGK参与多种肿瘤的增殖、侵袭和转移,在肿瘤细胞的生长分化、生存和物质转运、代谢等方面发挥着重要作用[10],但在BRCA中SGK3的表达与功能尚不明确。SGK3是SGK家族的一员,其表达与人类卵巢癌、肝癌、大肠癌、前列腺癌等多种肿瘤的发生有关[11]。本研究通过生物信息数据库数据分析,SGK3在乳腺癌组织相较于正常组织表达明显增加,提示SGK3高表达可能与乳腺癌的发生、发展有关。并且在TCGA数据库中,按SGK3表达的程度分类,其高表达的患者无病生存期较低,预后较差[12]。
众所周知,增殖异常是恶性肿瘤的基本生物学特征,为了进一步探究SGK3是否能够对乳腺癌发生、发展产生一定的影响,本研究通过构建Tet-On可诱导系统,用DOX特异性过表达SGK3后能够显著促进其增殖、降低其凋亡水平。说明SGK3过表达可能与促进乳腺癌的发展有关,这给乳腺癌发生、发展提供了新的认识。
除了增殖异常外,细胞凋亡变化也是肿瘤发生的重要原因,二者失衡可以导致机体功能障碍或疾病的发生,也是导致肿瘤发生发展的重要机制[13]。凋亡是一种继发性程序化的死亡过程,有多种基因参与调控,主要分为两种方式,一种为Bax/Bcl-2依赖方式,另外一种为Caspase蛋白家族依赖性方式。其中,Bax及Bcl-2是凋亡发生启动的关键性分子,Bax是受Bcl-2调控的促凋亡分子,具有诱导线粒体渗透性改变,激活凋亡蛋白,释放细胞色素等功能,在细胞凋亡中发挥着重要的作用[14]。Bcl-2可以抑制Bax表达从而抑制细胞凋亡。因此,Bax/Bcl-2比例决定着细胞是否发生凋亡,为凋亡的关键因素。Cleaved-PARP为凋亡的关键蛋白,其表达水平反映凋亡水平的高低。mTOR是一种非典型的丝氨酸/苏氨酸蛋白激酶,属于大分子蛋白,参与多种信号通路,主要影响细胞的生长、自噬以及凋亡进程。和AKT一样,SGK主要涉及PI3K-mTOR信号,此通路被激活可以增强抗凋亡蛋白Bcl-2和Bcl-XL的表达,抑制促凋亡蛋白P53进而保护细胞免受凋亡,抑制该通路可以诱导凋亡[15]。因此,我们推测,与AKT结构相似、功能相似的SGK3蛋白可能也是通过类似的机制影响抗凋亡蛋白(如Bcl-2)的表达从而发挥抗凋亡作用。
综上所述,SGK3在乳腺癌细胞的发展中起着重要作用,本研究为乳腺癌的治疗提供了新的靶点。后续我们将围绕下游分子机制开展更为详细的研究,为深入了解SGK3在调控乳腺癌发生、发展提供新的依据。
| [1] |
SIEGELR L, MILLER K D, JEMAL A. Cancer statistics, 2020[J]. CA Cancer J Clin, 2020, 70(1): 7-30. |
| [2] |
SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2019[J]. CA Cancer J Clin, 2019, 69(1): 7-34. |
| [3] |
WAKSA G, WINER E P. Breast cancer treatment: a review[J]. JAMA, 2019, 321(3): 288-300. |
| [4] |
HANKERA B, SUDHAN D R, ARTEAGA C L. Overcoming endocrine resistance in breast cancer[J]. Cancer Cell, 2020, 37(4): 496-513. |
| [5] |
VASUDEVANK M, BARBIE D A, DAVIES M A, et al. AKT-independent signaling downstream of oncogenic PIK3CA mutations in human cancer[J]. Cancer Cell, 2009, 16(1): 21-32. |
| [6] |
CHIM N, GUO S T, WILMOTT J S, et al. INPP4B is upregulated and functions as an oncogenic driver through SGK3 in a subset of melanomas[J]. Oncotarget, 2015, 6(37): 39891-39907. |
| [7] |
FRUMAND A, CHIU H, HOPKINS B D, et al. The PI3K pathway in human disease[J]. Cell, 2017, 170(4): 605-635. |
| [8] |
DI CRISTOFANO A. SGK1: the dark side of PI3K signaling[J]. Curr Top Dev Biol, 2017, 123: 49-71. |
| [9] |
TANG Z, LI C, KANG B, et al. GEPIA: a web server for cancer and normal gene expression profiling and interactive analyses[J]. Nucleic Acids Res, 2017, 45(w1): W98-W102. |
| [10] |
BRUHN M A, PEARSON R B, HANNAN R D, et al. AKT-independent PI3-K signaling in cancer—emerging role for SGK3[J]. Cancer Manag Res, 2013, 5: 281-292. |
| [11] |
BRUHNM A, PEARSON R B, HANNAN R D, et al. Second AKT: the rise of SGK in cancer signalling[J]. Growth Factors, 2010, 28(6): 394-408. |
| [12] |
SCORTEGAGNA M, LAU E, ZHANG T W, et al. PDK1 and SGK3 contribute to the growth of BRAF-mutant melanomas and are potential therapeutic targets[J]. Cancer Res, 2015, 75(7): 1399-1412. |
| [13] |
龙星星, 文锋, 陈茜, 等. TRIM31基因沉默对U266细胞增殖及凋亡的影响及其机制[J]. 中国实验血液学杂志, 2021, 29(3): 805-811. LONG X X, WEN F, CHEN Q, et al. Effect of TRIM31 gene silencing on the proliferation and apoptosis of U266 cells and its mechanism[J]. J Exp Hematol, 2021, 29(3): 805-811. |
| [14] |
XU X B, LAI Y Y, HUA Z C. Apoptosis and apoptotic body: disease message and therapeutic target potentials[J]. Biosci Rep, 2019, 39(1): BSR20180992. |
| [15] |
孙阳, 孙悦, 顾媛媛, 等. mTOR信号通路在细胞自噬和凋亡调节中的作用[J]. 中国医学装备, 2021, 18(1): 162-166. SUN Y, SUN Y, GU Y Y, et al. Role of mTOR signaling pathway in the regulation of autophagy and apoptosis[J]. China Med Equip, 2021, 18(1): 162-166. |




