2. 61053 山东 潍坊,潍坊医学院免疫学教研室;
3. 61053 山东 潍坊,潍坊医学院病原微生物教研室;
4. 61053 山东 潍坊,潍坊医学院第一附属医院内分泌科
2. Department of Immunology, Weifang Medical University, Weifang, Shandong Province, 261053, China;
3. Department of Pathogenic Microbiology, Weifang Medical University, Weifang, Shandong Province, 261053, China;
4. Department of Endocrinology, the First Affiliated Hospital of Weifang Medical University, Weifang Medical University, Weifang, Shandong Province, 261053, China
非酒精性脂肪性肝病(non-alcoholic fatty liver diseases,NAFLD)是一种与胰岛素抵抗和遗传易感密切相关的代谢应激性肝损伤,主要病理特征为肝细胞内甘油三酯(Triglyceride, TG)异常聚集[1]。其疾病谱系包括:非酒精性单纯性脂肪肝(non-alcoholic simple fatly liver,NAFL)以及由其演变的非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)和非酒精性脂肪性肝硬化。近年来,随着饮食结构西方化,摄入食品中以脂肪、糖类(蔗糖或果糖)为代表的高热量食物和饮品所占比例明显增加,NAFLD发病率也逐年递增。NASH是NAFLD疾病谱中关键性的进展阶段[2],是肝硬化甚至肝细胞肝癌等严重致死性疾病的重要危险因素[3]。因此,明确NASH发病机制对NAFLD治疗及减缓恶化有重要意义。
相关研究指出,高脂肪和高糖饮食能够改变肠道菌群,出现肠道菌群失调或紊乱,此时肠道内革兰阴性菌过度生长会引起内源性内毒素(endotoxin)释放增加。高脂饮食通常也会引起肠黏膜屏障的破坏,由于“肠肝轴”的存在,肠腔内的脂多糖(Lipopolysacchrides, LPS)可以通过肝门静脉进入血液循环。进入血液循环的LPS可导致全身炎症[4],从而影响相应器官疾病的发生,例如循环型LPS可以加重动脉粥样硬化[5]。肝脏是LPS进入循环前首先被累及的器官之一,已经有研究表明,肠道菌群紊乱导致的持续性低浓度LPS在NASH中起着重要作用,但相关机制尚不完全明确。为此,本研究在高脂饮食基础上对小鼠进行低剂量LPS腹腔注射,进一步探讨内源性LPS在NASH进展中的作用及相关机制,以期为NASH的临床治疗提供新思路。
1 材料与方法 1.1 材料 1.1.1 实验动物6~8周雄性野生型B6.WT(C57BL/6)小鼠(购于潍坊医学院动物实验中心,46只,体质量18~20 g)饲养在无特定病原体环境中,恒温(20±2)℃、恒湿(50±2)%、明暗各12 h,所有动物研究根据潍坊医学院动物保护与使用委员会批准的方案进行。
1.1.2 动物饲料高脂饲料(货号MD12033,供能比:蛋白质20%、脂肪60%、碳水化合物20%)购自江苏美迪森生物医药有限公司。大小鼠繁殖饲料(供能比:蛋白质24.02%、脂肪12.95%、碳水化合物63.03%)购自北京科奥协力饲料有限公司。
1.1.3 试剂LPS(0111∶B4)、ORO粉末购自美国Sigma-Aldrich;TG、TC、ALT和AST测试盒购自南京建成生物工程研究所。用于免疫荧光(immunofluorescence,IF)检测的大鼠抗小鼠F4/80-Alexa Fluor647(F4/80-647)、大鼠抗小鼠IgG购自美国Abcam,山羊抗大鼠IgG(H+L)-FITC购自美国Invitrogen,山羊抗兔IgG(H+L)-Alexa Fluor 647购自英国Jackson ImmunoResearch,兔抗小鼠IgG抗体购自美国Biorbyt。用于流式细胞术(flow cytometry,FCM)检测的大鼠抗小鼠CD16/CD32抗体、CD11b-PE、Ly6C-FITC、Ly6G-APC均购自美国Biolegend。RIPA裂解液、肝组织TG检测盒购自北京普利莱基因技术有限公司,BCA蛋白浓度测定试剂盒购自北京索莱宝科技有限公司,小鼠IL-1β、TNF-α检测试剂盒购自美国eBioscience,小鼠CCL4、CCL5检测试剂盒购自中国Absin公司,小鼠CCL2检测试剂盒购自达科为有限公司,反转录试剂盒购自美国Thermo scientific,qPCR试剂盒购自美国Roche公司。
1.2 方法 1.2.1 动物饲养及分组取6~8周龄的B6.WT雄性小鼠,分别给予正常饮食(ND组)与高脂饮食(HFD组),自建模开始,HFD+LPS组每周1次腹腔注射LPS(1.25 μg/g体质量),ND组和HFD组注射等体积生理盐水,干预10周处死小鼠,每组至少4只,实验重复3次。
1.2.2 酶法检测血清、肝组织匀浆中TG、TC水平收集小鼠血清,依据试剂盒说明书检测TG、TC水平。准确称取新鲜肝脏组织,按照1 mg组织加20 μL裂解液,冰水浴条件下机械匀浆,根据试剂盒说明书检测TG、TC含量,并用蛋白浓度进行校正。
1.2.3 油红O染色观察肝组织脂质沉积收集小鼠新鲜肝组织,OCT包埋后液氮快速冰冻,进行冰冻切片,厚度5 μm。60%异丙醇快速固定后,PBS冲洗,油红O染色8 min,苏木精复染后用50%甘油封片,光学显微镜下观察并采集图像,观察肝组织脂质沉积情况,并用Image J软件对其进行定量分析。
1.2.4 酶法检测血清中、肝组织中ALT、AST水平收集小鼠血清;准确称取新鲜肝脏组织,按照1 mg组织加9 μL生理盐水,冰水浴条件下机械匀浆,取上清。依据试剂盒说明书分别检测血清与肝脏组织中ALT、AST的水平,并用蛋白浓度进行校正。
1.2.5 HE染色观察肝脏组织炎症浸润末次注射LPS 12 h处死小鼠,将新鲜肝脏组织置于4%多聚甲醛固定过夜,常规石蜡包埋后进行切片,切片厚度5 μm,经二甲苯及梯度酒精脱蜡水化后,用苏木精染色5 min,伊红复染后封片,光学显微镜下观察并采集图像,观察肝脏组织炎症浸润情况。同时,采用美国国立卫生研究院NASH临床研究网病理工作组指南中的NAFLD活动评分(NAFLD activity score,NAS)[6]对NASH的严重程度进行评估。
1.2.6 ELISA检测血清、肝组织中IL-1β、TNF-α、CCL5、CCL2、CCL4水平末次注射LPS 6 h后收集小鼠血清,检测IL-1β、TNF-α、CCL5、CCL2、CCL4的水平,操作过程严格按照说明书进行。准确称取新鲜肝脏组织,按照1 mg肝脏组织加入10 μL与蛋白酶抑制剂预混的RIPA裂解缓冲液,冰水浴条件下机械匀浆,12 000×g,4 ℃离心10 min,取上清液。BCA定量法检测组织抽提物的蛋白浓度。选择适量肝脏组织抽提物检测IL-1β(500 μg)、TNF-α(500 μg)、CCL5(12.5 μg)、CCL2(500 μg)、CCL4(50 μg)的水平,操作过程严格按照说明书进行。
1.2.7 IF检测肝脏组织巨噬细胞、中性粒细胞沉积及TLR4蛋白表达将OCT包埋的冰冻组织进行切片,厚度为5 μm,冷丙酮固定10 min,10%山羊血清封闭1 h,用于后续检测。F4/80-Alexa Fluor 647(1∶50)为直标抗体,4 ℃孵育过夜;大鼠抗小鼠Gr-1抗体(1∶100)、兔抗小鼠TLR4抗体(1∶200)为间标抗体,同时设置Isotype组,加入各自抗体同种属、同型、同来源、同型的免疫球蛋白作为对照,用以排除假阳性。4 ℃孵育过夜后加入山羊抗大鼠IgG(H+L)-FITC(1∶400)室温孵育1 h,DAPI染色5 min,PBS洗涤后加抗荧光淬灭剂封片,置于荧光显微镜下观察。
1.2.8 RT-qPCR检测肝脏中IL-1β、TNF-α、CCL5、CCL2、CCL4 mRNA水平采用RT-qPCR检测相关基因mRNA表达。利用TRIzol-氯仿法提取小鼠肝脏组织RNA,测定RNA浓度及纯度。以5 μg RNA进行反转录,反应体系为20 μL。取2 μL反转录产物cDNA进行检测,引物序列由上海铂尚生物技术有限公司合成(见表 1),总反应体系为20 μL,以GAPDH作为内参,通过2-ΔΔCt分析IL-1β、TNF-α、CCL2、CCL5、CCL4的mRNA水平变化。
| 基因 | 序列(5′→3′) | 产物长度/bp | |
| IL-1β | 正义 | GACGGACCCCAAAAGATGAA | 283 |
| 反义 | ATGGGAACGTCACACACCAG | ||
| IL-8 | 正义 | AGATACCGCCACGTTCTGAC | 252 |
| 反义 | GAAATGGAGAGGCATCCGG | ||
| TNF-α | 正义 | CAGGCGGTGCCTATGTCTC | 88 |
| 反义 | CGATCACCCCGAAGTTCAGTAG | ||
| CCL5 | 正义 | GCTCCAATCTTGCAGTCGTG | 242 |
| 反义 | GAGCAGCTGAGATGCCCATT | ||
| CCL2 | 正义 | GACCCGTAAATCTGAAGCTAATGC | 117 |
| 反义 | AATTAAGGCATCACAGTCCGAGTC | ||
| CCL4 | 正义 | CCAGGGTTCTCAGCACCAAT | 122 |
| 反义 | TTGGAGCAAAGACTGCTGGT | ||
| GAPDH | 正义 | TGTGTCCGTCGTGGATCTGA | 131 |
| 反义 | TTGCTGTTGAAGTCGCAGGAG |
1.2.9 FCM检测小鼠肝脏单个核细胞中的巨噬细胞及中性粒细胞
200目尼龙网上低温研磨新鲜肝脏组织,离心去除杂质及肝实质细胞,通过红细胞裂解液去除红细胞,40%Percoll梯度分层,800×g离心25 min,升速5、降速0,以收集肝脏单个核细胞,进行计数。取1×106个细胞,加入抗小鼠CD16/CD32抗体1 μL封闭15 min,加入相应细胞群的检测抗体:CD11b-PE、Ly6C-FITC抗体标记巨噬细胞;CD11b-PE、Ly6G-APC抗体标记中性粒细胞。避光染色30 min,PBS洗涤细胞后,用FCM buffer重悬细胞经200目尼龙网过滤,经流式细胞仪检测。
1.3 统计学分析采用GraphPad Prism 8.0.1统计软件进行分析,计量资料以x±s表示,两组间均数采用t检验,以P < 0.05为差异有统计学意义。
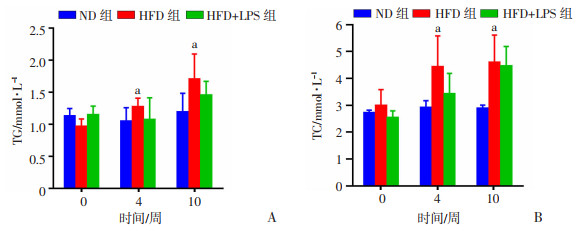
2 结果 2.1 LPS联合HFD对血清中脂代谢指标TG、TC水平的影响建模4周后,动态检测模型小鼠血清TG、TC水平,每次均选择在LPS注射前采样。结果显示:建模4周开始,HFD组小鼠血清TG(P < 0.05,图 1A)、TC(P < 0.05,图 1B)水平升高,显著高于ND组,提示建立的模型成功。随后比较HFD组与同期HFD+LPS组小鼠以上指标差异,结果显示,两组小鼠TG、TC水平无明显差异(P>0.05)。
|
| a:P < 0.05,与ND组比较 图 1 干预10周后小鼠血清TG(A)、TC(B)水平变化(ND组n=8,HFD与HFD +LPS组n=10,x±s) |
2.2 LPS联合HFD对小鼠肝内脂质沉积的影响
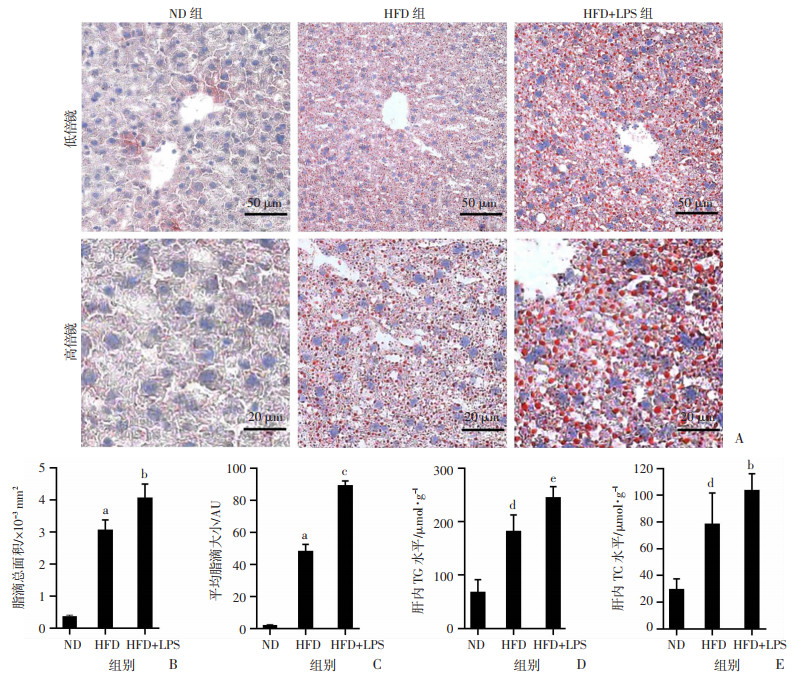
干预10周,处死小鼠,油红O染色检测肝组织内脂质沉积,HFD+LPS组小鼠肝内脂滴沉积明显高于HFD组(图 2A)。Image J定量分析,HFD+LPS组小鼠肝脏脂质沉积面积(P < 0.05,图 2B)与平均脂滴大小(P < 0.001,图 2C)皆高于HFD组。检测各组小鼠肝内TG、TC水平,HFD+LPS组肝内TG(P < 0.01,图 2D)、TC(P < 0.01,图 2E)水平显著高于HFD组。以上提示,LPS加重HFD诱导的NASH小鼠肝组织内脂质沉积。
|
|
a:P < 0.000 1,d:P < 0.01,与ND组比较;b:P < 0.05,c:P < 0.001,e:P < 0.01,与HFD组比较
A:肝脏油红O染色;B:Image J定量分析脂滴总面积;C:Image J定量分析平均脂滴大小;D:肝组织TG水平;E:肝组织TC水平 图 2 各组小鼠肝脏组织油红O染色观察结果及TG、TC水平定量分析(ND组n=8,HFD与HFD +LPS组n=10,x±s) |
2.3 LPS联合HFD加重小鼠肝内炎症浸润
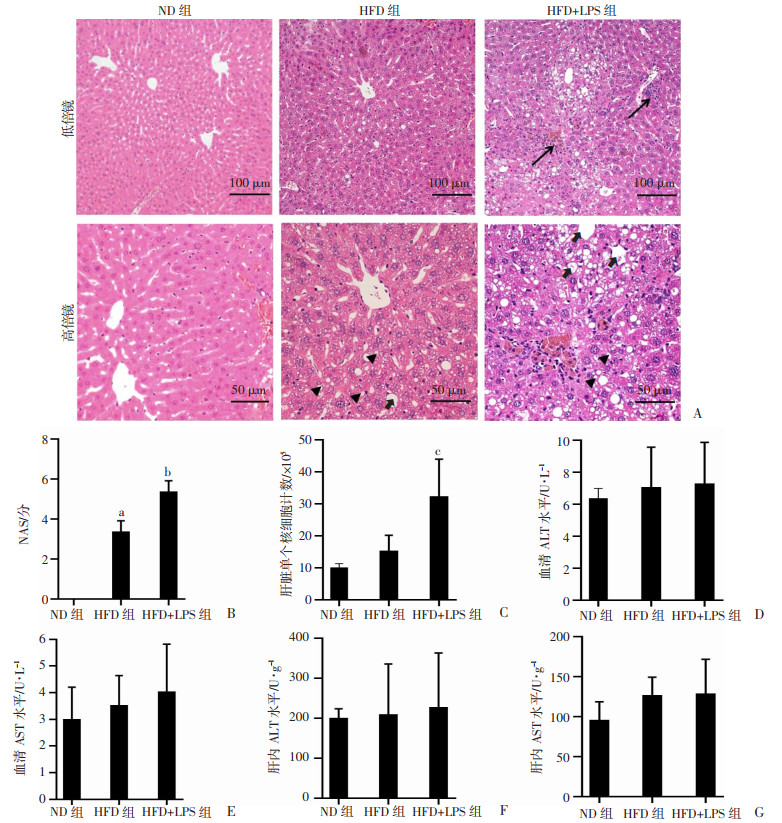
HE染色观察结果表明,单纯HFD组肝脏组织结构紊乱,出现明显空泡样变,存在少量的炎性因子浸润,HFD+LPS组肝脏组织脂肪样变及炎症细胞浸润皆显著高于HFD组(图 3A);HFD+LPS组的肝组织NAS评分(P < 0.05,图 3B)及肝脏内单个核细胞计数均显著高于HFD组(P < 0.01,图 3C),提示LPS加重了HFD诱导的小鼠肝内炎症反应。但是,HFD+LPS组小鼠血清、肝组织AST、ALT水平与HFD组无明显差异(P>0.05,图 3D~G),提示在NASH早期,LPS并未造成明显的肝脏损伤。
|
A:肝脏组织HE染色↑:示炎性浸润,▲:示空泡样变, :示空泡融合;B:NAS评分;C:肝脏单个核细胞计数;D:血清ALT水平;E:血清AST水平;F:肝组织ALT水平;G:肝组织AST水平a:P < 0.000 1,与ND组比较;b:P < 0.05,c:P < 0.01,与HFD组比较
图 3
各组小鼠肝脏病理学观察及血清、肝脏组织ALT、AST水平对比(ND组n=8,HFD与HFD +LPS组n=10,x±s) :示空泡融合;B:NAS评分;C:肝脏单个核细胞计数;D:血清ALT水平;E:血清AST水平;F:肝组织ALT水平;G:肝组织AST水平a:P < 0.000 1,与ND组比较;b:P < 0.05,c:P < 0.01,与HFD组比较
图 3
各组小鼠肝脏病理学观察及血清、肝脏组织ALT、AST水平对比(ND组n=8,HFD与HFD +LPS组n=10,x±s)
|
2.4 LPS联合HFD促进小鼠肝内巨噬细胞、中性粒细胞浸润
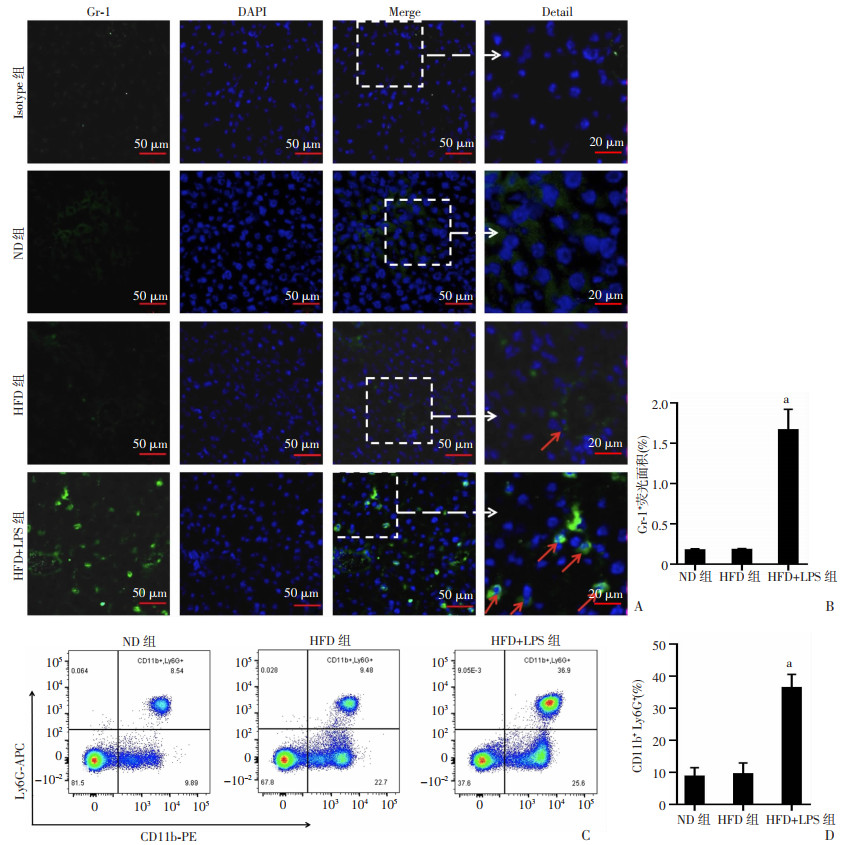
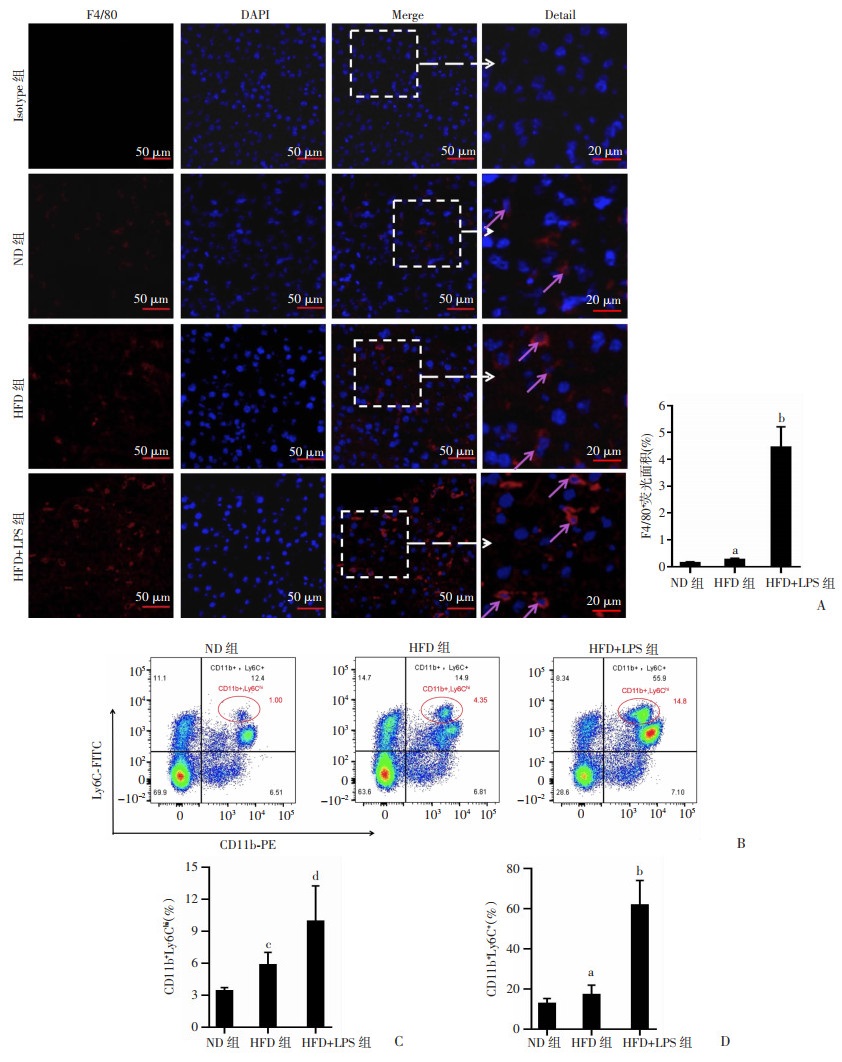
采用IF技术观察小鼠肝脏组织原位巨噬细胞、中性粒细胞炎性浸润情况。结果显示,HFD组肝脏组织中巨噬细胞(F4/80+)浸润明显多于ND组,但中性粒细胞(Gr-1+)无明显差异;HFD+LPS组小鼠肝脏组织中性粒细胞(Gr-1+)、巨噬细胞(F4/80+)浸润显著高于HFD组(图 4、5)。同时,采用FCM技术检测肝脏中浸润的巨噬细胞和中性粒细胞情况,结果显示,HFD组肝脏单个核细胞中CD11b+Ly6C+巨噬细胞、CD11b+Ly6Chi单核细胞比例显著高于ND组,但CD11b+Ly6G+中性粒细胞无显著性差异。而HFD联合LPS后CD11b+Ly6G+中性粒细胞(P < 0.000 1,图 4)、CD11b+Ly6C+巨噬细胞(P < 0.001,图 5)、CD11b+Ly6Chi单核细胞(P < 0.000 1,图 5)显著高于HFD组。提示LPS存在导致以巨噬细胞为主的炎性细胞被募集至肝脏,可能是加重HFD所致NASH的重要因素。
|
| A:肝脏中性粒细胞(Gr-1+)浸润免疫荧光观察↑:示中性粒细胞;B:Image J定量分析肝脏中性粒细胞(Gr-1+)浸润程度;C:肝脏CD11b+Ly6G+中性粒细胞流式细胞仪检测结果;D:肝脏CD11b+Ly6G+中性粒细胞比例a:P < 0.001,与HFD比较 图 4 肝脏组织中中性粒细胞的浸润情况(ND组n=8,HFD与HFD +LPS组n=10,x±s) |
|
| A:肝脏巨噬细胞(F480+)浸润免疫荧光观察 ↑: 示巨噬细胞;B:肝脏CD11b+Ly6Chi 单个核细胞及CD11b+Ly6C+巨噬细胞流式检测;C:肝脏CD11b+Ly6Chi 单个核细胞比例;D:肝脏CD11b+Ly6C+巨噬细胞比例 a:P < 0.05,c:P < 0.01,与ND组比较;b:P < 0.001,d:P < 0.000 1,与HFD组比较 图 5 肝脏组织中巨噬细胞的浸润情况(ND组n=8,HFD与HFD +LPS组n=10,x±s) |
2.5 LPS联合HFD升高小鼠血清IL-1β、TNF-α、CCL5、CCL2、CCL4水平
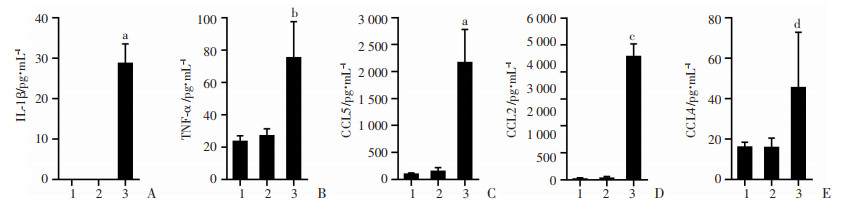
IL-1β、TNF-α被认为是NASH进展的主要细胞因子,检测结果显示:HFD+LPS组血清IL-1β(P < 0.05,图 6A)、TNF-α(P < 0.001,图 6B)水平显著高于HFD组,其中IL-1β变化较为显著。趋化因子作为继发性炎症因子,可促进单核-巨噬细胞募集。检测与巨噬细胞趋化相关因子CCL5、CCL4、CCL2的结果显示:HFD+LPS组血清CCL5(P < 0.001,图 6C)、CCL2(P < 0.000 1,图 6D)、CCL4(P < 0.01,图 6E)水平高于HFD组,其中CCL5、CCL2变化更为明显。以上提示低水平LPS主要影响IL-1β、CCL5、CCL2加重全身炎症水平,从而进一步促进NASH发展。
|
|
1:ND组;2:HFD组;3:HFD+LPS组
A:IL-1β;B:TNF-α;C:CCL5;D:CCL2;E:CCL4;a:P < 0.001,b:P < 0.05,c:P < 0.000 1,d:P < 0.01,与HFD组比较 图 6 小鼠血清IL-1β、TNF-α、C CL5、CCL2、CCL4水平(ND组n=8,HFD与HFD+LPS组n=10,x±s) |
2.6 LPS联合HFD上调小鼠肝内IL-1β、CCL5、CCL2 mRNA表达
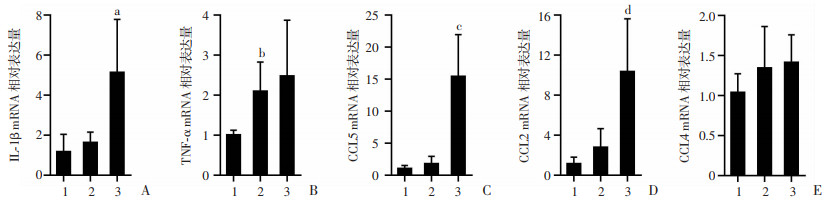
采用RT-qPCR检测小鼠肝脏组织内相关炎性和趋化性因子表达,结果显示:HFD+LPS组肝内IL-1β(P < 0.05,图 7A)mRNA水平高于HFD组,而TNF-α mRNA无明显差异(P>0.05,图 7B)。HFD+LPS组CCL5(P < 0.001,图 7C)、CCL2(P < 0.05,图 7D)mRNA水平显著高于HFD组,CCL4 mRNA无明显差异(P>0.05,图 7E)。
|
|
1:ND组;2:HFD组;3:HFD+LPS组 A:IL-1β;B:TNF-α;C:CCL5;D:CCL2;E:CCL4; a:P < 0.05,c:P < 0.001,d:P < 0.01,与HFD组比较;b:P < 0.05,与ND组比较 图 7 RT-qPCR检测各组小鼠肝脏组织中IL-1β、TNF-α、CCL5、CCL2、CCL4 mRNA表达(ND组n=8,HFD与HFD+LPS组n=10,x±s) |
2.7 LPS联合HFD促进小鼠肝内IL-1β、CCL5、CCL2蛋白表达
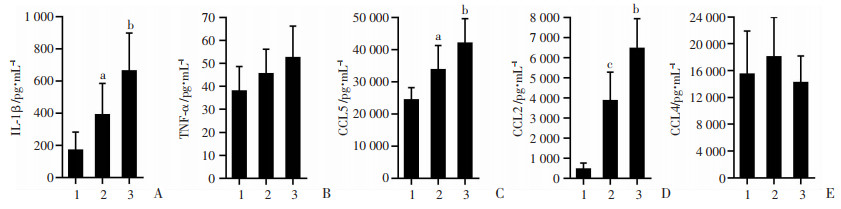
采用ELISA检测肝脏组织提取物中趋化因子和炎症性因子的水平。结果显示:HFD+LPS组肝组织IL-1β(P < 0.05,图 8A)、CCL5(P < 0.05,图 8C)、CCL2(P < 0.05,图 8D)水平高于HFD组,但TNF-α、CCL4无显著性差异(P>0.05,图 8B、8E),这结果与mRNA分析结果相一致。综上结果提示,LPS增加HFD小鼠肝内炎症因子水平。
|
|
1:ND组;2:HFD组;3:HFD+LPS组 A:IL-1β;B:TNF-α;C:CCL5;D:CCL2;E:CCL4;a:P < 0.05,c:P < 0.01,与HFD组比较;b:P < 0.05,与ND组比较 图 8 ELISA检测小鼠肝脏抽提物IL-1β、TNF-α、CCL5、CCL2、CCL4表达水平(ND组n=8,HFD与HFD +LPS组n=10,x±s) |
2.8 LPS联合HFD诱导小鼠肝脏巨噬细胞表达高水平的膜型TLR4
TLR4是LPS作用的重要受体,为了深入探讨LPS诱导小鼠表达高水平炎症相关因子的机制,检测了肝脏组织中TLR4表达水平。结果显示:HFD小鼠肝脏组织中TLR4蛋白主要表达于细胞内,水平高于ND组(P < 0.01);LPS联合HFD作用后TLR4水平高于HFD组(P < 0.05),并出现明显的由细胞质向细胞膜的转位现象。此外,TLR4与F4/80共定位染色结果显示,与HFD小鼠相比,HFD+LPS组小鼠肝脏巨噬细胞表达TLR4蛋白水平升高(P < 0.01,图 9),提示LPS诱导的炎症因子释放和炎症浸润增加可能与上调巨噬细胞表达TLR4有关,这一机制可能在NASH过程中发挥重要作用。
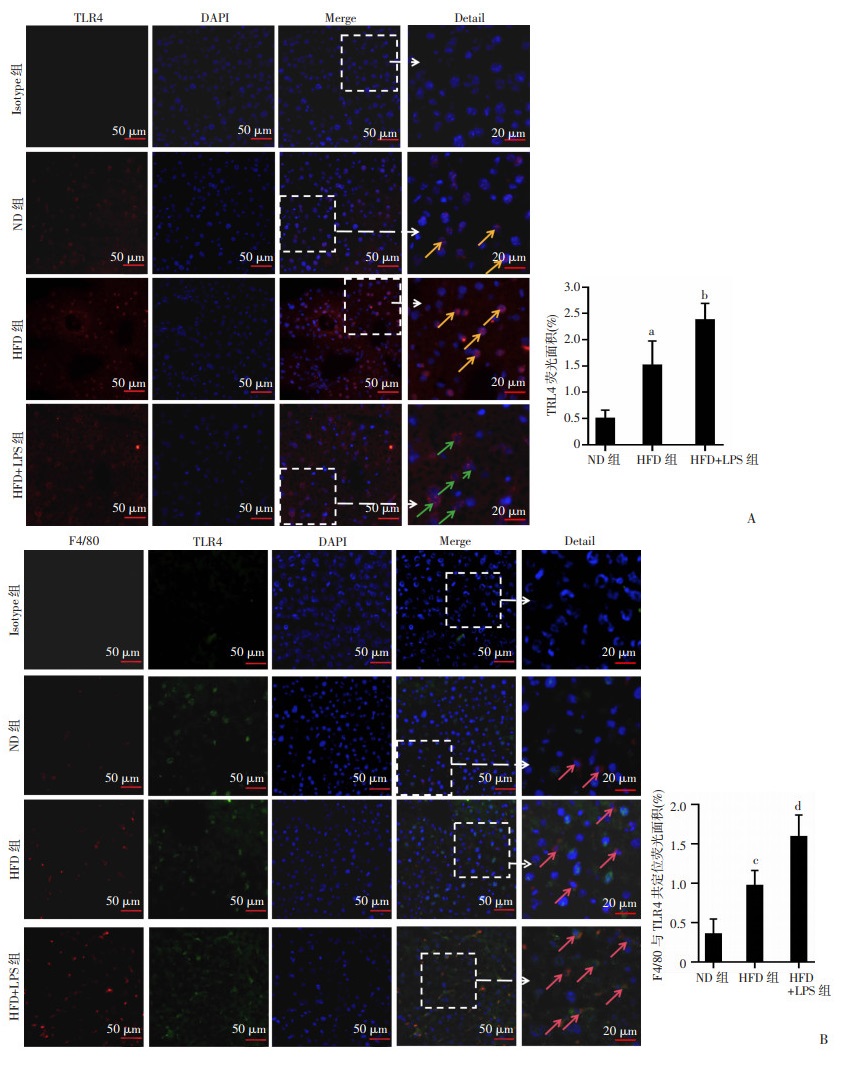
|
|
a:P < 0.01,c:P < 0.001,与ND组比较;b:P < 0.05,d:P < 0.01,与HFD组比较 A:肝组织TLR4表达水平黄色箭头示表达于细胞质的TLR4蛋白,绿色箭头示表达于细胞膜的TLR4蛋白; B:肝组织中巨噬细胞与TLR4表达共定位粉色箭头示共定位的巨噬细胞与TLR4蛋白 图 9 各组小鼠肝脏组织免疫荧光共定位检测TLR4表达(ND组n=8,HFD与HFD+LPS组n=10,x±s) |
3 讨论
由于NAFLD发病机制的复杂性,NASH的发病并非单一因素作用的结果。包括神经内分泌、免疫炎症网络在内的“多重打击”理论,较准确地概括了从脂肪变性到NASH进展背后的病理生理因素[3]。高脂饮食作为第一次打击诱发了胰岛素抵抗与脂质沉积,线粒体功能障碍、内质网应激、炎症激活、肠道菌群、脂肪组织功能障碍、铁超载等因素导致第二次打击,脂肪变的肝细胞发生炎症、坏死、纤维化/硬化。已有研究[7]表明,NASH患者小肠内细菌过度繁殖是造成患者体内LPS水平增高的主要原因。这些研究支持LPS与NASH发展密切相关,但相关机制尚不明确。
为探讨低水平LPS对NASH的影响及其相关机制,本研究利用高脂饲料饲喂小鼠,建立NASH模型,并长期腹腔注射低剂量LPS。结果显示,低水平LPS加剧NASH小鼠肝组织内脂质沉积,出现大量脂滴空泡融合及明显的肝细胞气球样变。肝组织HE染色表明LPS明显促进肝内炎性浸润,这些数据均支持LPS在NASH发生发展中发挥了重要作用。但HFD+LPS组血清和肝组织内ALT、AST水平与HFD组无显著差异,可能的原因是此阶段肝细胞损伤不明显,仍然处于早期炎细胞浸润反应,这与非酒精性脂肪性肝病防治指南[8](2018版)认为的血清ALT正常并不意味着无肝组织炎症损伤相一致。近年来,越来越多的研究指出,巨噬细胞、中性粒细胞募集在多种慢性肝脏疾病中发挥作用[9]。肝内固有免疫细胞亚群变化参与影响脂代谢紊乱的关键过程[10],关注LPS诱导的固有免疫紊乱对肝脏脂肪代谢的影响具有重要意义。据此,本研究采用IF原位观察小鼠肝脏内巨噬细胞、中性粒细胞浸润情况,发现HFD+LPS组小鼠肝脏原位巨噬细胞、中性粒细胞浸润显著多于HFD组。同时,FCM结果显示,HFD+LPS组小鼠肝脏内巨噬细胞与中性粒细胞比例均明显增多。据此推断循环中的巨噬细胞与中性粒细胞由于内毒素作用被募集至肝血窦进而影响脂肪代谢过程。研究表明,CD11b+Ly6C+中Ly6Chi细胞群可分化为组织炎症巨噬细胞,是造成肝脏细胞损伤的浸润性巨噬细胞的前体细胞,表达炎症趋化因子受体、模式识别受体与细胞因子[11]。LPS联合HFD刺激,小鼠肝脏内CD11b+Ly6Chi细胞比例显著高于HFD组,这提示LPS诱导NASH肝脏中促炎性巨噬细胞增加。
趋化因子在募集免疫细胞向组织浸润过程中发挥关键作用,系由上游炎症介质如IL-1或TNF诱导产生的继发性炎症介质[12]。临床资料显示,NASH患者体内CCL2、CCL4、CCL5等水平高于健康人群[13]。对趋化因子与NAFLD关系的分析提示,CCL2、CCL4浓度升高与NAFL或NASH密切有关[14]。游离脂肪酸的增加和TLRs的激活通过NF-κB促进CCL2的产生,从而趋化单核细胞造成肝脏损伤[15]。而肝细胞产生的CCL5能够促进NAFLD发生肝纤维化[16]。综合以上结果,说明LPS导致HFD小鼠全身及肝组织内炎症因子及趋化因子水平升高。由此推测,LPS可能主要通过诱导IL-1 β、CCL2、CCL5高表达,导致炎症反应加重进而促进疾病进展。但是,以上炎症和趋化因子的细胞来源仍需进一步确认。
TLR4是LPS触发巨噬细胞免疫应答的关键受体[17],LPS触发TLR4后将刺激巨噬细胞分泌大量炎症因子[18],因而在炎症反应中扮演重要角色。研究表明,NASH和NAFL患者肝组织中TLR4+巨噬细胞水平升高,且与LPS水平呈正相关,提示LPS可能活化TLR4+巨噬细胞诱导炎症反应[19]。本研究结果显示:HFD+LPS组小鼠肝脏中巨噬细胞浸润数量、肝脏中TLR4表达水平皆显著高于HFD组。利用免疫荧光共定位分析证实,HFD+LPS组小鼠肝脏内巨噬细胞与TLR4呈现共定位模式,且TLR4出现明显的由细胞质向细胞膜的转位。综合以上数据,本研究提示LPS不仅能够通过增加肝脏内巨噬细胞浸润,还能通过上调巨噬细胞表面TLR4的表达,导致炎性和趋化性因子释放增加,从而加剧肝内脂代谢相关炎症损伤,促进NASH进程。靶向LPS激发的促进NASH相关机制将为临床该类疾病的预防和治疗提供有力依据和潜在靶点;同时这一问题背后的深入机制仍需要进一步研究予以解析。
| [1] |
FRIEDMAN S L, NEUSCHWANDER-TETRI B A, RINELLA M, et al. Mechanisms of NAFLD development and therapeutic strategies[J]. Nat Med, 2018, 24(7): 908-922. |
| [2] |
RINELLA M E. Nonalcoholic fatty liver disease: a systematic review[J]. JAMA, 2015, 313(22): 2263-2273. |
| [3] |
YOUNOSSI Z, ANSTEE Q M, MARIETTI M, et al. Global burden of NAFLD and NASH: trends, predictions, risk factors and prevention[J]. Nat Rev Gastroenterol Hepatol, 2018, 15(1): 11-20. |
| [4] |
YEH C F, CHEN Y H, LIU S F, et al. Mutual interplay of host immune system and gut microbiota in the immunopathology of atherosclerosis[J]. Int J Mol Sci, 2020, 21(22): E8729. |
| [5] |
RATZIU V, HARRISON S A, FRANCQUE S, et al. Elafibranor, an agonist of the peroxisome proliferator-activated receptor-α and -δ, induces resolution of nonalcoholic steatohepatitis without fibrosis worsening[J]. Gastroenterology, 2016, 150(5): 1147-1159. e5. |
| [6] |
WIGG A J, ROBERTS-THOMSON I C, DYMOCK R B, et al. The role of small intestinal bacterial overgrowth, intestinal permeability, endotoxaemia, and tumour necrosis factor alpha in the pathogenesis of non-alcoholic steatohepatitis[J]. Gut, 2001, 48(2): 206-211. |
| [7] |
JINDAL A, BRUZZÌ S, SUTTI S, et al. Fat-laden macrophages modulate lobular inflammation in nonalcoholic steatohepatitis (NASH)[J]. Exp Mol Pathol, 2015, 99(1): 155-162. |
| [8] |
中华医学会肝病学分会脂肪肝和酒精性肝病学组, 中国医师协会脂肪性肝病专家委员会. 非酒精性脂肪性肝病防治指南(2018年更新版). 临床肝胆病杂志, 2018, 34(5): 947-957. DOI: 10.3969/j.issn.1001-5256.2018.05.007. National Group on Fatty Liver and Alcoholic Liver Disease of Chinese Society of Hepatology of Chinese Medical Association, Fatty Liver Expert Committee of Chinese Medical Doctor Association. Guidelines of prevention and treatment for nonalcoholic fatty liver disease: A 2018 update. J Clin Hepatol, 2018, 34(5): 947-957. DOI: 10.3969/j.issn.1001-5256.2018.05.007. |
| [9] |
BAECK C, WEI X, BARTNECK M, et al. Pharmacological inhibition of the chemokine C-C motif chemokine ligand 2 (monocyte chemoattractant protein 1) accelerates liver fibrosis regression by suppressing Ly-6C(+) macrophage infiltration in mice[J]. Hepatology, 2014, 59(3): 1060-1072. |
| [10] |
吴剑平, 肖海英, 郑雪莲, 等. 白介素25及其相关因子在非酒精性脂肪肝患者血清及肝内的表达及其意义[J]. 第三军医大学学报, 2021, 43(01): 83-90. WU J P, XIAO H Y, ZHENG X L, et al. Expression and significance of interleukin 25 and its related factors in serum and liver of patients with non-alcoholic fatty liver[J]. J Third Mil Med Univ, 2021, 43(01): 83-90. |
| [11] |
WESOLOWSKI S R, KASMI K C, JONSCHER K R, et al. Developmental origins of NAFLD: a womb with a clue[J]. Nat Rev Gastroenterol Hepatol, 2017, 14(2): 81-96. |
| [12] |
GRAVES D T, JIANG Y. Chemokines, a family of chemotactic cytokines[J]. Crit Rev Oral Biol Med, 1995, 6(2): 109-118. |
| [13] |
MARRA F, TACKE F. Roles for chemokines in liver disease[J]. Gastroenterology, 2014, 147(3): 577-594. e1. |
| [14] |
PAN X F, CHIWANDA KAMINGA A, LIU A Z, et al. Chemokines in non-alcoholic fatty liver disease: a systematic review and network meta-analysis[J]. Front Immunol, 2020, 11: 1802. |
| [15] |
MIURA K, YANG L, VAN ROOIJEN N, et al. Hepatic recruitment of macrophages promotes nonalcoholic steatohepatitis through CCR2[J]. Am J Physiol Gastrointest Liver Physiol, 2012, 302(11): G1310-G1321. |
| [16] |
LI B H, HE F P, YANG X, et al. Steatosis induced CCL5 contributes to early-stage liver fibrosis in nonalcoholic fatty liver disease progress[J]. Transl Res, 2017, 180: 103-117.e4. |
| [17] |
BESSONE F, RAZORI M V, ROMA M G. Molecular pathways of nonalcoholic fatty liver disease development and progression[J]. Cell Mol Life Sci, 2019, 76(1): 99-128. |
| [18] |
刘彦, 吴皓, 龚建平, 等. 阻断Kupffer细胞的TIM-4蛋白功能对小鼠肝脏缺血再灌注损伤的影响[J]. 第三军医大学学报, 2019, 041(001): 48-55. LIU Y, WU H, GONG J P, et al. Inhibition of TIM-4 in Kupffer cells alleviates hepatic ischemia-reperfusion injury in mice[J]. J Third Mil Med Univ, 2019, 041(001): 48-55. |
| [19] |
CARPINO G, DEL BEN M, PASTORI D, et al. Increased liver localization of lipopolysaccharides in human and experimental NAFLD[J]. Hepatology, 2020, 72(2): 470-485. |




