2. 200233 上海,上海交通大学附属第六人民医院,上海超声医学研究所
2. Shanghai Institute of Ultrasound Medicine, Sixth People's Hospital affiliated to Shanghai Jiaotong University, Shanghai, 200233, China
恶性肿瘤是威胁人类健康的重大疾病之一,已成为目前全球性的健康挑战[1]。尽管肿瘤治疗已经取得了一些突破性的进展,但患者病死率一直居高不下。化疗仍然是临床上肿瘤治疗最常用的方式,然而化疗药物的不良反应严重影响患者的生存质量[2]。因此,急需开发新的治疗策略来解决这个难题。近年来,基于纳米材料的协同治疗模式引起了科研工作者的广泛关注。与传统的化学疗法和放射疗法相比,通过纳米材料实现几种治疗模式联合而产生协同效应,可以达到疗效高且不良反应小的目的[3-6],为肿瘤的特异性治疗带来了曙光。
声动力学疗法(sonodynamic therapy,SDT)作为一种新兴的非侵入性的治疗手段,近年来得到迅速发展。这种治疗方式依赖于超声(ultrasound,US)诱导气泡不断生成和破裂,即所谓的“空化效应”。空化效应释放的能量可以诱导声致发光或热解过程,以激活声敏剂产生以单线态氧(1O2)为主的活性氧(reactive oxygen species,ROS)[7-8]。与光相比,超声具有更强穿透深度的优点,因此有望实现深部肿瘤更好的治疗效果[7, 9-10]。研究表明,US可以触发药物释放,实现化疗药物在肿瘤部位精准释放,降低其不良反应[11-13]。其中,声敏剂的选择对于高效SDT非常关键。与传统的有机声敏剂相比,无机纳米声敏剂具有稳定性高、理化性质可控以及易于功能化等优点[14]。目前已有许多无机声敏剂,如二氧化钛、晶体硅、二维碳材料等相继被开发[15-18]。铱(iridium,Ir)作为一种过渡金属,由于其独特的物理和光学性能而在光电、催化、能源等诸多领域引起了广泛的关注[19-22]。已有研究[23-24]发现,氧化铱(IrOX)在激光照射下能够产生活性氧,且其具有良好的生物相容性,因此其在纳米肿瘤诊疗领域中展示出了广泛的应用潜力。然而,目前针对铱基纳米材料在肿瘤治疗的研究尚处于起步阶段。与此同时,系统地探讨其作为声敏剂的可行性对于基于无机声敏剂的SDT研究具有重要意义。
基于以上的研究背景,本研究聚焦于IrOX在SDT中的应用展开系统研究,通过直接热水解制备IrOX纳米颗粒,并负载化疗药物阿霉素(doxorubicin,DOX),构建纳米载药复合物IrOX@DOX。由于肿瘤细胞内呈微酸性,IrOX@DOX可以实现pH及US双重刺激响应药物释放行为以提高化疗效果。与此同时,IrOX作为声敏剂在US辐照下可以产生ROS,放大细胞内氧化应激加速肿瘤细胞死亡,最终达到SDT-化疗协同治疗的效果。本研究为基于IrOX纳米药物的开发提供新的思路,同时也将为SDT联合化疗策略的制订提供一种通用性的方案。
1 材料与方法 1.1 研究材料与实验动物氯化铱(IrCl3,上海麦克林生化科技有限公司);阿霉素(DOX,上海阿拉丁试剂有限公司);4’, 6-二脒基-2-苯基吲哚(DAPI,碧云天生物公司);2, 2, 6, 6-四甲基哌啶(TEMP,同仁化学有限公司);3-二苯基异苯并呋喃(DPBF,美国Sigma公司);活性氧检测试剂盒(碧云天生物公司);CCK-8试剂盒(同仁化学有限公司);钙黄绿素-PI试剂盒(同仁化学有限公司);Annexin V-FITC细胞凋亡检测试剂盒(碧云天生物公司);人脐静脉内皮细胞(HUVEC,中科院生命科学研究院细胞资源中心);小鼠乳腺癌4T1细胞(中科院生命科学研究院细胞资源中心)。4~6周BABL/c雌性裸鼠15只,体质量约18 g,购于卡文斯百格(苏州)模式动物研究有限公司。
1.2 仪器透射电子显微镜(TEM,JEM-2100F,日本电子株式会社);傅立叶红外光谱仪(FT-IR,Perkin Elmer,美国);X射线光电子能谱仪(XPS,Thermo公司,美国);X射线晶体粉末衍射仪(XRD,理学Rigaku,日本);顺磁共振波谱仪(ESR,布鲁克,德国);粒度和Zeta电位分析仪(Malvern公司,英国);紫外可见光分光光度计(UV-Vis,Perkin Elmer,美国);激光共聚焦显微镜(confocal laser scanning microscopy,CLSM,Nikon公司,日本);荧光显微镜(Nikon公司,日本);流式细胞仪(Beckman coulter公司,美国);多功能酶标仪(Thermo公司,美国);超声治疗仪(威尔德超声治疗仪,中国)。
1.3 实验方法 1.3.1 IrOX@DOX的制备及表征将氯化铱(IrCl3,0.149 3 g)溶解在50 mL去离子水中,用氢氧化钠溶液(1 mol/L)调节pH值至12,室温搅拌2.5 h。随后,将溶液转移到油浴中(80 ℃)继续搅拌反应1 h,得到产物IrOX分散液。将上述溶液转移到超滤管(MWCO=14 kDa)中离心(2 660×g)15 min,用去离子水重悬,重复3次以去除过量的IrCl3及副产物。
将上述所得IrOX分散液与DOX按不同比例(IrOX∶DOX=1∶2、1∶1、2∶1、4∶1、6∶1)混合,室温下避光搅拌24 h。将产物离心(20 000×g)15 min,收集上清液,重复3次以去除过量的DOX,最后用去离子水重悬,得到IrOX@DOX分散液。收集所有上清液和洗涤液,采用UV-Vis测定DOX的吸光度并根据公式计算不同条件的负载率。
负载率=(DOX初始质量-上清液中DOX的质量)/ IrOX@DOX的质量×100%。
采用TEM观察IrOX的形状;使用XRD对样品进行物相表征;通过XPS对IrOX中的不同元素及价态进行表征;用FT-IR对纳米颗粒表面的官能团进行考察;采用UV-Vis测定不同样品的紫外吸收光谱;使用Zeta电位分析仪对材料合成过程中各个阶段的产物进行电位测定。
1.3.2 体外药物释放行为考察采用透析法对IrOX@DOX进行药物释放行为考察。具体地,精密称取一定质量的DOX溶解于pH值为7.4和5.5的PBS缓冲溶液(200 mL)中,分别测定其吸光度得到不同pH值条件下DOX的标准曲线。随后将2 mL IrOX@DOX分散液装入透析袋(MWCO=3 kDa)并置于不同pH值的缓冲液(pH值为5.5或7.4)中室温避光搅拌。US组在一定时间给予超声辐照(1 W/cm2)30 s。在不同时间点从烧杯中取出1 mL释放液并补充同等体积的新鲜缓冲液。采用UV-Vis测定稀释液在500 nm处的吸光度。通过标准曲线计算不同条件下DOX的累积释放量,得到DOX的释放曲线。药物释放率=(释放的DOX质量/复合物中DOX的总质量)×100%
1.3.3 体外SDT效果评价将200 μL IrOX@DOX分散液(100 μg/mL)与200 μL TEMP溶液(100 mmol/L)混合,通过US辐照(1.0 MHz、1.0 W/cm2)2 min,立即通过ESR光谱仪检测1O2的生成。同时,未进行超声处理作为对照。为了探究不同超声功率对1O2生成的影响,使用不同功率(0.5、1.0、1.5、2.0、2.5 W/cm2)的US辐照相同浓度IrOX@DOX分散液,通过ESR检测1O2的生成。此外,将2.96 mL的IrOX@DOX溶液(100 μg/mL)和40 μL的DBPF(2 mg/mL)避光混合,每隔2 min进行US辐射(1.0 MHz、1 W/cm2、2 min),通过UV-Vis记录溶液在200~650 nm波长处的吸收曲线检测ROS的生成。
1.3.4 体外细胞摄取采用CLSM观察4T1细胞对IrOX@DOX的摄取能力。将4T1细胞(1×105 /孔)接种到共聚焦培养皿中,待细胞贴壁后,空白对照组加入含PBS的培养基培养6 h;实验组加入含IrOX@DOX的培养基,并对其进行有无超声辐照(1 MHz、1.0 W/cm2、1 min)处理,随后继续培养6 h。用PBS清洗细胞3次,除去未被吞噬的纳米颗粒,用4%的多聚甲醛固定细胞15 min后加入DAPI染色5 min,最后用CLSM进行观察。
1.3.5 体外细胞SDT效果将4T1细胞接种于6孔板中(1×105/孔)培养24 h。将细胞进行以下分组:①PBS组;②PBS+US组;③IrOX组;④IrOX+US组;⑤IrOX@DOX组;⑥IrOX@DOX+US组。加入2 mL含有上述纳米颗粒的新鲜培养基继续孵育12 h。PBS洗涤3次,随后加入ROS探针(DCFH-DA)孵育30 min后,继续用PBS洗涤3次,同时对②、④和⑥组进行超声辐照(1.0 MHz、1.0 W/cm2、1 min)后继续孵育2 h。最后将细胞用荧光显微镜进行观察。进一步采用流式细胞仪检测ROS生成情况,细胞处理如上所述。
1.3.6 体外化疗-SDT协同治疗效果首先对IrOX的细胞相容性进行考察。具体地,将HUVEC细胞接种于96孔板(1×104/孔)中,在37 ℃、5% CO2 培养箱中培养24 h。随后加入100 μL含有不同浓度IrOX的新鲜培养基继续孵育12 h。移除培养基,用PBS洗涤3次,随后加入100 μL含10 μL CCK-8试剂的培养基继续孵育1 h。最后,用酶标仪读取450 nm处的吸光值,根据说明书计算细胞存活率。每组样品设置5个复孔,每个样品平行测定3次。
采用CCK-8法评估IrOX@DOX引发的化疗-SDT协同治疗效果。将4T1细胞接种于96孔板(1×104/孔)中培养24 h。实验按1.3.5分组。对于US辐射组,细胞加入纳米颗粒孵育6 h后进行US辐照(1.0 MHz、1 min),并继续孵育12 h。随后移除培养基,用PBS洗涤3次后,采用CCK-8法计算细胞存活率。此外, 细胞经过不同治疗处理后, 加入Calcein AM/PI(Calcein AM 2 μmol/L,PI 4.5 μmol/L,100 μL)进行染色15 min。随后弃去培养液并用PBS清洗,最后在荧光显微镜下观察细胞生存状态。
流式细胞仪检测细胞凋亡:4T1细胞(1×105 /孔)接种在6孔板中孵育24 h。根据上述CCK-8的实验步骤对细胞进行处理。孵育后, 细胞用胰酶消化,PBS洗涤,离心收集细胞后用流式凋亡染色试剂盒(Annexin V-FITC/PI染液)分析早期凋亡、晚期凋亡和坏死细胞数量。
1.4 肿瘤模型的建立和治疗将100 μL含2×106个Hepa 1-6细胞悬液皮下注射至BALB/c雌性裸鼠,建立皮下移植瘤模型。当肿瘤体积达到120 mm3时,随机分为5组(n=3):①生理盐水组;②IrOX组;③IrOX@DOX组;④IrOX+US组;⑤IrOX@DOX+US组。裸鼠相应注射生理盐水,IrOX及IrOX@DOX(8 mg/mL,100 μL)。超声辐照组在注药12 h后进行超声照射(1.5 W/cm2、1.5 MHz、50%占空比、5 min),治疗过程每3天重复1次,每隔3天对小鼠体质量及肿瘤体积进行记录,连续14 d。肿瘤体积计算公式为:V=L×W2/2,其中V、L和W分别代表肿瘤的体积、长度和宽度。治疗14天后进行静脉注射造影剂,观察肿瘤生长情况,并对裸鼠施行安乐死,取相应的瘤体拍照并进行HE染色观察。计算肿瘤体积抑制率=(V对照组-V实验组)/V对照组×100%。
1.5 统计学分析采用Origin和SPSS 26.0统计软件进行制图和统计学分析。数据以x±s表示。两两比较采用独立样本t检验,多样本均数比较采用单因素方差分析,P < 0.05表示差异具有统计学意义。
2 结果 2.1 IrOX@DOX的制备、表征及理化性质评价采用热水解法制备了IrOX纳米颗粒。TEM显示制备的IrOX呈不规则纳米簇结构,且粒径大约在5 nm(图 1A)。同时可以清晰地观察到IrOX的晶格条纹(图 1B)。对比反应前后的溶液颜色,可以看到合成的IrOX为蓝紫色分散液,不同于氯化铱溶液(图 1C),证明高温引发了Ir3+的氧化反应。XRD谱图中,IrOX显示了明显的宽峰,表明其趋向于小颗粒聚集生长(图 1D)。通过XPS对IrOX中的元素价态进行确证,从XPS全谱(图 1E)可以看到与Ir4f、O1s和C1s相关的特征峰,初步说明IrOX的成功制备。Ir4f的XPS谱在64.7 eV和61.8 eV处显示了两个特征峰(图 1F),可以归属于Ir4f5/2和Ir4f7/2。FT-IR光谱显示:IrOX 在3 300 cm-1附近出现强而宽吸收,归属于IrOX表面存在的一些氢氧化物(图 1G),可能是由于Ir3+的氧化所致。从UV-Vis光谱可以看出,IrOX在200~650 nm都具有较好的吸收。在IrOX@DOX的UV-Vis光谱中出现了DOX的特征吸收峰(485 nm), 证明DOX的成功负载(图 1H)。此外,Zeta电位测定显示IrOX的电势为(-22.30±0.47)mV,而DOX的电势为(23.60±0.62)mV。DOX负载后,IrOX@DOX的电势变为(1.40±0.39)mV(图 1I),说明IrOX与DOX之间可以依靠静电引力相结合。
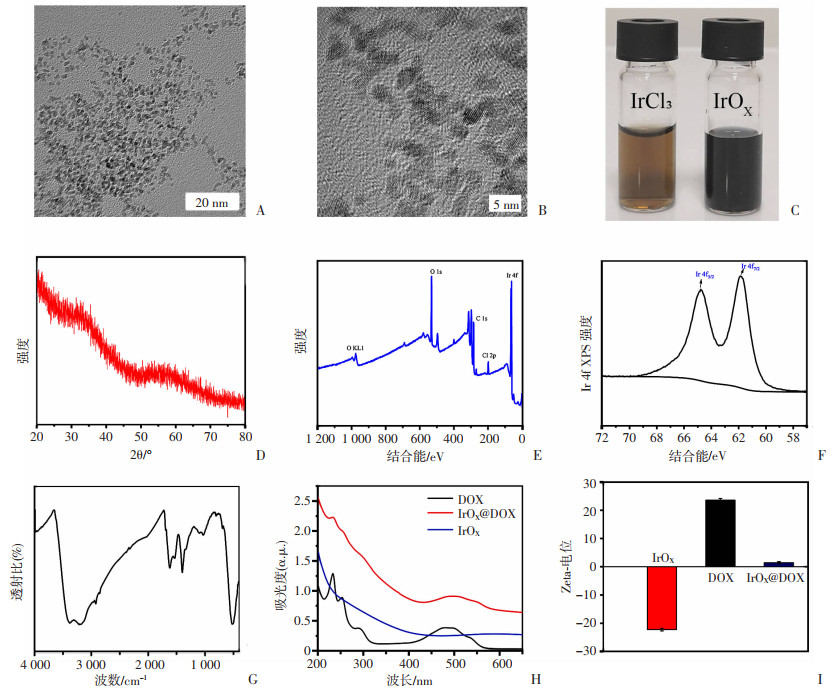
|
| A、B:IrOX的电镜图像,呈颗粒状聚集态;C:反应前后的溶液;D:IrOX纳米颗粒的XRD图谱;E:XPS图谱;F:Ir 4f的XPS图谱;G:IrOX的FT-IR光谱图;H:IrOX、DOX和IrOX@DOX的紫外吸收光谱图;I:IrOX、DOX和IrOX@DOX的Zeta电位 图 1 IrOX与IrOX@DOX的形貌表征及理化性能测试 |
2.2 药物负载及体外药物释放
通过UV-Vis对其载药量进行考察,建立DOX的标准曲线,如图 2A所示。IrOX对DOX的负载量在一定药物浓度内随着DOX的浓度的增加而增加(图 2B)。当IrOX与DOX的比例为4∶1时,载药率达到了(18.7±0.2)%。

|
| A:DOX溶液的标准曲线;B:不同比例(IrOX: DOX)下DOX的载药率;C:IrOX@DOX在不同pH值及有无US辐照下的DOX释放行为;D:IrOX在US辐照前后的ESR光谱;E:IrOX在不同US功率辐照下的ESR光谱;F:IrOX与DPBF混合后,经超声辐照后,在不同时间点DPBF的UV-Vis光谱 图 2 药量、体外药物释放曲线和单线态氧产生性能考察 |
IrOX@DOX体外药物释放:如图 2C所示,当pH=7.4时,DOX释放率为(9.7±1.2)%,而在pH=5.5时,DOX释放率为(40.0±1.7)%。这是由于酸性pH值使得DOX发生质子化而释放。此外,US刺激会进一步加速DOX释放。在pH=5.5及US刺激条件下,DOX的释放率增加到(61.1±1.3)%。可能是由于US刺激下的空化效应使得DOX与IrOX之间的作用力减弱而释放药物。综上,IrOX@DOX具有pH及US双重响应药物释放行为,有望提高DOX的化疗效果。
2.3 IrOX体外活性氧产生性能考察IrOX的体外ROS产生性能:与未进行US辐照组相比,US辐照组可以明显检测到1O2的生成(图 2D)。同时,随着US辐照功率的增大,TEMP/1O2光谱峰值逐渐增大,表明IrOX引发的1O2产生具有功率依赖性(图 2E)。此外,采用DPBF作为活性氧探针,通过UV-Vis记录不同时间点吸收峰强度。由图 2F可知,在398 nm波长处,DPBF的吸收峰随时间延长而下降,表明在US辐照下,随着时间的延长,IrOX可以不断产生1O2。
2.4 体外细胞摄取采用CLSM观察4T1细胞对IrOX@DOX的摄取行为。如图 3所示,细胞核被DAPI染色而呈现蓝色荧光,而DOX在激发光照射下呈现红色荧光。空白对照组无红色荧光,而经IrOX@DOX处理后的细胞,可观察到明显的红色荧光,表明4TI细胞能够摄取IrOX@DOX。相比之下,IrOX@DOX+US组显示出更强的红色荧光信号, 表明超声不仅可以增强细胞对纳米颗粒的摄取,而且可以促进DOX在胞内释放,这为后续SDT-化疗协同治疗提供了基础。
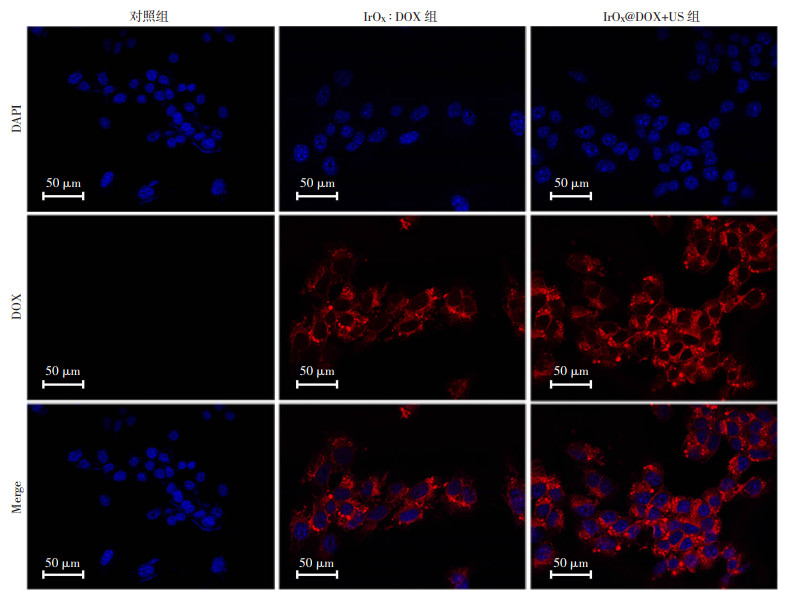
|
| DAPI标记细胞核(蓝色荧光);DOX为红色荧光;Merge为融合图像 图 3 4T1细胞经IrOX@DOX孵育后在有无US辐照下的CLSM图像 |
2.5 细胞水平上的SDT性能评价
DCFH-DA无荧光,可以穿过细胞膜,进入细胞后被细胞内的酯酶水解生成DCFH,而DCFH不能通透细胞膜,从而使探针装载到细胞内。细胞内的活性氧可以氧化无荧光的DCFH生成有荧光的DCF,从而检测细胞内活性氧的水平。荧光显微镜下观察到:对照组几乎未见绿色荧光,而IrOX+US组的绿色荧光明显强于单独IrOX组或PBS+US组(图 4A)。进一步证明IrOX的SDT效果。此外,IrOX@DOX+US组活性氧产量明显高于其余组。同时,流式细胞术定量检测也证实了以上结论,IrOX@DOX+US组活性氧产量最高(图 4B)。
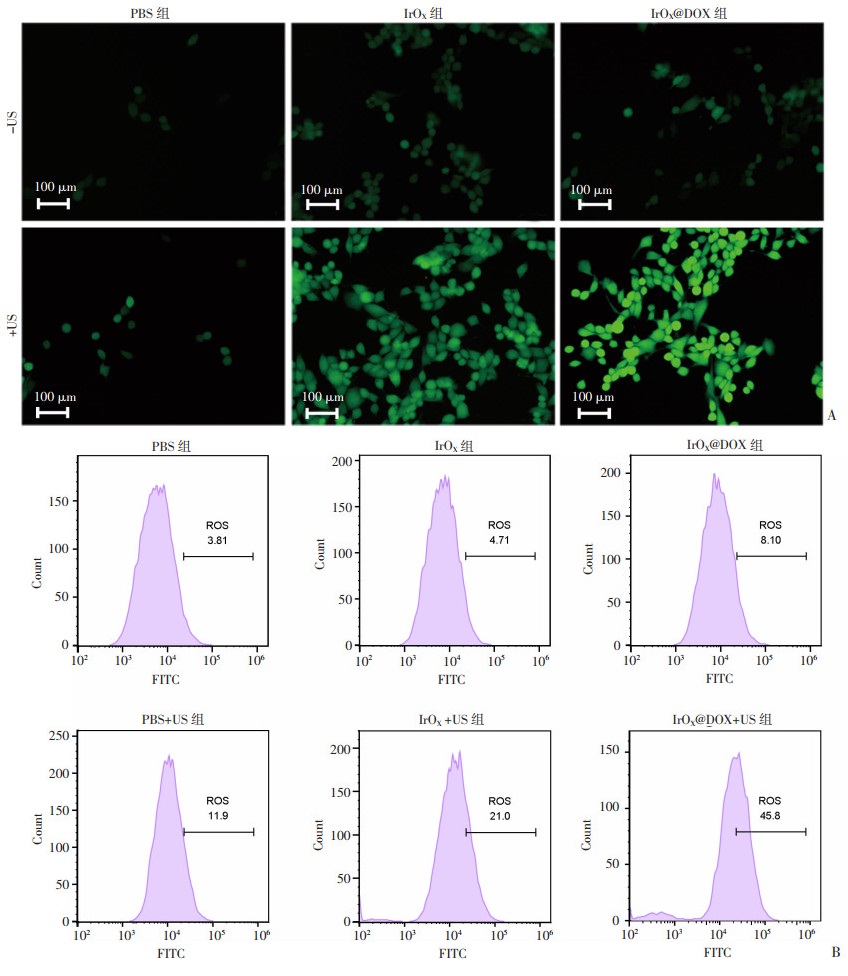
|
| A:4T1细胞与DCFH-DA探针孵育后经不同方式处理后的荧光图片;B:相对应的流式定量结果 图 4 细胞水平上IrOX@DOX的活性氧产生性能评价 |
2.6 体外SDT-化疗协同治疗效果评价
IrOX的细胞相容性:如图 5A所示,当IrOX浓度在0~100 μg/mL,4T1细胞与之共孵育12 h后的存活率均高于85%,可见实验浓度范围IrOX的细胞相容性良好。IrOX联合低频超声后,细胞的生长明显受到抑制,证明了IrOX的SDT效果(图 5B)。IrOX@DOX与US的协同治疗效果:如图 5C所示,在相同的DOX浓度下,IrOX@DOX+US组的细胞存活率(19.4%)明显低于无US辐射组(37.4%),且细胞毒性呈现明显的DOX浓度依赖性,可见IrOX@DOX与US辐照相结合可以产生明显的协同治疗效果。Calcein AM和PI双染色结果显示(图 5D):与IrOX+US、IrOX@DOX组相比,IrOX@DOX+US组显示出了大量的红色荧光信号(肿瘤细胞死亡)。流式细胞术实验结果表明(图 5E):对照组、PBS+US、IrOX、IrOX+US、IrOX@DOX和IrOX@DOX+US组细胞凋亡率分别为6.8%、14.6%、6.9%、38.8%、37.8%、54.7%。
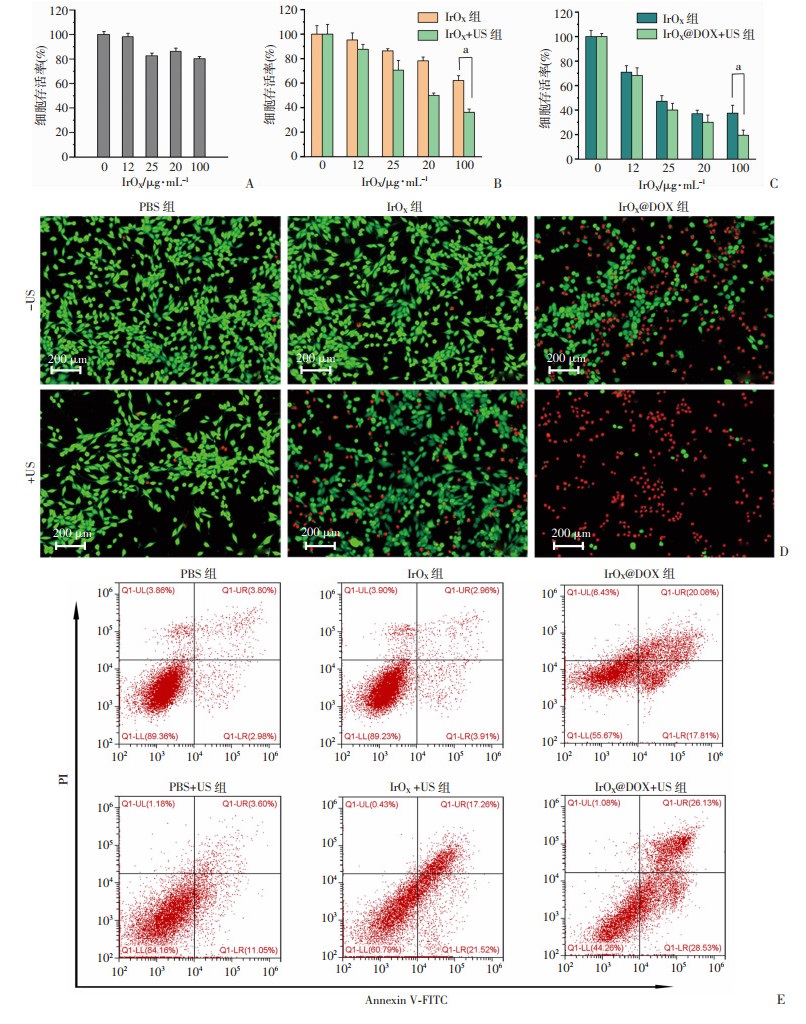
|
| A:不同浓度IrOX处理4T1细胞24 h后的细胞存活率(n=5);B:US辐照对4T1细胞不同浓度IrOX孵育后存活率的影响(n=4) a: P < 0.05;C:US辐照对4T1细胞不同DOX浓度的IrOX@DOX处理后细胞存活率的影响(n=4) a: P < 0.05;D:4T1细胞经不同方式处理后Calcein AM和PI双染色后的荧光图片;E:流式细胞术分析4T1细胞经不同治疗方式处理后采用AnnexinV-FITC/PI染色的凋亡情况 图 5 细胞毒性与SDT-化疗协同治疗效果评价 |
2.7 体内抗肿瘤疗效
建立皮下移植瘤来验证治疗效果,治疗过程中各组小鼠体质量变化(图 6A)差异无统计学意义,表明各组所注射的纳米粒子对小鼠体质量无明显影响。IrOX+US组、IrOX@DOX组、IrOX@DOX+US组与对照组相比,肿瘤体积有所缩小(图 6B),差异具有统计学意义(P < 0.05)。抑制率分别为27%、57%及76%,这与数码图片(图 6C)相符,表明IrOX@DOX与US辐照相结合可以产生明显的协同治疗效果。此外,超声造影结果(图 6D)显示,与对照组相比,IrOX@DOX+US组肿瘤体积小,肿瘤内部组织存在坏死,治疗效果最好,这与HE实验结果一致(图 6E)。以上实验结果表明表明当化疗药物DOX与SDT联合作用时,可以得到良好的治疗效果。

|
| A:治疗期间小鼠体质量变化(n=3);B:治疗期间小鼠肿瘤体积生长变化(n=3) a: P < 0.05;C:治疗结束后瘤块离体照片;D:经不同治疗方式处理后小鼠瘤体的超声造影图;E:治疗结束后瘤块离体HE染色观察凋亡情况;D1、E1:生理盐水组;D2、E2:IrOX组;D3、E3:IrOX+US组;D4、E4:IrOX@DOX组;D5、E5:IrOX@DOX+US组 图 6 SDT-化疗协同治疗体内治疗效果评价 |
3 讨论
化疗作为目前临床上治疗肿瘤最常见的一种治疗方式,但由于其不良反应给病人带来了极大的痛苦,因此,科研工作者们也为减轻化疗带来的不良反应做了很多研究。与单一疗法获得的有限疗效及明显的不良反应相比,协同治疗有望实现在较低剂量的药物下产生更高的治疗效果,从而减轻高剂量给药带来的不良反应。
SDT作为一种新兴的肿瘤治疗策略,近年来受到了科研工作者的广泛关注[25-26]。由于超声具有高聚焦、强穿透力的特点,可以解决激光面临的穿透力不足的缺点[8]。然而,SDT的治疗效率受限于肿瘤微环境,尤其是乏氧问题。因此,单一的SDT往往无法达到预期的治疗效果,急需开发一种基于SDT的协同治疗模式用于肿瘤的高效治疗[7, 9]。传统的有机声敏剂的水溶性有限、化学稳定性低、光毒性大,限制了它们在癌症治疗中的应用[18]。无机声敏剂成为近年来的研究热点,已有相关文献报道二氧化钛可作为声敏剂进行声动力治疗,其产生ROS机制可能是超声辐照能够使钛元素发生电子跃迁,产生电子空穴(H+ -e-),进一步将周围的水和氧气转换为ROS[27]。在探究IrOX的声动力效果时,发现IrOX产生活性氧,我们推测IrOX作为无机声敏剂产生ROS的机制与二氧化钛相似,可能是由于超声空化效应产生的局部能量可以使IrOX发生电子跃迁,产生电子空穴,与水和氧气发生作用从而产生单线态氧[23, 28-29]。
本研究以IrOX作为一种无机声敏剂,并复合DOX形成一种纳米载药复合物IrOX@DOX用于肿瘤SDT-化疗协同治疗。超声不仅可以增强细胞对纳米颗粒的摄取,而且可以促进DOX在胞内释放。这可能是由于超声刺激产生的空化效应可以提高细胞膜的通透性, 从而促进了肿瘤细胞对纳米颗粒的摄取[30]。IrOX@DOX具有pH和超声双重响应药物释放行为,同时可以实现声动力疗法协同化疗高效杀死肿瘤细胞。一方面,超声刺激IrOX生成ROS,实现声动力治疗;另一方面,超声促进了纳米药物的吞噬,一定程度上降低了化疗药物的用量,起到协同治疗的效果。本研究在细胞层面上采用CCK-8、Calcein AM和PI双染色及流式凋亡检测结果表明IrOX@DOX可在US辐照下产生活性氧,结合DOX化疗,验证了其良好的协同治疗效果。需要指出的是,本研究还存在一定的不足,如未进行深入的机制探究,未进行详细的体内研究,同时IrOX@DOX的肿瘤富集与体内生物安全性需进一步验证。
综上所述,本研究成功制备的IrOX@DOX的纳米载药体系,实现了pH及超声控制释药,可实现声动力与化疗联合的协同治疗。本研究拓展IrOX作为声敏剂在SDT中应用,同时也为构建新型肿瘤协同治疗纳米系统提供了一种新思路与新方法。
| [1] |
SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. |
| [2] |
MILLER K D, SIEGEL R L, LIN C C, et al. Cancer treatment and survivorship statistics, 2016[J]. CA Cancer J Clin, 2016, 66(4): 271-289. |
| [3] |
KONG F H, YE Q F, MIAO X Y, et al. Current status of sorafenib nanoparticle delivery systems in the treatment of hepatocellular carcinoma[J]. Theranostics, 2021, 11(11): 5464-5490. |
| [4] |
HU H, FENG W, QIAN X Q, et al. Emerging nanomedicine-enabled/enhanced nanodynamic therapies beyond traditional photodynamics[J]. Adv Mater, 2021, 33(12): e2005062. |
| [5] |
REN Z G, SUN S C, SUN R R, et al. A metal-polyphenol-coordinated nanomedicine for synergistic cascade cancer chemotherapy and chemodynamic therapy[J]. Adv Mater, 2020, 32(6): e1906024. |
| [6] |
ZHAO N X, ZENG Z H, ZU Y L. Self-assembled aptamer-nanomedicine for targeted chemotherapy and gene therapy[J]. Small, 2018, 14(4): 1702103. |
| [7] |
QIAN X Q, ZHENG Y Y, CHEN Y. Micro/nanoparticle-augmented sonodynamic therapy (SDT): breaking the depth shallow of photoactivation[J]. Adv Mater, 2016, 28(37): 8097-8129. |
| [8] |
PAN X T, WANG H Y, WANG S H, et al. Sonodynamic therapy (SDT): a novel strategy for cancer nanotheranostics[J]. Sci China Life Sci, 2018, 61(4): 415-426. |
| [9] |
MA A Q, CHEN H Q, CUI Y H, et al. Metalloporphyrin complex-based nanosonosensitizers for deep-tissue tumor theranostics by noninvasive sonodynamic therapy[J]. Small, 2019, 15(5): e1804028. |
| [10] |
SON S, KIM J H, WANG X W, et al. Multifunctional sonosensitizers in sonodynamic cancer therapy[J]. Chem Soc Rev, 2020, 49(11): 3244-3261. |
| [11] |
LEI B, CHEN M, WANG Y, et al. Double security drug delivery system DDS constructed by multi-responsive (pH/redox/US) microgel[J]. Colloids Surf B Biointerfaces, 2020, 193: 111022. |
| [12] |
KARIMI M, GHASEMI A, SAHANDI ZANGABAD P, et al. Smart micro/nanoparticles in stimulus-responsive drug/gene delivery systems[J]. Chem Soc Rev, 2016, 45(5): 1457-1501. |
| [13] |
MENG Z Q, ZHOU X F, SHE J L, et al. Ultrasound-responsive conversion of microbubbles to nanoparticles to enable background-free in vivo photoacoustic imaging[J]. Nano Lett, 2019, 19(11): 8109-8117. |
| [14] |
QIAN X Q, HAN X X, CHEN Y. Insights into the unique functionality of inorganic micro/nanoparticles for versatile ultrasound theranostics[J]. Biomaterials, 2017, 142: 13-30. |
| [15] |
YANG S W, WANG X L, HE P, et al. Graphene quantum dots with pyrrole N and pyridine N: superior reactive oxygen species generation efficiency for metal-free sonodynamic tumor therapy[J]. Small, 2021, 17(10): e2004867. |
| [16] |
OSMINKINA L A, NIKOLAEV A L, SVIRIDOV A P, et al. Porous silicon nanoparticles as efficient sensitizers for sonodynamic therapy of cancer[J]. Micropor Mesopor Mater, 2015, 210: 169-175. |
| [17] |
ZHAO Y, ZHU Y C. Synergistic cytotoxicity of low-energy ultrasound and innovative mesoporous silica-based sensitive nanoagents[J]. J Mater Sci, 2014, 49(10): 3665-3673. |
| [18] |
BAI S, YANG N, WANG X, et al. Ultrasmall iron-doped titanium oxide nanodots for enhanced sonodynamic and chemodynamic cancer therapy[J]. ACS Nano, 2020, 14(11): 15119-15130. |
| [19] |
WU J R, WILLIAMS G R, NIU S W, et al. Biomineralized bimetallic oxide nanotheranostics for multimodal imaging-guided combination therapy[J]. Theranostics, 2020, 10(2): 841-855. |
| [20] |
ZHEN W Y, LIU Y, LIN L, et al. BSA-IrO2: catalase-like nanoparticles with high photothermal conversion efficiency and a high X-ray absorption coefficient for anti-inflammation and antitumor theranostics[J]. Angew Chem Int Ed, 2018, 57(32): 10309-10313. |
| [21] |
WU J R, NIU S W, BREMNER D H, et al. A tumor microenvironment-responsive biodegradable mesoporous nanosystem for anti-inflammation and cancer theranostics[J]. Adv Healthc Mater, 2020, 9(2): e1901307. |
| [22] |
LI Q L, LIU D L, XU L, et al. Wire-in-tube IrOx architectures: alternative label-free immunosensor for amperometric immunoassay toward α-fetoprotein[J]. ACS Appl Mater Interfaces, 2015, 7(40): 22719-22726. |
| [23] |
ZHEN W Y, LIU Y, ZHANG M C, et al. Multi-caged IrO x for facile preparation of "six-in-one" nanoagent for subcutaneous and lymphatic tumors inhibition against recurrence and metastasis[J]. Adv Funct Mater, 2020, 30(24): 2002274. |
| [24] |
ZHEN W Y, LIU Y, WANG W, et al. Specific "unlocking" of a nanozyme-based butterfly effect to break the evolutionary fitness of chaotic tumors[J]. Angew Chem Int Ed, 2020, 59(24): 9491-9497. |
| [25] |
郭丹, 汪星月, 谭米肖, 等. 声敏型脂质纳米粒联合低功率聚焦超声对HepG2细胞增殖的影响及其体外CT成像的实验研究[J]. 第三军医大学学报, 2018, 40(23): 2180-2189. GUO D, WANG X Y, TAN M X, et al. Effect of sound sensitive nano-liposomes combined with low intensity focused ultrasound on proliferation of HepG2 cells and its CT imaging in vitro[J]. J Third Mil Med Univ, 2018, 40(23): 2180-2189. |
| [26] |
李倩茹, 郝兰, 王艺睿, 等. 基于DVDMS/IR780复合纳米粒抗肿瘤声动力实验研究[J]. 第三军医大学学报, 2021, 43(7): 606-613. LI Q R, HAO L, WANG Y R, et al. Preparation of sinoporphyrin sodium and IR780-based composite nanoparticles and its anti-tumor efficacy in sonodynamic therapy[J]. J Third Mil Med Univ, 2021, 43(7): 606-613. |
| [27] |
WANG X W, ZHONG X Y, BAI L X, et al. Ultrafine titanium monoxide (TiO1+x) nanorods for enhanced sonodynamic therapy[J]. J Am Chem Soc, 2020, 142(14): 6527-6537. |
| [28] |
CHEN H J, ZHOU X B, GAO Y, et al. Recent progress in development of new sonosensitizers for sonodynamic cancer therapy[J]. Drug Discov Today, 2014, 19(4): 502-509. |
| [29] |
COSTLEY D, MC EWAN C, FOWLEY C, et al. Treating cancer with sonodynamic therapy: a review[J]. Int J Hyperther, 2015, 31(2): 107-117. |
| [30] |
GEERS B, LENTACKER I, SANDERS N N, et al. Self-assembled liposome-loaded microbubbles: The missing link for safe and efficient ultrasound triggered drug-delivery[J]. J Control Release, 2011, 152(2): 249-256. |




