2. 750004 银川,宁夏医科大学总医院医学实验中心
2. Medical Laboratory Center, General Hospital of Ningxia Medical University, Yinchuan, Ningxia Hui Autonomous Region, 750004, China
急性髓系白血病(acute myeloid leukemia,AML)是一类髓系造血干祖细胞的恶性克隆性疾病,发病时骨髓中异常的原始细胞及幼稚细胞大量增殖并抑制正常造血,可广泛浸润肝、脾、淋巴结等各种脏器,表现为贫血、出血、感染和浸润等征象[1]。混合谱系白血病基因(mixed lineage leukemia,MLL)定位于11号染色体的长臂2区3带(11q23),11q23位点常见异常有断裂、易位、融合、重复、缺失等[2-3]。伴MLL基因重排的白血病具有恶性程度高、不易缓解、容易复发、预后差的临床特征[2]。微小RNA(microRNAs,miRNAs)是一类长度约为18~25个核苷酸,具有在转录后水平调控基因表达功能的内源性非编码RNA,是表观遗传学中的重要一员[1]。近年来,许多研究发现miRNAs在正常组织和肿瘤组织间表达存在差异,这些差异表达的miRNAs与AML的发生发展有着密切的联系[4-5]。
miRNA-495是位于人类染色体14q32.31位点上的一个非编码RNA分子,已有研究发现miRNA-495是胚胎发育和肿瘤发生发展的重要调控因子之一,主要参与调控间充质干细胞分化及多种肿瘤的増殖、迁移、侵袭等生物学行为[6-10]。本研究希望通过研究miRNA-495从而探究MLL基因重排的AML发生发展。因此,本研究通过检测miRNA-495在不同骨髓样本中的表达,从而探究miRNA-495对MLL基因重排的AML中的发生发展作用的机制。为AML未来的靶向治疗提供依据。
1 材料与方法 1.1 研究对象 1.1.1 样本来源2017年8月至2019年5月于我院确诊为急性白血病的患者275例,所有患者均经过骨髓常规、免疫分型、融合基因和染色体等分型确诊。经过多重巢式PCR检测筛选后,其中有10例MLL-AF9融合基因阳性AML患者(男性6例,女性4例),年龄(39.37±2.71)岁; 10例急性髓系白血病患者(男性5例,女性5例),年龄(41.12±1.92)岁。NC组病例来源:同时间段于我院外科就诊患者10例(男性6例,女性4例),年龄(42.31±3.21)岁。本研究经宁夏医科大学总医院伦理委员会批准(批件号:2019-491),符合赫尔辛基宣言,所有样本和信息经受试者同意采集,并签署知情同意书。
1.1.2 实验材料来源RPMI-1640培养基购自美国Life Technologies公司。所有引物由上海生工生物技术有限公司设计合成。反转录病毒MSCV-PIG/-miR495载体和pMSCVneo/-STYX载体均由云周生物科技(广州)有限公司提供。所有抗体购自美国Abcam公司。实验所用载体和SYBR荧光定量试剂盒购自日本TaKaRa公司。cDNA Synthesis Kit购自Thermo Fisher公司。荧光素酶报告基因检测试剂盒购自美国Promega公司。AnnexinVFITC细胞凋亡检测试剂盒为南京凯基生物科技发展有限公司产品。CCK-8为日本同仁化学研究所产品。荧光定量PCR仪(Quant Studio 7 Flex)购自美国Applied Biosystems公司。酶标仪购自美国Bio-Rad公司。流式细胞仪(分析型COULTER-XL.MCL)购自美国贝克曼库尔特有限公司。
1.2 方法 1.2.1 细胞培养AML细胞系人单核细胞白血病细胞THP-1(含有MLL-AF9融合基因)培养于含10%血清+1%双抗青霉素/链霉素的RPMI-1640培养基,置于37 ℃、5%CO2培养箱中培养。
1.2.2 细胞分组转染根据THP-1细胞的转染情况分为Control组、miRNA-495组、丝氨酸/苏氨酸/酪氨酸相互作用蛋白(Serine/threonine/tyrosine interacting protein,STYX)组、miRNA-495+STYX组。Control组:将反转录病毒MSCV-PIG载体和pMSCVneo载体,共转染到THP-1细胞中。miRNA-495组:将反转录病毒MSCV-PIG-miRNA-495载体和pMSCVneo载体,共转染到THP-1细胞中。STYX组:将反转录病毒MSCV-PIG载体和pMSCVneo -STYX载体,共转染到THP-1细胞中。miRNA-495+STYX组:将反转录病毒MSCV-PIG-miRNA-495载体和pMSCVneo -STYX载体,共转染到THP-1细胞中。
1.2.3 CCK-8检测细胞增殖将各组细胞制成浓度为1×109/L的细胞悬液,以每孔100 μL在96孔板上进行接种,每组做3个重复,并于培养箱中常规培养。每孔加入10 μL CCK-8溶液,充分混匀后,培养4 h,使用酶标仪进行检测,测定450 nm吸光度D(450)值。
1.2.4 靶基因预测及双荧光素酶报告实验验证MiRNA靶点预测数据库TargetScan( www.targetscan.org )鉴定miRNA-495与靶向结合位点。构建野生型质粒(WT)和突变型质粒(MUT),将质粒与载体共转染至THP-1细胞,培养48 h。测定细胞荧光素酶活性,海肾荧光素酶的荧光值作为内参,按照双荧光素酶报告基因检测试剂盒说明书进行操作。
1.2.5 荧光实时定量PCR(quantitative real-time PCR,RT-qPCR)首先用Trizol试剂提取总RNA,随后用试剂盒,将总RNA反转录为cDNA。反应条件:25 ℃,5 min;42 ℃,60 min;85 ℃,5 min。-20 ℃保存。反应体系(20 μL):ddH2O,6 μL;10 mmol/L dNTP mix,2 μL;RT primer,1 μL;RNase inhibitor,1 μL;M-MuLV Reverse Transcriotase,1 μL;总RNA,5 μL。将获得的cDNA作为模板,采用SYBR荧光定量试剂盒荧光定量PCR仪(Quant Studio 7 Flex)进行扩增。反应体系(10 μL):RNase Free ddH2O,2 μL;SYBR Green,5 μL;上游引物,1 μL;下游引物,1 μL;cDNA模板,1 μL。反应条件(40个循环):95 ℃,5 min;95 ℃,10 s;60 ℃,30 s;72℃,40 s。U6作为miRNA的内参,GAPDH基因为其他基因的内参。每个样本所得的Ct值以相对表达量2-△Ct表示(△Ct=目的基因Ct-内参基因Ct)。实验组对于对照组的相对表达量采用2-△△Ct 法。引物序列见表 1。
| 基因 | 引物序列(5’→3’) |
| miRNA-495 | 上游:AAACAAACATGGTGCA |
| 下游:GAGCAGGCTGGAGAA | |
| Ki-67 | 上游:CGGCATTGACCATGAGC |
| 下游:TTAGGCATGAACTGAGT | |
| PCNA | 上游:AAGCCGAAACCAGCTAGACTTTC |
| 下游:TGGCGGAGTGGCAACAA | |
| Bcl-2 | 上游:AACATCGCCCTGTGGATGAC |
| 下游:GACTTCACTTGTGGCCCAGAT | |
| Bax | 上游:TCGGGAGATGCTCATTGGAC |
| 下游:GACTCAGATGCCGAAGTGTG | |
| Caspase-3 | 上游:GGAACCATCATACATGGAAGCG |
| 下游:TCACCATGGCTCAGAAGCAC | |
| STYX | 上游:TGCTATGAAAAGCAAGCTACCTG |
| 下游:CCCATTTGTAAGCTCCCATCAA | |
| U6 | 上游:CTCGCTTCGGCAGCACA |
| 下游:AACGCTTCACGAATTTGCGT | |
| GAPDH | 上游:ACGGATTTGGTCGTATTGGGCG |
| 下游:CTCCTGGAAGATGGTGATGG |
1.2.6 免疫印迹试验(Western blot)
将收集的细胞加入RIPA裂解液,13 518×g离心10 min,提取总蛋白。用聚丙烯酰胺凝胶电泳分离蛋白,电转移法至PVDF膜上。使用5%脱脂奶粉封闭2 h,加入特异性一抗4 ℃过夜。第2天,加入二抗室温下孵育1 h。用化学发光成像系统成像分析。β-actin是内参。
1.3 统计学方法每组实验均独立重复3次,采用SPSS 13.0软件进行统计分析,使用graphPad prism软件绘制图像。计量资料以x±s表示,MLL-AF9与NC病例组织之间、miRNA-495与Control组之间、STYX与Control组之间、miRNA-495+STYX与miRNA-495组之间都采用t检验,P < 0.05表示差异具有统计学意义。
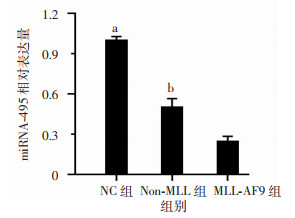
2 结果 2.1 miRNA-495在MLL-AF9的AML患者中表达下调RT-qPCR检测miRNA-495在骨髓样本中的表达结果如图 1所示,相较于正常和非MLL重排患者,miRNA-495在MLL-AF9基因重排患者中表达明显下调(相对表达量Non-MLL组为0.50±0.14,MLL-AF9组为0.25±0.08,NC vs MLL-AF9 95%CI:-0.86~-0.65,P < 0.001;Non-MLL vs MLL-AF9 95% CI:-0.43~-0.08,P < 0.01)。基于以上结果,推测miRNA-495可能与急性骨髓白血病的发生发展有关。
|
| a:P < 0.001,b:P < 0.01,与MLL-AF9组比较 图 1 RT-qPCR检测miRNA-495在不同骨髓样本中的表达 (n=10x±s) |
2.2 miRNA-495可以抑制THP-1细胞增殖
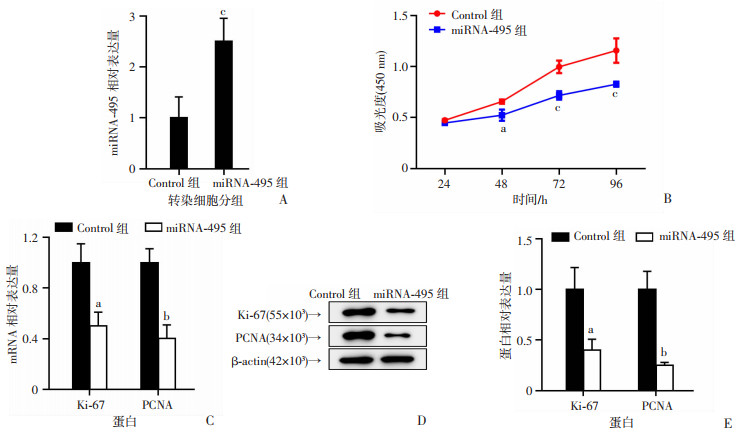
通过RT-qPCR检测各转染THP-1细胞中miRNA-495的表达结果显示,转染miRNA-495的THP-1细胞miRNA-495表达明显高于Control组(P < 0.001,图 2A)。CCK-8法检测THP-1细胞的增殖情况结果显示:转染24 h后,转染miRNA-495的THP-1细胞增殖水平明显低于Control组(P < 0.001,图 2B)。研究还检测了增殖相关因子Ki-67和PCNA的表达水平,RT-qPCR结果显示miRNA-495组的细胞增殖相关因子表达均显著低于Control组(P < 0.01),Western blot实验显示出相似结果(P < 0.05,P < 0.01,图 2C~E)。基于以上结果,推测miRNA-495可以通过抑制增殖相关因子的表达,从而抑制THP-1细胞增殖。
|
| A:RT-qPCR检测转染后THP-1细胞miRNA-495的表达;B:CCK-8检测转染各组THP-1细胞增殖情况;C:RT-qPCR检测各组THP-1细胞增殖相关因子Ki-67、PCNA的mRNA表达;D、E:Western blot检测各组THP-1细胞增殖相关因子Ki-67、PCNA的蛋白表达与定量分析 a:P < 0.05,b:P < 0.01,c:P < 0.001,与Control组比较 图 2 miRNA-495抑制THP-1细胞增殖 (n=3x±s) |
2.3 miRNA-495可以诱导THP-1细胞的凋亡
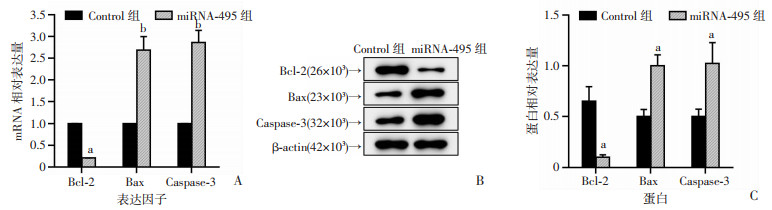
为确定miRNA-495是否是通过诱导细胞凋亡而抑制细胞增殖,采用流式细胞术检测了各组细胞的凋亡情况。结果如图 3A所示,miRNA-495组的THP-1细胞凋亡率高于Control组。研究同时检测了凋亡相关因子Bcl-2、Bax和Caspase-3的表达,RT-qPCR结果显示miRNA-495组中Bax和Caspase-3的表达显著高于Control组,而Bcl-2则呈现显著低表达(P < 0.05,P < 0.001,图 3A)。Western blot实验也有相似结果(P < 0.05,图 3C)。
|
| A:RT-qPCR检测各组THP-1细胞凋亡相关因子Bcl-2、Bax、Caspase-3的mRNA表达;B、C:Western blot检测各组THP-1细胞凋亡相关因子Bcl-2、Bax、Caspase-3的蛋白表达 a:P < 0.05,b:P < 0.001,与Control组比较 图 3 miRNA-495诱导THP-1细胞的凋亡 (n=3x±s) |
2.4 miRNA-495靶向结合STYX
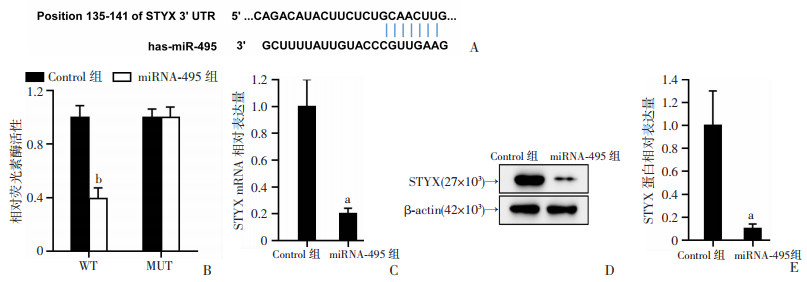
采用TargetScan检测miRNA-495靶向结合STYX基因,并通过双荧光素酶报告基因实验验证了这一结果(P < 0.001,图 4A、B)。通过RT-qPCR和Western blot检测了STYX在各组细胞中的转录和翻译水平,发现miRNA-495组中STYX基因表达下调(P < 0.01,图 4C),在Western blot实验也呈现相同的结果(P < 0.01,图 4D)。因此,miRNA-495靶向结合STYX基因,并且呈现负调控。
|
| A:TargetScan数据库预测miRNA-495靶向结合STYX;B:双荧光素酶报告实验验证miRNA-495靶向结合STYX;C:RT-qPCR检测各组THP-1细胞中STYX的mRNA表达;D、E:Western blot检测各组THP-1细胞中STYX的蛋白表达 a:P < 0.01,b:P < 0.001,与Control组比较 图 4 miRNA-495靶向结合STYX (n=3,x±s) |
2.5 STYX过表达可以逆转miRNA-495对THP-1细胞增殖和凋亡的影响
为了进一步确定STYX基因的作用,检测各组细胞中STYX的蛋白表达。结果显示:miRNA-495组相较于Control组miRNA-495表达下调,而STYX组则相反,相较于STYX组,miRNA-495+STYX组表达下调(P < 0.05,P < 0.001,图 5A)。RT-qPCR和Western blot实验检测了各组增殖相关因子Ki-67和PCNA在转录和翻译水平的表达,结果显示,miRNA-495+STYX组中增殖相关因子的表达均高于miRNA-495组(P < 0.05,P < 0.01,P < 0.001,图 5B、C)。检测各组的凋亡相关因子Bcl-2、Bax和Caspase-3的转录和翻译水平表达,结果显示:miRNA-495+STYX组Bax和Caspase-3的表达均低于对照组,而Bcl-2则明显高于miRNA-495组(P < 0.05,P < 0.01,P < 0.001,图 5D、E)。以上结果提示STYX逆转了miRNA-495对THP-1细胞增殖和凋亡的作用。
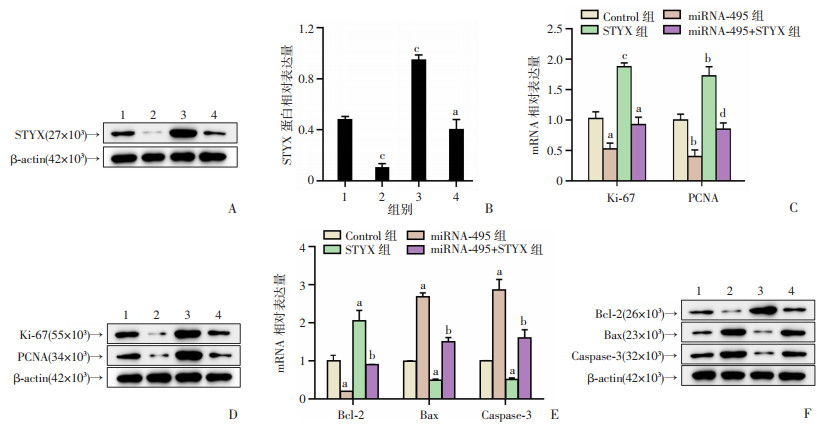
|
|
1: Control组;2:miR-495组;3:STYX组;4: miRNA-495+PBX3组
A、B:Western blot检测各组THP-1细胞中STYX的蛋白表达a:P < 0.05,与miRNA-495组比较;c:P < 0.001,与Control组比较; C:RT-qPCR检测细胞增殖相关因子Ki-67和PCNA的mRNA表达a:P < 0.05,b:P < 0.01, c:P < 0.001,与Control组比较; d:P < 0.05,与miRNA-495组比较;D:Western blot检测细胞增殖相关因子Ki-67和PCNA的蛋白表达;E:RT-qPCR检测细胞凋亡相关因子Bcl-2、Bax和Caspase-3的mRNA表达a:P < 0.05, c:P < 0.001,与Control组比较; b:P < 0.01, 与miRNA-495组比较; F:Western blot检测细胞凋亡相关因子Bcl-2、Bax和Caspase-3的蛋白表达 图 5 过表达STYX可以逆转miRNA-495对THP-1细胞增殖和凋亡的影响 (n=3,x±s) |
3 讨论
AML是成人最常见的血液系统恶性肿瘤之一,在恶性肿瘤所致的死亡率中居于前十[1]。然而,AML的病因及发病机制十分复杂,至今尚不清楚。AML在临床表现、免疫分型、细胞形态学、分子生物学、细胞遗传学等各个方面都具有高度的异质性[1]。
3.1 miRNA-495在MLL-AF9的AML患者中的抑癌作用miRNAs是一类广泛存在于真核细胞中的一种重要的调控因子,其通过与靶基因mRNA特异性的结合而导致靶mRNA降解或抑制其翻译,在转录后调控基因的表达,广泛参与个体发育、细胞分化、增殖、凋亡、衰老、应激等生物学过程[11]。研究发现,miRNA-495在多种肿瘤中可作为一种抑癌基因或者原癌基因发挥作用,如非小细胞肺癌、恶性胶质瘤、胃癌和白血病、乳腺癌等[12]。然而,miRNA-495在MLL基因重排的AML中却很少有研究。本研究通过检测miRNA-495在不同骨髓样本中的表达,发现相较于正常组和非MLL基因重排患者,miRNA-495在MLL基因重排的AML中有着显著的表达下调。这一结果也与miRNA-495在肾细胞癌中的表达结果相似[12]。白血病常被人称作血癌,miRNA-495在癌症中可作为抑癌基因,而在MLL基因重排的AML中也呈现下调,这或许与它作为抑癌基因发挥作用有关。
3.2 miRNA-495过表达可以抑制THP-1细胞增殖并诱导细胞凋亡现有文献表明,超过半数的急性髓系白血病存在细胞遗传学的异常,多表现为克隆性染色数量、结构或二者兼有的异常以及一些能够调控细胞增殖、分化、凋亡等功能的基因异常[13]。miRNA-495可以通过下调PCNA从而抑制人血管内皮细胞增殖[14]。但是在对LPS刺激的人牙周膜细胞(human periodontal ligament cells, hPDLC)的增殖研究中发现,过表达miRNA-495-3p可显著促进hPDLC细胞的增殖[15]。在本研究中,通过CCK-8检测各转染细胞THP-1细胞增殖情况,并检测了细胞增殖相关因子Ki-67和PCNA的转录和翻译水平的表达。结果发现,转染miRNA-495的THP-1细胞的增殖低于对照组,并且细胞增殖相关因子均表达下调。因此,本研究推断miRNA-495的过表达会抑制THP-1细胞的增殖。随后,本研究还检测了miRNA-495对THP-1细胞凋亡的影响,结果发现,转染miRNA-495的THP-1细胞中细胞凋亡相关因子转录和翻译表达均增加。因此,推断miRNA-495过表达可以诱导THP-1细胞凋亡。根据细胞增殖和细胞凋亡的结果,推测miRNA-495有可能是通过诱导细胞凋亡,从而抑制细胞的增殖。有研究展现了相反的结果,miRNA-495可以抑制高糖诱导的视神经节细胞凋亡。miRNA-495不但可以调节癌细胞的增殖和凋亡,而且可以在THP-1细胞中发挥同样作用。基于上述证据,提示miRNA-495过表达可以抑制THP-1细胞的增殖并诱导细胞凋亡。
3.3 miRNA-495靶向结合STYX调控THP-1细胞的增殖凋亡根据前文中提到的miRNAs通过作用于靶基因从而参与细胞增殖和凋亡等过程。本研究通过检测发现,miRNA-495靶向结合STYX基因。丝氨酸/苏氨酸/酪氨酸相互作用蛋白(STYX)是蛋白酪氨酸磷酸酶(PTPs)家族的一个蛋白[16]。STYX过表达可以促进结直肠癌(CRC)细胞增殖,并抑制CRC细胞凋亡[17]。还有研究表明STYX通过结合F-box和WD40域蛋白7(FBXW7,也叫hCDC4,Fbw7)蛋白来抑制结乳腺癌的细胞凋亡[18]。大多数研究都证明STYX是一个潜在的致癌基因。本研究结果发现STYX的表达会促进细胞增殖相关因子的表达,同时还会减弱促细胞凋亡相关因子表达,增加抑制细胞凋亡因子的表达。STYX的表达引起的结果,与miRNA-495表达引起的结果完全相反。而在此之前并没有任何研究提示STYX MLL基因重排之间存在关联。基于STYX基因是miRNA-495的靶向结合基因,推测STYX的表达会促进细胞增殖,抑制细胞凋亡,而miRNA-495则与之作用相反。当miRNA-495和STYX同时表达时,STYX可以逆转miRNA-495对THP-1细胞增殖和凋亡的作用。基于上述证据,推测STYX可能是THP-1细胞中引起病变的关键基因,而miRNA-495可作为重要的调控因子,以抑制其表达。
综上所述,miRNA-495可以通过靶向沉默STYX,从而抑制THP-细胞增殖并诱导细胞凋亡,为以miRNA-495为靶点开发新药,对MLL基因重排的AML的治疗具有良好的应用前景。
| [1] |
颜金花. miR-217在急性髓系白血病中的临床意义及其机制研究[D]. 南昌: 南昌大学, 2019. YAN J H. Clinical significance and mechanism of miR-217 in acute myeloid leukemia[D]. Nanchang: Nanchang University, 2019. |
| [2] |
刘之茵, 张苏江, 陈玉宝, 等. MLL基因重排在急性白血病亚型分布及疗效分析[J]. 临床血液学杂志, 2021, 34(3): 177-181. LIU Z Y, ZHANG S J, CHEN Y B, et al. Distribution and efficacy of MLL gene rearrangement in acute leukemia subtypes[J]. J Clin Hematol, 2021, 34(3): 177-181. |
| [3] |
李昱瑛. MLL重排白血病人源化小鼠模型的建立及系别转换的研究[D]. 长春: 吉林大学, 2017. LI Y Y. Establishment of humanized mouse model of MLL rearranged leukemias and lineage switch determination[D]. Changchun: Jilin University, 2017. |
| [4] |
余梦霞. miR-320c在急性髓系白血病中的临床意义及其机制研究[D]. 杭州: 浙江大学, 2017. YU M X. The clinical significance and mechanism of miR-320c in acute myeloid leukemia[D]. Hangzhou: Zhejiang University, 2017. |
| [5] |
胡超. miR-550-1在急性髓系白血病中的抑癌作用及其机制研究[D]. 杭州: 浙江大学, 2016. HU C. The anti-tumor function and mechanism of miR-550-1 in acute myeloid leukemia[D]. Hangzhou: Zhejiang University, 2016. |
| [6] |
CHU H Y, CHEN X D, WANG H Q, et al. MiRNA-495 regulates proliferation and migration in NSCLC by targeting MTA3[J]. Tumor Biol, 2014, 35(4): 3487-3494. |
| [7] |
NIE S, LI K Q, HUANG Y, et al. MiRNA-495 mediates metabolic shift in glioma cells via targeting Glut1[J]. J Craniofacial Surg, 2015, 26(2): e155-e158. |
| [8] |
HWANG-VERSLUES W W, CHANG P H, WEI P C, et al. MiRNA-495 is upregulated by E12/E47 in breast cancer stem cells, and promotes oncogenesis and hypoxia resistance via downregulation of E-cadherin and REDD1[J]. Oncogene, 2011, 30(21): 2463-2474. |
| [9] |
LI Z, ZHANG G, LI D, et al. Methylation-associated silencing of miRNA-495 inhibit the migration and invasion of human gastric cancer cells by directly targeting PRL-3[J]. Biochem Biophys Res Commun, 2015, 456(1): 344-350. |
| [10] |
叶敏婷. miRNA-495调控TSPAN12在小细胞肺癌耐药和增殖中的作用研究[D]. 广州: 南方医科大学, 2015. YE M T. Investigation of role for TSPAN12 in chemoresistance and proliferation of SCLC under regulation of miRNA-495[D]. Guangzhou: Southern Medical University, 2015. |
| [11] |
王娜. MiR-34b在儿童急性白血病中的表达、甲基化调控及临床意义的研究[D]. 苏州: 苏州大学, 2013. WANG N. The expression, methylated regulation and clinical significances of miR-34b in pediatric acute leukemia[D]. Suzhou: Soochow University, 2013. |
| [12] |
吕蔡. miRNA-495靶向SATB1基因对肾细胞癌调控作用的研究[D]. 武汉: 武汉大学, 2015. LYU C. MicroRNA-495 suppresses human renal cell carcinoma malignancy by targeting SATB1[D]. Wuhan: Wuhan University, 2015. |
| [13] |
刘静. MLL-AF6、MLL-AF9及MLL-AF10与急性髓系白血病的临床研究[D]. 合肥: 安徽医科大学, 2015. LIU J. The clinical study of MLL-AF6, MLL-AF9 and MLL-AF10 In acute myeloid leukemia[D]. Hefei: Anhui Medical University, 2015. |
| [14] |
郑华峰, 陶晶, 张斌, 等. miRNA-495通过下调PCNA抑制人血管内皮细胞增殖的作用研究[J]. 中国心血管病研究, 2016, 14(4): 374-379. ZHENG H F, TAO J, ZHANG B, et al. MiRNA-495 inhibits human vascular endothelial cells proliferation by down-regulating PCNA[J]. Chin J Cardiouasc Res, 2016, 14(004): 374-379. |
| [15] |
张帆, 余国玺, 王力锋. miRNA-495-3p对LPS刺激人牙周膜细胞增殖及炎性因子表达的影响[J]. 口腔生物医学, 2017, 8(2): 86-89. ZHANG F, YU G X, WANG L F. Effect of miRNA-495-3p onthe proliferation of hPDLC and the production of inflammatory cytokines induced by LPS[J]. Oral Biomed, 2017, 8(2): 86-89. |
| [16] |
TOMAR V S, BARAL T K, NAGAVELU K, et al. Serine/threonine/tyrosine-interacting-like protein 1 (STYXL1), a pseudo phosphatase, promotes oncogenesis in glioma[J]. Biochem Biophys Res Commun, 2019, 515(1): 241-247. |
| [17] |
HE D, MA Z, FANG C, et al. Pseudophosphatase STYX promotes tumor growth and metastasis by inhibiting FBXW7 function in colorectal cancer[J]. Cancer Lett, 2019, 454: 53-65. |
| [18] |
REITERER V, FIGUERAS-PUIG C, LE GUERROUE F, et al. The pseudophosphatase STYX targets the F-box of FBXW7 and inhibits SCFFBXW7 function[J]. EMBO J, 2017, 36(3): 260-273. |




