肝癌在全世界范围内被列为第六大常见癌症(发病率4.7%)和第四大癌症病死原因(病死率8.2%),每年有约841 000例新增、782 000例死亡病例。肝细胞癌(hepatocellular carcinoma,HCC)是最常见的原发性肝脏恶性肿瘤(75%~85%)[1]。绝大多数肝癌患者诊断时已经处于进展期,治疗手段有限,预后不佳[2-3]。直到有研究证实索拉菲尼可以有效提高晚期肝癌患者的中位生存期,并被批准为晚期肝癌的一线治疗用药,才给晚期肝癌患者的治疗带来一线希望[4-5]。但是耐药性的出现导致索拉菲尼的治疗获益非常有限[6]。解决这一问题迫切需要进一步探究索拉非尼的耐药机制,延缓或者逆转耐药性的产生,从而改善索拉菲尼的患者受益。
microRNA(miRNA)是19~25个核苷酸的短RNA分子,可调节靶基因的转录后沉默。单个miRNA可以靶向数百个mRNA,影响细胞内大量信号通路的基因表达,从而直接或间接地调控细胞周期、凋亡、衰老和迁移等许多细胞过程,在很多疾病的发生发展中起着重要作用[7]。近年来,许多研究表明miRNA通过靶向与耐药性有关的基因或与细胞增殖、细胞周期和细胞凋亡有关的基因影响肿瘤细胞的耐药性[8]。miRNA-200b是miRNA-200家族的成员之一,目前研究表明它是上皮细胞的一个标志,是上皮间质转变中一个基础调节因子[9-10],但其在不同肿瘤细胞中可能存在相反的作用[11]。miRNA-200b参与改善乳腺癌、卵巢癌、结肠癌等化疗耐药已有诸多报道[12-14],但其是否参与肝癌的索拉菲尼耐药目前并不清楚。本研究旨在探究miRNA-200b对肝癌索拉菲尼耐药的影响,以期延缓或改善晚期肝癌患者对索拉菲尼的耐药,增加索拉菲尼的疗效。
1 材料与方法 1.1 材料与试剂肝细胞癌HepG2细胞系购自美国ATCC细胞库,DMEM培养基及胎牛血清购自美国GIBICO公司,索拉菲尼购自SIGMA公司,CCK试剂盒购自日本同仁化学公司,miRNA-200b mimics购自锐博生物,lipofectamine-2000转染试剂购自赛默飞公司,凋亡检测试剂盒购自美国BD公司,E-cadherin、N-cadherin、Vimentin抗体购自武汉三鹰公司,BCA蛋白定量试剂盒、GAPDH抗体购上海碧云天公司,山羊抗鼠和山羊抗兔二抗购自中杉金桥公司。
1.2 索拉菲尼耐药肝癌细胞系的建立人肝癌HepG2细胞在含10%胎牛血清(FBS)的DMEM完全培养基中培养。首先将HepG2细胞在0.01 μmol/L索拉非尼中培养至细胞耐受,然后逐渐提高培养基中的索拉菲尼浓度(依次为0.03、0.05、0.1、0.2、0.5、1.0、1.5、2.0、3.0和5.0 μmol/L),每个浓度均培养至存活细胞在培养皿中融合度达到70%以上。所有细胞均培养在37 ℃、含5% CO2的恒温培养箱中。
1.3 RT-PCR检测细胞中miRNA-200b的表达水平收集已经处理好的细胞,TRIzol法提取各组细胞总RNA;取5 ng去除基因组DNA反转录为cDNA,三步法进行RT-PCR,反应体系为:蒸馏水6 μL,SYBR Green Realtime PCR Master Mix 10 μL,上游引物(10 μmol/L)1 μL,下游引物(10 μmol/L)1 μL,反转录样品2 μL。反应条件:95 ℃变性5 min,然后95 ℃ 15 s,60 ℃ 15 s,72 ℃ 10 s,40个循环。每个样品设置3个复孔,反应结束后miRNA-200b表达水平采用2-ΔΔCt法进行计算。miRNA-200 b上游引物:5′-TCATCATTACCAGGCAGTATTA-3′,下游引物:5′-TCCATCATTACCCGGCAGTATTA-3′;内参U6上游引物,5′-CTCGCTTCGGCAGCACA-3′,下游引物,5′-AACGCTTCACGAATTTGCGT-3′。
1.4 细胞转染miR200-b mimicsHepG2-SR细胞接种于六孔板中,置入37 ℃,5%CO2的培养箱中培养,当细胞融合度达到30%~50%时,按照lipofectamine-2000使用说明转染miRNA-200b mimics及空白对照。72 h后收集细胞,并用RT-PCR法检测miRNA-200b的表达水平。
1.5 CCK-8检测细胞活性将HepG2,HepG2-SR及后续实验中转染空白对照和miRNA-200b mimics的细胞经胰酶消化计数后,按每孔2×104个细胞接种于96孔板中,待细胞贴壁后,加入不同浓度的索拉菲尼进行培养(第一孔浓度为50 μmol/L,倍比稀释至第九孔,第十孔加入溶剂DMSO),每组设3个复孔。培养箱培养48 h后弃去96孔板的培养基,每孔加入90 μL DMEM培养基和10 μL CCK-8试剂,放细胞培养箱孵育1 h后,用酶标仪测450 nm波长各孔吸光值。相同条件下实验重复3次。
1.6 划痕实验将转染空白对照和miRNA-200b mimics的细胞接种于六孔板中,当细胞融合率达到90%以上后,用200 μL枪头在板中划线,PBS漂洗3次后加入无血清培养基,随后显微镜拍摄划痕并做好标记,继续培养24 h后,再次显微镜下拍摄划痕。分析照片并计算2组细胞迁移率。
1.7 Transwell侵袭实验基质胶4 ℃过夜融化,与3倍体积的无血清培养基混合均匀后加入Transwell小室(6.5 mm直径,8.0 μm孔径; Corning),每孔50 μL。复温30 min,待基质胶凝固后上室加入500 μL无血清细胞悬液(1×105个),下室添加750 μL含有10%胎牛血清的完全培养液。在37 ℃孵育24 h后,用棉签除去上表面的细胞,多聚甲醛固定侵袭的细胞,用10%结晶紫染色并计数。
1.8 流式细胞仪检测细胞凋亡采用BD Pharmingen PE Annexin凋亡检测试剂盒(BD Biosciences)检测细胞凋亡。对照组和转染miRNA-200b组HepG2-SR细胞经胰酶消化后,1 000 r/min,4 ℃离心10 min,弃上清,加入1 mL预冷的PBS重悬细胞,再次离心去上清。重复此步骤3次后,将细胞重悬于100 μL Binding Buffer,加入5 μL PE Annexin V和5 μL 7-AAD,避光室温反应15 min;加入400 μL Binding Buffer后上机检测。
1.9 Western blot检测收集两组细胞,加入细胞裂解液,冰上裂解30 min,接着用1 mL枪头刮下裂解液,12 000 r/min,离心20 min,取上清至新的1.5 mL EP管中。按1∶2的比例加入2×SDS PAGE上样缓冲液,100 ℃金属浴10 min。随后进行SDS-PAGE电泳,后采用250 mA电流恒流湿转90 min,使蛋白转移到PVDF膜上,用含5%脱脂奶粉的TBST溶液封闭2 h后,分别加入稀释后的一抗E-cadherin(1∶5 000)、N-cadherin(1∶2 000)、Vimentin (1∶2 000)及GAPDH(1∶1 000),4 ℃孵育过夜,次日洗膜,用1∶5 000稀释的二抗室温孵育2 h,TBST洗膜3次,用化学发光法在凝胶成像仪上显影。
1.10 统计学分析计量资料数据以x±s表示,采用GraphPad 7.0软件作图,SPSS 16.0统计软件进行数据分析,两组比较采用t检验,P < 0.05认为有统计学意义。
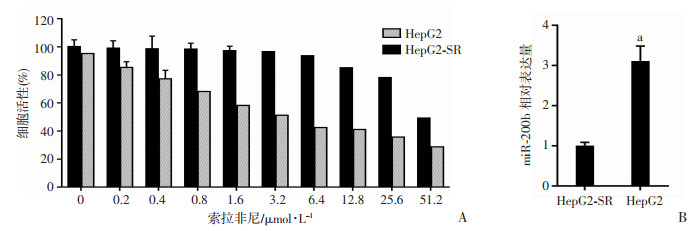
2 结果 2.1 索拉菲尼耐药肝癌细胞株的建立及miRNA-200b的表达差异采用逐渐提高培养基中索拉菲尼浓度的方法得到肝癌HepG2的索拉菲尼耐药株。通过CCK-8试剂盒测量耐药株(HepG2-SR)和母本株(HepG2)的增殖活性并计算得到2个细胞株的索拉菲尼半抑制浓度(IC50)。HepG2-SR组的IC50为46.79 μmol/L,HepG2组的IC50为4.43 μmol/L,HepG2-SR组明显高于HepG2组(图 1A)。明确索拉菲尼耐药株建立成功后,分别测定2株细胞的miRNA-200b的表达差异,发现HepG2-SR细胞株的miRNA-200b表达量显著低于其母本株HepG2(1.00±0.08 vs 3.11±0.37,P < 0.01,图 1B)。
|
| A:不同浓度索拉菲尼对肝细胞癌细胞株HepG2和其诱导耐药株HepG2-SR活性的影响;B:miRNA-200b在HepG2和HepG2-SR中的表达差异 a:P < 0.01,与HepG2-SR比较 图 1 索拉菲尼耐药肝癌细胞株的建立及miRNA-200b的表达差异 (n=5,x±s) |
2.2 过表达miRNA-200b改善耐药株HepG2-SR对索拉菲尼的耐药性
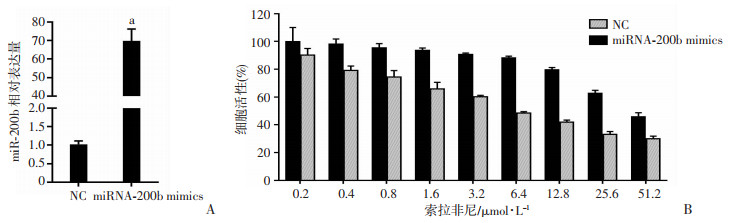
耐药株较母本株miRNA-200b表达量下调后,通过人工转染miRNA-200b mimics的方式上调了耐药株的miRNA-200b表达,经检测miRNA-200b mimics组的表达明显高于空白对照(NC)组(69.78±6.41 vs 1.02±0.09,P < 0.01,图 2A)。随后检测2组细胞的增殖活性并计算各自的IC50,miRNA-200b mimics组明显低于NC组(6.43 μmol/L vs 44.92 μmol/L,图 2B)。
|
| A:转染miRNA-200b mimics后对miRNA-200b表达的影响 a:P < 0.01,与NC比较;B:过表达miRNA-200b对索拉菲尼耐药株HepG2-SR耐药性的影响 图 2 在索拉菲尼耐药株HepG2中过表达miRNA-200b后对细胞活性的影响 (n=5,x±s) |
2.3 过表达miRNA-200b抑制耐药株HepG2-SR的迁移和侵袭
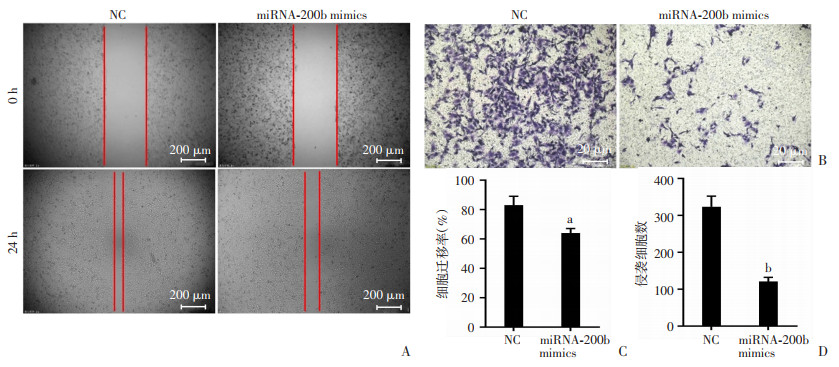
划痕实验显示,miRNA-200b mimics组的细胞迁移速度较NC组明显减慢(图 3A),24 h迁移率两组比较为(63.93±3.12)% vs(82.97±5.99)%,P < 0.05,(图 3C)。为进一步测定两组细胞向远处转移的能力,本研究进行了细胞侵袭实验,结果显示,miRNA-200b mimics组的侵袭细胞数量较NC组明显减少(120.71±11.14 vs 323.22±28.79,P < 0.01,图 3B、D)。
|
| A、C:细胞划痕实验检测细胞迁移能力及定量分析;B、D:细胞侵袭实验及定量分析 a:P < 0.05,b:P < 0.01,与NC比较 图 3 过表达miRNA-200b对索拉菲尼耐药株HepG2-SR迁移和侵袭的影响 (n=5,x±s) |
2.4 过表达miRNA-200b促进耐药株HepG2-SR细胞凋亡
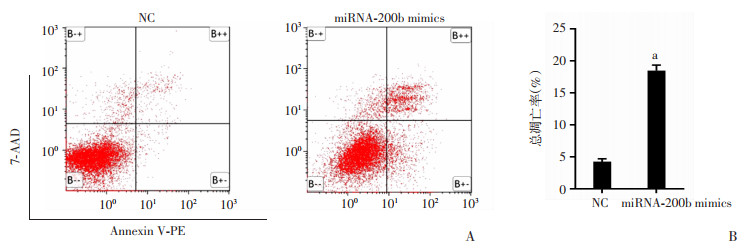
凋亡也是参与细胞耐药的机制之一。本研究通过流式细胞仪检测2组细胞的凋亡情况,miRNA-200b mimics组的细胞凋亡率较NC组明显升高。流式细胞仪检测⒉组细胞的凋亡情况, miRNA-200bmimics组的细胞凋亡率较NC组明显升高[(18.47±0.86) % vs (4.23±0.43) %, P < 0.001,图 4]。
|
| A:流式细胞仪检测HepG2-SR凋亡;B:定量分析 a:P < 0.001,与NC比较 图 4 过表达miRNA-200b对索拉菲尼耐药株HepG2-SR凋亡的影响 (n=5,x±s) |
2.5 过表达miRNA-200b对耐药株HepG2-SR上皮间质转化的影响
肿瘤细胞的上皮间质转化(epithelial mesenchymal transition, EMT)是目前认为参与细胞耐药转变的重要原因之一。本研究用Western blot方法检测细胞上皮间质转化的相关标志物,E-钙粘蛋白(E-cadherin),N-钙粘蛋白(N-cadherin)及波形蛋白(Vimentin)。结果显示,miRNA-200b mimics组E-cadherin较NC组增加,N-cadherin、Vimentin较NC组减少(P < 0.001, 图 5)。
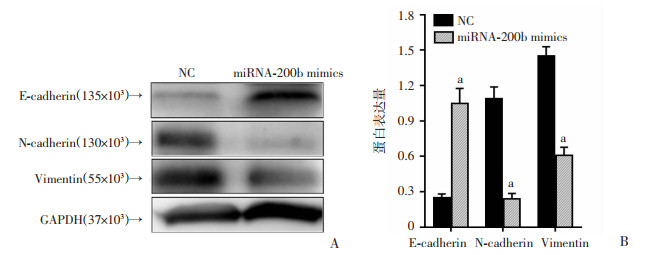
|
| A:过表达miRNA-200b对耐药株HepG2-SR上皮间质转化相关标志物的影响;B:上皮间质转化标志物(E-cadherin、N-cadherin和Vimentin)内参校准后表达量 a:P < 0.001,与NC组比较 图 5 过表达miRNA-200b对耐药株HepG2-SR上皮间质转化(EMT)的影响 (n=5,x±s) |
3 讨论
肿瘤细胞的耐药性受到非常复杂的因素影响,细胞对药物的摄入减少、药物作用靶点发生修饰改变、细胞周期检查点改变、肿瘤细胞DNA修复增强、凋亡信号通路抑制以及上皮间质转化等等都会影响肿瘤细胞对药物的敏感性[15]。miRNAs通过靶向信使RNA(mRNA),使之发生降解或抑制其翻译,参与多种生物过程的调控,如细胞周期、分化、增殖、凋亡、应激耐受、能量代谢和免疫应答等等[16]。近年来,大量研究表明,许多受miRNAs调控的基因与肿瘤细胞对化疗药物的反应有关。
Wnt信号通路与胚胎发育,肿瘤发生,细胞增殖,和细胞凋亡等有关,miRNA-200b被证实直接靶向Wnt1,抑制Wnt/β-catenin信号通路,进而抑制结肠癌细胞的增殖并诱导其凋亡[17]。我们推测在肝癌细胞中,miRNA-200b也可能通过这一机制抑制肝癌细胞的增殖并促进其凋亡,但结果还有待进一步实验证实。还有研究表明,miRNA-200b可在肝癌细胞中靶向Ras同源基因家族蛋白A(RhoA),而RhoA可通过激活细胞骨架蛋白,促进肌球蛋白和肌动蛋白丝的相互作用,使其收缩,从而增强肿瘤细胞的运动和迁移能力,RhoA还可促进肿瘤血管生成,改善肿瘤细胞中血管内皮生长因子的表达,促进肿瘤侵袭[18]。我们的研究结果也与该结果一致,在索拉菲尼耐药的HepG2-SR细胞中上调miRNA-200b的表达可显著抑制肿瘤细胞的迁移和侵袭。
EMT是一种胚胎发育过程,肿瘤细胞在增强迁移和侵袭能力的过程中都发生了此种转变[19]。EMT由特定的转录因子家族如SNAIL、basic helix loop helix (bHLH)、TWIST和ZEB等等参与执行,这些转录因子家族可作为E-Cadherin的抑制物,促进EMT效应基因的表达。而miRNA-200b可以通过直接或间接作用抑制这些转录因子,从而抑制EMT效应基因的表达[20-21]。我们的研究也证实miRNA-200b可增加索拉菲尼耐药的HepG2-SR细胞中上皮细胞标志物E-Cadherin的表达,减少间质细胞标志物N-Cadherin和Vimentin的表达。
综上所述,在发生索拉菲尼耐药的肝癌细胞HepG2-SR中,miRNA-200b的表达出现了下调,通过转染方式上调HepG2-SR的miRNA-200b表达后,其生物学行为发生了明显的改变,细胞增殖、迁移、侵袭受到抑制,细胞凋亡受到促进,上皮间质转变标志改变,细胞对索拉菲尼的敏感性得到增强。基于miRNA-200b的治疗可以改善索拉菲尼的耐药性,增强进展期肝癌患者的药物获益。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. |
| [2] |
BALOGH J, VICTOR D, ASHAM E H, et al. Hepatocellular carcinoma: a review[J]. J Hepatocell Carcinoma, 2016, 3: 41-53. |
| [3] |
FORNER A, REIG M, BRUIX J. Hepatocellular carcinoma[J]. Lancet, 2018, 391(10127): 1301-1314. |
| [4] |
CHENG A L, KANG Y K, CHEN Z, et al. Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma: a phase Ⅲ randomised, double-blind, placebo-controlled trial[J]. Lancet Oncol, 2009, 10(1): 25-34. |
| [5] |
BRUIX J, RAOUL J L, SHERMAN M, et al. Efficacy and safety of sorafenib in patients with advanced hepatocellular carcinoma: subanalyses of a phase Ⅲ trial[J]. J Hepatol, 2012, 57(4): 821-829. |
| [6] |
BERASAIN C. Hepatocellular carcinoma and sorafenib: too many resistance mechanisms?[J]. Gut, 2013, 62(12): 1674-1675. |
| [7] |
LU T X, ROTHENBERG M E. MicroRNA[J]. J Allergy Clin Immunol, 2018, 141(4): 1202-1207. |
| [8] |
SI W, SHEN J, ZHENG H, et al. The role and mechanisms of action of microRNAs in cancer drug resistance[J]. Clin Epigenetics, 2019, 11(1): 25. |
| [9] |
GOLLAVILLI P N, PARMA B, SIDDIQUI A, et al. The role of miRNA-200b/c in balancing EMT and proliferation revealed by an activity reporter[J]. Oncogene, 2021, 40(12): 2309-2322. |
| [10] |
PIPERIGKOU Z, FRANCHI M, RIETHMÜLLER C, et al. MiRNA-200b restrains EMT and aggressiveness and regulates matrix composition depending on ER status and signaling in mammary cancer[J]. Matrix Biol Plus, 2020, 6/7: 100024. |
| [11] |
FENG B, WANG R, CHEN L B. Review of miRNA-200b and cancer chemosensitivity[J]. Biomed Pharmacother, 2012, 66(6): 397-402. |
| [12] |
POGRIBNY I P, FILKOWSKI J N, TRYNDYAK V P, et al. Alterations of microRNAs and their targets are associated with acquired resistance of MCF-7 breast cancer cells to cisplatin[J]. Int J Cancer, 2010, 127(8): 1785-1794. |
| [13] |
LIU J, ZHANG X, HUANG Y, et al. MiRNA-200b and miRNA-200c co-contribute to the cisplatin sensitivity of ovarian cancer cells by targeting DNA methyltransferases[J]. Oncol Lett, 2019, 17(2): 1453-1460. |
| [14] |
LV Z, WEI J L, YOU W X, et al. Disruption of the c-Myc/miRNA-200b-3p/PRDX2 regulatory loop enhances tumor metastasis and chemotherapeutic resistance in colorectal cancer[J]. J Transl Med, 2017, 15(1): 257. |
| [15] |
HAIDER T, PANDEY V, BANJARE N, et al. Drug resistance in cancer: mechanisms and tackling strategies[J]. Pharmacol Rep, 2020, 72(5): 1125-1151. |
| [16] |
GIOVANNETTI E, EROZENCI A, SMIT J, et al. Molecular mechanisms underlying the role of microRNAs (miRNAs) in anticancer drug resistance and implications for clinical practice[J]. Crit Rev Oncol Hematol, 2012, 81(2): 103-122. |
| [17] |
CHEN L, WANG X, ZHU Y, et al. miR-200b-3p inhibits proliferation and induces apoptosis in colorectal cancer by targeting Wnt1[J]. Mol Med Rep, 2018, 18(3): 2571-2580. |
| [18] |
WANG B G, LI J S, LIU Y F, et al. MicroRNA-200b suppresses the invasion and migration of hepatocellular carcinoma by downregulating RhoA and circRNA_000839[J]. Tumour Biol, 2017, 39(7): 1010428317719577. |
| [19] |
THIERY J P, ACLOQUE H, HUANG R Y, et al. Epithelial-mesenchymal transitions in development and disease[J]. Cell, 2009, 139(5): 871-890. |
| [20] |
HUNG C S, LIU H H, LIU J J, et al. MicroRNA-200a and -200b mediated hepatocellular carcinoma cell migration through the epithelial to mesenchymal transition markers[J]. Ann Surg Oncol, 2013, 20(3): 360-368. |
| [21] |
TSAI S C, LIN C C, SHIH T C, et al. The miRNA-200b-ZEB1 circuit regulates diverse stemness of human hepatocellular carcinoma[J]. Mol Carcinog, 2017, 56(9): 2035-2047. |




