2. 400038 重庆,陆军军医大学(第三军医大学)第一附属医院:病理科,全军临床病理学研究所
2. Department of Pathology, PLA Institute of Clinical Pathology, First Affiliated Hospital, Army Medical University, Chongqing, 400038, China
全胃肠外营养(total parenteral nutrition,TPN)是重要的营养支持治疗手段,已广泛应用于儿童及成人。早产儿尤其是极低或超低出生体重儿,早期肠内喂养困难,通常需要接受TPN。部分早产儿由于合并窒息、感染、出血等,胃肠内营养受到限制,也需要接受TPN;除此之外,患坏死性小肠结肠炎、短肠综合征、胃肠道手术术后等患儿,通常需要接受长时期的TPN治疗。因此,TPN对于肠内喂养不耐受或肠内喂养禁忌的患儿来说是挽救其生命的关键治疗措施[1-2]。
然而,TPN的应用也存在着许多并发症,包括血栓形成、肝损伤、感染风险和代谢紊乱等,其中继发感染是其重要的并发症之一。有研究表明,长期接受胃肠外营养(parenteral nutrition,PN)的新生儿医院内感染发生率高达47.8%[3],是导致新生儿致残率及病死率增加、住院时间延长以及医疗费用增加的重要原因,而>2周的TPN治疗是院内感染的独立危险因素[4-5]。但TPN引起感染并发症的机制尚不清楚。由于临床研究常常受到基础疾病的影响,故本研究拟通过建立TPN幼鼠动物模型,研究其接受2周TPN对先天性及获得性免疫功能的影响以及炎症因子的变化,为探索TPN致感染并发症的发病机制提供理论基础。
1 材料与方法 1.1 实验动物及分组本研究中涉及的动物伦理已通过陆军军医大学动物伦理委员会批准[AMUWEC20201551]。18只雄性SD幼鼠(6~8周龄,体质量220~240 g)购于陆军军医大学实验动物中心。将SD幼鼠分为3组:正常组(不予静脉置管,喂食标准鼠粮和水)、对照组[行右颈静脉置管,在输液泵控制(1.5 mL/h)下输入生盐理水,持续14 d,同时喂食标准鼠粮和水]和TPN组[幼鼠行右颈静脉置管在输液泵控制(1.5 mL/h)下输入TPN营养液并禁食、禁水],每组6只。
1.2 TPN营养液的配制TPN组幼鼠根据CAROLINE等[6]建模方法配制并输入TPN营养液14 d(205 kcal/kg·d),TPN溶液每升中包含450 mL复方氨基酸(华润双鹤制药公司,中国),360 mL 50%葡萄糖(大冢制药有限公司,中国),140 mL脂肪乳(费森尤斯卡比华瑞制药有限公司,中国),同时添加微量元素、维生素和电解质,颈静脉置管术后24 h内TPN输液速度减半,24 h后改为正常输注速度。对照组幼鼠经中心静脉导管持续输注0.9% NaCl,并与正常组幼鼠同样正常进食进水。
1.3 主要试剂及仪器 1.3.1 试剂细胞因子(IL-1β、TNF-α、IL-10、IL-4) ELISA检测试剂盒(碧云天公司,中国),流式荧光抗体染料APC-cy7 live/dead dye(Invitrogen公司,美国),FITC标记的anti-rat MHC-Ⅱ(HLA-DR) 抗体(Thermofisher公司,美国),FITC标记的anti-rat Foxp3抗体、PE标记的anti-rat TNFα抗体、PE标记的anti-rat CD25抗体、PE-cy7标记的anti-rat CD8抗体、APC标记的anti-rat CD3抗体、PerCP标记的anti-rat CD11b抗体、PB标记的anti-rat IFNγ抗体、LPS、PHA、DNase Ⅰ(Biolegend公司,美国),PB标记的anti-rat CD4抗体、Annexin V/7AAD apoptosis kit、GolgiStop、Golgi Plug(BD Pharmingen公司,美国)。
1.3.2 仪器全自动流式血细胞计数仪(希森美康公司,日本)、酶标仪(Thermofisher公司,美国)、流式细胞仪(BD Pharmingen公司,美国)。
1.4 标本收集所有组别幼鼠禁食6 h经腹腔麻醉后通过腹主动脉穿刺获取血液标本并同时获取脾脏标本。留取部分血液样本经450×g离心15 min后留取血浆,剩余血液标本及脾脏组织经红细胞裂解液处理获取白细胞及脾脏细胞。
1.5 酶联免疫吸附法(ELISA)检测血浆中炎症因子的含量将待测的血浆及相关ELISA试剂盒准备好,包被抗体:按说明步骤用1×包被液稀释包被抗体,然后将稀释的包被抗体,加入96孔板(100 μL/孔),置于4 ℃冰箱过夜。操作步骤如下:洗板、封闭、孵育标准品和样本、孵育检测抗体10~15 min。显色反应和终止反应后,使用酶标仪检测波长在450 nm处96孔板各孔光密度值D(450)。采用Read-er Fit ELISA软件进行分析,根据标准品D(450) 值绘出标准曲线,计算样品细胞因子含量。
1.6 流式细胞术 1.6.1 脾脏细胞中HLA-DR表达情况取每组幼鼠脾脏加入红细胞裂解液在滤网上研磨后静置3 min收集悬液,经507×g离心5 min,弃上清,FACS液洗涤2次后以FACS液重悬,悬液中加入APC标记的anti-rat CD3抗体、PerCP标记的anti-rat CD11b抗体、FITC标记的anti-rat MHC-Ⅱ(HLA-DR)抗体、APC-cy7 live/dead dye,室温孵育30 min后,用流式细胞仪检测脾脏细胞HLA-DR表达情况。
1.6.2 检测淋巴细胞(CD4+、CD8+T)的凋亡情况及Treg细胞比例取每组幼鼠全血经裂解红细胞处理后向所得沉淀中加入FACS液重悬,向需检测凋亡的EP管中加入PB标记的anti-rat CD4抗体、PE-cy7标记的anti-rat CD8抗体,冰上孵育30 min后用冰的PBS洗涤2次,并用Binding buffer(1×)重悬细胞至浓度为1×106/mL,转移100 μL的混悬液至5 mL EP管中,加入5 μL PE Annexin V和5 μL的7-ADD,轻轻斡旋后常温避光孵育15 min,结束后加入1×Binding buffer在1 h内用流式仪检测淋巴细胞凋亡情况。向需检测Treg细胞的EP管中加入APC标记的anti-rat CD3抗体、PE标记的anti-rat CD25抗体、APC-cy7 live/dead dye、PB标记的anti-rat CD4抗体,冰上孵育30 min后用FACS液洗涤2次,加入1mL新鲜制备的1×Fix/Perm缓冲液,重悬3 s后4℃避光培养40~50 min,时间结束后用1×perm wash洗涤2次,弃上清,加入100 μL 1×perm wash,向悬液中加入FITC标记的anti-rat Foxp3抗体,冰上培养40~50 min,最后以1×perm wash洗涤2次后用流式细胞仪检测Treg细胞比例。
1.6.3 检测诱导产生炎症相关因子的细胞用内毒素诱导单核细胞产生TNF-α以及用植物血凝素(phytohemagglutinin,PHA)刺激淋巴细胞(CD4+T),产生IFN-γ。裂解红细胞后直接用完全1640培养基将细胞重悬放入24孔细胞培养板中,同时设置阴性对照孔,向需检测IFN-γ的孔中添加PHA至终浓度5 μg/mL;向需检测TNF-α的孔中添加LPS至终浓度100 ng/mL。将细胞放入培养箱中刺激24 h,在细胞刺激结束前4 h,分别向每孔中加入Golgi stop(1 ∶1 000), Golgi plug(1 ∶1 000), DNAase(1 ∶1 000),继续培养至时间满。刺激结束以FACS液洗涤2次后向需检测IFN-γ的悬液中加入APC标记的anti-rat CD3抗体、PE-cy7标记的anti-rat CD8抗体、APC-cy7 live/dead dye、PB标记的anti-rat CD4抗体;向需检测TNF-α的悬液中加入PerCP标记的anti-rat CD11b抗体、FITC标记的anti-rat MHC-Ⅱ(HLA-DR)抗体、APC-cy7 live/dead dye。冰上孵育30 min经Transcription Factor Buffer Set打孔后根据组别分别加入PE标记的anti-rat TNFα抗体及PB标记的anti-rat IFNγ抗体,冰上培养40~50 min后用流式细胞仪检测TNF-α及IFN-γ表达情况。
1.7 统计学分析计量资料用x±s表示,运用SPSS 18.0统计软件进行分析,采用GraphPad Prism 8.0软件作图,各组间比较采用单因素方差分析,并进一步采用LSD法对各组间有差异的指标进行两两比较,数据分析时首先进行正态性分布检验,检验水准α=0.05。
2 结果 2.1 白细胞(WBC)、血小板(PLT)、淋巴细胞(LYMPH)、中性粒细胞(NEUT)计数结果由表 1可见,TPN组幼鼠LYMPH相较于正常组与对照组幼鼠均减少(P<0.05),PLT增高(P<0.05),WBC、NEUT各组间差异无统计学意义。
| 组别 | WBC(109/L) | PLT(109/L) | LYMPH(109/L) | NEUT(109/L) |
| 正常组 | 10.87±1.45 | 844.17±91.52 | 2.45±0.79 | 7.15±1.42 |
| 对照组 | 11.49±1.42 | 804.33±45.26 | 2.36±0.71 | 8.44±1.48 |
| TPN组 | 10.82±2.48 | 1 074.17±198.42 | 1.36±0.86 | 6.17±2.57 |
| F | 0.702 | 7.669 | 3.564 | 2.169 |
| P | >0.05 | <0.05 | <0.05 | >0.05 |
2.2 脾脏细胞中的HLA-DR表达情况
如图 1所示,相较于正常组与对照组,TPN组幼鼠脾脏细胞HLA-DR的表达明显减低,差异有统计学意义(P<0.05)。
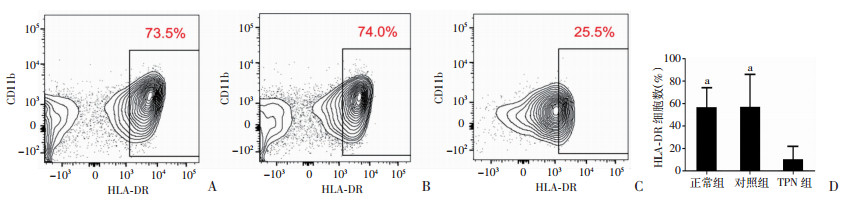
|
| A~C:分别为正常组、对照组、TPN组流式细胞术结果;D:HLA-DR细胞占比的比较 a:P<0.05,与TPN组比较 图 1 3组幼鼠脾脏细胞中的HLA |
2.3 外周血Treg细胞水平
如图 2所示,相较于正常组与对照组,TPN组幼鼠Treg细胞的百分比明显增加,差异有统计学意义(P<0.05)。如图 3所示:相较于正常组与对照组,TPN组幼鼠外周血CD4+T及CD8+T淋巴细胞晚期凋亡均增加(P<0.05),而早期凋亡各组间无明显区别,差异无统计学意义。

|
| A~C:分别为正常组、对照组、TPN组流式细胞术结果;D:Treg细胞占比的比较 a:P<0.05,与TPN组比较 图 2 3组幼鼠外周血Treg细胞比例 |
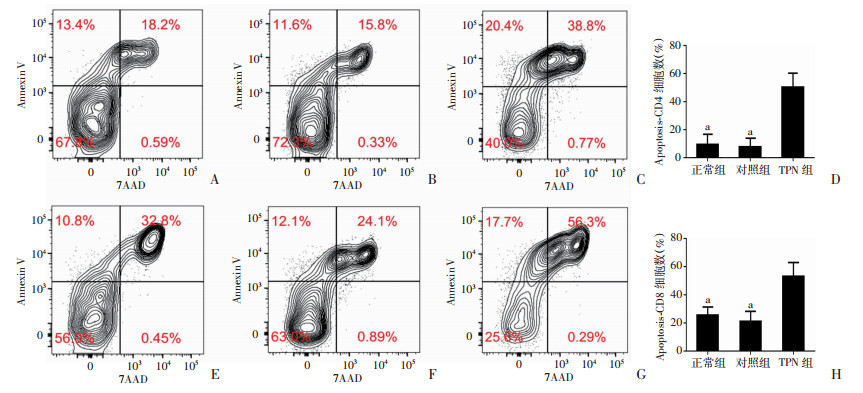
|
| A~D:分别为正常组、对照组、TPN组CD4+淋巴细胞流式细胞术结果与细胞凋亡比较;E~H:分别为正常组、对照组、TPN组CD8+淋巴细胞流式细胞术结果与细胞凋亡比较 a:P<0.05,与TPN组比较 图 3 3组幼鼠外周血T淋巴细胞(CD4+、CD8+)凋亡情况 |
2.4 内毒素诱导单核细胞产生TNF-α以及淋巴细胞(CD4+T)经PHA刺激后产生IFN-γ的能力
外周血单核细胞经内毒素刺激后与正常组及对照组相比,TPN组产生的TNF-α所占比例明显降低(P<0.05,图 4),而CD4+T淋巴细胞经PHA刺激后所产生IFN-γ的百分比也明显减少(图 5),差异均有统计学意义(P<0.05)。
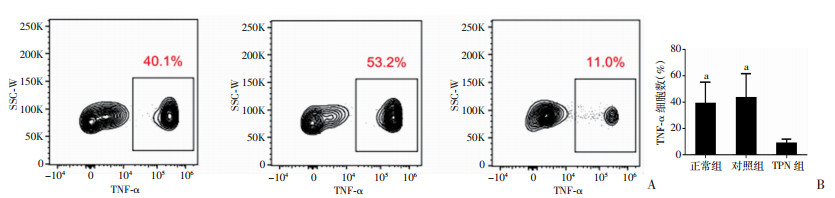
|
| A:流式细胞仪结果;B:TNF-α细胞占比的比较 a:P<0.05,与TPN组比较 图 4 3组幼鼠外周血单核细胞经内毒素诱导后产生TNF-α的能力 |
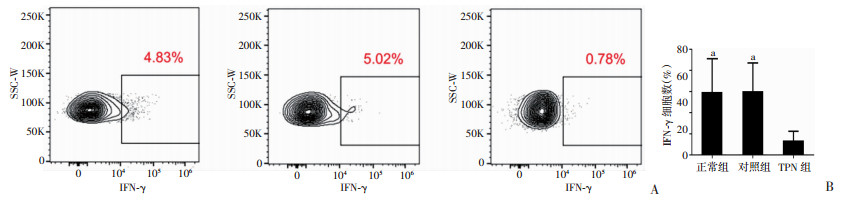
|
| A:流式细胞仪结果;B:IFN-γ细胞占比的比较 a:P<0.05,与TPN组比较 图 5 3组幼鼠外周血T淋巴细胞(CD4+)用PHA刺激后产生IFN-γ的能力 |
2.5 血浆中IL-1β、TNF-α、IL-10、IL-4水平
如表 2所示:与正常组及对照组幼鼠相比,TPN组幼鼠炎症因子IL-1β、TNF-α表达水平明显增加(P<0.05),而抗炎因子IL-10、IL-4的表达水平显著降低,差异有统计学意义(P<0.05)。结果提示TPN促进了炎症反应并抑制了抗炎反应。
| 组别 | IL-1β | TNF-α | IL-4 | IL-10 |
| 正常组 | 45.34±7.45a | 36.73±2.97a | 19.22±1.26a | 92.72±24.58a |
| 对照组 | 47.05±7.82a | 38.67±1.42a | 18.23±2.02a | 94.59±6.19a |
| TPN组 | 73.60±6.21 | 47.82±2.23 | 13.58±2.87 | 71.32±4.45 |
| a:P<0.05,与TPN组比较 | ||||
3 讨论
TPN作为重要的治疗手段已在临床上广泛应用并成为挽救部分危重患者生命的重要治疗方式,但长时间TPN的使用会出现许多并发症,院内感染是其重要的并发症之一。文献[7]报道207例接受PN治疗的儿童中院内感染发生率为5.5%,与未暴露于PN的住院患儿相比,风险差为4.1%(95%CI:3.4%~4.9%)。NETTO等[8]对在PICU住院的1106例患儿进行的前瞻性观察研究发现,92例(8.3%)患儿出现院内感染,而PN天数是其独立危险因素,并可成为院内感染最重要的预测因素之一。然而,TPN增加感染风险的确切机制尚未完全阐明,国内尚少见相关报道,本研究通过构建TPN幼鼠动物模型,探讨了TPN对幼鼠先天性及获得性免疫功能及炎症反应的影响。
3.1 TPN可导致幼鼠先天性免疫功能受损本研究发现HLA-DR在TPN组的表达明显下降。HLA-DR的表达被认为是反映先天免疫功能最特征性的指标之一[9]。HLA-DR系MHC Ⅱ类细胞表面分子,是一种糖基化细胞表面跨膜蛋白,表达于B淋巴细胞、单核细胞、巨噬细胞、活化T淋巴细胞、活化NK淋巴细胞和人祖细胞上。单核巨噬细胞表面的HLA-DR是外来抗原提呈过程中最重要的分子,单核细胞上HLA-DR的表达(mHLA-DR)对于将来自摄入微生物的多肽逞递给CD4或CD8阳性T细胞从而启动消除潜在病原体的特异性免疫应答来说至关重要,当病原微生物入侵时,细胞活化表达HLA-DR/CD14,并通过HLA-DR的协助将有效抗原成分传递给淋巴细胞,T淋巴细胞通过TCR识别阳性细胞表面的HLA-DR分子后提供第一刺激信号,从而启动T细胞活化增殖,机体即呈现免疫应答并促进免疫反应过程完成,同时,HLA-DR通过激活辅助性T淋巴细胞在针对感染的特异性免疫应答中发挥核心作用[10]。NAVIN等[11]发现PICU危重患儿所有单核细胞亚群中HLA-DR表达均降低,并在住院期间进一步下降,入院后第2天和第3天单核细胞HLA-DR水平降低与院内感染发生率和患儿死亡率增加呈显著负相关。
LPS诱导TNF-α产生的能力被用作危重疾病中评估单核细胞功能的第2个生物标志物[12],我们的研究发现:TPN组幼鼠外周血单核细胞经内毒素诱导后产生TNF-α的能力降低。因LPS刺激外周血单核细胞上的toll样受体(TLR)-4复合物可以诱导TNF-α的快速转录、翻译和释放,反映的不是血浆中循环TNF-α的水平,而是患儿外周血产生TNF-α的能力,其与脓毒症、MODS、创伤及体外循环的不良结局密切相关[13-15],单核细胞经LPS刺激后产生TNF-α的能力越低医院感染及死亡风险越高[16-17]。文献[18]对76例PICU危重患儿的研究发现,在发生院内感染的16例患儿中其体外LPS诱导产生TNF-α的能力均较低。肠道是人体最大的免疫器官,存在着人体70%以上的淋巴细胞,是与抗原接触的最大区域,也是全身炎症反应的启动、动力、中心器官,受到肠道微生物群的调控。在TPN治疗下因长时间没有肠内营养的刺激,肠道蠕动不足,肠道内微生物群的组成和功能发生改变,由正常肠内营养下占优势的厚壁菌门转变为拟杆菌门,厚壁菌门与拟杆菌门细菌比例失调。拟杆菌门细菌可促进肠道炎症,增加肠道通透性,有利于细菌穿过黏膜屏障[19]。正常胃肠内营养下一方面肠道微生物群的代谢产物,如蛋白质和多糖,可以通过激活模式识别受体刺激黏膜免疫系统;另一方面肠道菌群可以促进肠黏膜免疫耐受(如刺激淋巴细胞,减少NF-kB信号通路等),防止细菌过度生长[20]。因此,TPN治疗过程中微生物群的变化是免疫反应和内毒素介导的全身炎症的驱动因素[21]。
3.2 TPN可导致幼鼠获得性免疫功能受损我们的研究还发现Treg (CD4+ CD25+ Foxp3+ T)细胞在TPN组大鼠外周血呈高表达状态。Treg(CD4+ CD25+ Foxp3+ T)细胞的主要功能是抑制创伤或脓毒症后T细胞的增殖,抑制保护性Th1型细胞因子的产生,在维持促炎反应和抗炎反应之间的平衡中扮演着重要的角色,如果Treg的负性免疫调节作用占优势,将导致免疫抑制状态。Treg细胞可以通过抑制T细胞的增殖和干扰保护性Th1型细胞因子(如IL- 10)的产生发挥免疫抑制作用[22]。IL-10是促进Treg细胞分化和维持其功能的主要因子,由肠道的巨噬细胞产生,受肠内营养素的调节,TPN可导致小肠中产生IL-10的巨噬细胞数量明显下降,可能是导致Treg细胞比例增加的重要机制,同时TPN可促进微生物群向更具有免疫原性的表型(富含TLR配体的变形菌门)转变,也可能是Treg细胞比例增加的重要机制[20]。
除此之外,本研究还发现TPN组幼鼠外周血淋巴细胞绝对值降低、T淋巴细胞(CD4+、CD8+T)晚期凋亡明显增多和淋巴细胞(CD4+T)经PHA刺激后产生IFN-γ的能力减弱。淋巴细胞凋亡增加能通过减少免疫效应细胞的数量参与免疫抑制[23]。有研究表明[24],创伤患者的外周血淋巴细胞呈下降趋势,在第3天时达最低,而在发生感染或死亡患者中淋巴细胞数量明显减少,此外,淋巴细胞计数减少超过3 d的重症患者发生院内感染的风险也会明显增加[25]。TPN导致淋巴细胞凋亡增加以及数量减少可能与肠道缺乏营养素刺激,肠道完整性受到破坏,导致细菌和(或)内毒素移位,从而加重全身炎症有关[26]。同时,我们发现TPN组幼鼠外周血淋巴细胞反应性也降低,即当淋巴细胞与其刺激物PHA在体外孵育时,其产生IFN-γ的能力降低,表明获得性免疫受到抑制,成为在临床上危重患者感染并发症及死亡率增加的重要原因[27-28]。
3.3 TPN可促进炎症反应并抑制抗炎反应本实验还进一步观察了TPN对炎症因子的影响,实验结果显示TPN组幼鼠外周血炎症因子TNF-α、IL-1β增高而抗炎因子IL-4、IL-10降低,这可能是诱导免疫损伤的重要机制。TPN诱导炎症反应不仅与肠道菌群改变有关,还与脂质类型有关,传统的肠外营养脂质乳剂主要为大豆油,由ω-3脂肪酸、ω-6脂肪酸、α-亚麻酸等组成,在人体中,ω-6脂肪酸通过延长酶和去饱和酶的作用转化为花生四烯酸,花生四烯酸在体内可转变成各种代谢产物, 如前列腺素(PGs)、血栓烷(TXs)、5-羟基二十烷四烯酸(HETE)和白三烯(lt)等,参与炎症、免疫抑制和血栓形成等[29]。脂肪乳剂中ω-6多不饱和脂肪酸是否增加炎症目前尚存争议,但当ω-6 /ω-3比例较高时,具有明显的促炎作用。
综上,我们的研究证实2周的TPN可导致幼鼠免疫功能受损,表现为先天性和获得性免疫功能均有所减弱,炎症反应明显增强,可能是临床上TPN增加感染发生率重要分子机制。因此,尽可能减少TPN使用时间,尽早开始肠内营养,具有重要的临床意义,然而TPN导致免疫功能受损的具体分子机制仍不完全清楚,尚待我们在今后的工作中深入研究。
| [1] |
NAKAYAMA D K. The development of total parenteral nutrition[J]. Am Surg, 2017, 83(1): 36-38. |
| [2] |
PATEL P, BHATIA J. Total parenteral nutrition for the very low birth weight infant[J]. Semin Fetal Neonatal Med, 2017, 22(1): 2-7. |
| [3] |
DEL MORAL T. Nosocomial infections in premature infants, where are we going?[J]. An Pediatr (Engl Ed), 2019, 91(1): 1-2. |
| [4] |
张德双, 谢东可, 何娜, 等. 极早产儿医院内感染的病原分布及其危险因素的结局分析[J]. 中国当代儿科杂志, 2017, 19(8): 866-871. ZHANG D S, XIE D K, HE N, et al. Pathogen distribution, risk factors, and outcomes of nosocomial infection in very premature infants[J]. Zhongguo Dang Dai Er Ke Za Zhi, 2017, 19(8): 866-871. |
| [5] |
YANG J, SUN H, WAN S, et al. Prolonged parenteral nutrition is one of the most significant risk factors for nosocomial infections in adult patients with intestinal failure[J]. Nutr Clin Pract, 2020, 35(5): 903-910. |
| [6] |
HODIN C M, VISSCHERS R G, RENSEN S S, et al. Total parenteral nutrition induces a shift in the Firmicutes to Bacteroidetes ratio in association with Paneth cell activation in rats[J]. J Nutr, 2012, 142(12): 2141-2147. |
| [7] |
EGBERG M D, GALANKO J A, BARNES E L, et al. Thrombotic and infectious risks of parenteral nutrition in hospitalized pediatric inflammatory bowel disease[J]. Inflamm Bowel Dis, 2019, 25(3): 601-609. |
| [8] |
NETTO R, MONDINI M, PEZZELLA C, et al. Parenteral nutrition is one of the most significant risk factors for nosocomial infections in a pediatric cardiac intensive care unit[J]. JPEN J Parenter Enteral Nutr, 2017, 41(4): 612-618. |
| [9] |
SHANKER A, THOUNAOJAM M C, MISHRA M K, et al. Innate-adaptive immune crosstalk[J]. J Immunol Res, 2015, 2015: 982465. |
| [10] |
ZHUANG Y, PENG H, CHEN Y, et al. Dynamic monitoring of monocyte HLA-DR expression for the diagnosis, prognosis, and prediction of Sepsis[J]. Front Biosci (Landmark Ed), 2017, 22: 1344-1354. |
| [11] |
BOEDDHA N P, KERKLAAN D, DUNBAR A, et al. HLA-DR expression on monocyte subsets in critically ill children[J]. Pediatr Infect Dis J, 2018, 37(10): 1034-1040. |
| [12] |
HALL M W, KNATZ N L, VETTERLY C, et al. Immunoparalysis and nosocomial infection in children with multiple organ dysfunction syndrome[J]. Intensive Care Med, 2011, 37(3): 525-532. |
| [13] |
BORTOLOTTI P, FAURE E, KIPNIS E. Inflammasomes in tissue damages and immune disorders after trauma[J]. Front Immunol, 2018, 9: 1900. |
| [14] |
DELANO M J, WARD P A. The immune system's role in Sepsis progression, resolution, and long-term outcome[J]. Immunol Rev, 2016, 274(1): 330-353. |
| [15] |
MILLAR J E, FANNING J P, MCDONALD C I, et al. The inflammatory response to extracorporeal membrane oxygenation (ECMO): a review of the pathophysiology[J]. Crit Care, 2016, 20(1): 387. |
| [16] |
MIRA J C, GENTILE L F, MATHIAS B J, et al. Sepsis pathophysiology, chronic critical illness, and persistent inflammation-immunosuppression and catabolism syndrome[J]. Crit Care Med, 2017, 45(2): 253-262. |
| [17] |
PATIL N K, BOHANNON J K, SHERWOOD E R. Immunotherapy: a promising approach to reverse Sepsis-induced immunosuppression[J]. Pharmacol Res, 2016, 111: 688-702. |
| [18] |
MUSZYNSKI J A, NOFZIGER R, GREATHOUSE K, et al. Innate immune function predicts the development of nosocomial infection in critically injured children[J]. Shock, 2014, 42(4): 313-321. |
| [19] |
MADNAWAT H, WELU A L, GILBERT E J, et al. Mechanisms of parenteral nutrition-associated liver and gut injury[J]. Nutr Clin Pract, 2020, 35(1): 63-71. |
| [20] |
CAHOVA M, BRATOVA M, WOHL P. Parenteral nutrition-associated liver disease: the role of the gut microbiota[J]. Nutrients, 2017, 9(9): 987. |
| [21] |
CHANDRA SHEKHARA M, VAN N J, VIDUL M, et al. Role of bile acids and gut microbiota in parenteral nutrition associated injury[J]. J Hum Nutr, 2020, 4(1). |
| [22] |
SHI Z W, LIU Y, XU Y, et al. Tremella Polysaccharides attenuated Sepsis through inhibiting abnormal CD4+CD25(high) regulatory T cells in mice[J]. Cell Immunol, 2014, 288(1/2): 60-65. |
| [23] |
GIRARDOT T, RIMMELÉ T, VENET F, et al. Apoptosis-induced lymphopenia in Sepsis and other severe injuries[J]. Apoptosis, 2017, 22(2): 295-305. |
| [24] |
THAKKAR R K, DILTZ Z, DREWS J D, et al. Abnormal lymphocyte response after pediatric thermal injury is associated with adverse outcomes[J]. J Surg Res, 2018, 228: 221-227. |
| [25] |
ALKAN OZDEMIR S, ARUN OZER E, ILHAN O, et al. Can neutrophil to lymphocyte ratio predict late-onset Sepsis in preterm infants?[J]. J Clin Lab Anal, 2018, 32(4): e22338. |
| [26] |
THAISS C A, ZMORA N, LEVY M, et al. The microbiome and innate immunity[J]. Nature, 2016, 535(7610): 65-74. |
| [27] |
BOOMER J S, TO K, CHANG K C, et al. Immunosuppression in patients who die of sepsis and multiple organ failure[J]. JAMA, 2011, 306(23): 2594-2605. |
| [28] |
MUSZYNSKI J A, NOFZIGER R, GREATHOUSE K, et al. Early adaptive immune suppression in children with septic shock: a prospective observational study[J]. Crit Care, 2014, 18(4): R145. |
| [29] |
CALDER P C, WAITZBERG D L, KLEK S, et al. Lipids in parenteral nutrition: biological aspects[J]. JPEN J Parenter Enteral Nutr, 2020, 44(Suppl 1): S21-S27. |




