前列腺癌是全球范围内男性第二大常见癌症,也是男性死亡的主要原因[1]。目前对其病因所知甚少,仅有少数风险因素被确定。因此,挖掘前列腺癌更多的发病原因和具体机制对于更有效地诊治前列腺癌患者至关重要[2]。大量研究表明,自主神经系统可支配癌症的进程[3-4],我们前期的研究发现交感神经β2肾上腺素受体与前列腺癌转移及肿瘤细胞的凋亡密切相关[5]。此外,有研究显示交感神经系统可对其原发生长和远处转移产生较大的影响[3-4]。副交感神经受体M1(muscarinic acetylcholine M1 receptor,CHRM1)作为副交感神经系统胆碱能受体中最主要表达的受体亚型,已被证明在多种肿瘤尤其乳腺癌和胰腺癌中可调控癌症进展[6-7]。同时,CHRM1在正常和癌变的前列腺中均有高度表达,刺激前列腺癌中的CHRM1可促进肿瘤进展,并且已有实验证明CHRM1可诱导前列腺癌的侵袭和转移[8-10]。
细胞焦亡是一种由Caspase家族诱导的炎症性细胞程序性死亡,近年逐渐被大家所关注。细胞焦亡可影响神经系统疾病、感染性疾病、自身免疫性疾病、心血管疾病等,并与多种肿瘤包括前列腺癌密切相关[11]。CHRM1对于前列腺癌的调控过程中涉及多种细胞程序性死亡进程[8],但CHRM1与前列腺癌细胞焦亡的关系有待阐明。因此,本研究通过观察CHRM1对前列腺癌细胞焦亡的影响,探究其在前列腺癌发生、发展中的作用,为前列腺癌的靶向治疗提供新的思考方向。
1 材料与方法 1.1 材料与试剂前列腺癌细胞株PC-3购自中国科学院细胞库,于课题组液氮罐中长期储存。胎牛血清购自以色列BI公司,DMEM/F12购自美国Gibco公司,青霉素链霉素、0.25%胰酶、嘌呤霉素、RIPA裂解液、Hoechst-PI双染试剂盒、LDH释放检测试剂盒均购自北京碧云天公司;PMSF、DEPC水、BSA、DMSO购自北京索莱宝公司;PBS粉末购自北京中杉金桥公司;PAGE凝胶快速制备试剂盒购自上海雅酶公司;细胞冻存液、通用型抗体稀释液购自苏州新赛美公司;PVDF膜(0.22 μm)购自美国Millipore公司;CCK-8购自江苏凯基生物公司;甘氨酸粉末、Tris-base粉末购自美国Amresco公司;盐酸、无水乙醇购自重庆川东化工有限公司;氯贝胆碱(bethanechol,BETH)购自上海陶素公司,哌仑西平(pirenzepine,PIN)购自美国MCE公司;CHRM1敲低病毒液及其对照、GSDMD敲低质粒及对照购自上海吉凯基因化学技术有限公司,CHRM1、Caspase-1、ASC、cleaved Caspase-1、GSDMD、NLRP3抗体购自美国CST公司,GAPDH购自北京博奥森公司。
1.2 实验方法 1.2.1 细胞培养及分组使用10%胎牛血清以及1%青霉素链霉素双抗、DMEM/F12培养液制成的培养基,在37 ℃、5%CO2的状态下培养PC-3细胞。在生长良好的PC-3细胞中分别加入200 μmol/L最适浓度的PIN和10 μmol/L最适浓度的BETH处理24 h,将其设置为CTRL组(DMSO)、PIN组和BETH组;另外分别加入0、100、200 μmol/L PIN与2、5、10 μmol/L BETH处理PC-3细胞24 h,设置6个实验组别。
1.2.2 慢病毒构建稳转细胞株及分组把状态良好的PC-3细胞均匀铺在12孔板里,待细胞长到40%~50%时,更换无双抗培养基,按照说明书计算病毒滴度后均匀加入适量CHRM1敲低病毒及病毒增强液,轻轻摇匀,12~16 h后更换为完全培养基,在荧光显微镜下密切关注感染荧光状况,待长满后可用胰酶消化传代,并添加适量浓度的嘌呤霉素以筛选带靶标的细胞。取生长良好的sh-CHRM1细胞进行实验,加入10 μmol/L BETH处理24 h,设置为NC组(DMSO)、sh-CHRM1组和sh-CHRM1+BETH组。
1.2.3 质粒转染及分组待PC-3细胞在24孔板中贴壁生长至80%~90%时准备转染,转染前24 h更换无双抗培养基,设置si-GSDMD敲低组与si-NC阴性对照组,按照LipofectamineTM 2000使用说明书备好质粒DNA稀释液和转染试剂,将其混匀室温静置20 min后,加入每孔100 μL转染混合试剂,轻轻摇匀,培养6 h后更换为完全培养基,24 h后再进行传代并用对应的抗生素进行筛选。取生长良好的si-GSDMD细胞进行实验, 在si-NC细胞和si-GSDMD细胞里均加入200 μmol/L PIN处理24 h,另在si-NC细胞中加入焦亡诱导剂10 μmol/L LPS+5 mmol/L ATP处理设置为焦亡阳性对照,设置5个组,分别为NC组、LPS组、si-GSDMD组、PIN处理组和si-GSDMD+PIN处理组。
1.2.4 Western blot检测将处理好的细胞置于冰上,加入适量RIPA蛋白裂解液(RIPA ∶PMSF=100 ∶1),30 min后用细胞刮刮至2 mL EP管中,4 ℃、12 000 r/min离心20 min,取上清液并用BCA法检测蛋白浓度,再4 ∶1加入5×上样buffer,震荡混匀后100 ℃煮10 min,按照所需依次上样于配制凝好的SDS-PAGE凝胶泳道内,恒压85 V至溴酚蓝跑至底部,恒流250 mA冰浴转膜1.5 h,用5%脱脂牛奶浸泡转好的PVDF膜,室温下慢摇2 h,一抗4℃孵育过夜;次日用TBST洗膜3次,每次10 min后孵育对应二抗,室温下慢摇1.5 h,再次洗膜后显影。使用Image J软件对灰度值进行分析,目的条带灰度值/GAPDH内参灰度值表示结果。
1.2.5 CCK-8检测细胞活力在96孔板中均匀铺好适量前列腺癌PC-3细胞,待细胞贴壁后分别于12、24、48 h使用0、2、10、100、200、300 μmol/L CHRM1特异性抑制剂PIN和0、2、5、10、20、50 μmol/L M受体激动剂BETH处理,24 h后吸去培养基,每孔加入100 μL CCK-8液体,小心混匀避免气泡产生,37 ℃避光孵育2 h后使用酶标仪检测波长460 nm处光密度值[D(460)]。
1.2.6 LDH释放试验将细胞按需接种于96孔板中,贴壁后将培养基更换为无血清培养基,设置好背景空白对照孔和未加药物的样品对照孔,加药处理后,于收样前1 h在设置的阳性对照孔中加入LDH释放试剂,到达设定时间后将所有孔液体吸至EP管中400×g离心5 min,取上清液120 μL加入新的96孔板中,依次加入盒中LDH检测试剂,室温避光孵育30 min后在酶标仪检测波长490 nm处检测光密度值[D(490)]。
1.2.7 Annexin V-PI流式细胞术将处理好的细胞的培养基分别收集在各离心管内,用胰酶消化贴壁细胞后800 r/min离心5 min后收集细胞沉淀,并用PBS洗涤重悬细胞继续离心,重复2次后用500 μL PBS重悬细胞后送流式房上机进行Annexin V-PI双染。
1.2.8 Hoechst-PI双染将细胞均匀铺于6孔板中,按需处理24 h后吸去培养基,用PBS洗3次后,每孔加入1 mL细胞染色缓冲液、5 μL PI染液、5 μL Hoechst染液,轻轻混匀后,4 ℃避光孵育30 min,吸去染液,PBS洗后在荧光倒置显微镜下观察。
1.2.9 透射电镜观察细胞样本将处理好的细胞用胰酶消化后移至离心管800 r/min离心5 min后,用1.5 mL培养基重悬后转移至2 mL EP管中1200 r/min离心10 min,小心吸去上清液,并沿管壁缓缓加入固定液,注意不要吹散细胞团块,将标本送电镜室制样后续透射电镜(日本电子透射电镜JEM-1400Plus)下观察。
1.3 统计学分析实验均重复3次,数据以 x±s表示,采用Graphpad Prism 9.0对数据进行处理,多组均数比较采用方差分析,两组数据间差异采用非配对t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 抑制CHRM1可降低前列腺癌细胞活力对不同时间、浓度PIN处理后的PC-3细胞进行CCK-8检测,发现细胞活力随PIN处理浓度增加而降低(P < 0.05,图 1A);相反,随BETH处理浓度增加,细胞活力在一定浓度范围内逐渐升高(P < 0.05,图 1B)。这说明抑制CHRM1可降低前列腺癌PC-3细胞活力,激动CHRM1可增加前列腺癌PC-3细胞活力。
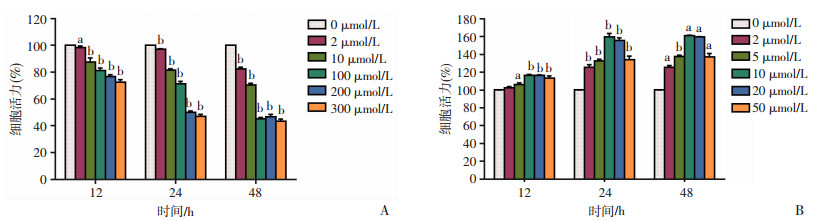
|
| a: P < 0.05,b: P < 0.01,与对照组(0 μmol/L)比较; A:PIN处理后PC-3的细胞活力;B:BETH处理后PC-3的细胞活力 图 1 CCK-8检测不同时间、不同浓度CHRM1抑制剂与激动剂对PC-3细胞活力的影响 |
2.2 抑制CHRM1可提高PI阳性细胞率
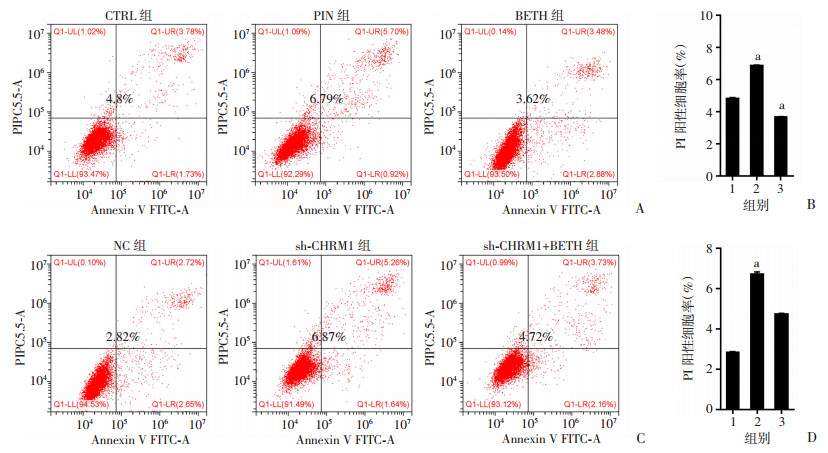
通过慢病毒感染PC-3细胞构建CHRM1的稳定敲低细胞模型(图 2C、D)。对各组细胞进行Hoechst-PI双染以及流式细胞术染Annexin V-PI检测PI阳性细胞率,结果发现与CTRL组比较,PIN组的PI阳性细胞率显著提升,而BETH组的PI阳性细胞率明显下降(P < 0.01,图 2A、B;图 3A、B);与NC组比较,sh-CHRM1组的PI阳性细胞率也显著上升(P < 0.01,图 2E、F;图 3C、D)。结果提示我们抑制CHRM1可提高前列腺癌PI阳性细胞率。

|
| a: P < 0.01,与CTRL组或NC组比较; A、B: Hoechst-PI双染PC-3细胞后检测PI阳性率及统计分析图 1: CTRL组;2:PIN组;3:BETH组;C、D: Western blot检测CHRM1敲低效率及蛋白半定量分析;E、F: Hoechst-PI双染敲低CHRM1各组检测PI阳性率及统计分析图 1: NC组;2:sh-CHRM1组;3:sh-CHRM1+BETH组 图 2 药物抑制CHRM1及敲低CHRM1后Hoechst-PI双染检测PI阳性细胞率 |
|
| a: P < 0.01,与CTRL组或NC组比较 A、B:加药处理组细胞PI阳性率及统计分析 1: CTRL组;2:PIN组;3:BETH组;C、D:敲低组细胞PI阳性率及统计分析;1: NC组;2:sh-CHRM1组;3:sh-CHRM1+BETH组 图 3 Annexin V-PI流式细胞术检测抑制CHRM1后PI阳性细胞率 |
2.3 抑制CHRM1可提高LDH释放水平
按需处理细胞24 h后,检测各组细胞LDH释放水平。结果提示PIN处理组细胞LDH释放水平显著增高,BETH处理组LDH释放水平降低(P < 0.01,图 4A),sh-CHRM1组LDH释放水平较NC组升高(P < 0.01,图 4B),提示抑制CHRM1可提高LDH释放水平。
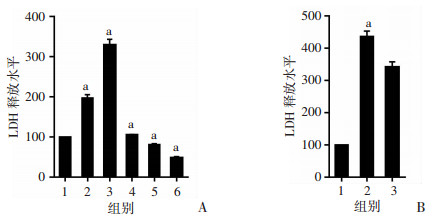
|
| A: PC-3细胞不同处理后LDH释放水平 1:对照组;2、3:分别为100、200 μmol/L PIN处理组;4~6:分别为2、5、10 μmol/L BETH处理组;a: P < 0.01,与对照组比较;B:抑制CHRM1后细胞LDH释放水平分析 a: P < 0.01,与NC组比较;1: NC组;2:sh-CHRM1组;3:sh-CHRM1+BETH组 图 4 LDH释放试验检测各组细胞LDH释放水平 |
2.4 抑制CHRM1可诱导细胞焦亡
将PIN处理的PC-3细胞收集起来在电镜下观察其形态,发现处理后的细胞内产生大量空泡,形成气泡状突起物,细胞膨大变形,发生明显的细胞焦亡现象(图 5),证实了在前列腺癌细胞中抑制CHRM1可诱导细胞焦亡的产生。
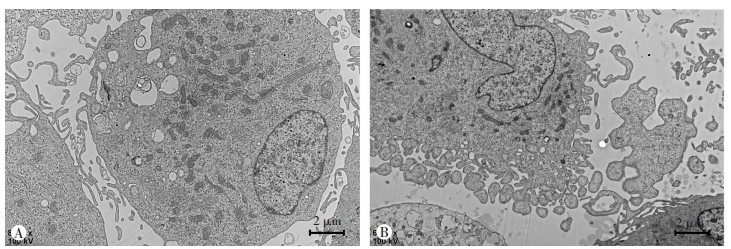
|
| A: CTRL组;B:PIN组 图 5 透射电镜检测下调CHRM1细胞焦亡现象 |
2.5 CHRM1调控焦亡与Caspase-1/GSDMD通路相关
Western blot检测各组Caspase-1/GSDMD通路相关的蛋白表达水平,发现随着PIN浓度增加,GSDMD、NLRP3、ASC、Caspase-1以及cleaved Caspase-1的表达水平呈逐渐增加的趋势,而随着BETH浓度增加,以上蛋白水平呈逐渐降低趋势(P < 0.05,图 6)。而与NC组比较,sh-CHRM1组的Caspase-1/GSDMD通路相关蛋白表达水平明显提高(P < 0.01,图 7),且有统计学意义,这说明了在前列腺癌细胞中下调CHRM1可抑制Caspase-1/GSDMD通路表达。

|
| 1:对照组;2、3:分别为100、200 μmol/L PIN处理组;4~6:分别为2、5、10 μmol/L BETH处理组;A:各组细胞Caspase-1/GSDMD通路相关蛋白表达水平;B:各组蛋白表达半定量分析 a: P < 0.05,b: P < 0.01,与对照组比较 图 6 Western blot检测CHRM1抑制剂、激动剂处理细胞后焦亡相关蛋白水平 |

|
| A:各组细胞Caspase-1/GSDMD通路相关蛋白表达水平;1:NC组;2:sh-CHRM1组;3:sh-CHRM1+BETH组;B:各组蛋白表达半定量分析,a: P < 0.01,与NC组比较 图 7 Western blot检测抑制CHRM1后细胞Caspase-1/GSDMD通路相关蛋白水平 |
2.6 CHRM1通过Caspase-1/GSDMD通路调控焦亡
用质粒转染PC-3细胞,构建敲低GSDMD的细胞系(图 8A、B),通过Hoechst-PI双染实验(图 8C、D)、LDH释放实验(图 8E)、流式细胞术Annexin V-PI染色(图 9)检测处理后各组PI阳性细胞率和LDH释放水平。与NC组比较,LPS组和PIN处理组PI阳性细胞率、LDH释放水平显著升高(P < 0.01),而si-GSDMD组的PI阳性细胞率、LDH释放水平明显下调(P < 0.05),加入CHRM1特异性抑制剂PIN仍不能使水平回复,提示细胞中敲低GSDMD后,原本下调CHRM1诱导的细胞焦亡现象消失。同时,Western blot检测结果(图 10)显示,与NC组比较,LPS组和PIN处理组GSDMD、NLRP3、ASC、Caspase-1、cleaved-Caspase-1表达水平显著上升(P < 0.01),而si-GSDMD组相关蛋白表达水平明显下调(P < 0.01),且在si-GSDMD细胞中加入PIN处理并未使之有明显水平回复。这说明敲低GSDMD抑制了CHRM1所调控的细胞焦亡作用,提示下调CHRM1通过GSDMD/Caspase-1通路调控细胞焦亡。
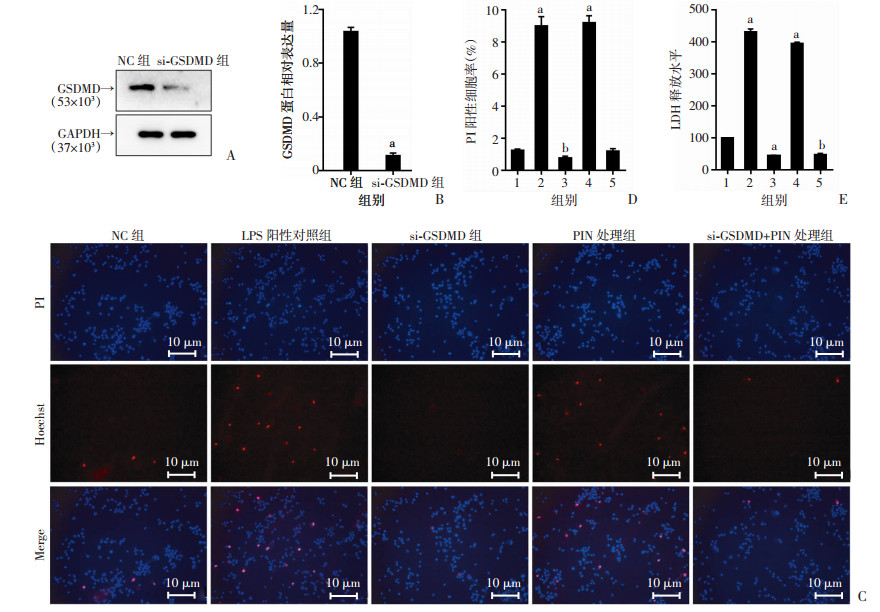
|
| 1:NC组;2:LPS阳性对照组;3:si-GSDMD组;4:PIN处理组;5:si-GSDMD+PIN处理组;A、B:GSDMD敲低效率的Western blot检测结果及蛋白半定量分析, a: P < 0.01,与NC组比较;C:Hoechst-PI双染处理各组细胞;D:PI阳性细胞率统计分析, a: P < 0.01,b: P < 0.05,与NC对照组比较;E:各组细胞LDH释放水平, a: P < 0.01,与NC对照组比较 图 8 敲低GSDMD后Hoechst-PI染色检测各组PI阳性细胞率及LDH释放水平 |
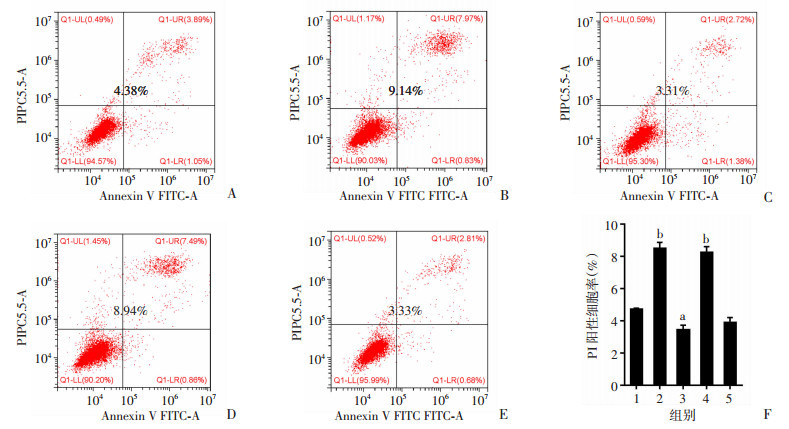
|
| A~E:依次为NC对照组、LPS阳性对照组、si-GSDMD组、PIN处理组、si-GSDMD+PIN组PI阳性细胞;F: PI阳性细胞率分析, 1:NC组;2:LPS组;3:si-GSDMD组;4:PIN处理组;5:si-GSDMD+PIN处理组; a: P < 0.05,b: P < 0.01,与NC组比较 图 9 流式细胞术检测敲低GSDMD后各组PI阳性细胞率 |
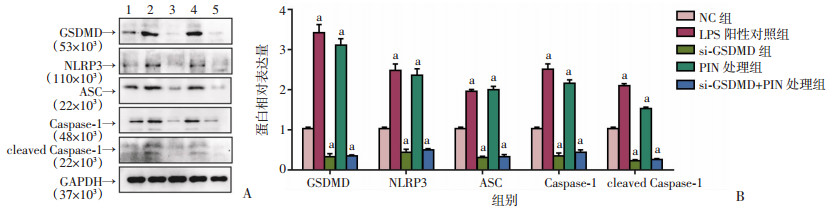
|
| A:各组细胞GSDMD/Caspase-1通路相关蛋白表达水平; 1:NC组;2:LPS阳性对照组;3:si-GSDMD组;4:PIN处理组;5:si-GSDMD+PIN处理组;B:各组蛋白表达半定量分析; a: P < 0.01,与NC组比较 图 10 Western blot检测si-GSDMD组细胞GSDMD/Caspase-1通路相关蛋白水平 |
3 讨论
副交感神经受体与癌症的发生进展有着密不可分的联系,胆碱能受体依赖的信号通路在细胞增殖和癌症进展中发挥不可替代的作用,以胆碱能受体为靶点进行用药治疗的方式已经应用在各种疾病中[12]。已知存在M1~M5等多种胆碱能受体,而在正常前列腺组织和前列腺癌组织中最主要表达的为副交感神经M1受体[13]。在两种前列腺癌小鼠模型中,CHRM1的缺陷显著抑制了胆碱能受体介导的前列腺癌侵袭和转移,提示CHRM1特异性的拮抗剂或可指导临床对肿瘤的治疗[12]。由此,本研究选择CHRM1特异性抑制剂哌仑西平和激动剂氯贝胆碱处理PC-3细胞,通过CCK-8检测其细胞活力,确定了抑制CHRM1可使前列腺癌PC-3细胞增殖能力在一定范围内呈时间和浓度依赖性降低,激活CHRM1使其在一定范围内呈时间和浓度依赖性增加。这提示抑制CHRM1可抑制前列腺癌细胞增殖能力。
细胞死亡作为一种正常的细胞生理进程,能通过去除受损细胞以及清理无用的细胞器来保持细胞的自我更新和维持生命力,在肿瘤环境的调节中尤其重要[14-15]。而细胞焦亡是近几年重点研究的程序性细胞死亡方式,越来越多的证据证明细胞焦亡在多种肿瘤发生发展中起到关键作用[16]。区别于传统的死亡方式,细胞焦亡的本质是细胞的一种炎性坏死。它是由活化的特异性半胱天冬蛋白酶切割Gasdermin家族,从而在胞膜上打孔以致细胞肿胀破裂、炎性物质流出导致细胞死亡的过程,常伴胞内大量LDH释放。本研究通过LDH释放实验检测发现下调CHRM1可显著提高PC-3细胞的LDH释放率,提示CHRM1可能影响前列腺癌细胞焦亡水平;通过Hoechst-PI双染、Annexin V-PI流式细胞术检测发现下调CHRM1后PI阳性细胞率较对照组显著提升,使用激动剂激动CHRM1后PI阳性率明显下降;且通过透射电镜观测下调CHRM1后的前列腺癌PC-3细胞,发现明显细胞焦亡现象。由此说明CHRM1可以负向调控前列腺癌焦亡水平。
截至目前,人们发现细胞焦亡可通过多种通路实现,其一是经典途径Caspase-1/GSDMD通路,其二是非经典途径,可通过Caspase-4、Caspase-5、Caspase-11等通路,其三是Caspase-3/Caspase-8介导的通路等等[17]。有研究发现前列腺结节在完全转化为前列腺肿瘤之后,机体内的肿瘤细胞焦亡机制在一定刺激下会被启动[18],且在前列腺癌细胞焦亡现象中有检测到Caspase-1通路的激活[19],但具体调节的机制仍不明朗。其中,Caspase-1/GSDMD通路诱导的焦亡是由炎症小体组装介导的,伴随着GSDMD的裂解和IL-1β、IL-18的释放。炎症小体是多分子复合物,当外界环境改变时可被激活,其中,NLRP3也称为炎症小体传感器,可与前体Caspase-1以及ASC组装成典型的炎症小体完成后续的细胞反应[20]。为了探索CHRM1诱导的前列腺癌细胞焦亡是否与此通路相关,本研究通过Western blot检测Caspase-1/GSDMD通路相关的分子GSDMD、NLRP3、ASC、Caspase-1、cleaved-Caspase-1的表达,发现下调CHRM1后,以上分子蛋白水平显著上调;激动剂处理后,以上分子蛋白水平明显降低,提示抑制或敲低CHRM1后Caspase-1/GSDMD通路可被激活。
为了明确CHRM1是否通过Caspase-1/GSDMD通路诱导前列腺癌细胞焦亡从而调控前列腺癌发展,本实验通过质粒转染敲低PC-3细胞中的GSDMD,并设置各对照组及实验组,再次通过Hoechst-PI双染、Annexin V-PI流式细胞术、LDH释放实验以及Western blot检测Caspase-1/GSDMD通路蛋白表达水平,发现敲低组各种相关指标水平的差异性表达非常显著,且敲低GSDMD后再抑制CHRM1无法再激活前列腺癌细胞焦亡。这有效证明CHRM1是通过调控Caspase-1/GSDMD通路实现前列腺癌细胞焦亡过程。
目前CHRM1抑制剂对于前列腺癌治疗作用的探索还处于基础研究阶段,仍需要进一步的体内实验及临床研究验证。本研究发现CHRM1能够通过Caspase-1/GSDMD通路负向调控前列腺癌细胞焦亡影响前列腺癌发展过程,有望为预防和治疗前列腺癌提供新的研究思路。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. |
| [2] |
YANG Y Y, LIU K Y, LIU Q, et al. Androgen receptor-related non-coding RNAs in prostate cancer[J]. Front Cell Dev Biol, 2021, 9: 660853. |
| [3] |
MAGNON C, HALL S J, LIN J, et al. Autonomic nerve development contributes to prostate cancer progression[J]. Science, 2013, 341(6142): 1236361. |
| [4] |
PENNEFATHER J N, LAU W A, MITCHELSON F, et al. The autonomic and sensory innervation of the smooth muscle of the prostate gland: a review of pharmacological and histological studies[J]. J Auton Pharmacol, 2000, 20(4): 193-206. |
| [5] |
张咪, 王千慧, 陈津滢, 等. 交感神经β2肾上腺素受体促进前列腺癌转移并抵抗肿瘤细胞的凋亡[J]. 第三军医大学学报, 2019, 41(21): 2051-2060. ZHANG M, WANG Q H, CHEN J Y, et al. Sympathetic β2 adrenergic receptor promotes prostate cancer metastasis and resists tumor cell apoptosis[J]. J Third Mil Med Univ, 2019, 41(21): 2051-2060. |
| [6] |
BAIG A M, IQBAL J, KHAN N A. In vitro efficacies of clinically available drugs against growth and viability of an Acanthamoeba castellanii keratitis isolate belonging to the T4 genotype[J]. Antimicrob Agents Chemother, 2013, 57(8): 3561-3567. |
| [7] |
ESPAÑOL A J, DE LA TORRE E, FISZMAN G L, et al. Role of non-neuronal cholinergic system in breast cancer progression[J]. Life Sci, 2007, 80(24/25): 2281-2285. |
| [8] |
KAMIYA A, HIYAMA T, FUJIMURA A, et al. Sympathetic and parasympathetic innervation in cancer: therapeutic implications[J]. Clin Auton Res, 2021, 31(2): 165-178. |
| [9] |
KAMIYA A, HAYAMA Y, KATO S, et al. Genetic manipulation of autonomic nerve fiber innervation and activity and its effect on breast cancer progression[J]. Nat Neurosci, 2019, 22(8): 1289-1305. |
| [10] |
COLE S W, NAGARAJA A S, LUTGENDORF S K, et al. Sympathetic nervous system regulation of the tumour microenvironment[J]. Nat Rev Cancer, 2015, 15(9): 563-572. |
| [11] |
BERTHELOOT D, LATZ E, FRANKLIN B S. Necroptosis, pyroptosis and apoptosis: an intricate game of cell death[J]. Cell Mol Immunol, 2021, 18(5): 1106-1121. |
| [12] |
KRUSE A C, KOBILKA B K, GAUTAM D, et al. Muscarinic acetylcholine receptors: novel opportunities for drug development[J]. Nat Rev Drug Discov, 2014, 13(7): 549-560. |
| [13] |
WITTE L P, TEITSMA C A, DE LA ROSETTE J J, et al. Muscarinic receptor subtype mRNA expression in the human prostate: association with age, pathological diagnosis, prostate size, or potentially interfering medications?[J]. Naunyn Schmiedebergs Arch Pharmacol, 2014, 387(2): 207-214. |
| [14] |
DEGTEREV A, YUAN J Y. Expansion and evolution of cell death programmes[J]. Nat Rev Mol Cell Biol, 2008, 9(5): 378-390. |
| [15] |
BEDOUI S, HEROLD M J, STRASSER A. Emerging connectivity of programmed cell death pathways and its physiological implications[J]. Nat Rev Mol Cell Biol, 2020, 21(11): 678-695. |
| [16] |
YU P, ZHANG X, LIU N, et al. Pyroptosis: mechanisms and diseases[J]. Signal Transduct Target Ther, 2021, 6(1): 128. |
| [17] |
XIA X, WANG X, CHENG Z, et al. The role of pyroptosis in cancer: pro-cancer or pro- "host"?[J]. Cell Death Dis, 2019, 10(9): 650. |
| [18] |
BERGSTRÖM S H, JÄREMO H, NILSSON M, et al. Prostate tumors downregulate microseminoprotein-beta (MSMB) in the surrounding benign prostate epithelium and this response is associated with tumor aggressiveness[J]. Prostate, 2018, 78(4): 257-265. |
| [19] |
KARAN D, TAWFIK O, DUBEY S. Expression analysis of inflammasome sensors and implication of NLRP12 inflammasome in prostate cancer[J]. Sci Rep, 2017, 7(1): 4378. |
| [20] |
FISCHER F A, CHEN K W, BEZBRADICA J S. Posttranslational andtherapeutic control of gasdermin-mediated pyroptosis and inflammation[J]. Front Immunol, 2021, 12: 661162. |




