2. 450002 郑州,河南省人民医院,河南大学人民医院,郑州大学人民医院医学遗传研究所泌尿外科;
3. 450002 郑州,河南省人民医院,河南大学人民医院,郑州大学人民医院医学遗传研究所肾内科;
4. 450002 郑州,河南省人民医院,河南大学人民医院,郑州大学人民医院医学遗传研究所神经外科
2. Department of Urology, Henan Provincial Key Laboratory of Genetic Diseases and Functional Genomics, Zhengzhou, Henan Province, 450002, China;
3. Department of Nephrology, Henan Provincial Key Laboratory of Genetic Diseases and Functional Genomics, Zhengzhou, Henan Province, 450002, China;
4. Department of Neurosurgery, Henan Provincial Key Laboratory of Genetic Diseases and Functional Genomics, Zhengzhou, Henan Province, 450002, China
常染色体显性遗传多囊肾病(autosomal dominant polycystic kidney disease,ADPKD,MIM#613095)是一种常见的遗传性疾病,全球患病率为1/1 000~1/400,主要表现为肾部囊肿渐进性增多,肾脏结构和功能不可逆受损,部分患者还伴有肝脏、胰腺囊肿[1-3]。由于缺乏有效的治疗手段,50%的患者会进展为终末期肾病[4],需要靠透析或肾移植维持生命,患者生活质量较差,经济负担加重,仅在我国就有150万ADPKD患者[5]。
ADPKD的主要致病基因是PKD1(polycystic kidney disease 1)和PKD2[6],对常染色显性遗传多囊肾病家系成员进行致病基因检测,明确致病遗传因素,通过植入前基因检测或产前指导,阻断疾病的传递,可从根本上降低ADPKD的发病率。本研究利用靶基因高通量测序技术,对3个ADPKD家系的先证者进行基因检测,分析可疑致病位点,并对家系成员进行测序验证,为3个ADPKD家系明确分子诊断,对于指导患者进行早期干预,延缓疾病进展,阻断下一代传递具有重要的意义。
1 资料与方法 1.1 研究对象3个家系来自2017-2020年河南省人民医院泌尿外科就诊的多囊肾患者。根据患者家族史及临床表现,首先对先证者行超声检查、肾功能检测,并询问病史及家族史,初步诊断为常染色体显性遗传多囊肾病,本研究经河南省人民医院伦理委员会批准(HNEECKY-2019-15-03),患者及家属知情同意,采集3个家系多名成员的外周血2~3 mL,放置在4 ℃冰箱,供基因检测,同时采集晨尿,进行尿蛋白、肾小球滤过率检测。
家系1,先证者,女性,35岁,有肾脏病家族史,超声结果显示,右肾大小约127 mm×62 mm×53 mm,左肾体积大,大小约132 mm×86 mm×62 mm,轮廓清晰,包膜完整,双肾可见多个大小不等的囊性回声(图 1A);肾功能正常,肾小球滤过率(eGFR):101 mL·min-1·1.73 m-2,尿微量白蛋白肌酐比(ACR):25 mg/g。根据主述,家中连续4代均有多囊肾患者,呈典型的常染色体显性遗传方式。
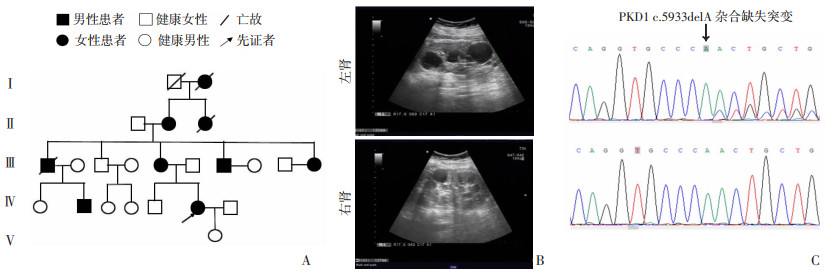
|
| A:家系图; B:先证者超声图示双侧多囊;C:Sanger测序图上图为家系1患者测序代表图,下图为家系正常成员测序代表图,箭头示核苷酸缺失位置 图 1 家系1的临床资料及Sanger测序图 |
家系2,先证者,男性,42岁,有肾脏病家族史,超声结果显示,双侧肾体积增大,右肾大小约235 mm×199 mm×109 mm,左肾大小约216 mm×157 mm×101 mm,形态饱满,包膜光滑,双侧可见多个大小不等的囊性回声(图 2A)。肾功能中度受损,eGFR: 56 mL·min-1·1.73 m-2,ACR:30 mg/g。
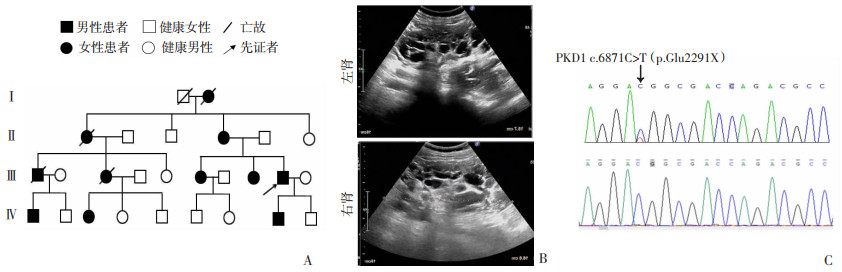
|
| A:家系图; B:先证者超声图示双侧多囊;右肾长约157 mm,左肾长约166 mm,形态失常,正常结构消失,双侧多囊;C:Sanger测序图上图为家系2患者测序代表图,下图为家系正常成员测序代表图,箭头示突变位点 图 2 家系2的临床资料及Sanger测序图 |
家系3,先证者,女性,42岁,尿毒症后期,有肾脏多囊家族史,双肾体积增大,右肾长约157 mm,左肾长约166 mm,形态失常,正常结构消失,代之多个大小不等的囊性回声(图 3A),肝内布满大小不等囊性回声,以小囊为主。肾功能严重受损,eGFR:4.4 mL·min-1·1.73 m-2,ACR:400 mg/g。
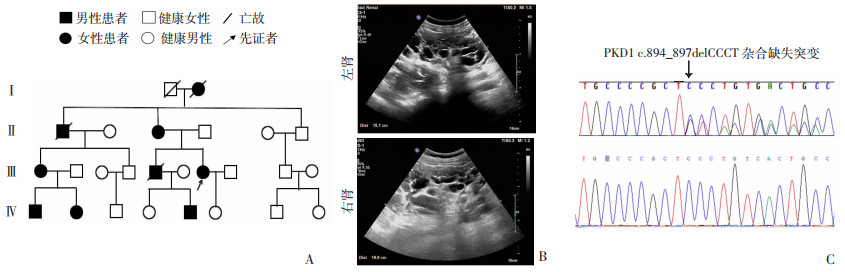
|
| A:家系图; B:先证者超声图示双侧多囊;C:Sanger测序图上图为家系3患者测序代表图,下图为家系正常成员测序代表图,箭头示变异核苷酸 图 3 家系3的临床资料及Sanger测序图 |
1.2 研究方法 1.2.1 先症者靶基因高通量测序
根据德国QIAGEN公司的QIAmp DNA mini kit(QIAGEN,德国)试剂盒操作说明书,从外周血中提取基因组DNA;按照Ion AmpliSeqTM Library Kit 2.0试剂盒的操作方法,构建包括PKD1和PKD2基因全部外显子及剪切区域的文库,并对文库进行扩增及富集;使用Ion PGM Hi-Q View Sequencing 200 Kit v2(Catalog No.A30043;美国Life Technologies公司)在Ion Torrent PGM平台上进行测序反应。采用the Ion Torrent Suite TM v3.6分析系统对测序结果进行分析。检测出的变异,去除同义突变,去除基因携带频率>5%的突变(参考数据库为dbSNP138,1000 Genomes,ExAC东亚人群基因突变频率)后,并用Mutation Taster(http://www.mutationtaster.org)、Polyphon、Shift软件预测其功能。
1.2.2 Sanger测序验证针对高通量测序结果检出的可疑致病突变设计引物,进行PCR扩增:每25 μL含0.25 μL Primer STARⓡ HS DNA Polymerase, 1.25 μL上下游引物,2.5 μL PCR缓冲液,1 μL GCBuffer, 1 μL基因组DNA 50~100 ng,2.5 μL dNTP,去离子水补至25 μL。扩增条件:95 ℃预变形5 min;95 ℃变性5 min,60 ℃退火40 s,72 ℃延伸40 s,共35轮循环,最后72 ℃延伸5 min。反应产物纯化后,在ABI3730测序仪上测序,并用Sequencher 4.9进行序列比对分析。
1.2.3 变异致病性分析根据美国医学遗传与基因组学会(The American College of Medical Genetics and Genomics,ACMG)制定的遗传变异分类标准与指南对变异进行分级。
2 结果 2.1 家系临床表型分析根据先证者主述,家系1有9人患有多囊肾病,其中男性3人,女性6人;家系2有11人患有多囊肾病,男性4人,女性7人;家系3有9人患病,男性4人,女性5人,3个家系均符合常染色体显性遗传模式(图 1A、2A、3A)即多代遗传,与性别无关。超声结果显示,3个家系的先证者双侧肾均有不同程度的多囊(图 1B、2B、3B)。根据慢性肾脏病分期标准,家系1先证者肾功能正常;家系2先证者双侧肾体积增大,肾功能中度受损,属G3a期;家系3先证者肾功能严重受损,属G5期(表 1)。
| 先证者 | 年龄/岁 | 性别 | 临床分期 | 变异在外显子的位置 | 核苷酸变化 | 氨基酸变化 | 变异类型 | 纯合/杂合 | ACMG分级 |
| 家系1 | 35 | 女 | G1 | 15 | c.5933delA | p. N1978fs*36 | 移码 | 杂合 | 可能致病 |
| 家系2 | 42 | 男 | G3a | 15 | c.6871C>T | p.Gln2291X | 无义 | 杂合 | 致病 |
| 家系3 | 42 | 女 | G5 | 5 | c.894_897delCCCT | p. P299fs*34 | 移码 | 杂合 | 可能致病 |
2.2 靶基因测序结果分析
对来自3个家系的先证者进行靶基因测序分析,发现家系1先证者PKD1基因15号外显子存在c.5933delA(N1978fs*36)杂合缺失突变,家系2先证者PKD1基因15号外显子存在c.6871C>T(G2291X)杂合无义突变,家系3先证者的PKD1基因5号外显子存在c.894_897delCCCT(P299fs*34)杂合缺失变异(表 1)。检索NCBI、人类遗传疾病突变数据库(Human Gene Mutation Database,HGMD)和常染色体显性遗传多囊肾数据库(ADPKD Mutation Database)表明,c.6871C>T(Glu2291X)位点的无义变异为已知致病突变,c.894_897delCCCT和c.5933delA未见相关报道。Mutation Taster预测PKD1基因c.894_897delCCCT和c.5933delA两个位点杂合缺失变异致病可能性大。
2.3 家系成员致病位点分析对家系1、2、3的先证者及其家系成员的PKD1基因相应突变进行Sanger测序分析。结果显示:家系1患者(Ⅱ-1、Ⅲ-1、Ⅲ-7、Ⅳ-1、Ⅳ-2、Ⅳ-5,图 1C)均检测到c.5933delA缺失变异;家系2患者(Ⅱ-4、Ⅲ-6、Ⅲ-8、Ⅲ-9、Ⅳ-1、Ⅳ-3、Ⅳ-8,图 2C)样本中检测到c.6871C>T(G2291X)无义突变;家系3患者(Ⅱ-3、Ⅲ-1、Ⅲ-7、Ⅳ-1、Ⅳ-2、Ⅳ-5,图 3C)样本检测到c.894_897delCCCT缺失变异,3个家系的无症状者成员均不携带此变异,符合表型和基因型相分离的特点。
根据美国医学遗传学会(American College of Medical Genetics and Genomics,ACMG)关于遗传变异分类标准,我们认为其中2个移码突变可能为致病性变异,依据如下:经检索ExAC和1000G数据库,均未发现该变异,符合PM2;该2个缺失变异均导致其编码的蛋白质长度发生截断,符合PM4;家系多个患者中检测到此变异,变异与疾病在家系中共分离,符合PP1;Mutation Taster软件预测,该2个缺失移码变异具有致病性,属于PP3;家系患者符合ADPKD的临床表现,提供支持致病性证据PP4。综合以上分析,该2个突变为PM2+ PM4+PP1+ PP3+PP4,符合可能致病性突变的诊断标准(表 1),很可能是家系1及家系3的致病突变。经查阅文献和数据库,该2个变异未见报道,为新突变。
3 讨论遗传性多囊肾病(APKD)主要有两种遗传模式,即常染色体显性遗传(ADPKD)多囊肾病和常染色体隐性遗传(ARPKD)多囊肾病。ARPKD主要致病基因是PKDH1[7],发病率只有1/40 000~1/20 000,多数早年夭折,很少存活至成年;ADPKD发病率相对较高,有明显的家族发病特征,发病时间较晚,主要致病基因是PKD1和PKD2。其中约85% ADPKD患者是由PKD1基因突变导致的,仅有约15%的ADPKD是由PKD2基因突变引起的[8-9]。患有这种疾病的人大约有一半会发展为终末期肾脏疾病,需要进行透析或肾移植。患者进展为终末期肾病通常发生在40~60岁之间[10]。治疗方面,有临床研究发现,血管加压素V2受体抑制剂托伐普坦,能降低细胞内cAMP的水平,可延缓ADPKD进展,但不良反应发生率高,因此至今尚没有理想的控制ADPKD进展的药物[11]。目前,临床上尚无有效的治疗方法,只能对症处理。由于该病发病晚,早发现、早预防或避免致病基因向下一代传递都依赖于致病基因的明确诊断。
本研究在2个ADPKD家系中分别发现了PKD1基因的2个新缺失移码突变,即c.894_897delCCCT(p.299Sfs*34)和c.5933delA(p.N1978Tfs*138)。据梅奥多囊肾数据库(ADPKD Mutation Database)统计,移码突变(449个)占收录的1 273个PKD1致病变异的35.3%,是PKD1突变的常见类型。PKD1编码多囊蛋白PC1,属于跨膜蛋白,由4 303个氨基酸组成,结构类似G粘连蛋白偶联受体(GPCRs)[12-13],PC1和PC2(PKD2编码蛋白)的羧基端在胞内形成异二聚体,调控胞内液体和Ca2+的流入。研究表明,PC1和PC2结构变化可能影响G蛋白和cAMP信号通路从而导致囊肿生成[14]。该2个移码突变均位于PKD1基因编码的PC1蛋白胞外N端区域,其对蛋白功能的影响,尚需要进一步功能实验进行分析。
研究报道,PKD1截断、PKD1框内插入/删除、PKD1非截断发生率分别为38.3%、4.3%、27.1%[15],并且相关研究显示PKD1突变类型与肾脏表型之间具有较强的相关性,PKD1基因突变的男性患者会更早进展到ESRD,与PKD1截断突变的患者相比,PKD1框内插入/缺失、PKD1非截断的患者具有较小的ESRD风险。在3个家系中,家系1和家系3为移码后发生的截断,家系2为无义突变导致的PKD1截断,符合多数突变类型为PKD1截断的报道。目前,家系2和家系3的肾脏病分期为G3a和G5期,表现为较严重的肾脏功能损害。家系1虽然也是PKD1截断突变,其肾脏功能尚无明显影响,鉴于本研究只有3例家系,尚需要更多的基因型-表型的数据来支持以上结论。
此外,PKD1和PKD2存在单个或多个外显子缺失或重复类型,基于高通量测序的基因检测不能检出该种突变,需要应用多重连接探针扩增技术(multiplex ligation-dependent probe amplification,MLPA)针对PKD1和PKD2进行检测,进而发现该种变异。我们建议,对于临床表现符合多囊肾诊断,而高通量测序检出阴性的病例,应利用后者对阴性病例进行筛查,以排除微重复和微缺失所导致的ADPKD。
总之,本研究丰富了PKD1的突变谱,也为3个多囊肾家系后续进行遗传咨询、家系中未发病患者的早期预防和治疗,以及产前诊断提供了有力的实验室证据。
| [1] |
CORNEC-LE GALL E, AUDRÉZET M P, LE MEUR Y, et al. Genetics and pathogenesis of autosomal dominant polycystic kidney disease: 20 years on[J]. Hum Mutat, 2014, 35(12): 1393-1406. |
| [2] |
BERGMANN C, GUAY-WOODFORD L M, HARRIS P C, et al. Polycystic kidney disease[J]. Nat Rev Dis Primers, 2018, 4(1): 50. |
| [3] |
NOBAKHT N, HANNA R M, AL-BAGHDADI M, et al. Advances in autosomal dominant polycystic kidney disease: a clinical review[J]. Kidney Med, 2020, 2(2): 196-208. |
| [4] |
BRAUN W E. Autosomal dominant polycystic kidney disease: emerging concepts of pathogenesis and new treatments[J]. Cleve Clin J Med, 2009, 76(2): 97-104. |
| [5] |
徐德超, 马熠熠, 梅长林. 托伐普坦治疗快速进展型常染色体显性多囊肾病的临床实践指南解读[J]. 中华肾脏病杂志, 2019, 35(5): 387-392. XU D C, MA Y Y, MEI C L. Interpretation of the clinical practice guideline for treatment of rapidly progressive autosomal dominant polycystic kidney disease with tolvaptan[J]. Chin J Nephrol, 2019, 35(5): 387-392. |
| [6] |
TORRES V E, HARRIS P C. Progress in the understanding of polycystic kidney disease[J]. Nat Rev Nephrol, 2019, 15(2): 70-72. |
| [7] |
PALYGIN O, ILATOVSKAYA D V, LEVCHENKO V, et al. Characterization of purinergic receptor expression in ARPKD cystic epithelia[J]. Purinergic Signal, 2018, 14(4): 485-497. |
| [8] |
LEUNG J. Inherited renal diseases[J]. Curr Pediatr Rev, 2014, 10(2): 95-100. |
| [9] |
XUE C, ZHOU C C, WU M, et al. The clinical manifestation and management of autosomal dominant polycystic kidney disease in China[J]. Kidney Dis (Basel), 2016, 2(3): 111-119. |
| [10] |
胡胜, 李东杰, 谭新骥, 等. 常染色体显性遗传多囊肾病的研究进展[J]. 中南大学学报(医学版), 2019, 44(10): 1179-1187. HU S, LI D J, TAN X J, et al. Research progress in autosomal dominant polycystic kidney disease[J]. J Central South Univ Med Sci, 2019, 44(10): 1179-1187. |
| [11] |
GRANTHAM J J, CHAPMAN A B, BLAIS J, et al. Tolvaptan suppresses monocyte chemotactic protein-1 excretion in autosomal-dominant polycystic kidney disease[J]. Nephrol Dial Transplant, 2017, 32(6): 969-975. |
| [12] |
GRANTHAM J J. Autosomal dominant polycystic kidney disease[J]. N Engl J Med, 2008, 359(14): 1477-1485. |
| [13] |
SU Q, HU F Z, GE X F, et al. Structure of the human PKD1-PKD2 complex[J]. Science, 2018, 361(6406): eaat9819. |
| [14] |
王秋菊, 沈亦平, 邬玲仟, 等. 遗传变异分类标准与指南[J]. 中国科学: 生命科学, 2017, 47(6): 668-688. WANG Q J, SHEN Y P, WU L Q, et al. Classification criteria and guidelines for genetic variation[J]. Sci Sin Vitae, 2017, 47(6): 668-688. |
| [15] |
HWANG Y H, CONKLIN J, CHAN W, et al. Refining genotype-phenotype correlation in autosomal dominant polycystic kidney disease[J]. J Am Soc Nephrol, 2016, 27(6): 1861-1868. |




