肺癌是全球最常见的恶性肿瘤之一[1]。2018年全球癌症统计数据显示中国诊断肺癌104万人,因肺癌致死92.1万人[2]。肿瘤细胞的侵袭是肿瘤细胞恶性行为之一,是导致患者不良预后的主要原因[3]。有研究发现烟草烟雾(cigarette smoke extract, CSE)暴露与肺癌细胞侵袭、转移密切相关[4-5],但具体机制不明。近年来炎症反应在肿瘤侵袭、转移中的作用被广泛关注[6],NLRP3炎症小体是一种由细胞内免疫受体NLRP3、连接蛋白ASC和蛋白酶Caspase-1组成的多蛋白复合物。该复合物的组装可诱导IL-1β促炎症因子的成熟和分泌,从而启动和参与炎症反应的核心环节[7]。研究表明,激活NLRP3炎症小体在促进肺癌细胞A549增殖、迁移、侵袭中发挥重要作用[8]。然而,NLRP3炎症小体在烟草烟雾暴露诱导的肺癌侵袭中的作用还少见报道。本研究探讨烟草烟雾提取物对PC-9细胞侵袭,以及对PC-9细胞中NLRP3炎性小体复合物和MMP-2表达的影响,再通过MCC950抑制NLRP3炎性小体活性,观察烟草烟雾提取物对PC-9细胞侵袭的影响,以期发现烟草烟雾暴露诱导肺癌侵袭性增强的机制并寻找新的干预靶点。
1 材料与方法 1.1 材料与试剂人肺腺癌细胞(PC-9)来源于何勇教授实验团队(陆军军医大学第三附属医院呼吸科实验室)。高糖Dulbecco’s modified Eagle’s medium (DMEM) 培养基和胎牛血清购自澳洲GIBCO;Transwell小室购自美国Corning公司;Matrigel胶购自美国BD公司;SDS-PAGE凝胶配置试剂盒购自碧云天生物技术研究所;PVDF膜购自美国Milipore;NLRP3、GAPDH、MMP-2抗体以及辣根过氧化物酶标记山羊抗兔IgG购于美国Abcam;Caspase-1/p20, mature IL-1β由中国万类生物有限公司提供;MCC950购自美国Med Chem Express Co;龙凤呈祥牌香烟购自重庆烟草公司。
1.2 方法 1.2.1 细胞培养及烟草烟雾制备配制含10%胎牛血清的完全培养基用于体外培养PC-9细胞。于培养箱中(培养条件:37 ℃,5% CO2及饱和湿度)培养2~3 d,当细胞融合度达到80%时进行传代,选择对数生长期的细胞进行后续实验。龙凤呈祥牌香烟(焦油11 mg;一氧化碳17 mg;尼古丁1.1 mg)用于制备烟草烟雾提取物。具体制备方法详见文献[9]:点燃香烟,去滤嘴,并安放于自动抽吸泵上, 使烟雾通过10 mL无血清的DMEM培养基,以DMEM培养基中产生大小均匀的气泡、每支香烟燃烧2 min为度,当10支香烟产生的烟雾通过该培养基后停止抽吸。调节pH值至7.4,使用0.22 μm的过滤器除去杂质和细菌,即得到CSE。使用Beckman DU 640分光计(美国),于320 nm处测定光密度值,为(1.36±0.12),CSE浓度为100%。根据实验需要使用DMEM培养基将100% CSE稀释至1%,2%和4% CSE。烟草提取物最好现配现用,尽量在制备好30 min内使用。
1.2.2 细胞侵袭实验将Matrigel胶稀释8倍后,包被Transwell上层小室底部膜的上室面,置于37 ℃放置30 min,使其聚合成凝胶。根据实验需求将PC-9细胞分为对照组、MCC950组、4%CSE组、4%CSE+MCC950组。其中对照组不做任何处理,MCC950组加入10 μmol/L MCC950共培养,4%CSE组加入4%CSE共培养,4%CSE+MCC950组先加入10 μmol/L MCC950预处理1 h,再加入4% CSE共培养,96 h后,将贴壁的细胞消化后,制备成细胞悬液。向Transwell上层小室中加入不含血清的培养基并植入5×104个PC-9细胞,下层小室中加入含20%胎牛血清的完全培养基。常规培养48 h,取出Transwell上层小室,用PBS清洗2次,0.1%结晶紫染色30 min,用棉签擦掉上层未迁移的细胞,400倍显微镜下随机选择5个视野观察细胞并计数。
1.2.3 Western blot实验收集PC-9细胞,并加入细胞裂解液(PARP∶PMSF =100∶1)100 μL并于冰上裂解30 min,随后于4 ℃低温离心机中以12 000 r/min离心15 min,吸取上清液,测定蛋白浓度(BCA法),加上样缓冲液(碧云天科技公司)煮沸10 min,使蛋白变性。将蛋白样品液加入SDS-PAGE凝胶上样孔进行电泳分离蛋白质(电泳条件:80 V恒压电泳30 min,待蛋白进入分离胶,调整电压至120 V恒压电泳1 h)。转膜(200 mA恒流转膜2 h),于室温下用5%的脱脂牛奶封闭蛋白膜2 h。一抗4 ℃孵育过夜。TBST缓冲液洗膜3次。加二抗于室温下孵育2 h,滴上超敏发光底物液于蛋白膜上显示荧光,用凝胶成像仪(Bio-Rad Laboratories, Hercules, CA, USA)捕捉荧光并成像。运用凝胶成像分析系统计算条带的灰度值,目的条带灰度值/内参灰度值=蛋白质相对表达水平。
1.3 统计学分析使用Graphpad Prism 5.01软件对实验数据进行统计学分析,数据以x±s表示。多组间比较采用单因素方差分析和Student-t检验,多重比较采用Turkey’s检验。当P < 0.05时,认为差异有统计学意义。
2 结果 2.1 CSE诱导肺腺癌PC-9细胞侵袭性增加将1%、2%、4% CSE与PC-9细胞共培养96 h后,检测细胞侵袭性。Transwell实验结果示: 与正常对照组(0% CSE)相比,经1%、2%、4% CSE处理后发生侵袭的PC-9细胞明显增加,细胞侵袭能力呈浓度依赖性增加,差异有统计学意义(P < 0.05),见图 1。
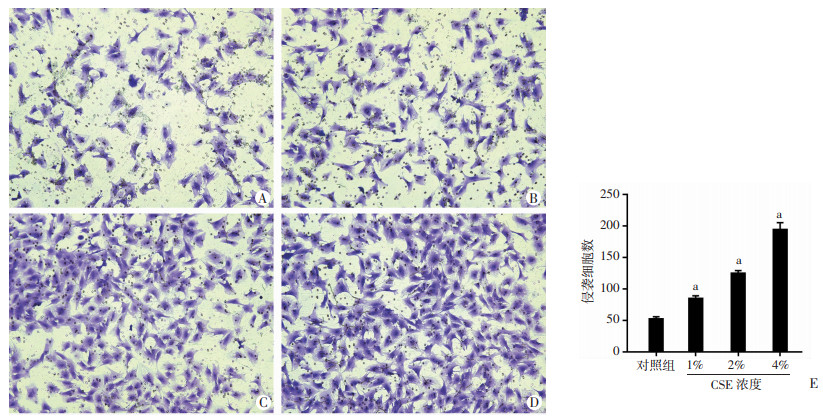
|
| A~D:倒置显微镜下观察侵袭的细胞(×200);A: 对照组; B~D: 分别为1%、2%、4% CSE处理组;E: 统计分析发生侵袭的细胞数a: P < 0.01,与对照组比较 图 1 倒置显微镜下观察CSE对PC-9细胞侵袭能力的影响 |
2.2 CSE诱导PC-9细胞NLRP3、Caspase-1、IL-β和MMP-2表达增加
将1%、2%、4% CSE与PC-9细胞共培养96 h后,Western blot检测PC-9细胞中NLRP3、Caspase-1、IL-β和MMP-2蛋白水平。Western blot实验结果示: 与正常对照组(未经CSE处理)相比,经1%、2%、4% CSE处理后PC-9细胞中NLRP3、Caspase-1、IL-1β和MMP-2蛋白表达明显升高,差异有统计学意义(P < 0.05),见图 2。
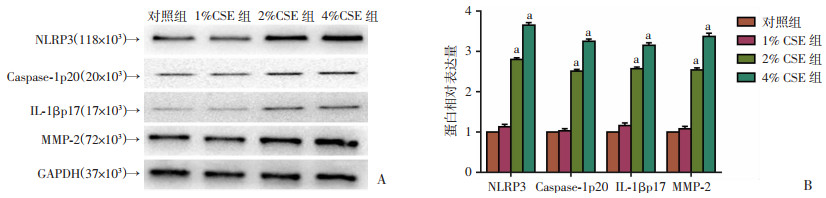
|
| A:Western blot检测;B:半定量分析a: P < 0.01,与对照组比较 图 2 Western blot检测NLRP3炎性小体相关蛋白表达 |
2.3 MCC950可以逆转CSE诱导的PC-9细胞侵袭性增强
MCC950是一种有效、选择性的NLRP3抑制剂。将10 μmol/L MCC950加入PC-9细胞中预处理1 h,再加入4%CSE共培养96 h后,检测细胞侵袭性。Transwell实验结果示: 与正常对照组相比,4%CSE处理后发生侵袭的PC-9细胞明显增加,MCC950干预后,可显著减少发生侵袭的PC-9细胞,差异有统计学意义(P < 0.05),见图 3。

|
| A~D:倒置显微镜下观察发生侵袭的PC-9细胞(×200);A: 对照组; B~D: 分别为MCC950、4%CSE、4%CSE+MCC950处理组;E: 统计分析发生侵袭的细胞数a: P < 0.01,与对照组比较; b: P < 0.01,与4%CSE组比较 图 3 倒置显微镜下观察CSE和MCC950对PC-9细胞侵袭能力的影响 |
2.4 MCC950抑制CSE诱导PC-9细胞NLRP3、Caspase-1、IL-β和MMP-2表达增加
将10 μmol/L MCC950加入PC-9细胞中预处理1 h,再加入4% CSE共培养96 h后,Western blot检测PC-9细胞中NLRP3、Caspase-1、IL-1β和MMP-2蛋白水平。Western blot实验结果示: 与正常对照组相比,4.0% CSE处理后PC-9细胞中NLRP3、Caspase-1、IL-1β和MMP-2蛋白表达明显升高,经MCC950干预后,可显著抑制CSE诱导的NLRP3、Caspase-1、IL-1β和MMP-2蛋白表达增加,差异有统计学意义(P < 0.05),见图 4。
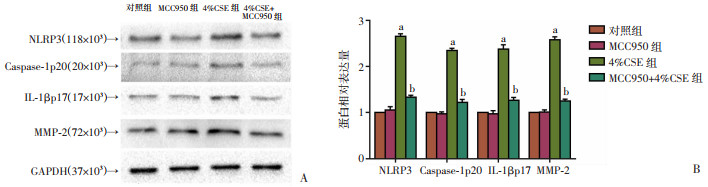
|
| A:Western blot检测;B:半定量分析a: P < 0.01,与对照组比较;b: P < 0.01,与4%CSE组比较 图 4 Western blot检测NLRP3炎性小体相关蛋白及MMP-2蛋白表达 |
3 讨论
肿瘤细胞侵袭、转移是肿瘤的恶性行为之一,也是导致患者不良预后及死亡的主要原因[10-12]。烟草烟雾成分中至少含有69种致癌物质,包括氨、镉、镍、尼古丁、稠环芳香烃和N-亚硝基胺等,不仅会导致癌症,还与肿瘤的侵袭和转移的发生密切相关[3]。吸烟会增加前列腺癌转移的风险[13],烟草烟雾暴露增加乳腺癌细胞转移能力[14]。有研究报道烟草烟雾提取可增强肺癌细胞的侵袭和转移能力[15]。与既往的文献报道一致的是,本研究发现CSE诱导肺癌PC-9细胞侵袭能力呈浓度依赖性增强。
炎症在肿瘤的侵袭、转移中发挥重要作用。研究表明,慢性炎症可触发一系列分子事件,导致分化细胞恶性转化,抑制抗肿瘤免疫,最终导致肿瘤的发生和转移[16-17]。炎性小体是炎症反应中重要组成部分。NLRP3炎症体是由细胞内固有免疫受体NLRP3、接头蛋白ASC和蛋白酶Caspase-1组成的多蛋白复合体。这种复合体的组装可以诱导促炎因子如IL-1β的成熟和分泌,从而促进炎症反应的发生[7]。烟草烟雾中含有大量的活性氧和有毒物质,可促进机体组织发生炎症反应。研究发现CSE可以激活NLRP3炎性小体诱导人支气管上皮细胞焦亡[18]。本研究也发现,CSE提取物可诱导肺腺癌细胞中NLRP3炎性小体活化。
既往的研究表明NLRP3炎性小体的激活与肿瘤的侵袭、转移密切相关[19]。DENG等[20]发现在乳腺癌细胞中损伤的、产生ROS的线粒体聚集激活NLRP3炎性小体,导致可溶性细胞因子的异常分泌,进而促进破骨细胞的分化和成熟,最终导致骨转移。有研究报道细菌脂多糖(LPS)激活NLRP3炎性小体并促进肿瘤的侵袭和转移[21]。基质金属蛋白酶2 (MMP-2)是MMPs家族的主要成员之一,其降解细胞外基质的功能特点为肿瘤侵入组织与转移提供了条件[22]。活化的NLRP3炎症小体可促进MMP-2的产生[23]。本研究发现,CSE提取物可诱导肺腺癌PC-9细胞中MMP-2表达增加,抑制NLRP3的活性可显著降低CSE诱导的PC-9侵袭活性与MMP-2的表达。
综上所述,烟草烟雾暴露可以促进肺腺癌细胞PC-9侵袭性增加,其机制可能是通过激活NLRP3炎性小体,诱导MMP-2表达来介导肺腺癌PC-9细胞侵袭。通过研究NLRP3炎性小体在烟草烟雾提取物诱导的肺癌细胞侵袭中的作用,将为烟草烟雾暴露诱导的肺癌细胞转移的治疗提供新的思路和靶点。
| [1] |
LIAO H L, LIANG Y Q, KANG L, et al. miR-454-3p inhibits non-small cell lung cancer cell proliferation and metastasis by targeting TGFB2[J]. Oncol Rep, 2021, 45(5): 67. |
| [2] |
FENG R M, ZONG Y N, CAO S M, et al. Current cancer situation in China: good or bad news from the 2018 Global Cancer Statistics?[J]. Cancer Commun, 2019, 39(1): 22. |
| [3] |
LIAO K, YONG C W, HUA K. SB431542 inhibited cigarette smoke extract induced invasiveness of A549 cells via the TGF-β1/Smad2/MMP3 pathway[J]. Oncol Lett, 2018, 15(6): 9681-9686. |
| [4] |
GOPALAKRISHNA R, CHEN Z H, GUNDIMEDA U. Tobacco smoke tumor promoters, catechol and hydroquinone, induce oxidative regulation of protein kinase C and influence invasion and metastasis of lung carcinoma cells[J]. Proc Natl Acad Sci USA, 1994, 91(25): 12233-12237. |
| [5] |
师萌, 王晓慧, 邓亚菲, 等. 烟草诱导的M2型巨噬细胞对肺癌细胞侵袭转移的影响[J]. 中国细胞生物学学报, 2019, 41(6): 1107-1113. SHI M, WANG X H, DENG Y F, et al. The effects of CSE-induced M2 polarized macrophages on lung carcinoma invasion and migration[J]. Chin J Cell Biol, 2019, 41(6): 1107-1113. |
| [6] |
GOMEZ-LARRAURI A, OURO A, TRUEBA M, et al. Regulation of cell growth, survival and migration by ceramide 1-phosphate—implications in lung cancer progression and inflammation[J]. Cell Signal, 2021, 83: 109980. |
| [7] |
SHAO B Z, WANG S L, PAN P, et al. Targeting NLRP3 inflammasome in inflammatory bowel disease: putting out the fire of inflammation[J]. Inflammation, 2019, 42(4): 1147-1159. |
| [8] |
WANG X, SHAO Q H, ZHOU H, et al. Ginkgolide B inhibits lung cancer cells promotion via beclin-1-dependent autophagy[J]. BMC Complement Med Ther, 2020, 20(1): 194. |
| [9] |
廖科, 陈虹, 赵绿翠, 等. 磷脂转运蛋白参与烟草提取物诱导的Ⅱ型肺泡上皮细胞凋亡[J]. 南方医科大学学报, 2015, 35(7): 941-946. LIAO K, CHEN H, ZHAO L C, et al. Role of phospholipid transfer protein in cigarette smoke-induced apoptosis of RLE-6TN cells[J]. J South Med Univ, 2015, 35(7): 941-946. |
| [10] |
LOPEZJ I, CAMENISCH T D, STEVENS M V, et al. CD44 attenuates metastatic invasion during breast cancer progression[J]. Cancer Res, 2005, 65(15): 6755-6763. |
| [11] |
LI Y, LIU H, HUANGY Y, et al. Suppression of endoplasmic reticulum stress-induced invasion and migration of breast cancer cells through the downregulation of heparanase[J]. Int J Mol Med, 2013, 31(5): 1234-1242. |
| [12] |
LI Y, LI Y, LIU J, et al. Expression levels of microRNA-145 and microRNA-10b are associated with metastasis in non-small cell lung cancer[J]. Cancer Biol Ther, 2016, 17(3): 272-279. |
| [13] |
MOREIRAD M, ARONSON W J, TERRIS M K, et al. Cigarette smoking is associated with an increased risk of biochemical disease recurrence, metastasis, castration-resistant prostate cancer, and mortality after radical prostatectomy: results from the SEARCH database[J]. Cancer, 2014, 120(2): 197-204. |
| [14] |
DI CELLO F, FLOWERSV L, LI H L, et al. Cigarette smoke induces epithelial to mesenchymal transition and increases the metastatic ability of breast cancer cells[J]. Mol Cancer, 2013, 12: 90. |
| [15] |
GOPALAKRISHNA R, CHENZ H, GUNDIMEDA U. Tobacco smoke tumor promoters, catechol and hydroquinone, induce oxidative regulation of protein kinase C and influence invasion and metastasis of lung carcinoma cells[J]. Proc Natl Acad Sci USA, 1994, 91(25): 12233-12237. |
| [16] |
SONG X L, WEI C R, LI X Q. The potential role and status of IL-17 family cytokines in breast cancer[J]. Int Immunopharmacol, 2021, 95: 107544. |
| [17] |
买新佳, 黄婧娟, 陈洪雷. 新兴免疫检查点VISTA在肿瘤与炎症中的作用[J]. 武汉大学学报(医学版), 2020, 41(2): 275-279. MAI X J, HUANG J J, CHEN H L. Function of an emerging immune checkpoint-VISTA in the cancer and inflammation[J]. Med J Wuhan Univ, 2020, 41(2): 275-279. |
| [18] |
ZHANG M Y, JIANG Y X, YANG Y C, et al. Cigarette smoke extract induces pyroptosis in human bronchial epithelial cells through the ROS/NLRP3/caspase-1 pathway[J]. Life Sci, 2021, 269: 119090. |
| [19] |
阮萍. 炎症小体NLRP3在肿瘤中的作用[J]. 医学理论与实践, 2021, 34(1): 23-25. RUAN P. The role of NLRP3 inflammasome in tumor[J]. J Med Theory Pract, 2021, 34(1): 23-25. |
| [20] |
DENG R, ZHANGH L, HUANG J H, et al. MAPK1/3 kinase-dependent ULK1 degradation attenuates mitophagy and promotes breast cancer bone metastasis[J]. Autophagy, 2020, 1-19. |
| [21] |
LINY S, TSAI K L, CHEN J N, et al. Mangiferin inhibits lipopolysaccharide-induced epithelial-mesenchymal transition (EMT) and enhances the expression of tumor suppressor gene PER1 in non-small cell lung cancer cells[J]. Environ Toxicol, 2020, 35(10): 1070-1081. |
| [22] |
WANG M, NAIM H, HUANG R Y, et al. High-throughput functional profiling of single adherent cells via hydrogel drop-screen[J]. Lab Chip, 2021, 21(4): 764-774. |
| [23] |
MCALLISTERM J, CHEMALY M, EAKIN A J, et al. NLRP3 as a potentially novel biomarker for the management of osteoarthritis[J]. Osteoarthr Cartilage, 2018, 26(5): 612-619. |




