生长激素(growth hormone,GH)是一种由腺垂体分泌的肽类激素,其通过血液作用于全身,主要通过血液循环作用于肝脏的生长激素受体(growth hormone receptor, GHR),结合后促进肝内胰岛素样生长因子-1(insulin growth factor-1, IGF-1)分泌,对人体的生长和代谢起着重要作用[1-3]。近年来越来越多的证据表明体内生长激素的缺乏与非酒精性脂肪肝的发生密切相关,早期补充生长激素可以一定程度改善患者代谢紊乱。有研究表明肝脏特异性敲低生长激素受体的小鼠更容易发生脂肪肝,而有效的生长激素替代治疗可以改善小鼠的血清转氨酶以及肝脏组织形态学的变化[4]。垂体功能减退患者的非酒精性脂肪肝发生率明显高于正常人,一项儿童起病的生长激素缺乏患者的研究中,患者10年非酒精性脂肪肝病(non-alcoholic fatty liver disease,NAFLD)的发生率为20%,20年NAFLD的发生率超过了30%[5],成人生长激素缺乏症(adult growth hormone deficiency, AGHD)患者有效的补充GH可以改善患者肝酶水平,甚至逆转NAFLD纤维化[6]。因此,我们推测GH可能是AGHD患者人群NAFLD发生的主要因素之一。
线粒体作为一种重要的膜性细胞器为细胞和机体提供能量,调节细胞生理过程,线粒体结构功能的完整性才能保证细胞的正常功能和工作[7-8]。当细胞受到外界不当的刺激,过度的ROS产生打破线粒体能量代谢的平衡,通过氧化应激诱导细胞发生线粒体凋亡[9-10]。随着人们生活习惯及饮食结构的改变,非酒精性脂肪肝的发生率越来越高,在最经典的“二次打击学说中”,线粒体功能降低加剧肝细胞的氧化应激程度,引起肝脏的脂质沉积,导致肝细胞凋亡。我们既往研究表明,AGHD患者内脏脂肪指数明显高于正常人[11],并且生长激素受体敲低状态下的肝细胞更容易发生脂肪沉积。本研究旨在研究生长激素受体敲低后肝细胞可能发生的线粒体的凋亡通路,以期为临床诊治提供较好的实验支持。
1 材料与方法 1.1 材料与试剂棕榈酸(palmitic acid, PA)、二甲基亚砜(DMSO)、苏木精染液、油红“O”、BODIPY均购自美国Sigma公司;RPMI1640培养基购自美国Gibco公司;青霉素-链霉素溶液、胰蛋白酶、蛋白提取试剂盒、SDS-PAGE凝胶配制试剂盒、BCA蛋白提取试剂盒、JC-1荧光探针、DAPI均购自中国上海碧云天生物技术公司;PVDF膜购自美国Millipore公司;引物、TRIzol、cDNA扩增及逆转录试剂盒、SYBR Green qPCR Mix染料均购自TaKaRa生物工程公司;CCK-8比色试剂盒购自日本东仁公司;MitoSox荧光探针购自Invitrogen公司;β-actin及β-Tublin购自天津三箭生物技术公司;Bcl-2单克隆抗体、Cleaved-Caspase9单克隆抗体、Cleaved-Caspase3单克隆抗体、PRRP单克隆抗体购自CST公司;Bax单克隆抗体购自Proteintech公司;山羊抗兔lgG二抗(HRP标记)、山羊抗鼠lgG二抗(HRP标记)购自中山金桥公司,细胞色素c单克隆抗体购自Abcam公司,DHE荧光试剂盒购自中国凯基公司,FITC Annexin V凋亡试剂盒、PE Annexin凋亡试剂盒购自美国BD公司,ECL发光试剂盒购自美国Advansta。
1.2 方法 1.2.1 肝L02细胞的分组和处理实验分组①:对照组(Ctrl),空载病毒组(Vector),GHR敲低组(shRNAGHR)。实验分组②:对照组(Ctrl),75 μmol/L PA组,150 μmol/L PA组,300 μmol/L PA组。实验分组③:空载病毒组(Vector Ctrl),空载体病毒干预12 h组(Vector PA 12 h),空载体病毒干预24 h组(Vector PA 24 h),空载体病毒干预48 h组(Vector PA 48 h),GHR敲低组(shRNAGHR Ctrl),GHR敲低PA干预12 h组(shRNAGHR PA 12 h),GHR敲低PA干预24 h组(shRNAGHR PA 24 h),GHR敲低PA干预48 h组(shRNAGHR PA 48 h)。实验分组④:空载病毒组(Vector),空载体病毒PA干预组(Vector+PA),GHR敲低组(shRNAGHR),GHR敲低PA干预组(shRNAGHR+PA)。实验分组⑤:GHR敲低组(shRNAGHR),GHR敲低PA干预组(PA),GHR敲低Mitotempo干预组(Mitotempo),GHR敲低组PA+Mitotempo干预组(PA+Mitotempo)。
1.2.2 细胞培养以及GHR慢病毒转染永生化人正常肝L02细胞株购于通派(上海)生物科技公司,本实验室保存。肝L02细胞用10%灭活的胎牛血清、1 000 U/L青霉素和100 μg/mL链霉素的RPMI1640培养基在37 ℃、5% CO2培养箱内传代培养,用于后续实验。
本课题组前期已构建生长激素受体敲低慢病毒序列,选取的人GHR基因序列为GenBank NM_001242399,由上海吉凯基因化学技术有限公司合成GHR干扰序列,正义链分别为:5′-ATCTGGATACC-TTATTGTA-3′;反义链分别为: 5′-TACAATAAGGTA-TCCAGATGG-3′,并且验证该序列有效。取对数生长期的L02细胞于转染前1 d接种于6孔板,按照说明书确定的感染复数(multiplicity of infection,MOI)加入GHR敲低慢病毒与对照空载病毒感染细胞(MOI=30),加入5 μg/mL的转染增敏剂凝聚胺(polybrene)。12 h后更换完全培养基,72 h后加入嘌呤霉素(1.0 μg/mL)进行压力筛选, 即获得稳定的GHR敲低组以及空载病毒组细胞株。相关实验按照实验分组①分为3组。
1.2.3 PA对L02细胞的干预条件按照实验分组②将细胞分为4组,当L02细胞汇合率达70%~80%时分别加入含有不同浓度PA(终浓度分别为0、75、150、300 μmol/L)的完全培养基培养12、24、48 h后,每孔加入10 μL CCK-8反应液,在培养箱内继续培养2 h。酶标仪450 nm测光密度值D(450),绘制生存曲线计算细胞存活率。
1.2.4 流式细胞仪检测细胞活性氧与凋亡水平将细胞均匀铺在12孔板内,待细胞贴壁后,用含有150 μmol/L PA的完全培养基培养细胞12、24、48 h;用不含EDTA的胰消化酶消化细胞离心,收集细胞,PBS洗涤细胞,200 mL PBS重悬细胞,采用DHE荧光试剂盒检测ROS水平,采用FITC Annexin V凋亡试剂盒检测细胞凋亡水平。相关实验按照实验分组③分为8组。
1.2.5 Mitosox染色检测线粒体内活性氧水平按照实验分组④将细胞分为4组,种于12孔板爬片中,PA干预24 h后去除培养基,PBS润洗3次,加入配制好的Mitosox染色工作液500 mL/孔,培养箱内避光孵育30 min,PBS润洗3次洗去多余染料,荧光显微镜下观察并采集图像。
1.2.6 Western blot检测相关凋亡蛋白的表达按照实验分组④将细胞分为4组,加入含有蛋白酶抑制剂的RIPA裂解液,冰上裂解10 min,超声10~15次,4 ℃离心机、12 000 ×g离心20 min,收集上清,使用BCA蛋白浓度检测试剂盒进行蛋白浓度的测定,分离胶使用8%(PARP)、12%(细胞色素c、Cleaved-Caspase9、Cleaved-Caspase3、bax、bcl-2),上样量为40 μg。10% SDS-PAGE电泳,250 mA电转;取出PVDF膜,浸泡在相应的一抗中,4 ℃孵育过夜;TBST漂洗10 min×5次,加入相应的辣根过氧化物酶标记的二抗室温孵育60 min,浸泡于ECL发光试剂盒显色,凝胶成像图像分析系统显像,Fusion软件进行灰度定量分析。实验重复3次。
1.2.7 油红“O”染色与BODIPY荧光染色检测细胞内脂质沉积按照实验分组④将细胞分为4组,种于12孔板爬片中,PA干预24 h后去除培养基,PBS润洗3次;4%多聚甲醛固定1~2 h;油红避光染色30 min;流水冲洗,60%异丙醇漂洗1次;苏木精避光染色2~5 min,流水冲洗;甘油明胶封片;避光配制BODIPY染液(10 μg/mL), 每孔500 μL放于孵箱内孵育1 h;PBS润洗3次后使用DAPI染核,抗荧光淬灭剂封片。显微镜下采集图像。
1.2.8 细胞内ATP水平检测按照实验分组④将细胞分为4组,种于6孔板中,吸除培养基PBS润洗3次,加入裂解液反复吹打后4 ℃ 12 000×g离心5 min,取上清,配制ATP检测工作液到96孔板内,室温放置3~5 min使本底性的ATP全部消耗,再在检测孔内加入20 μL待测样本以及标准品,使用化学荧光酶标仪检测光密度值,根据标准曲线计算细胞内ATP水平。
1.2.9 JC-1检测细胞线粒体膜电位按照实验分组④将细胞分为4组,细胞经过PA干预24 h后去除培养基,PBS清洗3次,加入1 mL的细胞培养液,按照说明书配制JC-1工作液(300 nmol/L),剧烈振荡充分溶解并混匀JC-1,再加入1 mL配制好的JC-1染色工作液,避光孵育30 min,孵育结束后洗出上清,用JC-1缓冲液洗涤2次,加入细胞培养液,荧光显微镜下观察JC-1单体(JC-1 monomers)与JC-1聚合体(JC-1 aggregates)并采集图像。
1.2.10 Mitotempo干预细胞按照实验分组⑤将细胞分为4组,将Mitotempo粉末用无菌PBS溶解,配制终浓度为100 nmol工作液,首先预处理shRNAGHR组细胞2 h,再用PA干预24 h后去除培养基,流式细胞仪以及Western blot检测细胞凋亡变化。
1.3 统计学分析采用GrapgPad 7.0,SPSS 22.0统计软件,资料采用x±s表示。全部试验重复次数≥3次,3组及以上比较采用单因素方差分析,组间进一步两两分析采用Turkey法。两组之间比较采用t检验,设检验水准α=0.05。
2 结果 2.1 不同浓度PA对细胞活力的影响以及慢病毒敲低生长激素受体效果验证在一定浓度范围内PA干预后,细胞存活率呈浓度依赖性下降(P<0.05,图 1A)。结果显示,PA对肝细胞具有一定的细胞毒性作用。PA浓度150 μmol/L, 干预24 h后细胞率存活约70%,故在后续的实验中选取该浓度来观察脂质沉积以及线粒体凋亡通路相关蛋白变化。
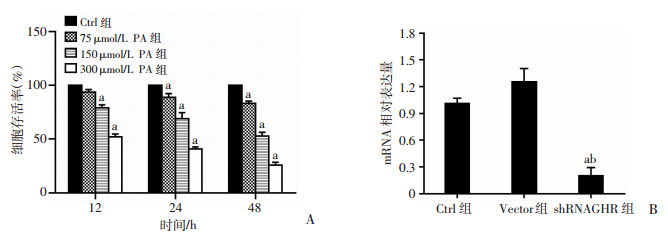
|
| a: P<0.05,与Ctrl组比较;b:P<0.05,与Vector组比较 A:CCK-8分析PA对L02细胞增殖影响;B:慢病毒转染后细胞mRNA表达 图 1 PA对正常肝L02细胞活力的影响及重组慢病毒转染L02细胞抑制GHR表达 |
感染慢病毒后生长激素受体基因敲低效率>70%,差异具有统计学意义(P<0.05,图 1B),提示稳定低表达生长激素受体的肝细胞模型建立成功。
2.2 敲低GHR对细胞凋亡及ROS水平的影响分析PA干预shRNAGHR组与Vector组不同时间点的凋亡以及ROS水平,结果显示,与Vector组相比,GHR敲低组细胞在PA干预12、24、48 h后凋亡细胞数明显高于Vector组(图 2A、C),细胞内ROS平均荧光值均高于Vector组(图 2B、D),差异有统计学意义(P<0.05)。
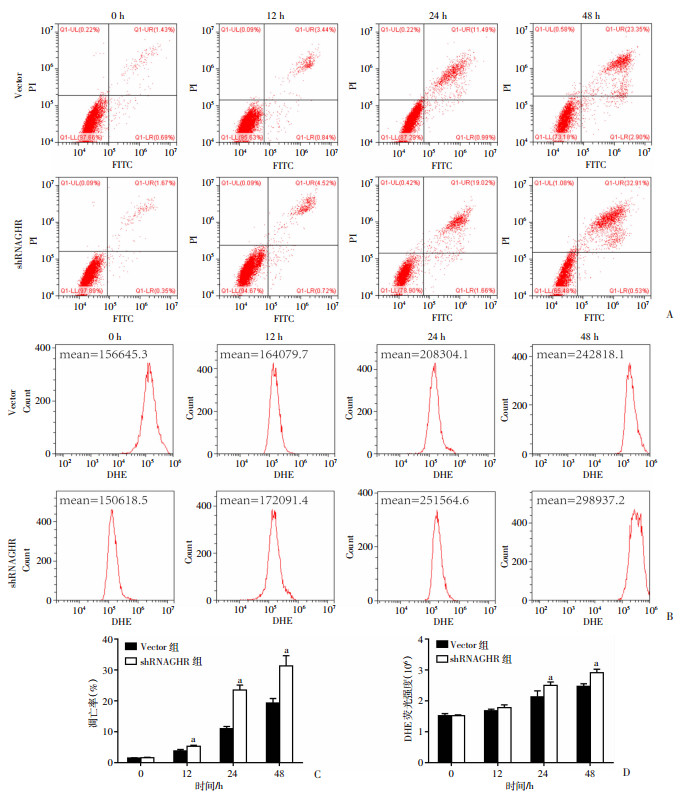
|
| A:流式细胞仪检测细胞凋亡率; B: 流式细胞仪检测细胞ROS水平;C: 凋亡率定量分析;D:ROS荧光强度定量分析 a: P<0.05,与Vector组比较 图 2 流式细胞仪检测PA干预shRNAGHR组与Vector组细胞不同时间的凋亡及ROS水平 |
2.3 敲低GHR对线粒体膜电位、线粒体内ROS、ATP以及脂质沉积的影响
图 3A中证实了PA干预后,敲低GHR的肝细胞JC-1染色复合体与单体比率明显下降,提示细胞线粒体膜电位去极化损伤更加严重;图 3B提示与Vector组相比,敲低GHR组在PA干预细胞后线粒体内ROS明显增加。同时PA干预敲低GHR组细胞后,ATP水平明显更低,证实了线粒体功能受损,利用ROS产生ATP的能力下降,细胞内氧自由基清除能力受损(图 3C),以上组间差异均有统计学意义(P<0.05)。
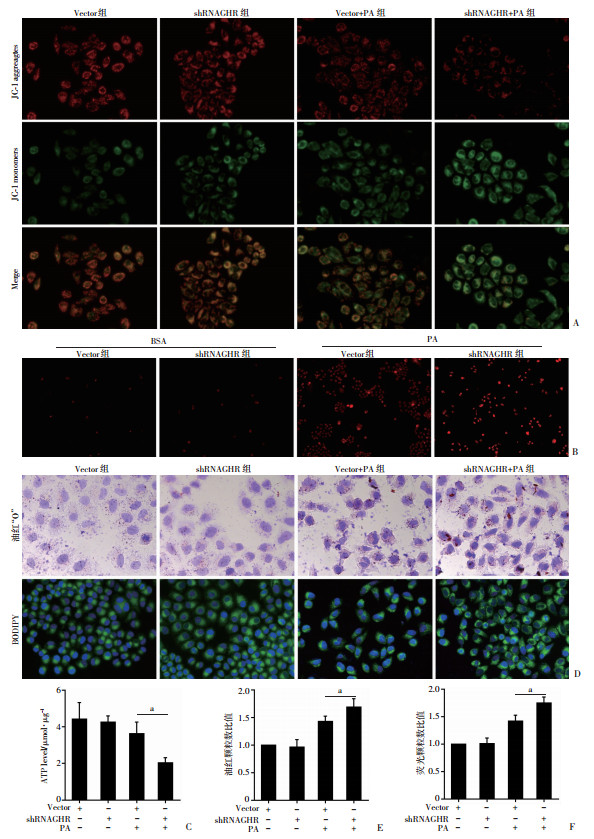
|
| A:JC-1染色检测细胞线粒体膜电位(×400);B: MitoSox染色检测细胞线粒体ROS(×50);C: ATP水平测定;D:油红“O”染色与BODIPY荧光染色检测脂肪颗粒(×400);E:油红“O”染色颗粒定量分析;F:BODIPY荧光颗粒定量分析 a: P<0.05 图 3 敲低GHR对线粒体膜电位、线粒体ROS、ATP以及脂肪沉积影响 |
GHR敲低组与Vector组相比肝细胞内油红颗粒聚集更加明显,BODIPY胞质内荧光染色脂质颗粒更丰富,提示PA干预敲低GHR的肝细胞更容易发生脂质沉积(图 3D)。
Western blot检测结果显示(图 4):PA干预GHR敲低的肝细胞后,细胞色素c产生更多,并且Cleaved-Caspase9、Cleaved-Caspase3以及PARP与Vector组比较都明显增多,并且差异具有统计学意义(P<0.05);GHR敲低的肝细胞在PA的干预下,Bax蛋白集聚以及bcl-2蛋白的减少(P<0.05)。以上结果均提示,GHR敲低加重肝细胞凋亡是通过线粒体途径实现的。

|
| a: P<0.05 图 4 Western blot检测各组细胞相关凋亡蛋白表达 |
2.4 Mitotempo处理对细胞凋亡的影响
为了探究PA诱导的线粒体ROS加重GHR敲低细胞凋亡的作用,我们使用Mitotempo特异性清除线粒体内ROS,结果提示肝细胞凋亡数明显下降,并且Cleaved-Caspase3蛋白也有明显的合成减少(P<0.05,图 5),表明Mitotempo抑制了GHR敲低介导的肝细胞凋亡。以上结果表示,线粒体抗氧化剂的预处理可以对抗GHR敲低加重的细胞凋亡,GHR敲低加重肝细胞的凋亡是通过线粒体途径实现的,并且线粒体的ROS产生介导了GHR敲低的肝细胞凋亡。
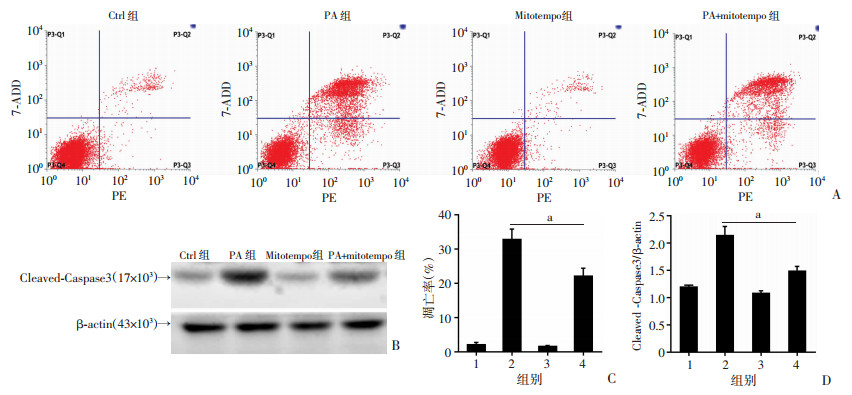
|
| A: 流式细胞仪检测细胞凋亡; B: Western blot检测细胞相关凋亡蛋白表达; C: 凋亡率定量分析;D:蛋白定量分析 1:Ctrl组; 2:PA组; 3:Mitotempo组; 4:PA+mitotempo组; a: P<0.05 图 5 Mitotempo处理减轻PA干预shRNAGHR细胞的凋亡 |
3 讨论
生长激素作用广泛,生物效应复杂,对机体的一系列代谢过程具有重要影响。生长激素可以促进脂肪分解,抑制脂肪合成,促进游离的脂肪酸进入循环代谢[12-14]。非酒精性脂肪肝通常是代谢综合征及其合并症的肝病表现,一项大型横断面研究表明,普通人群血清生长激素水平与非酒精性脂肪肝发病率呈明显负相关;与健康人相比,患有非酒精性脂肪肝的人群中血清生长激素水平更低,在相关性分析中生长激素水平与血脂、血糖、腰围等代谢性指标呈明显负相关[15],以上研究均证实,生长激素缺乏可能是非酒精性脂肪肝发病的危险因素,在非酒精性脂肪肝的病程中扮演重要作用。我们既往研究中也证实,成人生长激素缺乏患者的内脏脂肪以及内脏脂肪指数均高于正常对照组人群,而肌肉组织重量明显低于正常对照组[16-17]。本研究中生长激素受体敲低的状态下,PA会加重肝细胞脂质聚集,诱导肝细胞发生凋亡。
凋亡是细胞为维持内环境稳定出现的自发性的死亡过程,是一种主动、高度有序、基因控制、信号依赖以及一系列酶参与的过程,在维持组织细胞内环境稳态和控制感染方面起着重要作用[18]。ROS产生和消耗主要发生在线粒体内,病理状态下,ROS产生与清除失调,在细胞内堆积过多,活性氧自由基可以与多不饱和脂肪酸过氧化反应生成过氧化脂质,该过程会导致一系列毒性作用包括细胞内蛋白以及酶变形、DNA氧化修饰、生物膜脂质过氧化,增加细胞对外界刺激的敏感性,从而导致肝细胞更容易发生凋亡[19],但在GHR缺乏状态下ROS是否通过线粒体途径加重肝细胞凋亡目前尚少见研究报道。本研究观察PA干预后shRNAGHR组与Vector组细胞的ROS与细胞凋亡水平都呈现浓度依赖性增加,但是GHR敲低组的细胞内ROS更易堆积,凋亡细胞数目明显增加,特异性线粒体抗氧化剂mitotempo预处理细胞明显改善了PA诱导的shRNAGHR肝细胞凋亡,表明GHR敲低加重肝细胞凋亡可能是由过量线粒体ROS累积,导致线粒体结构功能发生障碍,导致敲低GHR的肝细胞凋亡程度更明显,证实了来源于线粒体的氧化应激介导了GHR降低带来的肝细胞凋亡。同时,线粒体膜电位是线粒体发挥功能的重要保证,线粒体膜电位去极化代表线粒体凋亡的早期发生。本研究中shRNAGHR肝细胞在PA干预后JC-1复合体与单体比率明显下降,膜电位去极化更严重,代表了线粒体膜功能完整性缺失更严重,触发细胞色素c更容易从损伤的线粒体释放,从而激活下游Caspase级联反应和线粒体介导的细胞凋亡。
线粒体凋亡通路是由线粒体损伤触发。含半胱氨酸的天冬氨酸水解酶(Caspase)分为凋亡启动因子、凋亡执行因子和炎症介导因子,细胞色素c从线粒体被释放到细胞质,募集启动因子Caspase9到凋亡小体继而发生凋亡级联反应,累及下游关键执行因子Caspase3活化,从而导致细胞凋亡[20-22]。PARP是Caspase的切割底物,其发生活化剪切形式被认为是线粒体凋亡通路激活的一个重要指标。Bax与bcl-2蛋白正常情况下结合在线粒体膜上,不同的比例变化对线粒体凋亡通路也起着至关重要的作用,控制着整个凋亡过程[23-24]。本研究中,PA干预24 h后,shRNAGHR组细胞活化形式的Caspase3、Caspase9以及PARP均呈现明显的升高,同时Bax与Bcl-2比值也明显高于对照组,这些结果显示,敲低生长激素受体的肝细胞发生更严重的凋亡,是通过线粒体凋亡途径产生的。既往有动物研究证实肝脏特异敲除GHR基因或者IGF-1的小鼠中,肝脏的脂质沉积加重,可能与凋亡相关,但是该研究未进一步阐述是否通过线粒体途径引起凋亡[25]。
综上,本研究通过体外细胞实验观察生长激素受体敲低状态下PA对肝细胞的功能影响以及机制,GHR敲低会加重肝细胞的凋亡,诱导脂质沉积加剧。清除线粒体中ROS可以明显改善GHR加重的细胞凋亡。然而,本实验由于试剂限制,没有进行外源性生长激素干预实验,但在实验过程中,我们观察到shRNAGHR组细胞生长速度较Vector组明显缓慢,我们推测在细胞培养基与胎牛血清中可能存在某些生长因子或者短肽类物质作用于生长激素受体促进细胞生长,后续工作仍需进一步研讨体内生长激素受体敲低状态下线粒体介导的凋亡的通路关系,以期能为AGHD患者更易发生非酒精性脂肪肝这一临床现象提供良好的理论基础。
| [1] |
ABDU T A, NEARY R, ELHADD T A, et al. Coronary risk in growth hormone deficient hypopituitary adults: increased predicted risk is due largely to lipid profile abnormalities[J]. Clin Endocrinol (Oxf), 2001, 55(2): 209-216. |
| [2] |
MURRAY R D, ADAMS J E, SHALET S M. Adults with partial growth hormone deficiency have an adverse body composition[J]. J Clin Endocrinol Metab, 2004, 89(4): 1586-1591. |
| [3] |
VIJAYAKUMAR A, NOVOSYADLYY R, WU Y, et al. Biological effects of growth hormone on carbohydrate and lipid metabolism[J]. Growth Horm IGF Res, 2010, 20(1): 1-7. |
| [4] |
MUELLER K M, KORNFELD J W, FRIEDBICHLER K, et al. Impairment of hepatic growth hormone and glucocorticoid receptor signaling causes steatosis and hepatocellular carcinoma in mice[J]. Hepatology, 2011, 54(4): 1398-1409. |
| [5] |
FUKUDA I, HIZUKA N, YASUMOTO K, et al. Metabolic co-morbidities revealed in patients with childhood-onset adult GH deficiency after cessation of GH replacement therapy for short stature[J]. Endocr J, 2008, 55(6): 977-984. |
| [6] |
TAKAHASHI Y, IIDA K, TAKAHASHI K, et al. Growth hormone reverses nonalcoholic steatohepatitis in a patient with adult growth hormone deficiency[J]. Gastroenterology, 2007, 132(3): 938-943. |
| [7] |
SCHEFFLER I E. A century of mitochondrial research: achievements and perspectives[J]. Mitochondrion, 2001, 1(1): 3-31. |
| [8] |
SCHEFFLER I E. Mitochondria make a come back[J]. Adv Drug Deliv Rev, 2001, 49(1/2): 3-26. |
| [9] |
MARCHI S, GIORGI C, SUSKI J M, et al. Mitochondria-ros crosstalk in the control of cell death and aging[J]. J Signal Transduct, 2012, 2012: 329635. |
| [10] |
SHIH C M, KO W C, WU J S, et al. Mediating of caspase-independent apoptosis by cadmium through the mitochondria-ROS pathway in MRC-5 fibroblasts[J]. J Cell Biochem, 2004, 91(2): 384-397. |
| [11] |
XIE X, LI Q, ZHANG L M, et al. Lipid accumulation product, visceral adiposity index, and Chinese visceral adiposity index as markers of cardiometabolic risk in adult growth hormone deficiency patients: a cross-sectional study[J]. Endocr Pract, 2018, 24(1): 33-39. |
| [12] |
BREDELLA M A, KARASTERGIOU K, BOS S A, et al. GH administration decreases subcutaneous abdominal adipocyte size in men with abdominal obesity[J]. Growth Horm IGF Res, 2017, 35: 17-20. |
| [13] |
TROIKE K M, HENRY B E, JENSEN E A, et al. Impact of growth hormone on regulation of adipose tissue[J]. Compr Physiol, 2017, 7(3): 819-840. |
| [14] |
WANG Y T, ZHENG X Y, XIE X, et al. Correlation of increased serum adipsin with increased cardiovascular risks in adult patients with growth hormone deficiency[J]. Endocr Pract, 2019, 25(5): 446-453. |
| [15] |
XU L, XU C, YU C, et al. Association between serum growth hormone levels and nonalcoholic fatty liver disease: a cross-sectional study[J]. PLoS ONE, 2012, 7(8): e44136. |
| [16] |
QING L, WEI R, CHAN L, et al. Sensitivity of various body indices and visceral adiposity index in predicting metabolic syndrome among Chinese patients with adult growth hormone deficiency[J]. J Endocrinol Invest, 2017, 40(6): 653-661. |
| [17] |
ZHENG X, CHENG Q, LONG J, et al. Prevalence of low lean mass in patients with adult growth hormone deficiency with or without low-dose growth hormone therapy[J]. Clin Endocrinol (Oxf), 2019, 90(6): 834-841. |
| [18] |
JIANG X, LIAO X H, HUANG L L, et al. Overexpression of augmenter of liver regeneration (ALR) mitigates the effect of H2O2-induced endoplasmic Reticulum stress in renal tubule epithelial cells[J]. Apoptosis, 2019, 24(3/4): 278-289. |
| [19] |
RIVES C, FOUGERAT A, ELLERO-SIMATOS S, et al. Oxidative stress in NAFLD: role of nutrients and food contaminants[J]. Biomolecules, 2020, 10(12): E1702. |
| [20] |
PORTER A G, JÄNICKE R U. Emerging roles of caspase-3 in apoptosis[J]. Cell Death Differ, 1999, 6(2): 99-104. |
| [21] |
RIEDL S J, SHI Y. Molecular mechanisms of caspase regulation during apoptosis[J]. Nat Rev Mol Cell Biol, 2004, 5(11): 897-907. |
| [22] |
HUANG Y, DONG F, DU Q, et al. Swainsonine induces apoptosis through mitochondrial pathway and caspase activation in goat trophoblasts[J]. Int J Biol Sci, 2014, 10(7): 789-797. |
| [23] |
HSU Y T, WOLTER K G, YOULE R J. Cytosol-to-membrane redistribution of Bax and Bcl-X(L) during apoptosis[J]. Proc Natl Acad Sci USA, 1997, 94(8): 3668-3672. |
| [24] |
KUWANA T, MACKEY M R, PERKINS G, et al. Bid, Bax, and lipids cooperate to form supramolecular openings in the outer mitochondrial membrane[J]. Cell, 2002, 111(3): 331-342. |
| [25] |
NISHIZAWA H, TAKAHASHI M, FUKUOKA H, et al. GH-independent IGF-I action is essential to prevent the development of nonalcoholic steatohepatitis in a GH-deficient rat model[J]. Biochem Biophys Res Commun, 2012, 423(2): 295-300. |




