近年来鲍曼不动杆菌(Acinetobacter baumannii, Ab)已成为医院获得性感染和社区获得性感染的主要致病菌[1],据中国细菌耐药监测网CHINET显示,2020年其临床分离菌株检出率位居第5位(http://www.chinets.com)。Ab具有天然感受态特性即遗传可塑性,使其拥有惊人的获得外源耐药基因的能力,常被检出多重耐药Ab(multidrug resistance Acinetobacter baumannii, MDRAB),甚至泛耐药Ab(pan-drug resistantce Acinetobacter baumannii, PDRAB),并且呈逐年增多的趋势[2]。MDRAB给临床快速选择最佳抗菌药物带来了巨大挑战,替加环素和粘菌素等少数药物虽较敏感,但并不适合临床经验性选用,同时经验性用药亦会增加Ab耐药菌株产生的风险[3]。基于体外培养的药敏试验的表型检测,结果可靠但检测周期较长,亟须快速的Ab药敏试验方法(antimicrobial susceptibility testing, AST)指导临床抗感染治疗精准用药。
目前,快速药敏检测方法主要有基因型检测和表型检测两类。基因型检测以检测已知耐药基因来预测致病菌的耐药性,由于Ab耐药机制复杂,基因型与耐药表型之间的联系尚未完全阐明,以致基因检测难以准确进行药敏预测[4]。SCHOEPP等[5-6]提出通过测定细菌生长状态,即暴露于抗菌药物下细菌特异核酸拷贝数变化预测其敏感性的表型AST方法。但这种方法的不足是,未去除抗菌药物作用下产生的大量细胞膜完整性受损的死亡细菌,进而对基因扩增和快速药敏判断产生干扰。叠氮溴化丙锭(propidium monoazide, PMA)是一种DNA高亲和力的光敏染料,能够选择性地穿透细胞膜完整性受损的细菌[7],强光作用下与DNA共价结合,阻止以此DNA为模板的扩增反应的进行。YUAN等[8]利用PMA-qPCR方法检测糖基转移酶ycjM基因定量环境水中大肠杆菌,结果与培养法计数一致。研究报道表面活性剂(十二烷基磺酸钠、脱氧胆酸钠、月桂酰基甘氨酸钠等)通过溶解膜蛋白增加细胞膜通透性,促进PMA穿透细菌细胞膜[9]。据此,基于核酸共价交联从分子水平检测Ab活菌特异核酸拷贝数(blaOXA-51),建立Ab定量检测和快速表型AST新方法,如图 1所示,为临床Ab感染精准治疗提供技术支撑和实验依据。
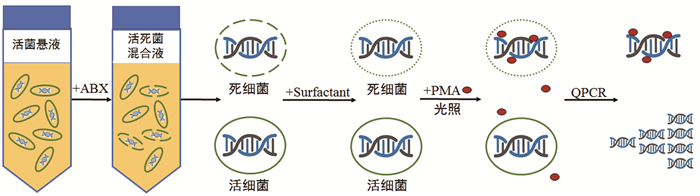
|
| ABX:抗菌药物; Surfactant: 表面活性剂 图 1 快速表型AST工作流程图 |
1 材料与方法 1.1 实验菌株
从本院收集鲍曼不动杆菌临床菌株18株。标准质控菌株鲍曼不动杆菌ATCC17978、铜绿假单胞菌ATCC27853、大肠杆菌ATCC25922来自于本院临床试验机构保存菌株。
1.2 主要试剂及仪器叠氮溴化丙锭PMAxx(PMA升级版,批号:19P0725)购于美国Biotium公司,头孢他啶(批号:130484-201806)、美罗培南(批号:130506-202004)、庆大霉素(批号:130326-201716)、多西环素(批号:130485-201703)、左氧氟沙星(批号:130455-201607)、头孢哌酮(批号:130420-201105)、舒巴坦(批号:130430-201408)购于中国食品药品检定研究院,替加环素(批号:N1130AS)、多粘菌素(批号:A1208B)购于大连美仑生物技术有限公司,M-H琼脂、CAMHB购于北京索莱宝科技有限公司,十二烷基磺酸钠(批号:ST626)、脱氧胆酸钠(批号:F319BA0014)、月桂酰基甘氨酸钠(批号:F231BA0023)购于生工生物工程(上海)股份有限公司,细菌DNA提取纯化试剂盒(QIAamp DNA Mini Kit)、2×SYBR Green PCR Master Mix购自德国QIAGEN公司,引物合成由Invitrogen公司完成。PMA-Lite LED购自美国Biotium公司,细菌多点接种仪购自日本Sakuma公司,荧光定量PCR仪购自美国Bio-Rad公司。
1.3 方法 1.3.1 PMAxx反应条件优化 1.3.1.1 最佳表面活性剂的选取细菌采用生理盐水稀释比浊至0.5麦氏单位,稀释100倍(约106 CFU/mL)后,取100 μL Ab稀释菌液,加入十二烷基磺酸钠、脱氧胆酸钠、月桂酰基甘氨酸钠,使其终浓度分别为0.02%、0.1%、0.5%,0.02%、0.1%、0.5%和0.04%、0.2%、1.0%。37 ℃孵育30 min,倍比稀释后取100 μL均匀涂布于营养琼脂平板,37 ℃培养16~18 h进行计数。设置未加表面活性剂处理为对照组。
1.3.1.2 热灭活死菌的制备采用热灭活方法制备细胞膜完整性受损的死菌。细菌采用生理盐水稀释比浊至0.5麦氏单位。稀释200倍(约5×105 CFU/mL) 后,取1 mL菌液于70 ℃水浴中加热1、3、5、10 min,取出,立即置于冰上冷却。倍比稀释后分别取100 μL均匀涂布于营养琼脂平板上,37 ℃培养16~18 h进行计数。设置未热灭活处理菌液为对照组。
1.3.1.3 最佳曝光时间的选取按1.3.1.2方法制备活菌和死菌菌液,按照1:9比例得到混合菌液,加入PMAxx混匀后于暗处孵育5 min,使其充分渗入死菌细胞中;然后置于光解仪中光照0、2、5、10、15、30 min,随后采用试剂盒提取基因组DNA,进行qPCR检测。设置不加PMAxx和光照0 min为对照组。
1.3.1.4 最佳PMAxx浓度的选取按1.3.1.2方法制备活菌和死菌菌液,分别加入PMAxx使其终浓度为0、2.5、5、10、20、40、80 μmol/L。体系混匀后于暗处孵育5 min,然后置于光解仪中光照5 min,随后试剂盒法提取基因组DNA,进行qPCR检测。设置不加PMAxx为对照组。
1.3.1.5 Ab特异核酸拷贝数检测针对Ab特异性鉴别基因blaOXA-51(NCBI accession number: NG_049788)设计合成引物并进行BLAST验证,正向引物5’-GGTAATGATCTTGCTCGTGCTT-3’,反向引物5’-TGTGGTGGTTGCCTTATGGT-3’。采用试剂盒法提取和纯化细菌基因组DNA。qPCR检测体系为:2×SYBR Green PCR Master Mix 10 μL,基因组DNA 2 μL,正向和反向引物(10 μmol/L)各0.8 μL,无酶水补足至20 μL。反应条件为:95 ℃预变性2 min,(95 ℃ 5 s,60 ℃ 10 s)×40个循环,收集SYBR荧光。
1.3.2 最低抑菌浓度(MIC)测定采用琼脂平板倍比稀释法测定Ab临床菌株对抗菌药物的敏感性,对多粘菌素E敏感性采用微量肉汤稀释法测定。根据美国临床和实验室标准协会最新发布的耐药折点(CLSI M100,30版)进行MIC结果判读。
1.3.3 基于抗菌药物暴露快速AST的建立与模型验证基于MIC结果和我国鲍曼不动杆菌感染诊治与防控专家共识[10],随机选取Ab敏感菌株和多重耐药株,制备细菌悬液,等体积加入药液,使头孢哌酮/舒巴坦(1/1)、多西环素及左氧氟沙星终浓度分别为8、8和4 μg/mL。设置不含药的菌液作为细菌生长对照。于0、15、30、60、120和240 min分别取180 μL混合体系,按照上述最佳反应条件进行处理,然后提取细菌基因组,进行qPCR扩增检测。
以抗菌药物暴露下处理组与对照组间P值预测敏感或耐药,建立表型AST预测模型。为进一步验证模型,以广谱抑菌剂多西环素(高浓度为杀菌剂)为模式药物,另选取临床多重耐药菌株10株作为测试集,于8 μg/mL多西环素暴露15、30、60和120 min取样,后续处理同上;同时于暴露24 h后肉眼观察混合体系浊度判断敏感或耐药,并与快速AST方法进行比较。
1.4 统计学分析采用SPSS 18.0软件,计量资料以x±s表示,两组比较采用t检验,3组及以上采用方差分析进行统计,P<0.05表示差异有统计学意义。
2 结果 2.1 PMAxx最佳反应条件 2.1.1 最适表面活性剂种类和浓度通过琼脂平板计数法分析表面活性剂种类和浓度对细菌活性影响,结果如图 2所示。十二烷基磺酸钠(0.02%、0.1%和0.5%)均显著影响细胞活力(P<0.05),脱氧胆酸钠和月桂酰基甘氨酸钠浓度低于0.1%和0.2%时,对细胞活力的影响可忽略不计。为促进PMAxx穿透细胞膜完整性受损和死亡的细菌,选择0.2%月桂酰基甘氨酸钠用于后续实验。
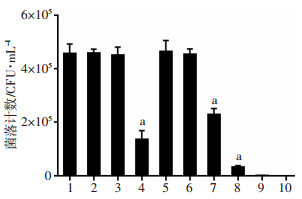
|
| 1:生理盐水组;2~4:月桂酰基甘氨酸钠(0.04%、0.2%、1%);5~7:脱氧胆酸钠(0.02%、0.1%、0.5%);8~10:十二烷基磺酸钠(0.02%、0.1%、0.5%);a:P<0.01,与生理盐水组比较 图 2 表面活性剂种类和浓度优化 |
2.1.2 最佳热灭活时间
通过琼脂平板计数法判断热灭活制备死菌的最佳反应时间,结果显示,70 ℃水浴5 min时,琼脂平板上不再有菌落长出,即细菌已全部死亡,故选择70 ℃水浴5 min制备细胞膜完整性受损的死菌用于PMAxx反应条件的优化。
2.1.3 最佳曝光时间优化通过qPCR扩增Ab特异性鉴别基因blaOXA-51,结果如图 3A所示。曝光超过2 min时,Ct较对照组显著增加(P<0.01);曝光时间2~30 min时,Ct不再显著增大,表明PMAxx已与死菌DNA充分交联。为保障PMAxx充分交联和游离PMAxx充分光解失活,后续实验5 min作为PMAxx最适光照时间。
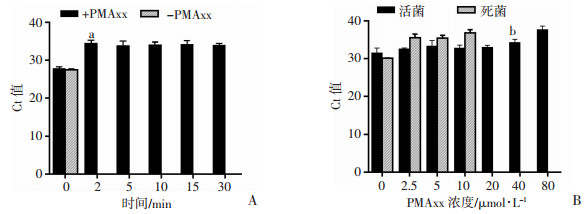
|
| A: 曝光时间优化; B: PMAxx浓度优化a:P<0.01,与未经曝光组比较;b:P<0.05,与未经PMAxx处理的活菌组比较 图 3 PMAxx反应参数优化 |
2.1.4 最佳PMAxx浓度优化
如图 3B所示,PMAxx浓度≥20 μmol/L时死菌DNA扩增的荧光信号消失,而活菌DNA扩增的荧光信号几乎没有改变,提示该浓度对活菌活性几乎没有影响。当PMAxx浓度≥40 μmol/L时活菌的Ct值开始增大(P<0.05),提示高浓度PMAxx可能会穿透活菌细胞膜,与其基因组DNA交联。故后续实验选择20 μmol/L作为PMAxx最适浓度。
2.2 MIC测定临床Ab菌株对抗菌药物的敏感性结果如表 1所示。对头孢他啶、美罗培南、头孢哌酮/舒巴坦以及庆大霉素耐药Ab占全部临床菌株比例超过88%。依据《中国鲍曼不动杆菌感染诊治与防控专家共识》,有17株为多重耐药Ab。
| 药物种类 | 抗菌药物 | MIC范围/μg·mL-1 | 耐药率[%(n)] |
| 头孢菌素类 | 头孢他啶 | 16~512 | 94.4(17) |
| 碳青酶烯类 | 美罗培南 | 16~128 | 94.4(17) |
| β-内酰胺类复合制剂 | 头孢哌酮/舒巴坦 | 2/2~128/128 | 94.4(17) |
| 氨基糖苷类 | 庆大霉素 | 1~>1 024 | 88.9(16) |
| 喹诺酮类 | 左氧氟沙星 | 4~16 | 66.7(12) |
| 四环素类 | 多西环素 | 1~128 | 61.1(11) |
| 替加环素 | 0.25~8 | 11.1(2) | |
| 多肽类 | 多粘菌素 | ≤2 | 0(0) |
2.3 Ab特异性鉴别基因blaOXA-51拷贝数变化、AST预测与验证
通过月桂酰基甘氨酸钠-PMAxx-qPCR扩增抗菌药物暴露下blaOXA-51基因,结果如图 4所示。Ab敏感株给予多西环素(图 4A)、左氧氟沙星(图 4B)、头孢哌酮/舒巴坦(图 4C)后,分别于15、15、120 min时,所检测到的Ct值较对照组显著增大(P<0.01,P<0.05),并随时间延长组间差异不断扩大;Ab耐药株(图 4D~F)在抗菌药物作用4 h内,处理组与对照组均未出现显著差异。以上结果提示,随着抗菌药物暴露时间的延长,敏感菌株生长受到药物抑制的作用可于短时间内显现,并被本研究所建立的方法检测到。
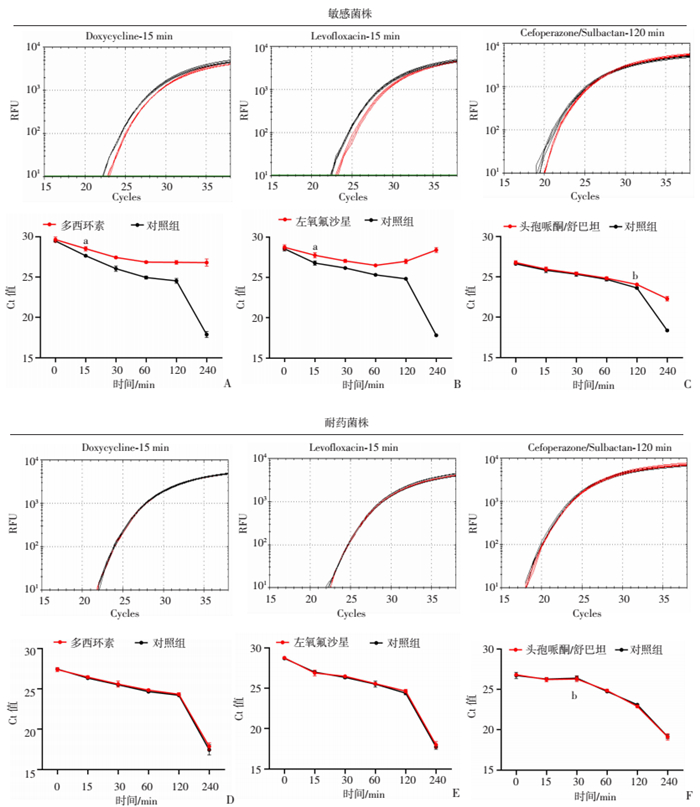
|
| A~F:上图为原始扩增曲线,下图为blaOXA-51拷贝数随时间变化曲线;A、D:给予多西环素8 μg/mL;B、E:给予左氧氟沙星4 μg/mL;C、F:给予头孢哌酮/舒巴坦8 μg/mL;a:P<0.01,b:P<0.05,与对照组比较 图 4 抗菌药物暴露下的blaOXA-51定量 |
以抗菌药物暴露下处理组与对照组间P<0.01预测为敏感,P>0.05为耐药,建立表型AST预测模型。选取10株临床MDRAB菌株作为测试集和多西环素为模式药物,以Ab对多西环素暴露24 h药敏结果为参考,本研究所构建的表型快速AST模型于15、30、60和120 min时预测药敏结果与参考方法结果一致,结果如表 2所示,测试果表明所构建的模型准确性较好。
| 菌株号 | 表型AST预测模型a | 敏感/耐药b | |||
| 15 min | 30 min | 60 min | 120 min | ||
| 1 | - | - | - | - | - |
| 2 | - | - | - | - | - |
| 3 | + | + | + | + | + |
| 4 | - | - | - | - | - |
| 5 | - | - | - | - | - |
| 6 | + | + | + | + | + |
| 7 | + | + | + | + | + |
| 8 | + | + | + | + | + |
| 9 | + | + | + | + | + |
| 10 | + | + | + | + | + |
| a:以处理组与对照组间P值判断敏感或耐药;b:以24 h浊度判断敏感或耐药(-:敏感,+:耐药) | |||||
3 讨论
Ab是一种临床常见的条件致病菌,分布极其广泛,当机体免疫力降低或某些侵入性操作(如创伤、气管插管、手术等)时可引起肺炎、伤口、腹腔和血液感染等,感染致死率高达20%[2]。MDRAB具有极强的耐药能力,给临床快速选择最佳抗菌药物带来了巨大困难[11]。临床常规药敏试验如纸片扩散法、稀释法、E-试验法和自动化仪器法,通常需要一个较长的周期用于细菌体外扩大培养。因此探索简单、快速、灵敏和特异的Ab耐药检测和快速药敏评估方法已成为临床耐药菌感染诊疗的迫切需求。目前Ab耐药检测和快速药敏评估方法,多以检测其相关耐药基因为主[12-13],如超广谱β-内酰胺酶、苯唑西林酶blaOXA-23、金属β-内酰胺酶blaNDM-1、头孢菌素酶AmpC等。然而,Ab的耐药机制非常复杂,如产生抗菌药物相关的酶类(β-内酰胺酶)、药物作用靶点的改变、膜孔通道蛋白的缺失或渗透性降低、过表达外排泵、整合子等可移动遗传元件参与的耐药机制等[14-15],导致既往基于耐药基因的检测结果与Ab耐药表型并不完全一致。KUMBURU等[16]对临床分离的14株Ab进行了经典表型耐药性检测,同时采用全基因组测序对菌株进行敏感性预测,结果有6种临床常用抗Ab药物的基因型预测与表型的符合率均低于90%。
近年来出现了通过检测暴露于抗菌药物下病原菌特定核酸拷贝数变化以判断对抗菌药物敏感性的新型快速AST方法[5-6]。这种基于抗菌药物暴露的表型快速药敏检测方法优势凸显,但在抗菌药物作用下敏感菌可产生大量死亡和细胞膜受损的细菌,尤其处于迟缓期(<4 h)病原菌尚未进入对数生长期,如不剔除细菌其DNA存留将会严重影响后续检测和快速药敏预测。核酸交联染料叠氮溴化丙锭(PMA、PMAxx)能够选择性穿透非活性细菌的受损细胞膜[7],在光照作用下叠氮基团光裂解为高活性氮化物,通过C-H插入与DNA共价交联,在后续的分子扩增技术中抑制死菌DNA的扩增[17]。但PMA并不总是能够渗透过死菌的细胞壁或细胞膜,尤其是浓度较低时渗透不完全。研究报道,表面活性剂可提高PMA对非活细菌的渗透性,增强对死细胞和活细胞的区别[18],此外,阴离子表面活性剂月桂酰基甘氨酸钠相较于胆盐更能有效破坏死亡细菌的受损细胞膜[19]。目前虽已有表面活性剂-PMA结合核酸扩增技术检测环境或食品污染中的活菌[20],但未见其应用于临床菌株的药敏检测的报道。
本研究将表面活性剂月桂酰基甘氨酸钠、PMAxx与qPCR技术相结合,建立了可区分鲍曼不动杆菌死活细胞的定量检测方法和快速表型药敏预测模型;并选取MDRAB对多西环素、左氧氟沙星和头孢哌酮/舒巴坦的药物敏感性进行评价,以及10株临床MDRAB作为测试集验证该模型。上述3种药物均为临床上治疗Ab感染的常用药,据最新CLSI标准,多西环素折点中介为8 μg/mL、左氧氟沙星为4 μg/mL,该浓度接近药物在人体血液或组织中可到达的水平,可作为判断菌株敏感、耐药的浓度临界值。头孢哌酮/舒巴坦是国内针对Ab治疗的首选药物,但由于其未在美国上市,CLSI并未给出折点数据,实验中我们参考氨苄西林/舒巴坦的中介折点选取8 μg/mL作为浓度临界值。以抗菌药物暴露下处理组与对照组间P<0.01预测为敏感,P>0.05为耐药。研究中选取月桂酰基甘氨酸钠增强PMAxx渗透细胞膜受损细菌和死菌的细胞壁、细胞膜,消除其基因组DNA对后续扩增的影响,进而更准确地监测细菌的生长状况和数量变化。基于此建立的快速表型AST模型和方法,能够在15 min~2 h内准确预测Ab对多西环素和左氧氟沙星的敏感性;对头孢哌酮/舒巴坦的敏感性尚需延长暴露时间(>2 h)以降低预测风险。该模型准确预测药敏所需时间的差异可能主要归因于抗菌药物种类和作用机制以及菌株间差异。
本研究建立了基于抗菌药物暴露下鲍曼不动杆菌生长状况和数量变化的快速表型AST新方法,因其仅针对有繁殖能力的活菌进行测定,为建立更为精准可靠、预测风险低的药敏预测模型奠定良好基础。今后可进一步依据抗菌药物作用机制异同,通过延长和细化药物暴露时间、增大测试集样本数,确定适合多种病原菌和多种抗菌药物的最适预测参数,以期建立适用性强、可应用于临床的快速表型药敏预测的模型和方法,促进临床抗感染诊疗的精准化和个体化。
| [1] |
TACCONELLI E, CARRARA E, SAVOLDI A, et al. Discovery, research, and development of new antibiotics: the WHO priority list of antibiotic-resistant bacteria and tuberculosis[J]. Lancet Infect Dis, 2018, 18(3): 318-327. |
| [2] |
GEISINGER E, HUO W W, HERNANDEZ-BIRD J, et al. Acinetobacter baumannii: envelope determinants that control drug resistance, virulence, and surface variability[J]. Annu Rev Microbiol, 2019, 73: 481-506. |
| [3] |
VRANCIANU C O, GHEORGHE I, CZOBOR I B, et al. Antibiotic resistance profiles, molecular mechanisms and innovative treatment strategies of Acinetobacter baumannii[J]. Microorganisms, 2020, 8(6): E935. |
| [4] |
SŁOCZYNSKA A, WAND M E, TYSKI S, et al. Analysis of blaCHDL genes and insertion sequences related to carbapenem resistance in Acinetobacter baumannii clinical strains isolated in warsaw, Poland[J]. Int J Mol Sci, 2021, 22(5): 2486. |
| [5] |
SCHOEPP N G, SCHLAPPI T S, CURTIS M S, et al. Rapid pathogen-specific phenotypic antibiotic susceptibility testing using digital LAMP quantification in clinical samples[J]. Sci Transl Med, 2017, 9(410): eaal3693. |
| [6] |
SCHOEPP N G, KHOROSHEVA E M, SCHLAPPI T S, et al. Digital quantification of DNA replication and chromosome segregation enables determination of antimicrobial susceptibility after only 15 Minutes of antibiotic exposure[J]. Angew Chem Int Ed Engl, 2016, 55(33): 9557-9561. |
| [7] |
GAO R, LIAO X Y, ZHAO X H, et al. The diagnostic tools for viable but nonculturable pathogens in the food industry: Current status and future prospects[J]. Compr Rev Food Sci Food Saf, 2021, 20(2): 2146-2175. |
| [8] |
YUAN Y, ZHENG G L, LIN M S, et al. Detection of viable Escherichia coli in environmental water using combined propidium monoazide staining and quantitative PCR[J]. Water Res, 2018, 145: 398-407. |
| [9] |
LEE H W, LEE H M, YOON S R, et al. Pretreatment with propidium monoazide/sodium lauroyl sarcosinate improves discrimination of infectious waterborne virus by RT-qPCR combined with magnetic separation[J]. Environ Pollut, 2018, 233: 306-314. |
| [10] |
陈佰义, 杨毅, 张菁, 等. 中国鲍曼不动杆菌感染诊治与防控专家共识[J]. 中华医学杂志, 2012, 92(2): 76-85. CHEN B Y, YANG Y, ZHANG J, et al. Chinese expert consensus for the diagnosis, treatment, prevention and control of acinetobacter baumannii infection[J]. Natt Med J China, 2012, 92(2): 76-85. |
| [11] |
DE OLIVEIRA D M P, FORDE B M, KIDD T J, et al. Antimicrobial resistance in ESKAPE pathogens[J]. Clin Microbiol Rev, 2020, 33(3): e00181-e00119. |
| [12] |
THOMSON G, TURNER D, BRASSO W, et al. High-stringency evaluation of the automated BD Phoenix CPO detect and rapidec carba NP tests for detection and classification of carbapenemases[J]. J Clin Microbiol, 2017, 55(12): 3437-3443. |
| [13] |
MARTÍN-PEÑA R, DOMÍNGUEZ-HERRERA J, PACHÓN J, et al. Rapid detection of antibiotic resistance in Acinetobacter baumannii using quantitative real-time PCR[J]. J Antimicrob Chemother, 2013, 68(7): 1572-1575. |
| [14] |
SKARIYACHAN S, TASKEEN N, GANTA M, et al. Recent perspectives on the virulent factors and treatment options for multidrug-resistant Acinetobacter baumannii[J]. Crit Rev Microbiol, 2019, 45(3): 315-333. |
| [15] |
RAMIREZ M S, BONOMO R A, TOLMASKY M E. Carbapenemases: transforming Acinetobacter baumannii into a yet more dangerous menace[J]. Biomolecules, 2020, 10(5): 720. |
| [16] |
KUMBURU H H, SONDA T, VAN ZWETSELAAR M, et al. Using WGS to identify antibiotic resistance genes and predict antimicrobial resistance phenotypes in MDR Acinetobacter baumannii in Tanzania[J]. J Antimicrob Chemother, 2019, 74(6): 1484-1493. |
| [17] |
KOBER C, NIESSNER R, SEIDEL M. Quantification of viable and non-viable Legionella spp. by heterogeneous asymmetric recombinase polymerase amplification (HaRPA) on a flow-based chemiluminescence microarray[J]. Biosens Bioelectron, 2018, 100: 49-55. |
| [18] |
WANG H, GILL C O, YANG X Q. Use of sodium lauroyl sarcosinate (sarkosyl) in viable real-time PCR for enumeration of Escherichia coli[J]. J Microbiol Methods, 2014, 98: 89-93. |
| [19] |
LI H Y, XIN H Y, LI S F. Multiplex PMA-qPCR assay with internal amplification control for simultaneous detection of viable Legionella pneumophila, Salmonella typhimurium, and Staphylococcus aureus in environmental waters[J]. Environ Sci Technol, 2015, 49(24): 14249-14256. |
| [20] |
TAO B L, PING Z, BAO Q Z, et al. Simultaneous quantitative detection of viable Escherichia coli O157: H7, Cronobacter spp. and Salmonella spp. using sodium deoxycholate-propidium monoazide with multiplex real-time PCR[J]. J Dairy Sci, 2019, 102(4): 2954-2965. |




