高原缺氧一直是人体健康的重大障碍,缺氧引起的心血管疾病是人类死亡的首要原因[1]。高原缺氧的病理机制与氧化应激和细胞凋亡密切相关,其预防和治疗一直面临很大压力[2]。由于高原的缺氧环境可导致水土不服,从而引起一系列其他疾病,因此,抗缺氧药物的寻找和研究迫在眉睫。近年来,有研究表明传统中药杜仲具有广泛药理活性如抗氧化作用[3],其主要成分为槲皮素、黄酮类等化合物[4-5]。也有实验研究表明杜仲主要单体成分槲皮素具有保护心肌细胞、抑制细胞凋亡的作用[6],但其作用机制尚不清楚。
本研究通过建立H9C2心肌细胞缺氧模型,筛选槲皮素对H9C2细胞抗缺氧损伤的最佳浓度,并探讨槲皮素发挥抗缺氧损伤作用与MAPK/ERK1/2信号途径的关系,为槲皮素中药的二次开发和机制研究奠定基础。
1 材料与方法 1.1 材料与试剂H9C2细胞株购自商业化的公司。DMEM培养基(美国Gibco公司);槲皮素(中国药品检定所,纯度含量98%以上);胎牛血清(杭州四季青生物科技有限公司);胰蛋白酶、碘化丙啶(PI)、噻唑蓝(MTT)、二甲基亚砜(DMSO)均购自Sigma公司;乳酸脱氢酶(LDH)、超氧化物歧化酶(SOD)、丙二醛(MDA)、检测试剂盒均购自南京建成生物工程研究所;兔抗MAPK、p-MAPK、β-actin、ERK1/2和ERK1/2一抗均购于Abcam公司;辣根过氧化物酶(HRP)标记二抗购于中杉金桥公司;SCH772984购于Selleck公司;青霉素钠、链霉素(华北制药有限公司);胰蛋白酶(上海生物工程有限公司),其他试剂均为国产分析纯。
1.2 仪器酶标仪(BioTeK公司,美国);倒置相差显微镜(日本OLYMPUS);SW-CJ-1F超净工作台(苏州安泰空气技术有限公司);三气细胞培养箱(美国赛默飞世尔科技);IX71倒置荧光显微镜(日本OLYMPUS公司)。
1.3 实验方法H9C2心肌细胞培养条件37 ℃ 5% CO2,含10%胎牛血清的DMEM培养液,待细胞融合至培养皿面积的70%~80%时进行传代培养,每隔3天更换培养液1次,取对数生长期的细胞进行后续实验。
1.4 H9C2细胞缺氧模型建立细胞计数调整细胞浓度为1×104个/mL,接种于24孔板中,每孔接种量为1 mL。37 ℃ 5% CO2培养的H9C2细胞融合生长达到70%~80%时开始改变培养条件为37 ℃ 95% N25% CO2,缺氧培养时间依次为0(Control)、6、12、24和48 h,测定LDH和SOD的含量,确定最适宜的缺氧培养时间。
1.5 槲皮素适宜药物浓度筛选细胞计数,调整细胞密度为1×104个/mL,接种于96孔板中,每孔200 μL。接种24 h后倒置相差显微镜下观察细胞贴壁生长达到80%以上时,依次分别使用不同浓度槲皮素(10-4、10-5、10-6、10-7mol/L)对培养37 ℃ 5% CO2的H9C2细胞进行干预。药物干预24 h弃掉培养液,37 ℃温浴的PBS漂洗3次后,依次加入10 μL 5 mg/mL的MTT继续培养4 h,弃去上清液,加入100 μL DMSO,置于摇床上震荡10 min使结晶充分溶解。酶标仪490 nm处测定光密度值。
1.6 槲皮素对H9C2细胞缺氧保护作用根据实验设计要求进行分组,待H9C2细胞接种培养融合达到80%以上时,将接种细胞依次分为对照组(37 ℃、95% O25% CO2:C组)、缺氧模型组(37 ℃ 95% N25% CO2:H组)、药物组(10-6 mol/L槲皮素37 ℃、95% N25% CO2:Q组)、SCH772984组(37 ℃ 95% O25% CO2 4 nmol/L的SCH772984:S组)、药物+缺氧组(37 ℃ 95% N25% CO210-6mol/L槲皮素:Q+H组)、药物+SCH772984组(37 ℃、5% CO2 10-5mol/L槲皮素和4 nmol/L SCH772984:Q+S组),然后按照上述条件对H9C2细胞进行处理。
1.7 LDH、SOD和MDA的含量分析上述各组H9C2细胞处理后24 h,分别测定LDH、SOD和MDA的含量,检测方法严格按照试剂盒说明书操作进行。
1.8 Western blot检测按照上述实验设计处理H9C2细胞24 h后取出培养细胞弃培养液,用4 ℃预冷的PBS清洗3次;加入300 μL含1%PMSF的RIPA蛋白裂解液,于冰上静置10 min裂解细胞;收集细胞裂解液,4 ℃ 12 000 r/min离心30 min;收集上清,BCA法测定蛋白质浓度,煮沸变性10 min;取20 μg进行SDS-PAGE凝胶电泳,然后蛋白转移至PVDF膜上,5%脱脂奶粉室温封闭2 h,加入一抗(p-ERK1/2、ERK1/2、p-MAPK、MAPK、β-actin)4 ℃孵育过夜,TBST清洗5次,每次5 min;加入二抗室温孵育2 h,TBST清洗5次,每次8 min;ECLPlus超敏发光液暗室发光显影,蛋白条带使用ipp软件扫描量化分析。
1.9 统计学分析采用SPSS 16.0软件进行分析,计量资料以x±s表示,采用单因素方差分析,组间多重比较采用LSD检验,P < 0.05为差异有统计学意义。
2 结果 2.1 缺氧改变了H9C2细胞形态正常和缺氧培养H9C2细胞24 h后,倒置显微镜下观察细胞形态,其中正常对照组H9C2细胞呈梭形,排列规整,大小均匀,胞核、胞质边缘界限清楚;缺氧培养组细胞呈不同程度收缩,细胞体积明显缩小、变圆,突起消失(图 1)。
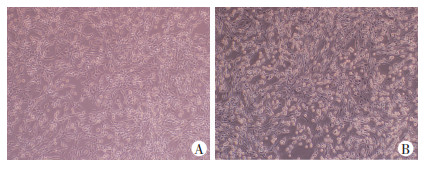
|
| A: 37 ℃ 5% CO2培养24 h后H9C2细胞;B: 37 ℃ 95% N2 5% CO2培养24 h后H9C2细胞 图 1 H9C2细胞形态观察(×40) |
2.2 H9C2细胞缺氧模型建立
H9C2细胞采用37 ℃ 95% N25% CO2条件分别培养0、6、12、24、48 h,测定LDH和SOD含量。随着缺氧时间的延长,细胞培养液中LDH含量逐渐升高,SOD含量逐渐降低,24 h时与对照相比均有统计学差异(P < 0.05,图 2)。因此,确定LDH和SOD含量缺氧的最佳时间为24h。
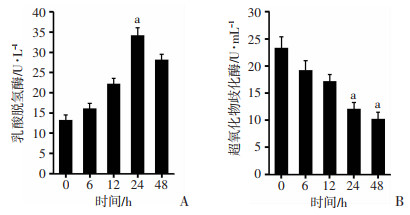
|
| A: 37 ℃ 95% N2 5% CO2培养H9C2细胞不同时间后LDH含量测定结果;B: 37 ℃ 95% N2 5% CO2培养H9C2细胞不同时间后SOD含量测定结果a:P < 0.05,与对照(0 h)比较 图 2 H9C2细胞缺氧模型建立(n=3) |
2.3 槲皮素最适浓度的筛选
H9C2细胞接种培养24 h后,分别使用含有10-4、10-5、10-6、10-7 mol/L的槲皮素处理H9C2细胞24 h,分析槲皮素对H9C2增殖的影响。结果显示,从10-4 mol/L开始,随着药物浓度的下降细胞活性升高,10-6 mol/L时达到最高,从10-7 mol/L时细胞活性开始下降,其中10-6 mol/L与对照比较差异有统计学意义(P < 0.05),因此槲皮素作用H9C2细胞最佳浓度为10-6 mol/L(图 3)。
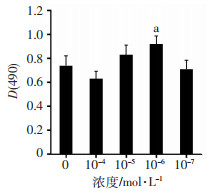
|
| a:P < 0.05,与对照(0 mol/L)比较 图 3 不同浓度槲皮素对H9C2细胞增殖的影响(n=6) |
2.4 H9C2细胞中LDH的含量
与对照组比较,H组和S组显著提高了H9C2细胞培养液中LDH的含量(P < 0.01,P < 0.05),缺氧加速了H9C2细胞损伤,ERK1/2阻断剂同时也能加速细胞损伤,分别与H组和S组比较,Q+H组和Q+S组均显著降低细胞培养液中LDH的含量(P < 0.05,P < 0.01),说明槲皮素对缺氧造成的损伤和ERK1/2信号被阻断造成的细胞损伤具有一定的保护作用(图 4)。
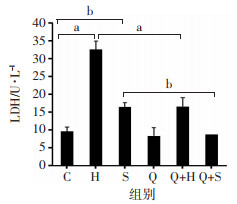
|
| a:P < 0.01,b:P < 0.05 图 4 槲皮素对H9C2细胞内LDH含量的影响(n=3) |
2.5 H9C2细胞中SOD含量
与对照组比较,H组和S组显著降低了H9C2细胞内SOD含量(P < 0.05,P < 0.01)。分别与H组和S组比较,Q+H组和Q+S组显著提高H9C2细胞SOD含量(P < 0.05)。结果表明槲皮素能有效抵抗缺氧造成的H9C2细胞内SOD含量下降(图 5)。
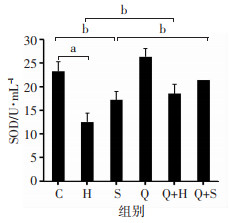
|
| a:P < 0.01,b:P < 0.05 图 5 槲皮素对H9C2细胞内SOD含量的影响(n=3) |
2.6 H9C2细胞中MDA含量
与对照组比较,H和S组显著提高了H9C2细胞内MDA的含量(P < 0.05,P < 0.01),与H组比较,Q+H组显著降低了细胞内MDA的含量(P < 0.05)。结果表明槲皮素能显著降低细胞中因缺氧和ERK1/2信号通路被阻断引起的MDA含量升高(图 6)。
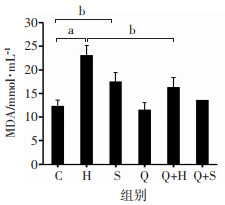
|
| a:P < 0.01,b:P < 0.05 图 6 槲皮素对H9C2细胞内MDA含量的影响(n=3) |
2.7 H9C2细胞中MAPK/ERK1/2蛋白表达
与对照比较,缺氧处理和ERK1/2信号通路被阻断后显著抑制了H9C2细胞内p-MAPK磷酸化的表达水平(P < 0.05,P < 0.01),而槲皮素显著提高了p-MAPK蛋白表达水平(P < 0.01),缺氧和ERK1/2阻断剂显著抑制槲皮素提高p-MAPK蛋白的表达水平(P < 0.01)。同时对p-ERK1/2和ERK1/2蛋白表达进行检测,结果显示p-ERK1/2蛋白表达水平与p-MAPK水平趋势基本一致。缺氧和ERK1/2阻断剂显著抑制槲皮素提高p-MAPK、p-ERK1/2蛋白的表达水平,缺氧显著降低槲皮素提高p-MAPK、p-ERK1/2蛋白的表达水平(图 7)。

|
| A: Western blot检测MAPK/ERK1/2蛋白表达;B: p-MAPK/MAPK比值;C: p-ERK1/2/ERK比值a:P < 0.01,b:P < 0.05 图 7 槲皮素对H9C2细胞内MAPK/ERK1/2信号通路的影响(n=3) |
3 讨论
随着人类活动范围的不断扩大,高原地区活动与人们生活关系越来越密切,但是高原低氧环境给生理活动带来极大挑战。目前低氧环境的调节药物如红景天等中药,均存在主要成分不清楚和作用机制不明等原因。研究表明,中药杜仲具有抗氧化等多种药理作用[7],其主要成分为槲皮素、黄酮类化合物。有研究观察了槲皮素对H9C2细胞氧化损伤的保护机制[8],但对抗缺氧损伤的作用机制尚未报道。本研究首先通过95% N2 5% CO2的培养条件造成缺氧模型,H9C2细胞对缺氧损伤具有一定的时间依赖性。同时H9C2细胞对槲皮素的作用存在一定浓度剂量的依赖性,实验结果进一步表明MAPK/ERK1/2信号通路参与了槲皮素对H9C2缺氧损伤的保护作用。
本研究通过95% N2 5% CO2的培养条件建立H9C2细胞缺氧模型。H9C2细胞缺氧培养不同时间(0、6、12、24、48h)后细胞形态发生明显变化,其中随着缺氧时间的延长,低氧条件对H9C2细胞造成的损伤加重。乳酸脱氢酶(LDH)为细胞内酶,当细胞受到各种损伤后,细胞膜发生破损导致LDH外漏至细胞培养液中,因此细胞培养液中LDH含量的高低反映细胞受损伤的程度。实验结果发现随着缺氧时间的延长LDH逐渐增加,24 h达到最高,24~48 h时LDH下降,其原因是由于随着缺氧时间的延长,细胞出现了大量的凋亡最终导致LDH含量的下降。超氧化物歧化酶(SOD)能清除细胞缺氧过程中产生的大量自由基等有害物质,结果显示,随着缺氧时间的延长,SOD的含量逐渐降低,推测缺氧过程中,细胞产生大量的有害物质消耗SOD以及缺氧造成SOD的表达降低等。本研究结果表明,H9C2细胞缺氧培养24 h为其指标检测的最佳时间点。
前期的研究表明杜仲具有很好的抗缺氧保护功效,槲皮素为其主要的有效成分[8],但其是否具有抗缺氧保护作用尚不清楚。本研究观察了不同浓度槲皮素对H9C2细胞活性作用,结果显示槲皮素作用于H9C2细胞具有一定的浓度依赖性,其中10-6mol/L的槲皮素对H9C2细胞具有一定活性。前期的研究报道细胞和机体在缺氧环境中会发生一系列的缺氧应激反应,尤其是心脏系统抗缺氧过程中产生过多的活性氧,最终导致抗氧化能力的减弱,引起心肌细胞功能障碍及结构破坏、凋亡、坏死、心肌细胞大量缺失等[9-11]。目前判断缺氧损伤基本依据是自由基的清除和抗氧化物和氧化过程中的一些代谢产物,如丙二醛(MDA)、超氧化物歧化酶(SOD)、LDH含量等。缺氧环境造成了H9C2细胞培养液中LDH含量的大量升高,而槲皮素处理H9C2细胞后显著抑制缺氧造成的培养液中LDH的升高[12]。然而使用ERK1/2阻断剂SCH772984处理H9C2细胞后LDH含量升高,槲皮素可以逆转这一过程,因此推测槲皮素对缺氧造成的H9C2细胞损伤具有一定的保护作用。SOD具有清除这些有害物质的功能,SOD的高低直接反映细胞抗氧化水平[13],本研究结果显示缺氧和ERK1/2信号通路被阻断后,显著抑制了SOD含量,然而槲皮素预处理后SOD含量有所升高,因此推断槲皮素具有提高H9C2细胞的抗氧化水平。MDA具有细胞毒性,能引起细胞的损伤[14],槲皮素具有清除缺氧和ERK1/2信号通路被阻断后造成MDA升高的能力。同时研究发现槲皮素也能提高p-MAPK和p-ERK1/2蛋白的表达水平,但是缺氧和ERK1/2阻断剂均抑制了其表达水平。本研究推测槲皮素通过ERK1/2信号通路提高H9C2细胞抗氧化能力,减少缺氧对细胞的损伤。
综上所述,槲皮素能有效提高H9C2细胞的抗氧化能力,减少缺氧对H9C2细胞过程中的损伤作用。本研究为槲皮素的抗缺氧保护作用的药理活性,以及为富含槲皮素的中药的开发奠定了基础。
| [1] |
SAVLA J J, LEVINE B D, SADEK H A. The effect of hypoxia on cardiovascular disease: friend or foe?[J]. High Alt Med Biol, 2018, 19(2): 124-130. |
| [2] |
赵敏, 陈垚, 李文华. 高原低氧影响学习记忆功能的机制研究进展[J]. 西北国防医学杂志, 2019, 40(9): 536-541. ZHAO M, CHEN Y, LI W H. Research progress on mechanism of altitude hypoxia affecting learning and memory function[J]. Med J Natl Defend Forces Northwest China, 2019, 40(9): 536-541. |
| [3] |
张帅男, 李煦照. 杜仲化学成分及药理作用研究进展[J]. 中国民族民间医药, 2017, 26(10): 56-61. ZHANG S N, LI X Z. The research review of the components and pharmacological action of the bark of Eucommia ulmoides oliv[J]. Chin J Ethnomed Ethnopharmacy, 2017, 26(10): 56-61. |
| [4] |
FOROUZANFAR F, ASADPOUR E, HOSSEINZADEH H, et al. Safranal protects against ischemia-induced PC12 cell injury through inhibiting oxidative stress and apoptosis[J]. Naunyn Schmiedebergs Arch Pharmacol, 2021, 394(4): 707-716. |
| [5] |
LI S T, JIANG J, YANG Z C, et al. Cardiac progenitor cell-derived exosomes promote H9C2 cell growth via Akt/mTOR activation[J]. Int J Mol Med, 2018, 42(3): 1517-1525. |
| [6] |
CAO W Q, ZHAI X Q, MA J W, et al. Natural borneol sensitizes human glioma cells to cisplatin-induced apoptosis by triggering ROS-mediated oxidative damage and regulation of MAPKs and PI3K/AKT pathway[J]. Pharm Biol, 2020, 58(1): 72-79. |
| [7] |
HU Q L, WANG H, HE C, et al. Polystyrene nanoparticles trigger the activation of p38MAPK and apoptosis via inducing oxidative stress in zebrafish and macrophage cells[J]. Environ Pollut, 2021, 269: 116075. |
| [8] |
JIANG C S, ZHUANG C L, ZHU K K, et al. Identification of a novel small-molecule Keap1-Nrf2 PPI inhibitor with cytoprotective effects on LPS-induced cardiomyopathy[J]. J Enzyme Inhib Med Chem, 2018, 33(1): 833-841. |
| [9] |
WANG H, ZHOU X M, WU L Y, et al. Aucubin alleviates oxidative stress and inflammation via Nrf2-mediated signaling activity in experimental traumatic brain injury[J]. J Neuroinflamm, 2020, 17(1): 188. |
| [10] |
SHI Y Y, TIAN C M, YU X F, et al. Protective effects of Smilax glabraroxb. against lead-induced renal oxidative stress, inflammation and apoptosis in weaning rats and HEK-293 cells[J]. Front Pharmacol, 2020, 11: 556248. |
| [11] |
蒋瑞彬, 朱学鑫, 邢丽婉, 等. 山核桃叶总黄酮对H9C2心肌细胞缺氧复氧损伤的保护作用[J]. 中药材, 2016, 18(2): 378-382. JIANG R B, ZHU X X, XING L W, et al. Protective effect of total flavonoids from Caryacathayensis leaf on cultured H9C2 cardiomyocytes during hypoxia/reoxygenationinjury[J]. J Chin Med Mater, 2016, 18(2): 378-382. |
| [12] |
关钧声, 郭海玲, 张紫佳, 等. 杜仲总提物对大鼠成骨细胞增殖、分化及Ⅰ型胶原蛋白表达的影响[J]. 上海中医药杂志, 2014, 48(7): 95-98. GUAN J S, GUO H L, ZHANG Z J, et al. Effects of Du-Zhong cortex extract on osteoblast cell proliferation, differentiation and Col1αⅠexpression[J]. Shanghai J Tradit Chin Med, 2014, 48(7): 95-98. |
| [13] |
FAN R F, LIU J X, YAN Y X, et al. Selenium relieves oxidative stress, inflammation, and apoptosis within spleen of chicken exposed to mercuric chloride[J]. Poult Sci, 2020, 99(11): 5430-5439. |
| [14] |
OTHMÈNE Y B, HAMDI H, SALEM I B, et al. Oxidative stress, DNA damage and apoptosis induced by tebuconazole in the kidney of male Wistar rat[J]. Chem Biol Interact, 2020, 330: 109114. |




