2. 400016 重庆,重庆医科大学检验医学院临床检验诊断学教育部重点实验室
2. College of Laboratory Medicine, Key Laboratory of Clinical Laboratory Diagnostics of Ministry of Education, Chongqing Medical University, Chongqing, 400016, China
世界卫生组织(WHO)将弱精症定义为精液样本中前向运动精子百分率 < 32%的病症,研究发现弱精症是导致男性不育的重要因素之一。弱精症的病因复杂多样,但约有50%的弱精症患者没有明确病因[1]。因此,研究弱精症的发生机制以及寻找精子质量的预测指标有着重要的临床意义。活性氧(reactive oxygen species,ROS)是造成男性不育的重要因素,在男性生殖道中,ROS的过量产生会破坏精子及精浆的抗氧化系统,通过攻击富含不饱和脂肪酸的精子膜、破坏精子DNA单双链[2]、损伤线粒体及线粒体DNA[3]等途径对精子的结构和功能造成损伤,大量研究数据已证实弱精症患者精液的ROS水平显著高于正常[4],这提示我们ROS水平异常增高可能与弱精症的发生相关。作为超氧化物歧化酶家族的重要成员之一,SOD2主要位于线粒体中,表达于精子头部的顶体区域及颈部[5],能够清除超氧阴离子自由基[6],从而保护细胞免受ROS损伤。此外,PRDX6是一类非硒依赖性抗氧化蛋白家族成员,具有谷胱甘肽过氧化物酶和磷脂酶A2活性。PRDX6主要表达于精子头部的顶体后区域、赤道段和尾部[7],能够对抗过量ROS产生的氧化应激损伤,对精子起到保护作用[8]。FERNANDE等[9]阐明了PRDX6在人类精子发生氧化应激时对其活力和DNA的保护作用。虽然上述研究证实了SOD2和PRDX6可在精子中发挥重要的抗氧化作用,但仍然缺少临床数据对精子抗氧化蛋白SOD2和PRDX6与弱精症的关系进行阐明,弱精症患者精子中SOD2和PRDX6的表达量对精子运动能力的预测价值尚未被报道。
本研究采用外源性H2O2刺激正常精子后通过CASA检测精子活力和运动参数变化,伊红染色检测精子存活率变化,Western blot检测精子SOD2和PRDX6表达变化,探讨ROS对精子运动能力的损伤作用及对SOD2和PRDX6表达的影响;RT-qPCR和Western blot两种方法检测抗氧化蛋白SOD2和PRDX6在弱精症患者精子中的表达变化并分析其与精子运动能力的相关性,旨在探讨弱精症发生的分子机制,寻找精子运动能力的预测指标。
1 资料与方法 1.1 研究对象收集2020年1-11月于我中心进行精液常规检查的精液标本进行研究。正常组精液样本纳入标准:①连续3次精液常规检查PR≥32%,PR+NP≥40%,精子密度≥15×106/mL;②睾酮、雌二醇等性激素水平正常;③临床各项检查指标未见明显异常。正常组精液样本排除标准:①精液常规任一参数存在异常;②睾酮、雌二醇等性激素水平异常;③先天性生殖系统异常或后天性生殖系统损伤和疾病等。弱精症组精液样本纳入标准:①连续3次精液常规均提示PR < 32%,PR+NP < 40%,精子密度≥15×106/mL;②睾酮、雌二醇等性激素水平正常;③泌尿生殖系统体格检查未见异常。弱精症组精液样本排除标准:①精液常规参数中除活力相关的任一参数存在异常;②睾酮、雌二醇等性激素水平异常;③先天性生殖系统异常或后天性生殖系统损伤和疾病等;④伴有遗传因素的弱精症。
检查前受试者均签署知情同意书,本研究通过重庆医科大学附属第一医院临床科研伦理委员会批准(2020-42)。共55例正常组精液标本、84例弱精症组精液标本纳入本项研究。
1.2 检测方法 1.2.1 标本采集和常规参数检测本研究中接受精液检查者均禁欲3~7 d后,依据WHO第5版《人类精液检查与处理的实验室手册》使用手淫法取精后将精液收集于消毒的广口干燥无菌容器中,37 ℃温浴30 min,液化后混匀精液,通过计算机辅助的精液分析(CASA)检测精液常规参数及运动参数;剩余精液使用90%(下层)和45%(上层)percoll液以700×g密度梯度离心30 min去除白细胞和死精子后得到精子沉淀,吸取90% percoll液底部的精子沉淀于无菌试管中,将少量精子沉淀涂片后显微镜下观察多个视野未见白细胞为准;使用PBS(pH=7.4)洗涤精子沉淀2次,每次600×g离心5 min;得到的精子沉淀分为两份置于两只1.5 mL离心管中,用于后续实验。精子存活率检测采用伊红染色法:滴加新鲜液化精液或含有不同浓度H2O2 BWW培养基处理后的重悬精子标本30 μL于洁净载玻片上,滴加伊红染色液1滴,混匀;加置盖玻片后立即于高倍镜(×400)下观察;镜下计数200个精子,计算未染色(活精子)精子占200个精子的百分率得到精子存活率。
1.2.2 精子H2O2处理按照前述方法密度梯度离心处理正常精液标本。将同一精液样本由percoll液分离得到的精子沉淀均分为4~5等份;使用37 ℃预热的PBS(pH=7.4)轻轻吹打洗涤精子沉淀2次,每次600×g离心5~8 min以去除percoll分离液;用配制好的含有不同浓度H2O2的BWW培养基重悬PBS洗涤后的精子沉淀,轻轻吹打混匀后加入12孔板内,置于37 ℃、5%CO2培养箱内孵育30 min;孵育结束后600×g离心10 min去除上清液,使用37 ℃预热的PBS(pH=7.4)轻轻吹打洗涤精子沉淀2次,每次600×g离心5~8 min以去除含有H2O2的BWW培养基;向精子沉淀中加入适量37 ℃预热的BWW培养基重悬,取少量悬液通过CASA检测相关参数,其余部分用于精子蛋白提取。
1.2.3 精子总RNA提取PBS洗涤后的精子沉淀(精子总数>20×106)中加入1 mL TRIzol,严格按照试剂说明书提取精子细胞总RNA后溶解于DEPC水中,储存于-80 ℃以备使用。
1.2.4 精子总蛋白质提取PBS液洗涤后的精子沉淀(精子总数>20×106)中加入50~100 μL含有蛋白酶抑制剂的细胞裂解液(RIPA∶PMSF=100∶1),冰上震荡裂解30 min(5 min 1次)后继续于冰上使用超声裂解(30%强度5次,每次3 s,避免产热导致蛋白降解),13 000 r/min离心30 min,得到的上清液即为精子总蛋白,BCA法测定蛋白浓度后加入1/4上清液体积的Loading Buffer煮沸6~8 min,储存于-80 ℃以备使用。
1.2.5 RT-qPCR检测以1 μg RNA为模板,20 μL体系进行逆转录反应,再进行PCR扩增。每个检测样本设置3个复孔,得到的Ct值(3个复孔均值)采用2-△△Ct法进行计算和统计学分析。SOD2上游引物:5′-GTGGAGAACCCAAAGGGGAGTT-3′,SOD2下游引物:5′-GTGGAATAAGGCCTGTTGTTCCTT-3′;PRDX6上游引物:5′-GCATCCGTTTCCACGACT-3′,PRDX6下游引物:5′-TGCACACTGGGGTAAAGTCC-3′;GAPDH上游引物:5′-GAAGGGCTCATGACCACAGT-3′,GAPDH下游引物:5′-GGATGCAGGGATGATGTTCT-3′。
1.2.6 Western blot实验蛋白上样量为20 μg;两步法电泳;Step1:U=90 V,I=100 mA,电泳30 min;Step2:U=120 V,I=100 mA,电泳90 min;湿转法转膜约1 h;转膜结束后将PVDF膜置于5%脱脂牛奶中室温封闭2 h;TBST洗涤2次后加一抗,4 ℃孵育过夜;TBST洗膜3次后加二抗,室温孵育1 h;TBST洗膜3次后显影液覆盖PVDF膜显影,结果使用Image Lab进行蛋白条带定量分析。
1.3 统计学分析采用Graphpad Prism 6.0和SPSS 25.0软件进行统计学分析和作图,进行正态性检验后符合正态分布的数据以x±s表示,通过Student’s t检验分析组间差异,不符合正态分布的以中位数(P25,P75)表示,采用Mann-Whitney U检验分析组间差异。使用Spearman秩相关进行相关性分析。
2 结果 2.1 ROS损伤正常精子的运动能力为了证实ROS对精子运动能力的影响,我们使用不同浓度H2O2(0.05、0.10、0.35、1.00 mmol/L)处理正常精子细胞,在37 ℃孵育30 min后,CASA检测结果显示精子的前向运动百分率和总活力在浓度大于0.10 mmol/L的处理组中显著降低(P < 0.05),在1.00 mmol/L H2O2处理组中几乎降低为0(P < 0.01, 图 1A、B)。由于1.00 mmol/L H2O2处理正常精子后精子几乎丧失了活力,所以我们后续使用0.05、0.10、0.35 mmol/L H2O2处理正常精子细胞30 min后CASA检测精子运动参数,结果显示曲线速率(VCL)、直线速率(VSL)、平均路径速率(VAP)和平均角位移(MAD)呈H2O2剂量依赖式降低(P < 0.05, 图 1C~F),侧摆幅度(ALH)、前向性(STR)、摆动性(WOB)和有线性(LIN)在较高浓度(0.10、0.35 mmol/L)的H2O2处理后显著降低(P < 0.05, 图 1G~J),但反叉频率(BCF)无显著变化(图 1K)。此外,精子的存活率在0.35 mmol/L和1.00 mmol/L H2O2处理组中显著降低(P < 0.05, 图 2)。
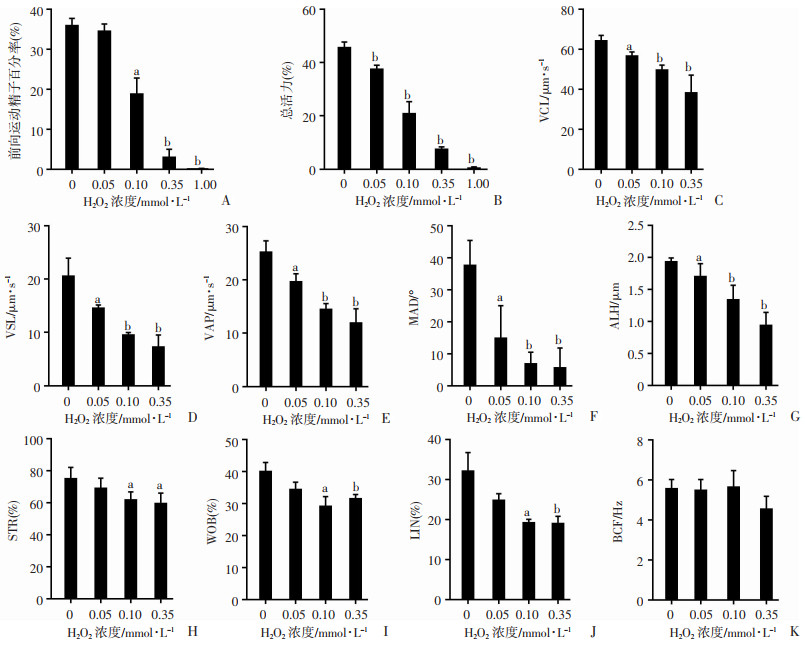
|
| A~K:CASA检测H2O2处理后正常精子前向运动精子百分率、总活力、VCL、VSL、VAP、MAD、ALH、STR、WOB、LIN、BCF的变化a:P < 0.05,b:P < 0.01,与0 mmol/L比较 图 1 H2O2处理正常精子后精子活力和运动参数变化(n=3) |
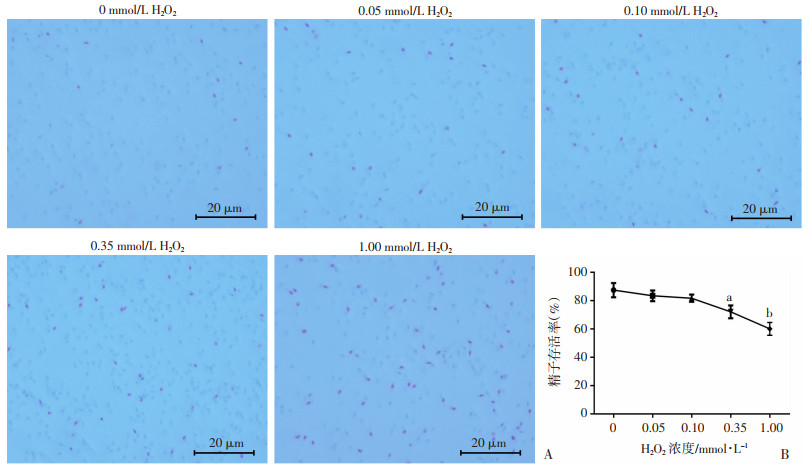
|
| A: 0.05~1.00 mmol/L H2O2处理正常精子后HE染色观察精子存活率变化;B:精子存活率定量分析a:P < 0.05,b:P < 0.01,与0 mmol/L比较 图 2 H2O2处理正常精子后精子存活率变化形态学观察及定量分析(n=3,x±s) |
2.2 ROS可上调正常精子SOD2和PRDX6的表达
Western blot检测结果显示H2O2处理正常精子后,精子抗氧化蛋白SOD2和PRDX6的表达以剂量依赖性方式显著增加(P < 0.05,P < 0.01,图 3)。
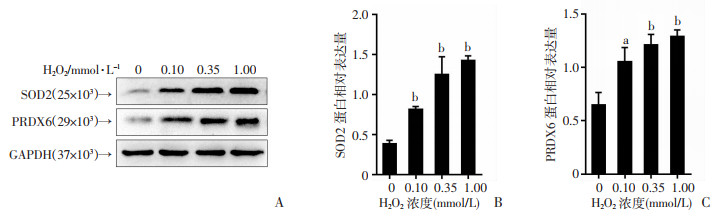
|
| A:Western blot检测H2O2处理后正常精子中SOD2和PRDX6的表达;B、C:蛋白表达半定量分析a:P < 0.05,b:P < 0.01,与0 mmol/L比较 图 3 H2O2处理上调正常精子SOD2和PRDX6的表达(n=3) |
2.3 正常组与弱精症组一般资料比较
两组被试前向运动百分率、总活力、STR、VCL、VSL、VAP显著低于正常组(P < 0.05),患者年龄、精液体积、pH值、浓度、LIN、WOB、ALH、BCF和MAD等指标数据见表 1。
| 项目 | 正常组(n=55) | 弱精症组(n=84) | P |
| 年龄/岁 | 30.89±4.30 | 31.63±4.87 | 0.361 |
| 精液体积/mL | 3.39±1.58 | 3.26 ± 1.52 | 0.641 |
| 精液pH值 | 7.47±0.10 | 7.45±0.14 | 0.272 |
| 精液密度/106·mL-1 | 127.60±93.68 | 102.40 ±74.58 | 0.081 |
| 前向运动精子百分率(%) | 45.70±10.26 | 17.38±7.72 | < 0.001 |
| 总活力(%) | 53.70±10.67 | 23.23±8.80 | < 0.001 |
| STR(%) | 87.23±3.72 | 84.25±8.32 | 0.014 |
| LIN(%) | 59.48±9.31 | 57.57±9.78 | 0.253 |
| WOB(%) | 65.79±8.86 | 64.87±10.16 | 0.584 |
| VCL/μm·s-1 | 67.73±24.02 | 49.22±17.79 | < 0.001 |
| VSL/μm·s-1 | 41.27±13.15 | 28.82±8.22 | < 0.001 |
| VAP/μm·s-1 | 44.82±13.28 | 31.65±8.56 | < 0.001 |
| ALH/μm | 2.84±0.66 | 2.78±0.89 | 0.667 |
| BCF/t·s-1 | 5.74±0.69 | 5.58±1.02 | 0.293 |
| MAD/° | 52.24±17.36 | 48.17±17.44 | 0.180 |
2.4 正常组与弱精症组精子SOD2、PRDX6 mRNA表达水平比较
RT-qPCR检测结果显示弱精症组精子SOD2与PRDX6相对表达量显著低于正常组(P < 0.01,图 4)。
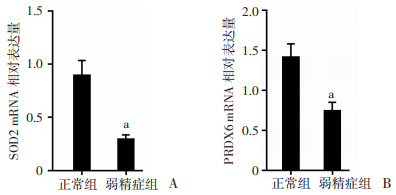
|
| A: S0D2 mRNA表达; B: PRDX6 mRNA表达a; P<0.01,与正常组比较 图 4 RT-qPCR检测正常组与弱精症组精子SOD2、PRDX6 mRNA表达 |
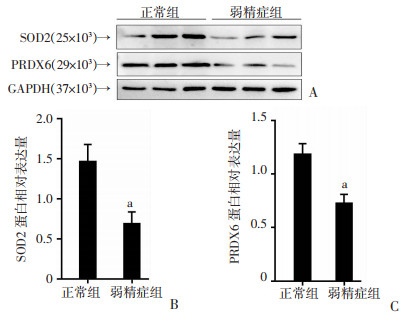
2.5 正常组与弱精症组精子SOD2、PRDX6蛋白表达水平比较
Western blot检测结果显示弱精症组精子SOD2和PRDX6蛋白相对表达量均低于正常组(P < 0.01, 图 5)。
|
| A:Western blot检测正常组与弱精症组精子SOD2和PRDX6表达;B、C:蛋白表达半定量分析a:P < 0.01,与正常组比较 图 5 正常组与弱精症组精子SOD2、PRDX6蛋白表达水平比较(x±s) |
2.6 SOD2、PRDX6 mRNA相对表达量与精液常规参数及精子运动参数的相关性分析
相关分析结果显示SOD2 mRNA相对表达量与前向运动精子百分率(r=0.267,P < 0.01)和总活力(r=0.329,P < 0.01)呈正相关,与其余精液常规参数及精子运动参数无相关性;PRDX6 mRNA相对表达量与前向运动精子百分率(r=0.453,P < 0.01)、总活力(r=0.476,P < 0.01)、STR(r=0.270,P < 0.01)、VCL(r=0.313,P < 0.01)、VSL(r=0.349,P < 0.01)、VAP(r=0.410,P < 0.01)呈正相关,与其余精液常规参数及精子运动参数无相关性(表 2)。
| 变量 | PRDX6 mRNA表达 | SOD2 mRNA表达 | |||
| r | P | r | P | ||
| 年龄/岁 | -0.045 | 0.644 | -0.123 | 0.201 | |
| 精液体积/mL | -0.087 | 0.366 | -0.006 | 0.953 | |
| 精液pH值 | -0.095 | 0.326 | 0.057 | 0.557 | |
| 精液密度/106·mL-1 | 0.003 | 0.976 | 0.145 | 0.130 | |
| 前向运动精子百分率(%) | 0.453 | < 0.001 | 0.267 | 0.005 | |
| 总活力(%) | 0.476 | < 0.001 | 0.329 | < 0.001 | |
| STR(%) | 0.270 | 0.004 | 0.173 | 0.071 | |
| LIN(%) | 0.151 | 0.116 | 0.114 | 0.236 | |
| WOB(%) | 0.023 | 0.814 | 0.166 | 0.084 | |
| VCL/μm·s-1 | 0.313 | < 0.001 | -0.050 | 0.605 | |
| VSL/μm·s-1 | 0.349 | < 0.001 | 0.052 | 0.586 | |
| VAP/μm·s-1 | 0.410 | < 0.001 | 0.051 | 0.594 | |
| ALH/μm | 0.046 | 0.636 | 0.096 | 0.317 | |
| BCF/t·s-1 | -0.052 | 0.589 | -0.096 | 0.317 | |
| MAD/° | 0.006 | 0.953 | -0.002 | 0.985 | |
3 讨论 3.1 ROS与精子运动能力
ROS是导致男性不育的重要因素之一,研究发现弱精症患者精液的ROS水平异常增高[4],而总抗氧化能力(T-AOC)显著低于正常[10],这表明ROS水平增高可能与精子活力降低有关。H2O2是一种可转变成如氧自由基和羟基自由基等其他类型ROS的非自由基ROS[6],这些类型的ROS与体内环境中精子细胞产生的ROS类型是相同的,且具备破坏蛋白质、脂质和核酸[11]的能力。目前H2O2处理是体外条件诱导细胞发生氧化应激最有效且最常见的方法,研究表明H2O2处理可引起精子细胞内源性ROS异常累积,从而导致线粒体膜电位下降和DNA断裂等一系列损伤,而这些变化与体内氧化应激发生时精子细胞的变化是一致的[12-13],且目前国内外研究没有明确指出H2O2体外模拟ROS环境和构建氧化应激模型的明显弊端,故本研究使用不同浓度的H2O2处理后检测ROS对精子运动能力和存活率的影响。研究表明0.1 mmol/L的H2O2刺激精子0.5 h后可以显著降低精子的活力和存活率[14-15],也有研究发现0.3 mmol/L的H2O2能够在0.5 h的孵育后将精子的活力降低至约5%,而0.6 mmol/L H2O2在0.5 h的孵育后可将精子的存活率降低约50%[16]。在本研究中,我们发现0.10 mmol/L H2O2处理精子0.5 h后,精子活力和前向运动百分率均显著降低,0.35 mmol/L处理组精子活力和前向运动百分率降低至10%以下,精子存活率也显著降低,而1 mmol/L H2O2处理0.5 h后精子活力几乎完全丧失,这与上述研究的结果基本一致。也有研究认为0.5 mmol/L H2O2处理0.5 h对精子存活率没有显著影响,当H2O2处理浓度增加至3 mmol/L时才能降低精子存活率[17]。我们认为这可能是精子优选过程中使用的方法不同导致的,使用上游法优选精子时得到的精子活力更好,运动能力更强,这样高质量的精子可能对H2O2损伤的抵抗作用更强,而本研究使用密度梯度离心法优选精子,精子回收率更高但精子回收质量不及上游法。目前尚未有研究对H2O2处理后精子运动参数的变化进行报道,本研究发现0.05 mmol/L H2O2处理即可显著降低精子的VCL、VSL、VAP和MAD,H2O2浓度增加至0.35 mmol/L和1 mmol/L时,ALH、STR、WOB和LIN显著下降,而BCF没有显著变化,我们推测较低浓度的H2O2对精子运动能力造成的影响主要是通过损伤精子膜导致的,ROS可使精子膜发生脂质过氧化,导致其产生具有高细胞毒性的亲电子脂质醛,增加电子在电子传输链中的流动[18],改变膜的流动性、渗透性和功能,最终导致精子运动能力的丧失[14]。而当H2O2浓度达到3 mmol/L时,精子的线粒体膜电位降低更为显著[17],在这种情况下线粒体功能受损明显,精子的BCF才会产生显著的变化。
3.2 精子抗氧化蛋白SOD2和PRDX6与弱精症SOD2是超氧化物歧化酶家族在精子中表达最多的同工酶,研究证实白藜芦醇可通过激活Nrf2促进SOD2的表达降低H2O2刺激,从而引起的大鼠肝原代细胞的氧化应激损伤[19]。PRDX6是过氧化物酶家族的重要成员之一,研究表明PRDX6是精子最为重要的抗氧化酶之一,发生氧化应激时,PRDX6能够起到保持精子活力和维持精子DNA完整性的作用[9]。O’ FLAHERTY等[20]研究发现精子PRDX6在0.05~5 mmol/L H2O2处理后剂量依赖式上调。在本研究中,我们发现在0.05~1.00 mmol/L H2O2处理后精子PRDX6剂量依赖式上调,与上述研究结果相符。目前尚未有研究报道精子SOD2在H2O2处理后的表达变化,本研究结果证实了精子SOD2在0.05~1.00 mmol/L H2O2处理后呈现与PRDX6相同的剂量依赖式上调,这提示正常精子中SOD2和PRDX6可被高水平的ROS上调而发挥抗氧化效应。基于ROS对精子运动能力和活力的损伤作用以及SOD2和PRDX6重要的抗氧化作用,我们提出假设:弱精症患者精子SOD2和PRDX6的表达是否相较正常存在改变,使精子抵抗ROS损伤的能力减弱,从而对精子的运动能力和活力造成影响,引发弱精症?
人的精子中含有大量的RNA,这些RNA来源于睾丸,是精子发生、发育过程中的残留物,其在精子的运动、获能、受精和胚胎发育的过程中发挥重要作用[21]。OSTERMEIER等[22]发现在睾丸和附睾中检测到的mRNA与在精子细胞中检测到的mRNA是一致的,可见精子mRNA对推测精子发生和阐释精子功能的重要作用。本研究同时检测了精子中抗氧化蛋白SOD2、PRDX6 mRNA和蛋白的表达水平,探究SOD2和PRDX6在弱精症患者精子中的表达变化及其与精子运动能力的相关性。
研究表明弱精症患者精液ROS水平更高[4],基于本研究结果提示,精子SOD2和PRDX6在高水平ROS环境下应该较正常表达更高以对抗ROS造成的损伤,而本研究RT-qPCR和Western blot检测结果却显示弱精症组精子SOD2和PRDX6 mRNA与蛋白相对表达量较正常组均降低。研究发现SOD2和PRDX6共同的上游调控分子Nrf2在弱精症患者精子中表达下调[23],这可能是SOD2和PRDX6表达降低的原因,而CHEN等[23]的研究发现SOD2 mRNA相对表达量在弱精症患者精子中表达虽然有下降趋势,但与正常没有显著差异,这可能与样本数差异和地域差异有关。目前尚未有临床研究对弱精症患者精子SOD2与PRDX6的蛋白表达变化和PRDX6 mRNA表达变化进行报道。我们推测正是这两者内源性的表达降低使精子在处于高水平的ROS环境时更容易发生氧化应激,ROS更容易使精子膜中的脂质过氧化,改变膜的完整性和蛋白质组成来破坏精子的运动能力,导致精子活力和运动参数的下降,成为弱精症发生的潜在分子机制。
相关性分析的结果也佐证了我们的推测。结果显示SOD2 mRNA相对表达量与前向运动精子百分率和总活力呈正相关;PRDX6 mRNA相对表达量与前向运动精子百分率、总活力、VCL、VSL、VAP呈正相关。这表明当SOD2和PRDX6表达量较高时,精子的抗氧化能力更强,更能有效抵抗ROS对精子运动能力造成的损伤,所以精子的活力和运动参数都位于正常水平;而当SOD2和PRDX6表达量较低时,精子的抗氧化能力较弱,精子更容易受到ROS对运动能力造成的损伤,使精子活力和运动参数明显下降,导致弱精症的发生。并且我们发现PRDX6 mRNA相对表达量与精子活力和运动参数相关性较高,这提示PRDX6具有预测精子运动能力的潜能。
本研究局限在于完成蛋白水平验证的标本量较少,仍需要进一步扩大标本量;另一方面对弱精症患者精子SOD2、PRDX6 mRNA和蛋白水平下调的机制未进行实验探讨。
综上,本研究验证了ROS对精子运动能力的损伤作用和对精子抗氧化蛋白SOD2及PRDX6的上调作用。同时发现弱精症患者精子SOD2和PRDX6 mRNA和蛋白表达水平显著降低,且PRDX6 mRNA与精子活力和运动速率有较好相关性,提示PRDX6具有预测精子运动能力的潜能。本研究基于精子SOD2和PRDX6的mRNA和蛋白水平检测,对寻找精子运动能力的预测分子及阐释弱精症发生的分子机制提供了新的实验数据和理论依据。
| [1] |
GILANY K, MOAZENI-POURASIL R S, JAFARZADEH N, et al. Metabolomics fingerprinting of the human seminal plasma of asthenozoospermic patients[J]. Mol Reprod Dev, 2014, 81(1): 84-86. |
| [2] |
HAMILTON T R D S, ASSUMPÇÃO M E O D. Sperm DNA fragmentation: causes and identification[J]. Zygote, 2020, 28(1): 1-8. |
| [3] |
DURAIRAJANAYAGAM D, SINGH D, AGARWAL A, et al. Causes and consequences of sperm mitochondrial dysfunction[J]. Andrologia, 2021, 53(1): e13666. |
| [4] |
VATANNEJAD A, TAVILANI H, SADEGHI M R, et al. Evaluation of ROS-TAC score and DNA damage in fertile normozoospermic and infertile asthenozoospermic males[J]. Urol J, 2017, 14(1): 2973-2978. |
| [5] |
MALIVINDI R, RAGO V, DE ROSE D, et al. Influence of all-trans retinoic acid on sperm metabolism and oxidative stress: Its involvement in the physiopathology of varicocele-associated male infertility[J]. J Cell Physiol, 2018, 233(12): 9526-9537. |
| [6] |
VILLAVERDE A I S B, NETHERTON J, BAKER M A. From past to present: the link between reactive oxygen species in sperm and male infertility[J]. Antioxidants (Basel), 2019, 8(12): E616. |
| [7] |
SHI H, LIU J, ZHU P, et al. Expression of peroxiredoxins in the human testis, epididymis and spermatozoa and their role in preventing H2O2-induced damage to spermatozoa[J]. Folia Histochem Cytobiol, 2018, 56(3): 141-150. |
| [8] |
O'FLAHERTY C. Peroxiredoxin 6: the protector of male fertility[J]. Antioxidants (Basel), 2018, 7(12): E173. |
| [9] |
FERNANDEZ M C, O'FLAHERTY C. Peroxiredoxin 6 is the primary antioxidant enzyme for the maintenance of viability and DNA integrity in human spermatozoa[J]. Hum Reprod, 2018, 33(8): 1394-1407. |
| [10] |
MORADI M N, KARIMI J, KHODADADI I, et al. Evaluation of the p53 and Thioredoxin reductase in sperm from asthenozoospermic males in comparison to normozoospermic males[J]. Free Radic Biol Med, 2018, 116: 123-128. |
| [11] |
LI R, JIA Z Q, TRUSH M A. Defining ROS in biology and medicine[J]. React Oxyg Species (Apex), 2016, 1(1): 9-21. |
| [12] |
BADER R, IBRAHIM J N, MOUSSA M, et al. In vitro effect of autologous platelet-rich plasma on H2O2-induced oxidative stress in human spermatozoa[J]. Andrology, 2020, 8(1): 191-200. |
| [13] |
DU PLESSIS S S, MCALLISTER D A, LUU A, et al. Effects of H(2)O(2) exposure on human sperm motility parameters, reactive oxygen species levels and nitric oxide levels[J]. Andrologia, 2010, 42(3): 206-210. |
| [14] |
MAHFOUZ R Z, DU PLESSIS S S, AZIZ N, et al. Sperm viability, apoptosis, and intracellular reactive oxygen species levels in human spermatozoa before and after induction of oxidative stress[J]. Fertil Steril, 2010, 93(3): 814-821. |
| [15] |
FATMA B A, NOZHA C F, INES D, et al. Sperm quality improvement after date seed oil in vitro supplementation in spontaneous and induced oxidative stress[J]. Asian J Androl, 2009, 11(3): 393-398. |
| [16] |
CHAKI S P, MISRO M M. Assessment of human sperm function after hydrogen peroxide exposure. development of a vaginal contraceptive[J]. Contraception, 2002, 66(3): 187-192. |
| [17] |
BRAVO A, QUILAQUEO N, JOFRÉ I, et al. Overtime expression of plasma membrane and mitochondrial function markers associated with cell death in human spermatozoa exposed to nonphysiological levels of reactive oxygen species[J]. Andrologia, 2021, 53(2): e13907. |
| [18] |
AITKEN R J, GIBB Z, MITCHELL L A, et al. Sperm motility is lost in vitro as a consequence of mitochondrial free radical production and the generation of electrophilic aldehydes but can be significantly rescued by the presence of nucleophilic thiols[J]. Biol Reprod, 2012, 87(5): 110. |
| [19] |
RUBIOLO J A, MITHIEUX G, VEGA F V. Resveratrol protects primary rat hepatocytes against oxidative stress damage: activation of the Nrf2 transcription factor and augmented activities of antioxidant enzymes[J]. Eur J Pharmacol, 2008, 591(1/2/3): 66-72. |
| [20] |
O'FLAHERTY C, DE SOUZA A R. Hydrogen peroxide modifies human sperm peroxiredoxins in a dose-dependent manner[J]. Biol Reprod, 2011, 84(2): 238-247. |
| [21] |
ZHANG Y F, SHI J C, RASSOULZADEGAN M, et al. Sperm RNA code programmes the metabolic health of offspring[J]. Nat Rev Endocrinol, 2019, 15(8): 489-498. |
| [22] |
OSTERMEIER G C, DIX D J, MILLER D, et al. Spermatozoal RNA profiles of normal fertile men[J]. Lancet, 2002, 360(9335): 772-777. |
| [23] |
CHEN K, MAI Z X, ZHOU Y L, et al. Low NRF2 mRNA expression in spermatozoa from men with low sperm motility[J]. Tohoku J Exp Med, 2012, 228(3): 259-266. |




