2. 400010 重庆,重庆医科大学附属第二医院消化内科;
3. 400016 重庆,重庆医科大学附属第一医院:消化内科;
4. 400016 重庆,重庆医科大学附属第一医院:重症医学科
2. Department of Gastroenterology, the Second Affiliated Hospital of Chongqing Medical University, Chongqing, 400010, China;
3. Department of Gastroenterology, the First Affiliated Hospital of Chongqing Medical University, Chongqing, 400016;
4. Department of Critical Care Medicine, the First Affiliated Hospital of Chongqing Medical University, Chongqing, 400016
肝硬化仍是我国发病率较高且严重影响患者生活的肝脏疾病[1],弥漫性肝纤维化伴假小叶形成是其重要病理特点[2],肝星状细胞(hepatic stellate cells,HSCs)的活化是肝纤维化形成机制中的关键环节,抑制HSCs的活化可阻断甚至逆转肝纤维化[2-3]。HSCs活化是指其从静止状态向增殖、可收缩、表达α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、分泌胶原蛋白和多种细胞因子的成纤维细胞分化的过程[4]。S100钙结合蛋白A6(S100 calcium binding protein A6,S100A6)是一种钙周期蛋白,为S100家族中的一员,在细胞分化、增殖、迁移、凋亡等过程中发挥重要作用[5]。针对HSCs的单细胞测序发现在肝脏组织内S100A6是HSCs活化成为肌成纤维细胞后特异性高表达蛋白[6]。另有研究利用重组人S100A6干预小鼠原代HSCs可诱导HSCs细胞周期从S期过渡到G2期,促进其增殖,而以高级糖基化终产物可溶性受体(soluble receptor for advanced glycation end products, sRAGE)竞争抑制S100/RAGE信号通路可以减轻四氯化碳(CCl4)诱导的小鼠肝纤维化[7],虽然这些研究证实了S100A6与HSCs以及肝纤维化的关系,但S100A6除了影响HSCs增殖,是否还影响其功能尚少见报道。本研究拟通过观察siRNA干扰HSCs S100A6 mRNA合成后HSCs活化相关蛋白表达,进而探讨S100A6对HSCs功能的影响,证实S100A6是一个调控HSCs活化的重要蛋白。
1 材料与方法 1.1 实验动物及主要试剂 1.1.1 实验动物以及处理6~8周龄的SPF级C57BL/6雄性小鼠12只从重庆医科大学实验动物中心购买。适应性饲养1周后,将小鼠分为对照组与纤维化组,每组6只。纤维化组经腹腔注射橄榄油稀释溶解的10% CCl4诱导小鼠慢性肝损伤构建肝纤维化模型,注射剂量为5 μL/g,每3天注射1次,对照组同步腹腔注射等量纯橄榄油,造模时间为6周。造模结束后,称体质量并收集肝脏标本,对肝组织采用Masson染色和免疫组织化学染色。本研究经重庆医科大学第一附属医院动物使用与伦理委员会(20200325)评审通过。
1.1.2 主要试剂细胞培养基DMEM、青霉素-链霉素双抗购自美国Gibico公司(8120365和2257205);胎牛血清购自杭州四季青公司;DNA酶、胶原酶Ⅳ和链蛋白酶均购自北京索莱宝科技有限公司(826A037, 1212N041和223P022);Masson染色试剂盒(G1340),即用型SABC兔试剂盒(SA1022)和即用型SABC小鼠试剂盒(SA1021)购自武汉博士德生物工程有限公司;S100A6抗体和α-SMA抗体购自美国Abcam公司(ab181975和ab5694)Ⅰ型胶原抗体购自美国Proteintech公司(14695-1-AP),GAPDH抗体购自武汉博士德公司(BM1623);S100A6 siRNA购自上海吉玛制药技术有限公司,RNA提取试剂盒购自无锡百泰克生物科技有限公司(RP1202),逆转录试剂盒和Real-time PCR试剂盒均购自TaKaRa公司(RR047A和RR066A)。
1.2 实验方法 1.2.1 细胞提取及培养根据文献[8-9]报道的研究方案提取并鉴定C57BL/6雄性小鼠原代HSCs,即Ⅳ型胶原酶和链蛋白酶E和消化、Percoll分离液梯度离心和选择性粘附,分离HSCs,以胶质纤维酸性蛋白、α-SMA抗体鉴定细胞纯度。细胞经台盼蓝染色确定活性后培养于含10%胎牛血清、100 U/mL青霉素G、100 U/mL链霉素的DMEM培养基中,培养皿置于37 ℃,5% CO2条件下培养。
1.2.2 Masson及免疫组化染色小鼠处死后分离肝脏,取肝脏相同部位以4%多聚甲醛固定,石蜡包埋,常规组织切片4 μm后Masson染色,光学显微镜下观察并采用Image J软件进行分析。免疫组化染色依次采用微波加热法进行抗原修复,3% H2O2去除内源性过氧化物酶干扰,山羊血清室温静置封闭后进行S100A6抗体孵育,即用型SABC兔试剂盒逐步处理后DAB显色,最后苏木精染核封片,光学显微镜下观察并计数S100A6染色阳性细胞数。
1.2.3 siRNA干扰NCBI GeneBank中查找S100A6小鼠基因mRNA序列,运用Genesil设计3条小干扰RNA(small interference RNA, siRNA)寡核苷酸序列,交付上海吉玛公司合成。验证序列有效性后选择干扰效果最佳的序列运用于后续实验,该序列为:5′-CCAGAAGGAGCUCACCAUUTT-3′(上游),5′-AAUGGUGAGCUCCUUCUGGTT-3′(下游),对照组转染无效干扰序列(Control)。原代HSCs提取铺板48 h后进行换液并转染,转染过程如下:取无菌EP管并吸取100 μL DMEM加入,继缓慢滴入20 pmol待转染siRNA,充分混匀后加入3 μL siRNA-mate转染试剂,移液器吹打完全混匀后室温静置10 min,使siRNA和转染试剂形成转染复合物,移液器吸取转染复合物滴入培养皿中,吹打混匀。转染24 h后更换培养基,维持培养48 h候收取细胞用以提RNA和蛋白。
1.2.4 RT-qPCR用TRIzol裂解C57BL/6小鼠肝脏组织或原代HSCs,RNA提取试剂盒提取总RNA后采用RT-PCR试剂盒将RNA反转录合成cDNA,然后以cDNA为模板,按照试剂盒体系说明书进行PCR定量检测。RT-PCR按以下步骤进行:95 ℃预变性2 min,变性阶段94 ℃ 15 s,退火阶段58 ℃ 45 s,延伸阶段72 ℃ 60 s,循环40次。以GAPDH为内参基因,2-ΔΔCt相对定量法处理数据。具体引物序列如下:S100A6 5′-TGGCAAGGAAGGTGACAAGC-3′(上游),5′-TTGTTA-CGGTCCAGATCATCCA-3′(下游),132 bpm;Ⅰ型胶原5′-CTGCCGTGACAAGCGAGTTC-3′(上游),5′-GCT-CACTCATGCGACTGAAACC-3′(下游),152 bpm;α-SMA 5′-GATCTCTATGCTAACAACGTCCTG-3′(上游),5′-CTTCGTCGTATTCCTGTTTGC-3′(下游),220 bpm。
1.2.5 Western blot检测用4 ℃含有蛋白酶抑制剂的裂解液(1 mL PIPA+10 μL PMSA)裂解C57BL/6小鼠肝脏组织或原代HSCs,BCA法蛋白定量完成后样品电泳、转膜、脱脂牛奶封闭,膜条带在4 ℃下过夜孵育待测指标一抗,第2天TBST清洗条带后二抗孵育,按超敏ECL化学发光试剂盒说明书配置显影剂;用Bio-Rad凝胶/发光图像分析系统进行图像采集,以目的蛋白/内参蛋白作为目的蛋白表达的相对量。
1.3 统计学分析采用SPSS 18.0统计软件分析,所有数据均为计量资料,数据正态分布性检验采用kolmogorov-smirnov检验,正态分布数据以x±s表示,偏态分布数据以中位数±四分位数间距表示,方差齐性检验采用Levene检验,正态分布数据若具有方差齐性,两组均数间比较采用t检验,若不具有方差齐性则采用校正t检验;所有数据总体具有方差齐性,行单因素方差分析(One-Way ANOVA),组间两两比较采用LSD-t检验,检验水准α=0.05。
2 结果 2.1 S100A6在CCl4诱导的小鼠肝纤维化组织中的表达Masson染色显示,在正常小鼠肝组织中几乎不可见特征性蓝染纤维素(图 1A),模型小鼠肝组织中假小叶形成,且可见较多蓝染的纤维素,提示模型复制成功(图 1B、C);对组织切片行免疫组化染色同样可发现在正常组小鼠肝组织中S100A6在肝实质内无表达,仅在血管或胆管上皮呈阳性表达(图 2A),而CCl4处理组小鼠可见大量S100A6阳性细胞(图 2B、C),主要表达于纤维索条区域,提示S100A6在肝纤维化的表达有一定的细胞特异性。同时我们也检测了小鼠肝组织中S100A6 mRNA和蛋白的表达(图 3),结果显示CCl4处理组小鼠肝组织S100A6 mRNA和蛋白表达显著高于对照组,S100A6 mRNA表达差异具有统计学意义(P<0.05)。
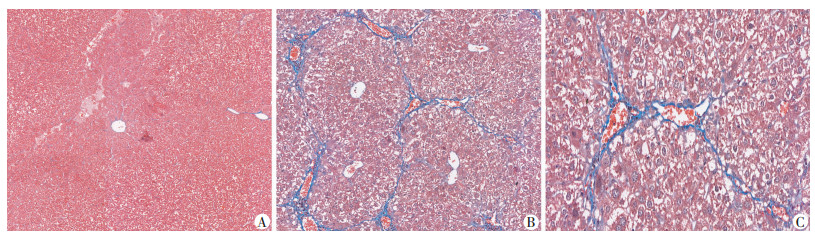
|
| A:正常对照组肝脏组织无明显特征性蓝染纤维素(×150);B:肝纤维化组肝脏组织可见假小叶形成及特征性蓝染纤维素(×150);C:肝纤维化组肝脏组织特征性蓝染纤维素部位局部放大(×360) 图 1 Masson染色评估肝组织纤维化程度 |
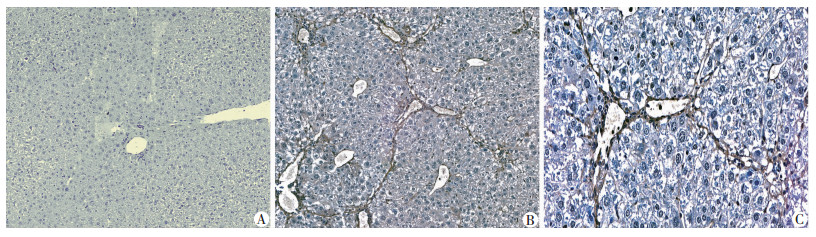
|
| A:正常对照组肝实质组织无明显S100A6表达(×150);B:肝纤维化组肝脏组织纤维索条区域可见明显S100A6表达(×150);C:肝纤维化组肝脏组织纤维索条区域局部放大(×360) 图 2 免疫组化检测S100A6在肝组织内表达(SABC) |
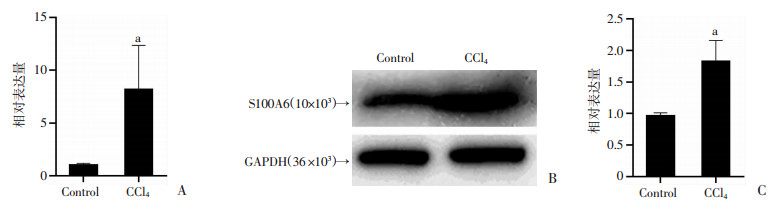
|
|
a:P<0.05,与Control组比较 A:正常对照组和肝纤维组肝组织S100A6 mRNA表达;B、C:正常对照组和肝纤维组肝组织S100A6蛋白表达 图 3 RT-qPCR、Western blot检测肝组织S100A6 mRNA和蛋白表达 |
2.2 S100A6在原代HSCs活化过程中表达
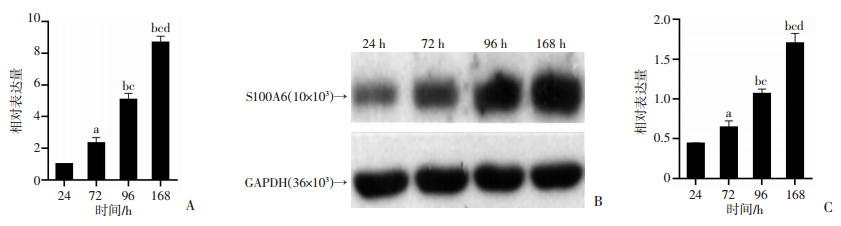
提取小鼠原代HSCs于体外培养活化,HSCs随培养时间延长逐渐由富含脂滴的静止期细胞向成纤维细胞分化(图 4),并于体外培养24、72、120 h和168 h后检测HSCs中S100A6 mRNA和蛋白表达,结果显示S100A6 mRNA和蛋白表达均随着HSCs的活化而逐渐升高,mRNA表达总体及各组间差异具有统计学意义(P<0.05或P<0.001, 图 5)。
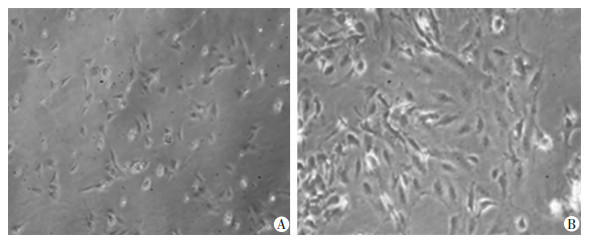
|
| A: 体外培养24 h后HSCs形态;B: 体外培养168 h后HSCs形态 图 4 小鼠原代HSCs体外培养24 h和168 h后细胞形态观察(×200) |
|
| a: P<0.05, b: P<0.001,与24 h比较; c: P<0.001,与72 h比较; d: P<0.001,与96 h比较 A:RT-qPCR检测结果;B:Western blot检测结果;C:半定量分析结果 图 5 RT-qPCR、Western blot检测不同培养时间HSCs S100A6 mRNA和蛋白表达 |
2.3 干扰S100A6的表达可抑制HSCs活化
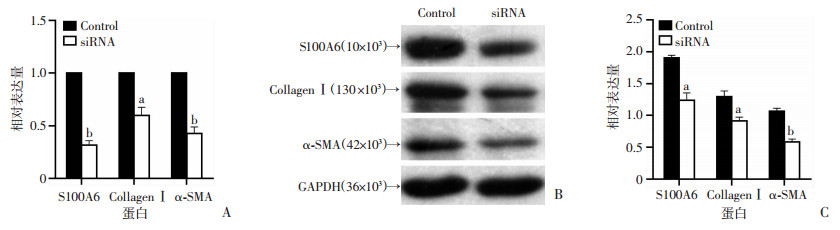
提取小鼠原代HSCs,体外培养24 h后分别加入对照siRNA和siRNA-S100A6,干扰72 h后分别提取mRNA及蛋白行RT-qPCR及Western blot检测。结果显示干扰S100A6 mRNA表达后可显著抑制HSCs活化相关标志物α-SMA和Ⅰ型胶原mRNA表达,与对照组相比差异具有统计学意义(P<0.05或P<0.001);此外,α-SMA和CollagenⅠ蛋白表达亦明显下降(图 6)。
|
| a:P<0.05,b:P<0.001,与各自Control组比较 A:RT-qPCR检测结果;B:Western blot检测结果;C:半定量分析结果 图 6 RT-qPCR、Western blot检测siRNA干扰HSCs S100A6 mRNA表达后S100A6、α-SMA和Collagen Ⅰ mRNA和蛋白表达 |
3 讨论
肝纤维化本质是对酒精、肝炎病毒、药物及自身免疫性疾病等因素导致慢性肝损伤的修复反应,其特点为细胞外基质的过度沉积[10],但其持续发展则导致肝硬化形成,其发展速度及程度等则决定了肝硬化患者生活质量及预后[11]。在肝纤维化进程中,肝星状细胞活化起着至关重要作用[12], 活化的星状细胞向肌纤维母细胞或成纤维细胞转化,并合成及分泌细胞外基质(主要为胶原蛋白)、α-SMA等细胞因子促进肝纤维化形成[13]。
目前对S100A6的研究尚少,主要在肿瘤及造血干细胞等领域。S100A6能结合细胞内外多种配体,如胞质内的膜联蛋白(annexins)、微管蛋白(tubulin)、CacyBP/SIP、Sgt1,细胞核中Lamin A/C、p53,细胞膜上高级聚糖化终产物受体(receptor for advanced glycation end products, RAGE)及整联蛋白β(integrin β)等,在细胞增殖、分化、迁移及应激反应中发挥正向调控作用[14-15],临床试验结果显示血清S100A6水平可能成为膀胱、胃、非小细胞肺癌等肿瘤潜在检测标志[16-18]。而S100A6在组织脏器纤维化领域的研究更为少见。除XIA等[7]报道外,有学者通过对系统性硬化合并肺纤维化患者肺泡灌洗液进行蛋白质组学分析发现S100A6差异性表达并可作为潜在生物标记物[19]。虽然有研究表明S100A6可能在肝纤维化发病机制中发挥作用,可以促进HSCs的增殖[7],但S100A6是否影响HSCs的活化尚少见报道。
其他研究者观察到S100A6在纤维化肝脏组织中HSCs活化后形成的肌成纤维细胞中特异性高表达[6],在本实验中同样观察到S100A6主要表达于纤维化肝组织中纤维素富集区域,该区域亦为星状细胞富集区域,因此验证了S100A6在纤维化肝脏组织中的具体表达细胞。而对小鼠正常肝组织原代HSCs进行提取和培养后分析发现随着培养时间延长S100A6表达逐渐增多,由于HSCs在提取后培养过程中即被激活,因此可以认为S100A6主要在活化的HSCs中表达,并伴随着肝星状细胞活化进程逐渐增加。此外,以siRNA技术干扰S100A6 mRNA与蛋白的表达后,HSCs活化标志蛋白Ⅰ型胶原和α-SMA的表达均显著降低。Ⅰ型胶原蛋白是肝星状细胞活化后分泌细胞外基质的主要成分[20];α-SMA是发挥促纤维化作用肌纤维母细胞的重要标志物[21],在培养的肝星状细胞中表达可提示肝星状细胞活化向肌纤维母细胞转化;随着S100A6表达下降三者同时出现表达下降说明S100A6可以影响HSCs的活化。
本实验从HSCs细胞功能角度观察S100A6在HSCs活化过程中的表达水平,而不局限于活化终末期,同时干扰HSCs S100A6 mRNA表达后发现纤维化相关物质mRNA和蛋白表达减少,提示S100A6在肝纤维化中具有正向调控作用,进而证实S100A6在肝纤维化中是HSCs活化的一个重要调控蛋白,但其具体机制仍需进一步研究。
| [1] |
单姗, 赵连晖, 马红, 等. 肝硬化的定义、病因及流行病学[J]. 临床肝胆病杂志, 2021, 37(1): 14-16. SHAN S, ZHAO L H, MA H, et al. Definition, etiology, and epidemiology of liver cirrhosis[J]. J Clin Hepatol, 2021, 37(1): 14-16. |
| [2] |
WIEGAND J, BERG T. The etiology, diagnosis and prevention of liver cirrhosis: part 1 of a series on liver cirrhosis[J]. Dtsch Arztebl Int, 2013, 110(6): 85-91. |
| [3] |
HERNANDEZ-GEA V, FRIEDMAN S L. Pathogenesis of liver fibrosis[J]. Annu Rev Pathol, 2011, 6: 425-456. |
| [4] |
REEVES H L, FRIEDMAN S L. Activation of hepatic stellate cells: a key issue in liver fibrosis[J]. Front Biosci, 2002, 7: d808-d826. |
| [5] |
DONATO R, SORCI G, GIAMBANCO I. S100A6 protein: functional roles[J]. Cell Mol Life Sci, 2017, 74(15): 2749-2760. |
| [6] |
KRENKEL O, HUNDERTMARK J, RITZ T P, et al. Single cell RNA sequencing identifies subsets of hepatic stellate cells and myofibroblasts in liver fibrosis[J]. Cell, 2019, 8(5): E503. |
| [7] |
XIA P, HE H L, KRISTINE M S, et al. Therapeutic effects of recombinant human S100A6 and soluble receptor for advanced glycation end products(sRAGE) on CCl4-induced liver fibrosis in mice[J]. Eur J Pharmacol, 2018, 833: 86-93. |
| [8] |
LI Y J, CHEN Y Y, HUANG H Y, et al. Autophagy mediated by endoplasmic reticulum stress enhances the caffeine-induced apoptosis of hepatic stellate cells[J]. Int J Mol Med, 2017, 40(5): 1405-1414. |
| [9] |
ZHONG L, HUANG L, XUE Q, et al. Cell-specific elevation of Runx2 promotes hepatic infiltration of macrophages by upregulating MCP-1 in high-fat diet-induced mice NAFLD[J]. 2019. DOI: 10.1002/jcb.28456. [Onlineaheadofprint].
|
| [10] |
BATALLER R, BRENNER D A. Liver fibrosis[J]. J Clin Invest, 2005, 115(2): 209-218. |
| [11] |
D'AMICO G, MORABITO A, D'AMICO M, et al. New concepts on the clinical course and stratification of compensated and decompensated cirrhosis[J]. Hepatol Int, 2018, 12(Suppl 1): 34-43. |
| [12] |
KITANO M, BLOOMSTON P M. Hepatic stellate cells and microRNAs in pathogenesis of liver fibrosis[J]. J Clin Med, 2016, 5(3): E38. |
| [13] |
DEWIDAR, MEYER, DOOLEY, et al. TGF-β in hepatic stellate cell activation and liver fibrogenesis—updated 2019[J]. Cells, 2019, 8(11): 1419. |
| [14] |
FILIPEK A, LEŚNIAK W. Current view on cellular function of S100A6 and its ligands, CacyBP/SIP and Sgt1[J]. Postepy Biochem, 2018, 64(3): 242-252. |
| [15] |
LESNIAK W, WILANOWSKI T, FILIPEK A. S100A6-focus on recent developments[J]. Biol Chem, 2017, 398(10): 1087-1094. |
| [16] |
NISHI M, MATSUMOTO K, KOBAYASHI M, et al. Serum expression of S100A6 is a potential detection marker in patients with urothelial carcinoma in the urinary bladder[J]. Biomed Res, 2014, 35(6): 351-356. |
| [17] |
WANG T, LIANG Y Q, THAKUR A, et al. Diagnostic significance of S100A2 and S100A6 levels in sera of patients with non-small cell lung cancer[J]. Tumour Biol, 2016, 37(2): 2299-2304. |
| [18] |
ZHANG J L, ZHANG K J, JIANG X L, et al. S100A6 as a potential serum prognostic biomarker and therapeutic target in gastric cancer[J]. Dig Dis Sci, 2014, 59(9): 2136-2144. |
| [19] |
LANDI C, BARGAGLI E, CARLEO A, et al. Bronchoalveolar lavage proteomic analysis in pulmonary fibrosis associated with systemic sclerosis: S100A6 and 14-3-3 epsilon as potential biomarkers[J]. Rheumatology (Oxf), 2019, 58(1): 165-78. |
| [20] |
PUCHE J E, SAIMAN Y, FRIEDMAN S L. Hepatic stellate cells and liver fibrosis[J]. Compr Physiol, 2013, 3(4): 1473-1492. |
| [21] |
FORBES S J, PAROLA M. Liver fibrogenic cells[J]. Best Pract Res Clin Gastroenterol, 2011, 25(2): 207-17. |




