结肠癌(colorectal cancer,CRC) 是常见的恶性肿瘤之一,其病死率在全球恶性肿瘤中位列前5[1],严重威胁人类生命健康。研究表明高脂、高热量饮食、大量饮酒和缺乏运动都会增加患结肠癌的风险,近年来,随着人均生活水平的提高、饮食习惯的改变,结肠癌患病率呈现逐渐上升的趋势[2-3]。尽管其治疗取得了进展,但5年存活率仍然不高[4]。因此,深入研究其发生发展机制,寻找新的检验及治疗靶点非常必要。微小RNA(microRNA, miRNA)是一种单链非编码小片段RNA调控分子,可对包括肿瘤细胞在内的多种细胞的生物功能进行调节,包括细胞的生长发育、分化及凋亡等[5-6]。近年来,研究发现miR-138参与了结肠癌细胞增殖、侵袭、凋亡等生物学行为的调节[7-8],提示miR-138与结肠癌的发生、发展密切相关,但其中涉及的病理生理学机制复杂,目前尚未研究清楚。因此,本研究探讨miR-138对结肠癌细胞凋亡的作用及可能的机制,以期为CRC的临床诊断和治疗的研究提供新的思路及靶点。
1 材料与方法 1.1 主要试剂人源性结肠癌细胞系HCT116、SW480、Caco-2、HT29、SW1116购自美国ATCC公司。RPMI1640及DMEM细胞完全培养基购自美国HyClone公司。胎牛血清购自美国Gibco公司。PrimeScript RT-PCR试剂盒购自日本TaKaRa公司。pAcGFPC1-SIRT1质粒,SIRT1 siRNA、miR-138 mimic(类似物)、miR-138 inhibitor(抑制物)、miR-138 negative control(阴性对照,NC)引物由广州锐博生物公司合成。pmirGLO vector、双荧光素酶检测试剂盒购自美国Promega公司。Lipofectamine 2000、Opti-MEM、TRIzol购自美国invitrogen公司。BCA蛋白质定量试剂盒、RIPA蛋白裂解液、SDS-PAGE凝胶配制试剂盒购自上海碧云天公司。人β-actin抗体、沉默信息调节因子2相关酶1 (silent mating type information regulation 2 homolog-1,SIRT1)、Caspase-3及Bcl-2抗体购自美国Santa Cruz公司。
1.2 方法 1.2.1 细胞培养与处理复苏冻存的HCoEpiC、HCT116、SW480、Caco-2、HT29、SW1116细胞,接种至含10%胎牛血清的DMEM培养液,置于37 ℃、5%CO2的培养箱中。48 h后制成单细胞悬液,调整细胞数为2×105/mL,接种至6孔板,培养24 h。采用Lipofectamine 2000转染miR-138 mimic、miR-138 inhibitor、miR-138 NC、pAcGFPC1-SIRT1质粒、SIRT1 siRNA至各实验组细胞。收集细胞上清液并提取总RNA,用于后续实验。
1.2.2 靶基因预测及双荧光素酶实验分析采用TargetScan、miRanda预测miR-138的靶基因,其中SIRT1在miR-138的3’UTR上有结合位点。用Lipofectamine 2000将荧光素酶报告载体(野生型SIRT1 3’UTR WT或突变型SIRT1 3’UTR MT)转染至上述处理后的细胞中,对照采用Renilla荧光素酶质粒。转染24 h后,用双荧光素酶报告分析系统进行检测。
1.2.3 siRNA干扰SIRT1表达根据人SIRT1 NM_001142498基因序列设计并合成siRNA。阴性对照:5′-UUCUCCGAACGUGUCACGUTT-3′(正义链),5′-ACGUGACACGUUCGGAGAATT-3′(反义链);SIRT1:5′-GAACCUUCCUCCUCUUCCUCCUCCT-3′(正义链),5′-AGGAGGAGGAAGAGGAGGAAGGUUCUG-3′(反义链)。转染24 h后进行后续实验。
1.2.4 RT-PCR检测mRNA表达采用TaqMan miRNA assays检测miR-138的表达,反应条件为95 ℃预变性20 s,1个循环;95 ℃变性15 s,60 ℃退火30 s,70 ℃延伸10 s,共40个循环;70 ℃总延伸3 min。miR-138引物序列:5′-UUAAUGCUAAUCGUGAUAGG-GGU-3′(正义链),5′-ACCCCUAUCACGAUUAGCA-UUAA-3′(反义链)。采用PrimeScript RT-PCR试剂盒检测SIRT1、Caspase-3和Bcl-2 mRNA的表达,反应条件为95 ℃预变性1 min,1个循环;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,共40个循环,72 ℃总延伸5 min。SIRT1引物序列:5′-TGGACAATTCC-AGCCATCTC-3′(正义链), 5′-GCGTGTCTATGTTC-TGGGTATAG-3′ (反义链)。Caspase-3引物序列:5′-GAAATTGTGGAATTGATGCGTGA-3′(正义链), 5′-GAAATTGTGGAATTGATGCGTGA-3′ (反义链)。Bcl-2引物序列:5′-GAACTGGGGGAGGATTGTGG-3′(正义链), 5′-ACTTCACTTGTGGCCCAGAT-3′ (反义链)。
1.2.5 Western blot检测相关蛋白表达将提取的蛋白样品通过SDS PAGE凝胶进行电泳,然后转移至PVDF膜,25 ℃,5%脱脂奶封闭2 h,TBST洗膜后加入对应的一抗,4 ℃孵育过夜,TBST洗膜3次,加入二抗,25 ℃孵育1 h。TBST洗膜3次,加入配制好的发光液,避光孵育5 min,化学发光凝胶成像仪中采集图片信息,并进行灰度分析。
1.2.6 流式细胞仪检测细胞凋亡将实验各组分别弃去上清,37 ℃预热的PBS洗涤3次,制成单个细胞悬液。轻轻吹打制成单个细胞悬液,100 μL细胞悬液中加入5 μL Annexin V-FITC,室温孵育10 min;再加入5 μL PI溶液,室温孵育5 min。流式细胞仪检测细胞凋亡情况。
1.3 统计学分析采用SPSS 20.0统计软件。计量资料以x±s表示。统计数据采用单因素方差分析,多重比较方差齐时采用LSD法,以P < 0.05为差异有统计学意义。
2 结果 2.1 结肠癌细胞HCT116、SW480、Caco-2、HT29、SW1116中miR-138表达水平应用RT-qPCR检测miR-138在人结肠癌细胞系HCT116、SW480、Caco-2、HT29、SW1116中的表达,同时检测miR-138在人正常结肠上皮细胞HCoEpiC中的表达作为对照。结果表明:与HCoEpiC细胞相比,miR-138在HT-29细胞中表达水平最高,在Caco-2细胞中表达水平最低(图 1)。
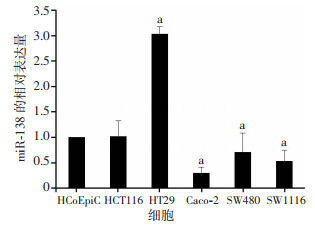
|
| a:P < 0.05,与HCoEpiC比较 图 1 人结肠癌细胞系HCT116、SW480、Caco-2、HT29、SW1116中miR-138表达水平 |
2.2 双荧光素酶实验验证人结肠癌细胞中miR-138靶标分子及SIRT1表达水平分析
通过生物信息学分析预测并结合文献报道,初步筛选出miR-138在HT29细胞中潜在的靶标分子SIRT1,其3’-UTR序列与miR-138部分互补,且它们间的“种子序列(seed sequences)”在7-mer以上(图 2A)。把构建好的含SIRT1 3’-UTR结合位点的荧光素酶报告基团(p-SIRT1-UTR,UTR)、含SIRT1 3’-UTR突变体的荧光素酶报告基团(p-mut-SIRT1-UTR,mut-UTR)、空白对照质粒(pmirGLO-control)、对照载体及miR-138 mimics、miR-138 inhibitor、阴性对照共转染入HT29细胞。发现SIRT1 3’-UTR荧光素酶报告基团与miR-138 mimics共转染后,其荧光素酶活性明显下降,而与miR-138 inhibitor共转染其荧光素酶活性明显上升(P < 0.05,图 2B)。同时,共转染SIRT1 3’-UTR突变的荧光素酶报告基团与miR-138 mimics、或共转染miR-138 inhibitor后,其荧光素酶活性无明显下降(图 2B)。此外,载体对照及miR-138阴性对照对荧光素酶活性无明显影响。以上结果表明miR-138通过作用于SIRT1 3’-UTR抑制其表达,即在结肠癌细胞中,SIRT1是miR-138的直接靶标分子。
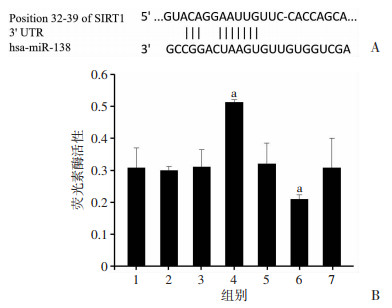
|
| A:miRanda、TargetScan数据库预测miR-138与其靶基因SIRT1 mRNA 3′-UTR区域结合位点;B:双荧光素酶报告分析系统检测各组细胞荧光素酶活性 1:pmirGLO-control;2:UTR;3:UTR+miR-138 control;4:UTR+miR-138 inhibitor;5:mut-UTR+miR-138 inhibitor;6:UTR+miR-138 mimics;7:mut-UTR+miR-138 mimics;a:P < 0.01与pmirGLO control比较 图 2 人结肠癌细胞中miR-138靶标分子预测及验证 |
2.3 结肠癌细胞中miR-138对SIRT1表达的影响
将miR-138 mimics和miR-138 negative control(NC)分别转染至Caco-2细胞,转染48 h后检测结果显示: SIRT1 mRNA及蛋白水平均显著降低;同时,将miR-138 inhibitor和miR-138 negative control(NC)分别转染至HT29细胞,转染48 h后检测结果显示: SIRT1 mRNA及蛋白水平均显著升高(P < 0.05,图 3、4),提示miR-138可在mRNA及蛋白水平抑制结肠癌细胞SIRT1的表达。
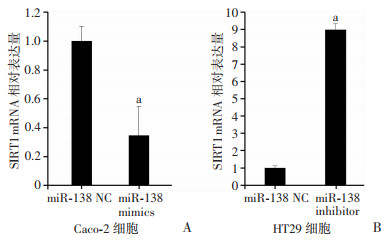
|
|
a:P < 0.05,与miR-138 NC比较 A:Caco-2细胞中SIRT1 mRNA水平;B:HT29细胞中SIRT1 mRNA水平 图 3 RT-qPCR检测结肠癌细胞Caco-2、HT29中miR-138对SIRT1 mRNA表达的影响 |
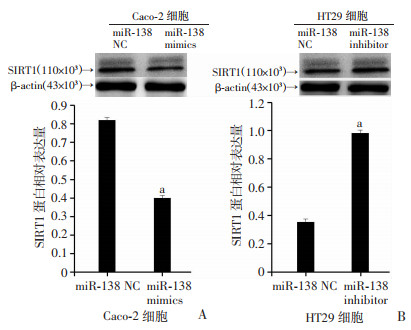
|
|
a:P < 0.05,与miR-138 NC比较 A:Caco-2细胞中SIRT1蛋白水平;B:HT29细胞中SIRT1蛋白水平 图 4 Western blot检测结肠癌细胞Caco-2、HT29中miR-138对SIRT1蛋白表达的影响 |
2.4 miR-138/SIRT1对结肠癌细胞凋亡的影响
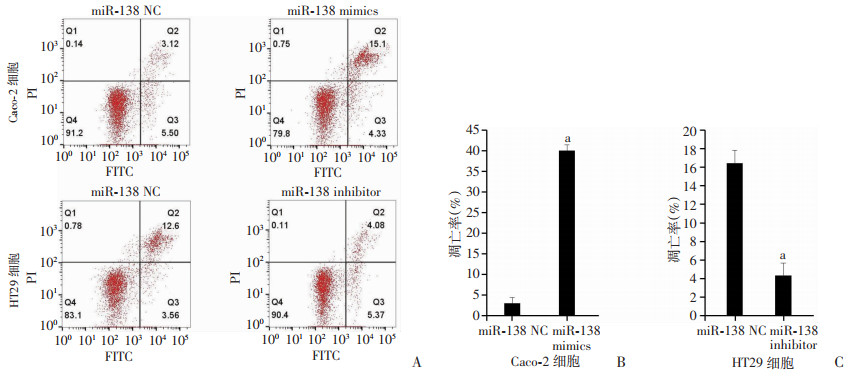
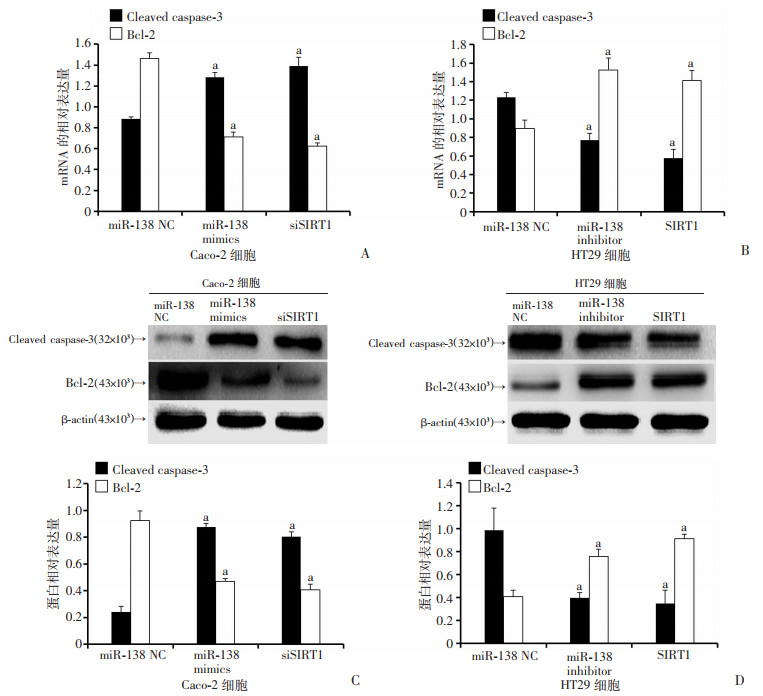
将miR-138 mimics和miR-138 negative control(NC)分别转染至Caco-2细胞,同时,将miR-138 inhibitor和miR-138 negative control(NC)分别转染至HT29细胞,转染24 h后,采用流式细胞仪检测细胞凋亡情况。结果显示:经miR-138 mimics处理后,结肠癌细胞凋亡增多,而经miR-138 inhibitor处理后,细胞凋亡减少(P < 0.05,图 5)。RT-qPCR和Western blot检测结果显示:经siSIRT1或miR-138 mimics处理后,Caspase-3显著增加,Bcl-2显著降低,而转染pAcGFPC1-SIRT1质粒过表达SIRT1(SIRT1)或miR-138 inhibitor处理后,Caspase-3显著降低,Bcl-2显著升高(P < 0.05,图 6)。以上结果提示miR-138可通过其靶标分子SIRT1影响结肠癌细胞的凋亡。
|
|
a:P < 0.05,与miR-138 NC比较 A:流式细胞仪检测Caco-2、HT29细胞凋亡水平;B:Caco-2细胞凋亡率;C:HT29细胞凋亡率 图 5 过表达、抑制miR-138后结肠癌细胞凋亡水平 |
|
|
a:P < 0.05,与miR-138 NC比较 A、B:RT-qPCR检测结肠癌细胞Caco-2、HT29中Cleaved caspase-3、Bcl-2 mRNA表达;C、D:Western blot检测结肠癌细胞Caco-2、HT29中Cleaved caspase-3、Bcl-2蛋白表达 图 6 过表达、抑制miR-138、SIRT1对结肠癌细胞凋亡相关分子Caspase-3、Bcl-2表达的影响 |
3 讨论
目前,对结肠癌最有效的治疗方法是根治性切除,其5年生存率可达到90%。但是由于许多结肠癌患者发现肿瘤时已发生转移,使结肠癌患者的长期生存率大大降低。研究发现当患者出现远处器官的播散时,患者5年生存率显著下降[4]。目前针对结肠癌的靶向治疗受到广泛关注,研究结肠癌发生及发展机制,寻找治疗结肠癌的有效靶标用于临床药物治疗具有重要的意义。
在细胞的各种生理功能中,非编码RNA(non-coding RNA,ncRNA)扮演着关键角色[9]。CHEN等[7]的研究发现miR-199b-5p及其介导的DDR1和JAG1信号通路参与了结肠癌的转移。miR-138也被证实参与了CRC的发生、发展。XU等[8]的研究提示miR-138可通过其靶标分子PODXL抑制结直肠癌细胞的增殖和转移。有研究发现在奥沙利铂处理下,miR-138过表达的HT29/R和SW480/R细胞产生更多的ROS,进入凋亡过程[10]。还有研究显示环状RNA hsa_circ_0020397可通过促进miR-138靶基因的表达来调节CRC细胞活力,凋亡和侵袭[11]。但是它们在结肠癌中的作用究竟如何,研究甚少。双荧光素酶实验结果证实:在结肠癌细胞中,SIRT1是miR-138的直接靶标分子。且miR-138能在mRNA及蛋白水平抑制SIRT1的表达。提示miR-138可通过作用于SIRT1影响结肠癌细胞的相关生物学行为。不少研究提示miR-138与其靶标分子SIRT1共同参与了一些肿瘤的生理过程[12-14],SIRT1是沉默信息调节因子2(silent information regulator 2, Sir2)基因的哺乳动物同源基因,其生理作用复杂,参与调节糖脂代谢、炎症、氧化应激、细胞衰老与凋亡等[15-16]。SUBRAMANIYAN等[17]研究发现SIRT1对线粒体凋亡及细胞周期有显著的影响。PAN等[18]的研究也显示:SIRT1/P53可诱导G0/G1细胞周期停滞,以及下游p21的上调和细胞周期蛋白D1、细胞周期蛋白E1和细胞周期蛋白E2表达的下调。提示SIRT1参与了结肠癌细胞凋亡的调节。本研究通过流式细胞仪检测对应实验组中结肠癌细胞的凋亡情况,结果显示:SIRT1的表达被miR-138抑制或被siRNA干扰后,结肠癌细胞凋亡显著增多,而当miR-138水平降低,无法抑制SIRT1表达时,或转染pAcGFPC1-SIRT1质粒使SIRT1的表达增加后,结肠癌细胞凋亡显著减少。
促凋亡分子Caspase-3是细胞凋亡过程中最主要的终末剪切酶,其主要底物为多聚(ADP-核糖)聚合酶PARP。Caspase-3可使PARP中与DNA结合的两个锌指结构与羧基端的催化区域分离,不能发挥正常功能,进而裂解核小体间的DNA,引起细胞凋亡[19]。Caspase-3在细胞凋亡中起着不可替代的作用,而Caspase-3引起的细胞凋亡过程可以被Bcl-2阻断[20]。研究显示:干扰SIRT1的表达可导致Bax表达增加,进而激活Caspase-3并抑制Bcl-2的表达,从而调节细胞凋亡[21]。SIRT1还可以影响p53的去乙酰化水平,而p53与Bcl-2分子存在相互作用,共同参与了细胞周期监控、细胞凋亡等生物学功能的调节[22-23]。因此,本研究对促凋亡分子Caspase-3及抑制凋亡的Bcl-2分子进行检测。结果显示:经siSIRT1或miR-138 mimics处理后,Caspase-3显著增加,Bcl-2显著降低,而miR-138 inhibitor处理或pAcGFPC1-SIRT1质粒转染增加SIRT1的表达后,Caspase-3显著降低,Bcl-2显著升高。这一结果提示:当miR-138表达下调时,SIRT1表达增加,促凋亡分子Caspase-3显著降低,抑制凋亡的Bcl-2分子则显著升高,进而使得结肠癌细胞的凋亡减少,细胞存活增加,由此可能进一步促进结肠癌的发展。
综上所述,在结肠癌细胞中,miR-138可通过其靶标分子SIRT1对凋亡进行调节,进一步深入研究将为阐明结肠癌发生、发展机制,寻找结肠癌诊疗和预后的早期检验标志物及治疗靶点提供新的思路。
| [1] |
DEWANJI A, JEON J, MEZA R, et al. Number and size distribution of colorectal adenomas under the multistage clonal expansion model of cancer[J]. PLoS Comput Biol, 2011, 7(10): e1002213. |
| [2] |
PENG F, HUANG Y, LI M Y, et al. Dissecting characteristics and dynamics of differentially expressed proteins during multistage carcinogenesis of human colorectal cancer[J]. World J Gastroenterol, 2016, 22(18): 4515-4528. |
| [3] |
STEINFELD B, SCOTT J, VILANDER G, et al. The role of lean process improvement in implementation of evidence-based practices in behavioral health care[J]. J Behav Health Serv Res, 2015, 42(4): 504-518. |
| [4] |
MILLER K D, NOGUEIRA L, MARIOTTO A B, et al. Cancer treatment and survivorship statistics, 2019[J]. CA Cancer J Clin, 2019, 69(5): 363-385. |
| [5] |
KESHAVARZI M, SORAYAYI S, JAFAR REZAEI M, et al. MicroRNAs-based imaging techniques in cancer diagnosis and therapy[J]. J Cell Biochem, 2017, 118(12): 4121-4128. |
| [6] |
ANASTASIADOU E, JACOB L S, SLACK F J. Non-coding RNA networks in cancer[J]. Nat Rev Cancer, 2018, 18(1): 5-18. |
| [7] |
CHEN L Y, ZHI Z, WANG L, et al. NSD2 circular RNA promotes metastasis of colorectal cancer by targeting miR-199b-5p-mediated DDR1 and JAG1 signalling[J]. J Pathol, 2019, 248(1): 103-115. |
| [8] |
XU Y, PAN Z G, SHU L, et al. Podocalyxin-like, targeted by miR-138, promotes colorectal cancer cell proliferation, migration, invasion and EMT[J]. Eur Rev Med Pharmacol Sci, 2018, 22(24): 8664-8674. |
| [9] |
BABAEI K, SHAMS S, KEYMORADZADEH A, et al. An insight of microRNAs performance in carcinogenesis and tumorigenesis; an overview of cancer therapy[J]. Life Sci, 2020, 240: 117077. |
| [10] |
WANG Y, ZHANG D, LI Y, et al. MiR-138 suppresses the PDK1 expression to decrease the oxaliplatin resistance of colorectal cancer[J]. Oncotargets Ther, 2020, 13: 3607-3618. |
| [11] |
ZHANG X L, XU L L, WANG F. Hsa_circ_0020397 regulates colorectal cancer cell viability, apoptosis and invasion by promoting the expression of the miR-138 targets TERT and PD-L1[J]. Cell Biol Int, 2017, 41(9): 1056-1064. |
| [12] |
YE Z T, FANG B M, PAN J W, et al. miR-138 suppresses the proliferation, metastasis and autophagy of non-small cell lung cancer by targeting Sirt1[J]. Oncol Rep, 2017, 37(6): 3244-3252. |
| [13] |
XU J, LI L, YUN H F, et al. MiR-138 promotes smooth muscle cells proliferation and migration in db/db mice through down-regulation of SIRT1[J]. Biochem Biophys Res Commun, 2015, 463(4): 1159-1164. |
| [14] |
LUO J, CHEN P, XIE W, et al. MicroRNA-138 inhibits cell proliferation in hepatocellular carcinoma by targeting Sirt1[J]. Oncol Rep, 2017, 38(2): 1067-1074. |
| [15] |
ALVES-FERNANDES D K, JASIULIONIS M G. The role of SIRT1 on DNA damage response and epigenetic alterations in cancer[J]. Int J Mol Sci, 2019, 20(13): 3153. |
| [16] |
QIANG L, SAMPLE A, LIU H, et al. Epidermal SIRT1 regulates inflammation, cell migration, and wound healing[J]. Sci Rep, 2017, 7(1): 1-10. |
| [17] |
SUBRAMANIYAN B, KUMAR V, MATHAN G. Effect of sodium salt of Butrin, a novel compound isolated from Butea monosperma flowers on suppressing the expression of SIRT1 and Aurora B kinase-mediated apoptosis in colorectal cancer cells[J]. Biomed Pharmacother, 2017, 90: 402-413. |
| [18] |
PAN J H, ZHOU H, ZHU S B, et al. Nicotinamide phosphoribosyl transferase regulates cell growth via the Sirt1/P53 signaling pathway and is a prognosis marker in colorectal cancer[J]. J Cell Physiol, 2019, 234(4): 4385-4395. |
| [19] |
NAGATA S, TANAKA M. Programmed cell death and the immune system[J]. Nat Rev Immunol, 2017, 17(5): 333-340. |
| [20] |
LEGRAND A J, KONSTANTINOU M, GOODE E F, et al. The diversification of cell death and immunity: memento mori[J]. Mol Cell, 2019, 76(2): 232-242. |
| [21] |
WANG C P, SUN X, QIU Z, et al. MiR-138-5p exacerbates hypoxia/reperfusion-induced heart injury through the inactivation of SIRT1-PGC-1α[J]. Inflamm Res, 2019, 68(10): 867-876. |
| [22] |
CHEN Y, FANG L, ZHANG J L, et al. Blockage of glyoxalase I inhibits colorectal tumorigenesis and tumor growth via upregulation of STAT1, p53, and bax and downregulation of c-myc and bcl-2[J]. Int J Mol Sci, 2017, 18(3): 570. |
| [23] |
MELUCCI E, COSIMELLI M, CARPANESE L, et al. Decrease of survivin, p53 and Bcl-2 expression in chemorefractory colorectal liver metastases may be predictive of radiosensivity radiosensivity after radioembolization with yttrium-90 resin microspheres[J]. J Exp Clin Cancer Res, 2013, 32: 13. |




