2. 412007 湖南 株洲,湖南省株洲市中心医院: 重症医学科
2. Department of Critical Care Medicine, Zhuzhou Central Hospital, Zhuzhou, Hunan Province, 412007, China
多发性骨髓瘤(multiple myeloma,MM)是一种克隆浆细胞异常增殖的恶性疾病,在很多国家是血液系统第2位常见恶性肿瘤[1]。尽管目前随着免疫调节剂、蛋白酶体抑制剂、CD38单克隆抗体等新药的问世,多发性骨髓瘤的治疗取得了重大的进展,但均存在复发的概率,迄今为止仍被认为是不可治愈的疾病[2]。因此,探索MM的发病机制,寻找有效的治疗手段具有重要意义。研究表明多发性骨髓瘤的发生、发展与多种癌基因过表达及抑癌基因失活密切相关,但目前对其发生、发展的分子机制尚不完全清楚。
DNAJC1与HSP40(热休克蛋白40)具有高度同源性,别名HTJ1、MTJ1、ERdj1、DNAJL1,是一种富含于微粒体和核片段中的跨膜蛋白,位于10p12.31,相对分子质量为64×103,在DNA的连接和蛋白的相互作用中发挥重要作用,并且属于一种转录因子,参与转录调节[3-4]。DNAJC1已被发现与多种肿瘤相关,可以通过调控肿瘤细胞的增殖及凋亡促进肿瘤的发生。CCLE数据库结果显示DNAJC1基因在多发性骨髓瘤细胞中的表达明显升高(http://www.broadinstitute.org/ccle/home)。并且将多发性骨髓瘤细胞株KAS6/1给予去甲基化药物处理后,多种抑癌基因的表达量增加,而包含DNAJC1在内的癌基因表达量下降,提示DNAJC1可能通过甲基化途径参与MM的发生[5]。DNAJC1在葡萄糖调节蛋白78(GRP78)转运至细胞表面与α2-巨球蛋白[α2-Macroglobulin(α2M*)]结合的过程中起着关键作用[6]。已知细胞表面GRP78与α2-巨球蛋白的相互作用可以激活ERK1/2、p38-MAPK、PI3K,并通过PI3K/Akt和NF-κB信号通路调节细胞增殖[7-8]。
综上所述,我们推测DNAJC1作为促癌基因参与多发性骨髓瘤的发生。为证实这一推测,本研究选择人MM细胞株U266为研究对象,应用siRNA降低人MM细胞株U266细胞中DNAJC1基因的表达,以探讨DNAJC1基因对U266细胞增殖及凋亡的影响,为下一步阐明DNAJC1基因在MM发生中的作用提供理论依据和实验基础。
1 材料与方法 1.1 材料包括:DNAJC1-siRNA、阴性siRNA、转染试剂riboFECT CP Transfection Kit(锐博生物);RPMI1640、胎牛血清(美国Gibco公司);RNA提取试剂盒、反转录试剂盒、定量PCR试剂盒(Tiangen公司);总蛋白提取试剂盒、BCA蛋白定量试剂盒(Beyotime公司);兔抗人DNAJC1抗体(英国Abcam公司);兔抗人PTEN抗体(美国Immunoway公司);兔抗人GAPDH多克隆抗体、辣根过氧化物酶标记山羊抗兔二抗(Mengbio公司);DNAJC1、GAPDH及PTEN上下游引物(日本TaKaRa公司);人MM细胞株U266细胞(Dowobio公司)。
1.2 方法 1.2.1 细胞培养U266细胞复苏后,采用含10% 胎牛血清及青霉素(100 U/mL)、链霉素(100 U/mL)的RPMI-1640培养基,37 ℃、5%CO2饱和湿度的培养箱中培养。2~3 d传代1次。取对数期细胞进行实验。
1.2.2 实验分组及细胞转染实验分为3组,对照组:未转染干预的U266细胞;阴性siRNA组:转染阴性siRNA的U266细胞;DNAJC1-siRNA组:转染DNAJC1-siRNA的U266细胞。取对数生长期的U266细胞,转染前24 h,按6×105/mL接种到6孔细胞培养板,用120 μL 1×riboFECTTMCP Buffer稀释1.25 μL 20 μmol/L siRNA储存液,轻轻混匀。然后加入12 μL riboFECTTMCP Reagent,轻轻吹打混匀,室温孵育0~15 min,制备成转染复合物。将转染复合物加入到适量无双抗完全培养基中,轻轻混匀将培养板置于37 ℃的CO2培养箱中,培养72 h后,收集细胞。
1.2.3 RT-qPCR检测mRNA表达转染后72 h,收集各组细胞,提取总RNA,逆转录为cDNA,进行定量PCR扩增反应,每组设3个复孔。DNAJC1上游引物:5′-ATTCCCGTCGTGTTCAAAG-3′,下游引物:5′-ACCTGATGCCCTATTACTC-3′,257 bp;GAPDH上游引物:5′-CTTTGGTATCGTGGAAGGACTC-3′,下游引物5′-GTAGAGGCAGGGATGATGTTCT-3′,132 bp;PTEN上游引物:5′-ATGACAGCCATCATCAAA-3′,下游引物:5′-TCAGACTTTTGTAATTTGTG-3′,216 bp。扩增条件为:95 ℃预变性30 s,95 ℃变性5 s,62 ℃退火30 s,共进行40个循环。以2-ΔΔCt法计算DNAJC1 mRNA的相对表达量。
1.2.4 Western blot检测蛋白表达转染后72 h,收集各组细胞,按照文献[9]操作方法进行Western blot检测。分别加入1 ∶1 000兔抗人DNAJC1抗体、1 ∶1 000兔抗人PTEN抗体和1 ∶2 000兔抗人GAPDH抗体。ECL化学发光法显色。以GAPDH为内参,Quantity One软件分析灰度值。
1.2.5 CCK-8检测细胞增殖转染后72 h,收集细胞,调整细胞密度为5×103/100 μL于96孔板中。每孔加入CCK-8试剂10 μL,细胞培养箱内作用2 h,在酶标仪450 nm波长处测定光密度值[D(450)]。细胞抑制率=[1-D(450)实验组]/ D(450)对照组×100%。
1.2.6 流式细胞仪检测细胞凋亡转染后72 h,收集各组细胞,进行Annexin V-FITC/PI双染标记,采用流式细胞仪检测细胞凋亡。
1.3 统计学分析实验数据均为计量资料,用x±s表示,采用SPSS 22.0统计软件,2组以上均数比较用单因素方差分析,组间两两均数比较用独立样本t检验。P < 0.05表明差异具有统计学意义。
2 结果 2.1 DNAJC1基因的干扰效果RT-qPCR检测结果显示:DNAJC1-siRNA能有效降低DNAJC1 mRNA表达,而对照组和阴性siRNA组之间的表达无明显差异(图 1A);Western blot检测结果显示:DNAJC1-siRNA组相对于阴性siRNA组DNAJC1蛋白表达明显下降(0.30±0.02 vs 0.49±0.05,P < 0.05),而对照组(0.49±0.03)和阴性siRNA组之间蛋白水平无明显差异(图 1B)。
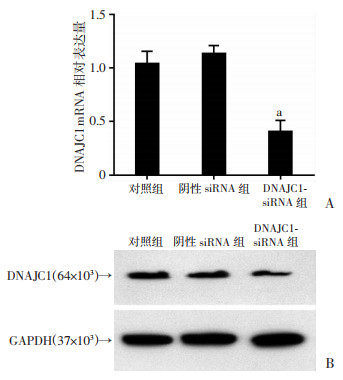
|
| A:RT-qPCR检测DNAJC1 mRNA表达(n=3) a:P < 0.05,与阴性siRNA组比较;B:Western blot检测DNAJC1蛋白表达 图 1 DNAJC1-siRNA干扰效果验证 |
2.2 干扰DNAJC1基因在体外对U266细胞生长的影响
CCK-8检测结果显示:DNAJC1-siRNA转染组细胞增殖变缓,生长明显受到抑制,其抑制率与阴性siRNA组比较差异有统计学意义(P < 0.05,表 1)。
| 组别 | D(450)值 | 抑制率(%) |
| 对照组 | 1.01±0.08 | 0 |
| 阴性siRNA组 | 0.90±0.02 | 9.82±2.29 |
| DNAJC1-siRNA组 | 0.41±0.06 | 58.95±8.13a |
| a:P < 0.05,与阴性siRNA组比较 | ||
2.3 干扰DNAJC1基因在体外对U266细胞凋亡的影响
流式细胞仪检测结果显示:DNAJC1-siRNA组细胞凋亡率[(44.95±6.06)%]增加,明显高于阴性siRNA组[(3.91±0.38)%]及对照组[(3.97±0.43)%],说明干扰DNAJC1可诱导U266细胞凋亡(P < 0.05,图 2)。
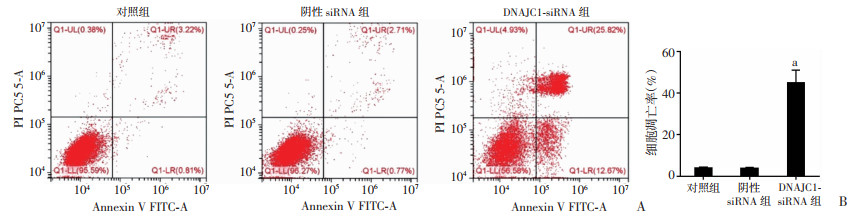
|
| A:流式细胞仪检测各组细胞凋亡;B:各组细胞凋亡率(n=3) a:P < 0.05,与阴性siRNA组比较 图 2 DNAJC1基因干扰在体外对U266细胞凋亡的影响 |
2.4 DNAJC1基因对U266细胞抑癌基因的影响
RT-qPCR检测结果显示:DNAJC1-siRNA组U266细胞内PTEN的mRNA表达明显高于阴性siRNA组,差异有统计学意义(P<0.05),而对照组和阴性siRNA组间无明显差异(图 3A)。Western blot检测结果显示:DNAJC1-siRNA组U266细胞内PTEN的蛋白表达明显高于阴性siRNA组,差异有统计学意义(0.36±0.02 vs 0.18±0.01, P<0.05),而对照组(0.19±0.01)和阴性siRNA组间蛋白水平无明显差异(图 3B),提示DNAJC1基因可能通过调节PTEN的表达,从而导致MM细胞生物学行为的异常。
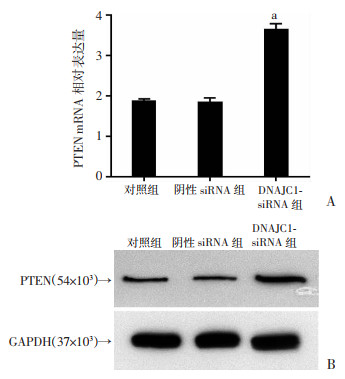
|
| A:RT-qPCR检测PTEN mRNA表达(n=3) a:P < 0.05,与阴性siRNA组比较;B:Western blot检测PTEN蛋白表达 图 3 DNAJC1基因对U266细胞抑癌基因PTEN表达的影响 |
3 讨论
研究报道,DNAJC1与胃癌、乳腺癌、卵巢癌等的发病密切有关[10-12]。2008年,有研究发现DNAJC1基因在MDS的5q-综合征患者中表达增高,可能参与MDS尤其是5q-综合征的发生[13]。后来MULAW等[14]又发现在CALM/AF10+髓系白血病患者的10p12区域DNAJC1基因的表达增高,并推测DNAJC1可能与CALM/AF10融合基因共同促进白血病的发生。近年来,利用高通量测序技术发现DNAJC1在MM患者中表达增高,可能成为MM发病机制及靶向药物开发的候选基因[15]。GRP78是一种内质网上的多功能钙结合蛋白,在内质网蛋白质合成、内质网稳态维持、细胞信号控制、细胞生存等多方面起着关键作用,GRP78可参与细胞表面信号转导,调控细胞凋亡,也可参与细胞内质网应激反应,GRP78参与蛋白质在内质网的正确折叠和转运过程中需依靠腺苷三磷酸酶(ATP)去磷酸化释放的能量。DNAJC1作为GRP78的分子伴侣,能刺激GRP78的ATP活性,并在GRP78转运至细胞表面与受体结合的过程中发挥重要作用[16]。在肿瘤细胞表面高表达的GRP78可分泌到细胞外,分泌的GRP78结合到内皮细胞的细胞表面受体,通过PI3K/Akt途径调节肿瘤细胞的增殖和存活[17]。在前列腺癌中,沉默DNAJC1的表达可逆转α2M*的诱导作用,最终影响前列腺癌细胞的增殖和凋亡[18]。PTEN是PI3K/Akt通路的主要负调控因子,主要是通过其脂质磷酸酶活性作用于PI3K的下游靶分子PIP3,从而阻断PI3K/Akt信号通路来实现其抑癌作用。PTEN表达的高低与多种血液系统恶性肿瘤密切相关,通过GRP78、PTEN双基因条件性敲除小鼠模型发现:GRP78的降低主要是因为PTEN在骨髓中的缺失降低了PI3K/Akt的活性,并能有效抑制白血病的发生[8, 19]。在多个多发性骨髓瘤细胞株中已经发现,有PTEN基因的突变或大片段缺失,并且证实PTEN在多发性骨髓瘤的发生、发展中起重要作用[20-21]。
本研究选用多发性骨髓瘤U266细胞株作为研究对象,靶向抑制U266细胞DNAJC1基因的表达,利用RT-qPCR及Western blot验证干扰效果,结果显示:DNAJC1-siRNA转染组DNAJC1 mRNA及蛋白表达较阴性siRNA组明显降低,干扰效果明显。进一步研究发现:转染DNAJC1-siRNA的U266细胞较阴性siRNA组体外生长明显减缓,细胞凋亡明显增加。以上结果说明DNAJC1基因可能通过影响细胞的凋亡而促进MM细胞生长。这与DNAJC1基因在其他肿瘤中的报道基本一致,提示DNAJC1基因在肿瘤细胞的生物学行为过程中发挥了促癌基因的作用。为进一步研究DNAJC1影响U266细胞生物学行为的机制,本研究对DNAJC1表达下调后PTEN表达水平进行检测,发现DNAJC1基因表达降低的同时,PTEN表达升高。因此推测在多发性骨髓瘤中DNAJC1基因可能通过影响GRP78转运至细胞表面与受体的结合,从而激活PTEN/PI3K/Akt通路而发挥促增殖作用,有待在后续研究中进一步验证。
综上所述,本研究结果表明DNAJC1基因促进U266细胞生长,抑制其凋亡,这种作用可能是通过上调PTEN水平来实现的。为进一步研究DNAJC1基因在多发性骨髓瘤发生中的作用奠定了实验基础。
| [1] |
WANG S, XU L, FENG J, et al. Prevalence and incidence of multiple myeloma in urban area in China: a national population-based analysis[J]. Front Oncol, 2019, 9: 1513. |
| [2] |
RAJKUMAR S V. Multiple myeloma: 2020 update on diagnosis, risk-stratification and management[J]. Am J Hematol, 2020, 95(5): 548-567. |
| [3] |
BLAU M, MULLAPUDI S, BECKER T, et al. ERj1p uses a universal ribosomal adaptor site to coordinate the 80S ribosome at the membrane[J]. Nat Struct Mol Biol, 2005, 12(11): 1015-1016. |
| [4] |
DUDEK J, GREINER M, MVLLER A, et al. ERj1p has a basic role in protein biogenesis at the endoplasmic Reticulum[J]. Nat Struct Mol Biol, 2005, 12(11): 1008-1014. |
| [5] |
POMPEIA C, HODGE D R, PENG B, et al. Epigenetic up-regulation of gene expression in KAS 6/1 human multiple myeloma cells[J]. Cancer Genom Proteom, 2004, 1(5/6): 387-406. |
| [6] |
MISRA U K, GONZALEZ-GRONOW M, GAWDI G, et al. The role of MTJ-1 in cell surface translocation of GRP78, a receptor for alpha 2-macroglobulin-dependent signaling[J]. J Immunol, 2005, 174(4): 2092-2097. |
| [7] |
LEE A S. Glucose-regulated proteins in cancer: molecular mechanisms and therapeutic potential[J]. Nat Rev Cancer, 2014, 14(4): 263-276. |
| [8] |
WEY S, LUO B, TSENG C C, et al. Inducible knockout of GRP78/BiP in the hematopoietic system suppresses Pten-null leukemogenesis and AKT oncogenic signaling[J]. Blood, 2012, 119(3): 817-825. |
| [9] |
杨碧慧, 张玉琳, 王利, 等. SPAG6基因RNAi慢病毒载体的构建及其对SKM-1细胞凋亡的影响[J]. 第三军医大学学报, 2015, 37(5): 474-479. YANG B H, ZHANG Y L, WANG L, et al. Construction of lentiviral vector for SPAG6 RNA interference and its influence on apoptosis of SKM-1 cells[J]. J Third Mil Med Univ, 2015, 37(5): 474-479. |
| [10] |
PHAROAH P D, TSAI Y Y, RAMUS S J, et al. GWAS meta-analysis and replication identifies three new susceptibility loci for ovarian cancer[J]. Nat Genet, 2013, 45(4): 362-370. |
| [11] |
SHI J, SUNG H, ZHANG B, et al. New breast cancer risk variant discovered at 10q25 in East Asian women[J]. Cancer Epidemiol Biomarkers Prev, 2013, 22(7): 1297-1303. |
| [12] |
JUNG J J, JEUNG H C, CHUNG H C, et al. In vitro pharmacogenomic database and chemosensitivity predictive genes in gastric cancer[J]. Genomics, 2009, 93(1): 52-61. |
| [13] |
WANG L, FIDLER C, NADIG N, et al. Genome-wide analysis of copy number changes and loss of heterozygosity in myelodysplastic syndrome with del(5q) using high-density single nucleotide polymorphism arrays[J]. Haematologica, 2008, 93(7): 994-1000. |
| [14] |
MULAW M A, KRAUSE A, DESHPANDE A J, et al. CALM/AF10-positive leukemias show upregulation of genes involved in chromatin assembly and DNA repair processes and of genes adjacent to the breakpoint at 10p12[J]. Leukemia, 2012, 26(5): 1012-1019. |
| [15] |
CARRASCO D R, TONON G, HUANG Y, et al. High-resolution genomic profiles define distinct clinico-pathogenetic subgroups of multiple myeloma patients[J]. Cancer Cell, 2006, 9(4): 313-325. |
| [16] |
CHEVALIER M, RHEE H, ELGUINDI E C, et al. Interaction of murine BiP/GRP78 with the DnaJ homologue MTJ1[J]. J Biol Chem, 2000, 275(26): 19620-19627. |
| [17] |
CASAS C. GRP78 at the centre of the stage in cancer and neuroprotection[J]. Front Neurosci, 2017, 11: 177. |
| [18] |
MISRA U K, MOWERY Y M, GAWDI G, et al. Loss of cell surface TFⅡ-Ⅰ promotes apoptosis in prostate cancer cells stimulated with activated α2 -macroglobulin[J]. J Cell Biochem, 2011, 112(6): 1685-1695. |
| [19] |
ZHANG J, GRINDLEY J C, YIN T, et al. PTEN maintains haematopoietic stem cells and acts in lineage choice and leukaemia prevention[J]. Nature, 2006, 441(7092): 518-522. |
| [20] |
GE N L, RUDIKOFF S. Expression of PTEN in PTEN-deficient multiple myeloma cells abolishes tumor growth in vivo[J]. Oncogene, 2000, 19(36): 4091-4095. |
| [21] |
HYUN T, YAM A, PECE S, et al. Loss of PTEN expression leading to high Akt activation in human multiple myelomas[J]. Blood, 2000, 96(10): 3560-3568. |




