据世界卫生组织发布的全球癌症负担数据显示[1]:2020年新发前列腺癌141万,位居男性新发癌症第2位。雄激素受体(androgen receptor,AR)是维持早期前列腺癌生长的主要通路,是肿瘤发生、发展的关键驱动因素。去势治疗(androgen deprivation therapy,ADT)是临床治疗早期前列腺癌的首要手段。但长时间接受ADT后,患者往往发展成雄激素非依赖性前列腺癌(androgen-independent prostate cancer,AIPC)。AIPC是导致前列腺癌患者预后不良以及死亡的主要原因,现今依然没有有效的应对策略。
蛋白激酶A(protein kinase A,AKT)是维持细胞生存的关键分子,研究发现:过度抑制AR可激活AKT[2]。异常激活的AKT是促进AIPC发生、发展的主要因素,且影响患者的生存率及生存质量[3]。研究表明:在AIPC中抑制AKT,可减少细胞增殖[4],诱导细胞凋亡以及降低细胞活力,最终改善治疗效果。进一步研究表明:过度抑制AKT可反馈性激活胞外信号调节激酶(extracellular signal-regulated kinase,ERK)[5]。异常激活的ERK已被证明与前列腺癌的进展和不良预后相关[6]。在前列腺癌中,过度抑制ERK可增加AKT依赖的肿瘤转移[6]。
索拉非尼(sorafenib,Sor)是第一个小分子多激酶抑制剂,在2013年的前列腺癌治疗指南中被推荐用于治疗晚期/难治性前列腺癌,但在治疗过程中伴随的不良反应及耐药性限制其对AIPC患者的应用。研究显示Sor可通过抑制AKT减少AIPC的增殖及诱导细胞凋亡[7],但并不影响ERK的活性。而在AIPC中同时使用AKT和ERK抑制剂可有效促进相互间的抗肿瘤效应[8]。植物化合物是抗肿瘤药物的丰富来源,而麦冬、桔梗等中药的有效抗肿瘤活性成份均主要为皂苷类。麦冬皂苷D'(Ophiopogonin D',OPD')是麦冬中的一种皂苷类单体,我们之前的研究表明OPD' 可有效抑制AIPC细胞,并在相同剂量下对人免疫细胞无明显抑制作用[9],具有一定的成药潜力。进一步研究显示:麦冬中的麦冬皂苷D[10]、麦冬皂苷A[11]和麦冬皂苷B[12]可通过调控ERK影响细胞命运。但尚不清楚OPD' 对ERK的作用以及是否可以促进Sor抗AIPC。因此,本研究采用AIPC细胞系(PC3细胞)评价OPD' 和Sor对ERK及AKT的影响,以及在体内外模型中观察OPD' 和Sor联用对AIPC的抗肿瘤作用。
1 材料与方法 1.1 化合物和试剂OPD' 购于成都曼思特生物科技有限公司(纯度>98%),Sor购于美国Selleck公司。Ham' F-12培养基、胎牛血清(FBS)购于美国Gibco公司,胰酶购于北京中杉金桥生物技术有限公司,磷酸盐缓冲液(PBS)购于江苏祥盛生物技术有限公司。Annexin V-FITC/PI试剂盒购于上海贝博生物。Western blot实验所用抗体:AKT、p-AKT(Ser473)、ERK和p-ERK(Thr202/Tyr204)购于美国Cell signaling technology公司。辣根过氧化物酶标记的山羊抗小鼠/兔IgG(H+L)购于北京中杉金桥生物技术有限公司。二甲基亚砜(dimethylsulfoxide,DMSO)购于美国Sigma公司。细胞RIPA裂解液、SDS-PAGE凝胶配制试剂盒、SDS-PAGE蛋白上样缓冲液(5×)以及BCA试剂盒均购于上海碧云天生物技术有限公司。ECL发光液和PVDF膜购于美国Bio-Rad公司。
1.2 细胞株和细胞培养人前列腺癌PC3细胞为本实验室所保存(购自中国科学院上海生命科学研究院细胞资源中心)。PC3细胞培养于Ham' F-12培养基(含10% FBS),在37 ℃含5%CO2的细胞培养箱中进行培养,根据细胞生长情况每2~3天进行传代。
1.3 Western blot检测相关蛋白表达PC3细胞(8×105个)培养于25 cm2细胞培养瓶中,分别采用1‰DMSO(对照组)、OPD' (1.0、2.5、5.0 μmol/L)、Sor(2.5、5.0、10.0 μmol/L)和1‰DMSO(对照组)、2.5 μmol/L OPD'、5.0 μmol/L Sor、2.5 μmol/L OPD' +5.0 μmol/L Sor联合处理。处理24 h后,提取细胞总蛋白,采用BCA法检测对照组、OPD' 组、Sor组、OPD' +Sor联用组的蛋白浓度。取30~50 μg蛋白样品行10%SDS-PAGE分离蛋白,并将分离后的蛋白转移至PVDF膜上。用含5%脱脂奶粉的封闭液室温封闭2 h,于4 ℃一抗(1 ∶1 000)孵育过夜。用TBST洗脱液洗膜(15 min×3次),孵育辣根过氧化物酶共轭的山羊抗鼠/兔二抗2 h,再次洗膜(15 min×3次)。实验均独立重复3次,应用Image Lab系统采集图像并对各蛋白条带进行灰度值检测,以目的蛋白条带与内参照GAPDH条带灰度值之比表示目的蛋白的相对表达水平。
1.4 流式细胞仪检测细胞凋亡将处于对数生长期的PC3细胞以2×105/孔接种于6孔板,置于细胞培养箱中培养过夜后,分别以1‰DMSO(对照组)、OPD' (2.5 μmol/L)、Sor(2.5、5.0、10.0 μmol/L)和OPD' (2.5 μmol/L)+Sor(2.5、5.0、10.0 μmol/L)联合处理细胞24 h,收集细胞及上清,以1 500 r/min离心5 min,弃上清,PBS洗涤2次后,用Annexin V-FITC和PI(1 ∶2)配置结合液重新悬浮细胞,于2~8 ℃避光孵育5 min后,用流式细胞仪进行检测。凋亡指数=(Q3处理组+Q2处理组)/(Q3对照组+Q2对照组)×100%,其中Q2表示晚期凋亡,Q3表示早期凋亡。
1.5 裸鼠异种移植瘤模型动物的护理和使用按照实验室动物使用指南进行。所有动物研究程序经陆军军医大学动物伦理委员会批准。雄性裸鼠24只(BALB/c,nu/nu,5~6周龄),购于陆军军医大学实验动物中心, 动物许可证号:SCXK(渝)20170002。收集培养的PC3细胞并重悬于含有Matrigel胶的无血清培养基中,然后皮下注射100 μL(含5×106 PC3细胞)细胞悬液到裸鼠的右腹股沟。植瘤6 d后,按肿瘤大小排序,蛇形均衡分为4组:对照组(荷瘤模型)、OPD' 组(1.0 mg/kg OPD')、Sor组(2.5 mg/kg Sor),OPD' + Sor联用组(1.0 mg/kg OPD' +2.5 mg/kg Sor),每组6只。监测动物活动及一般状况,每3天测量1次体质量和肿瘤大小,并根据公式计算肿瘤体积:肿瘤体积=(ab2)/2(a为长边,b为短边)。药物干预21 d后,处死小鼠,取肿瘤称量,并计算去瘤体质量。
1.6 统计学分析采用SPSS 23.0统计软件,多组间比较采用单因素方差分析,进一步两两比较采用LSD检验。P < 0.05表示差异有统计学意义。
2 结果 2.1 Sor对AKT、p-AKT、ERK和p-ERK蛋白表达的影响不同浓度Sor处理PC3细胞24 h后,Western blot检测结果显示:Sor明显抑制p-AKT的表达并具有剂量依赖性(图 1A)。灰度值分析结果显示(图 1B、C):5.0、10.0 μmol/L Sor组的p-AKT/AKT较对照组分别降低57.7%和77.2%,差异具有统计学意义(P < 0.05),但仅10.0 μmol/L Sor可显著抑制ERK通路活性(P < 0.05),表明AKT通路对Sor更为敏感。

|
|
1:对照组;2~4:分别为2.5、5.0、10.0 μmol/L Sor组 A:Western blot检测;B、C:p-AKT/AKT、p-ERK/ERK水平的半定量分析 a:P < 0.05,与对照组比较 图 1 不同浓度Sor对PC3细胞AKT、p-AKT、ERK和p-ERK蛋白表达的影响 |
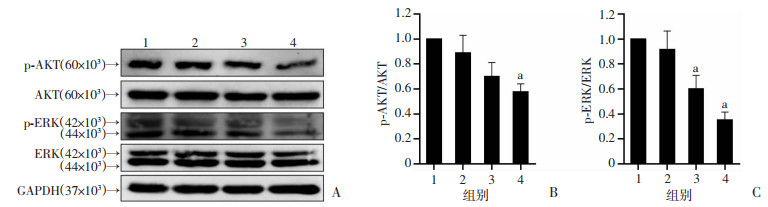
2.2 OPD' 对AKT、p-AKT、ERK和p-ERK蛋白表达的影响
不同浓度OPD' 处理PC3细胞24 h后,Western blot检测结果显示:OPD' 显著抑制p-ERK的表达且具有剂量依赖(图 2A)。灰度值分析结果显示(图 2B、C):2.5 μmol/L和5.0 μmol/L OPD' 组的p-ERK/ERK较对照组分别降低40.2%和64.9%,差异具有统计学意义(P < 0.05),而仅5.0 μmol/L OPD' 组可显著抑制AKT通路活性(P < 0.05),表明ERK通路对OPD' 更为敏感。
|
|
1:对照组;2~4:分别为1.0、2.5、5.0 μmol/L OPD' 组 A:Western blot检测;B、C:p-AKT/AKT、p-ERK/ERK水平的半定量分析 a: P < 0.05,与对照组比较 图 2 不同浓度OPD' 对PC3细胞AKT、p-AKT、ERK和p-ERK蛋白表达的影响 |
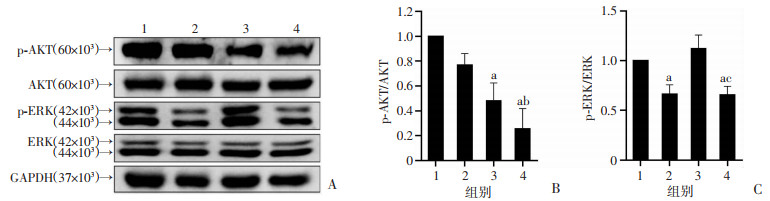
2.3 Sor联用OPD' 对AKT、p-AKT、ERK和p-ERK蛋白表达的影响
Western blot检测结果显示:2.5 μmol/L OPD' 和5.0 μmol/L Sor联用组可下调p-AKT和p-ERK蛋白表达(图 3A)。灰度值分析结果显示(图 3B、C):与各药单用组比较,两药联用后可显著降低p-AKT/AKT与p-ERK/ERK水平,分别为74.7%和34.4%(P < 0.05)。进一步分析表明:①p-AKT/AKT水平,两药联用组较2.5 μmol/L OPD' 组降低51.5%(P < 0.05), 但与5.0 μmol/L Sor组比较差异无统计学意义;②p-ERK/ERK水平,两药联用组较5.0 μmol/L Sor组降低46.6%(P < 0.05), 但与2.5 μmol/L OPD' 组比较差异无统计学意义。因此,两药联用在抑制AKT和ERK水平方面具有协同作用。
|
|
1:对照组;2:2.5 μmol/L OPD' 组;3:5.0 μmol/L Sor组;4:2.5 μmol/L OPD' +5.0 μmol/L Sor联用组 A:Western blot检测;B、C:p-AKT/AKT、p-ERK/ERK水平的半定量分析 a:P < 0.05,与对照组比较;b:P < 0.05,与2.5 μmol/L OPD' 组比较;c:P < 0.05,与5.0 μmol/L Sor组比较 图 3 Sor联用OPD' 对PC3细胞AKT、p-AKT、ERK和p-ERK蛋白表达的影响 |
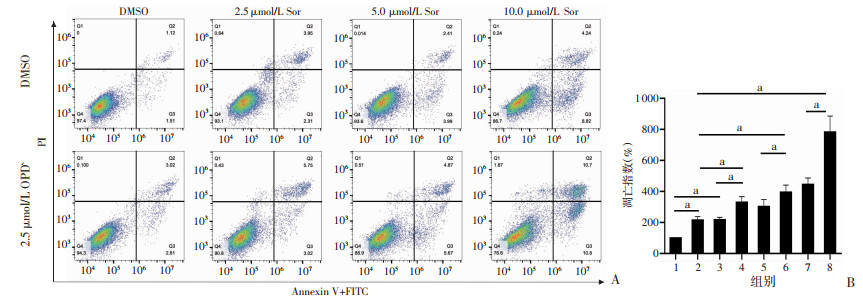
2.4 Sor联用OPD' 对雄激素非依赖前列腺癌细胞凋亡的影响
流式细胞仪检测结果显示:2.5 μmol/L OPD' 组可促进各浓度Sor诱导细胞凋亡的效果(图 4A)。进一步凋亡指数统计结果显示(图 4B):2.5 μmol/L OPD' 诱导PC3细胞的凋亡指数为(215.37±21.62)%,与2.5、5.0、10.0 μmol/L Sor联用后其凋亡指数均显著增加(P < 0.05),且10.0 μmol/L Sor与2.5 μmol/L OPD' 联用后,其凋亡指数由(445.20±40.71)%增加至(781.72±103.43)%,增加75.59%;而2.5 μmol/L Sor与2.5 μmol/L OPD' 联用后,其凋亡指数由(216.18±17.02)%增加至(329.70±36.57)%,只增加52.51%。表明OPD' 更易促进高浓度Sor诱导PC3细胞凋亡。
|
| A:Annexin V-FITC和PI双染检测Sor联用OPD' 对PC3细胞凋亡的作用;B:Sor联用OPD' 的凋亡指数1:对照组;2:2.5 μmol/L OPD' 组;3:2.5 μmol/L Sor组;4:2.5 μmol/L OPD' +2.5 μmol/L Sor联用组;5:5.0 μmol/L Sor组;6:2.5 μmol/L OPD' +5.0 μmol/L Sor联用组;7:10.0 μmol/L Sor组;8:2.5 μmol/L OPD' +10.0 μmol/L Sor联用组;a:P < 0.05 图 4 不同浓度Sor联用OPD' 对PC3细胞凋亡的影响 |
2.5 Sor联用OPD' 对裸鼠肿瘤及体质量的影响
构建裸鼠PC3异种移植瘤模型来评价Sor和OPD' 的抗肿瘤效果。结果显示: 在干预过程中,联用组肿瘤体积明显小于其他3组(P < 0.05,图 5A)。干预结束后,1.0 mg/kg OPD' 和2.5 mg/kg Sor联用组肿瘤质量较对照组降低54.84%,较1.0 mg/kg OPD' 组降低64.55%,较2.5 mg/kg Sor组降低52.89%,且差异均有统计学意义(P < 0.05,图 5B、C)。表明Sor与OPD' 在体内实验中可协同抑制肿瘤生长。

|
| 1:对照组;2:1.0 mg/kg OPD' 组;3:2.5 mg/kg Sor组;4:1.0 mg/kg OPD' +2.5 mg/kg Sor联用组;a:P < 0.05,与对照组比较;b:P < 0.05,与1.0 mg/kg OPD' 组比较;c:P < 0.05,与2.5 mg/kg Sor组比较 A:肿瘤体积变化;B:干预结束后肿瘤大体形态;C:干预结束后肿瘤质量比较;D:体质量变化;E:去瘤体质量比较 图 5 各组裸鼠肿瘤体积及质量、体质量及去瘤体质量比较 |
在干预过程中,1.0 mg/kg OPD' 组、1.0 mg/kg OPD' 和2.5 mg/kg Sor联用组裸鼠体质量略高于对照组和2.5 mg/kg Sor组,但4组间差异无统计学意义(图 5D)。干预结束后,各组间去瘤体质量差异均无统计学意义(图 5E)。
3 讨论ADT是治疗前列腺癌的标准方法,通过抑制AR通路来阻滞雄激素依赖型前列腺癌的进展[13]。然而,前列腺癌患者在接受18~24个月ADT治疗后,会对其产生耐药性导致发展为AIPC,是前列腺癌患者死亡的主要原因。本研究基于AIPC生存通路的变化,证明共同抑制AKT和ERK通路可有效诱导AIPC细胞死亡。
目前针对AIPC治疗的靶标主要包括PI3K/AKT/mTOR通路、Wnt/β-catenin通路、AR、NF-κB、Cyclin D1、Bcl-2家族和MicroRNA等[14]。在前列腺癌从雄激素依赖发展到雄激素非依赖的过程中,高表达的PI3K/AKT/mTOR通路作为主要驱动因素促使肿瘤细胞对ADT产生耐药性。目前针对AKT小分子抑制剂的研究主要集中在竞争性抑制剂和变构抑制剂。临床Ⅱ期研究表明:高选择性的AKT竞争性抑制剂——ipatasertib可显著提高阿比特龙对转移性难治性前列腺癌的治疗效果,改善患者生存率及PSA水平[15]。AKT变构抑制剂的代表——MK2206可抑制前列腺癌细胞运动、有氧糖酵解以及乳酸的生成,从而达到治疗前列腺癌的目的[16]。本研究证实Sor可作为一种AKT抑制剂诱导AIPC细胞凋亡。除此之外,Sor还一直用于治疗肾癌、肝癌以及分泌性甲状腺癌[17]。最新研究表明:Sor可维持FLT3-ITD阳性的白血病患者经骨髓移植后的治疗效果,降低白血病的复发风险及延长生命周期[18]。
在转移性难治性前列腺癌中,约有30%的患者存在ERK异常表达[19]。小分子抑制剂中的PD98059通过MEK1抑制ERK功能,促使前列腺癌侵袭能力下降[20]。植物化合物中的薯蓣皂苷也可通过抑制ERK阻滞AIPC细胞侵袭[21]。本研究发现OPD' 可抑制p-ERK表达诱导AIPC细胞凋亡。我们之前的研究还证实OPD' 可通过RIPK1促进AIPC细胞死亡[9]。OPD' 的肠道代谢物——薯蓣皂苷[22]可通过下调ERK抑制TGF-β介导的上皮间质转化以及肝癌细胞转移[23]。它也可以通过阻止ERK激活,诱导喉癌细胞凋亡、阻滞细胞周期以及细胞侵袭[24]。除此之外,与OPD' 仅在糖基上存在差异的麦冬皂苷D,可通过下调MMP-9抑制乳腺癌细胞转移和侵袭[25]。
AKT和ERK常在多种癌症中被异常激活,且长期作为癌症治疗的靶标,但仅运用单靶标治疗的临床收益有限。三期临床研究结果显示ipatasertib仅能使30%的前列腺癌患者获益[26]。盐霉素可抑制前列腺癌中AKT的磷酸化,但同时激活ERK依赖的自噬通路,使细胞避免凋亡。而在联用ERK抑制剂PD98059或SB203580后,可有效阻断盐霉素诱导的自噬,提高其诱导细胞凋亡的能力[27]。本研究发现Sor和OPD' 在低浓度下能分别抑制p-AKT和p-ERK的表达,且在该浓度下,凋亡实验结果表明OPD' 可有效促进Sor诱导AIPC细胞凋亡。在体内实验中,进一步证实了OPD' 能促进Sor抗肿瘤的效应。除此之外,Sor还可与氯福克酚协同诱导内质网应激从而诱导前列腺癌细胞死亡[28]。皂苷中的人参皂苷R3可通过抑制NF-κB提高前列腺癌对紫杉醇和其他化疗药物的敏感性[29]。
综上所述,本研究发现同时靶向ERK和AKT通路可提高药物对AIPC患者的疗效,在一定程度上证明Sor与OPD' 在治疗AIPC方面能发挥协同作用且不影响小鼠体质量,但仍需进行更多效应及毒理学研究阐明其他联用效果、机制以及毒副作用,为Sor联合OPD' 这一策略运用于临床治疗AIPC提供更多的理论依据。
| [1] |
FERLAY J, COLOMBET M, SOERJOMATARAM I, et al. Cancer statistics for the year 2020: an overview[J]. Int J Cancer, 2021. [Published online ahead of print]. DOI: 10.1002/ijc.33588.
|
| [2] |
CARVER B S, CHAPINSKI C, WONGVIPAT J, et al. Reciprocal feedback regulation of PI3K and androgen receptor signaling in PTEN-deficient prostate cancer[J]. Cancer Cell, 2011, 19(5): 575-586. |
| [3] |
TOREN P, ZOUBEIDI A. Targeting the PI3K/Akt pathway in prostate cancer: challenges and opportunities(review)[J]. Int J Oncol, 2014, 45(5): 1793-1801. |
| [4] |
YU S W, SHEN G X, KHOR T O, et al. Curcumin inhibits Akt/mammalian target of rapamycin signaling through protein phosphatase-dependent mechanism[J]. Mol Cancer Ther, 2008, 7(9): 2609-2620. |
| [5] |
BUTLER D E, MARLEIN C, WALKER H F, et al. Inhibition of the PI3K/AKT/mTOR pathway activates autophagy and compensatory Ras/Raf/MEK/ERK signalling in prostate cancer[J]. Oncotarget, 2017, 8(34): 56698-56713. |
| [6] |
GAN Y, SHI C, INGE L, et al. Differential roles of ERK and Akt pathways in regulation of EGFR-mediated signaling and motility in prostate cancer cells[J]. Oncogene, 2010, 29(35): 4947-4958. |
| [7] |
OH S J, ERB H H, HOBISCH A, et al. Sorafenib decreases proliferation and induces apoptosis of prostate cancer cells by inhibition of the androgen receptor and Akt signaling pathways[J]. Endocr Relat Cancer, 2012, 19(3): 305-319. |
| [8] |
KINKADE C W, CASTILLO-MARTIN M, PUZIO-KUTER A, et al. Targeting AKT/mTOR and ERK MAPK signaling inhibits hormone-refractory prostate cancer in a preclinical mouse model[J]. J Clin Invest, 2008, 118(9): 3051-3064. |
| [9] |
LU Z L, WANG H, ZHU M X, et al. Ophiopogonin D', a natural product from Radix ophiopogonis, induces in vitro and in vivo RIPK1-dependent and caspase-independent apoptotic death in androgen-independent human prostate cancer cells[J]. Front Pharmacol, 2018, 9: 432. |
| [10] |
QIAN J C, JIANG F R, WANG B, et al. Ophiopogonin D prevents H2O2-induced injury in primary human umbilical vein endothelial cells[J]. J Ethnopharmacol, 2010, 128(2): 438-445. |
| [11] |
SHENG X, YANG Y, LIU J, et al. Ophiopogonin A alleviates hemorrhagic shock-induced renal injury via induction of Nrf2 expression[J]. Front Physiol, 2020, 11(619740. DOI: 10.3389/fphys.2020.619740.
|
| [12] |
ZHONG Y, LIN Z, LU J, et al. CCL2-CCL5/CCR4 contributed to radiation-induced epithelial-mesenchymal transition of HPAEpiC cells via the ERK signaling pathways[J]. Am J Transl Res, 2019, 11(2): 733-743. |
| [13] |
LUO J, WANG D, WAN X C, et al. Crosstalk between AR and wnt signaling promotes castration-resistant prostate cancer growth[J]. Onco Targets Ther, 2020, 13: 9257-9267. |
| [14] |
ABD W N, LAJIS N H, ABAS F, et al. Mechanism of anti-cancer activity of curcumin on androgen-dependent and androgen-independent prostate cancer[J]. Nutrients, 2020, 12(3). |
| [15] |
DE BONO J S, DE GIORGI U, RODRIGUES D N, et al. Randomized phase Ⅱ study evaluating Akt blockade with ipatasertib, in combination with abiraterone, in patients with metastatic prostate cancer with and without PTEN loss[J]. Clin Cancer Res, 2019, 25(3): 928-936. |
| [16] |
T EE, SUSTER I, TRUONG S, et al. Targeted AKT inhibition in prostate cancer cells and spheroids reduces aerobic glycolysis and generation of hyperpolarized [1-13C] lactate[J]. Mol Cancer Res, 2018, 16(3): 453-460. |
| [17] |
ESCUDIER B, WORDEN F, KUDO M. Sorafenib: key lessons from over 10 years of experience[J]. Expert Rev Anticancer Ther, 2019, 19(2): 177-189. |
| [18] |
BURCHERT A, BUG G, FRITZ L V, et al. Sorafenib maintenance after allogeneic hematopoietic stem cell transplantation for acute myeloid leukemia with FLT3-internal tandem duplication mutation (SORMAIN)[J]. J Clin Oncol, 2020, 38(26): 2993-3002. |
| [19] |
NICKOLS N G, NAZARIAN R, ZHAO S G, et al. MEK-ERK signaling is a therapeutic target in metastatic castration resistant prostate cancer[J]. Prostate Cancer Prostatic Dis, 2019, 22(4): 531-538. |
| [20] |
SUTHIPHONGCHAI T, PHIMSEN S, SAKULKHU U, et al. PD98059-inhibited invasion of Dunning rat prostate cancer cells involves suppression of motility but not MMP-2 or uPA secretion[J]. Oncol Rep, 2006, 15(6): 1605-1610. |
| [21] |
CHEN P S, SHIH Y W, HUANG H C, et al. Diosgenin, a steroidal saponin, inhibits migration and invasion of human prostate cancer PC-3 cells by reducing matrix metalloproteinases expression[J]. PLoS ONE, 2011, 6(5): e20164. |
| [22] |
沈岚, 徐德生, 冯怡, 等. 大鼠肠内菌对麦冬皂苷D'代谢的研究[J]. 中国中药杂志, 2005, 30(8): 618-620. SHEN L, XU D S, FENG Y, et al. Effect of intestinal bacteria on metabolism of ophiopognin saponin D' in rats[J]. China J Chin Mater Med, 2005, 30(8): 618-620. |
| [23] |
CHEN B N, ZHOU S K, ZHAN Y J, et al. Dioscin inhibits the invasion and migration of hepatocellular carcinoma HepG2 cells by reversing TGF-β1-induced epithelial-mesenchymal transition[J]. Molecules, 2019, 24(12): E2222. |
| [24] |
SI L L, ZHENG L L, XU L N, et al. Dioscin suppresses human laryngeal cancer cells growth via induction of cell-cycle arrest and MAPK-mediated mitochondrial-derived apoptosis and inhibition of tumor invasion[J]. Eur J Pharmacol, 2016, 774: 105-117. |
| [25] |
ZHANG Y Y, HAN Y W, ZHAI K F, et al. Ophiopogonin-D suppresses MDA-MB-435 cell adhesion and invasion by inhibiting matrix metalloproteinase-9[J]. Mol Med Rep, 2015, 12(1): 1493-1498. |
| [26] |
CAO Z, LIAO Q J, SU M, et al. AKT and ERK dual inhibitors: The way forward?[J]. Cancer Lett, 2019, 459: 30-40. |
| [27] |
KIM K Y, PARK K I, KIM S H, et al. Inhibition of autophagy promotes salinomycin-induced apoptosis via reactive oxygen species-mediated PI3K/AKT/mTOR and ERK/p38 MAPK-dependent signaling in human prostate cancer cells[J]. Int J Mol Sci, 2017, 18(5): E1088. |
| [28] |
FAN L X, HE Z L, HEAD S A, et al. Clofoctol and sorafenib inhibit prostate cancer growth via synergistic induction of endoplasmic reticulum stress and UPR pathways[J]. Cancer Manag Res, 2018, 10: 4817-4829. |
| [29] |
KIM S M, LEE S Y, CHO J S, et al. Combination of ginsenoside Rg3 with docetaxel enhances the susceptibility of prostate cancer cells via inhibition of NF-kappaB[J]. Eur J Pharmacol, 2010, 631(1/2/3): 1-9. |




