2. 510010 广州,中国人民解放军南部战区总医院基础医学实验室
2. Basic Medical Laboratory, General Hospital of Southern Theatre Command of PLA, Guangzhou, Guangdong Province, 510010, China
宫颈癌严重危害女性健康,是女性发病率第2位的恶性肿瘤。研究表明持续的高危型人乳头瘤病毒(human papillomavirus, HPV)感染与宫颈上皮内瘤变和宫颈癌密切相关[1]。目前,HPV检测方法应用最广泛的是分子检测技术,如实时荧光定量PCR技术[2-3]、环介导等温扩增技术[4-5]、第2代杂交捕获技术[6]等。这类方法均以核酸提取为前提,核酸提取效率影响检测结果。宫颈脱落细胞样本HPV DNA提取方法主要有苯酚/氯仿法、煮沸法[7-8]、磁珠法[9-10]、固相核酸抽提法[11-12]和自动化核酸快速提取装置等。苯酚/氯仿法耗时且有毒,长时间操作危害健康;煮沸法只通过对样本进行裂解、煮沸、高速离心富集DNA等步骤,过程中易丢失DNA,容易裂解不充分或产生交叉污染,影响检测结果的准确性;磁珠法适用于大批量样本检测,但需要大型仪器设备,只能在实验室环境中进行;固相核酸抽提法操作复杂,需要温育和反复离心等过程;自动化核酸快速提取装置优点是自动化、一体化,但仪器大型,需要与仪器配套试剂同时使用,成本高。这些方法耗时且复杂,涉及许多液体处理步骤,对操作人员和设备有较高要求,依赖于大型仪器,不适用于条件有限地区的现场应用。因此,开展HPV核酸快速简便提取技术的研究具有明确的实用性。
纸基法提取纯化DNA的原理是DNA带负电荷,在碱性盐溶液中可快速吸附到纸纤维表面,在简单的洗涤过程中保留在纸纤维表面,并最终释放到扩增反应液中[13-14]。MARTINEZ等[15]最早开创纸基微流控技术,并设计了一种纸微流控分析装置[16],成功检测出尿液样本中的葡萄糖和牛血清白蛋白。ZOU等[13]研究了一种试纸条提取核酸的方法,用Whatman No.1滤纸在30 s内成功从拟南芥叶片、全血和猪肺中提取并纯化DNA。杨璐等[17]用试纸条法在30 s内提取了不同药用部位的中药材DNA,提取的核酸经PCR扩增和琼脂糖凝胶电泳检测,结果与传统核酸提取方法一致。试纸条核酸提取方法在植物核酸提取方面应用广泛,但未曾用于宫颈脱落细胞HPV DNA的提取。本研究通过建立HPV DNA纸基快速提取方法,结合实时荧光定量PCR,初步评价其对临床宫颈脱落细胞样本中HPV DNA提取检测效果,为在现场进行HPV DNA的快速检测提供实验依据。
1 材料与方法 1.1 仪器、材料和试剂材料包括:A4打印纸(山东晨鸣纸业集团股份有限公司);Whatman No.1滤纸(Whatman公司);定性滤纸(双圈牌,中速,通用电气生物科技有限公司);擦手纸(维达纸业有限公司);硝酸纤维膜(Pall Corporation公司);尼龙膜(GE Healthcare公司);石蜡颗粒(美国Sigma-Aldrich公司)。仪器包括:Nanodrop 2000紫外分光光度计(芬兰Thermo Fisher Scientific公司);直径6 mm打孔器(得力集团有限公司);Stratagene Mx 3 000 p实时荧光定量PCR仪(美国Agilent Technologies公司)。
试剂及样本包括:含HPV16基因片段的质粒(港龙生物技术有限公司);临床宫颈脱落细胞样本来自南部战区总医院检验科;核酸提取液(港龙生物技术有限公司);HPV核酸检测试剂盒(单个测试需Taq酶0.4 μL,UNG 0.1 μL,HPV PCR反应液37.5 μL,每管共38 μL,港龙生物技术有限公司,4 ℃保存备用);纸基法裂解液(800 mmol/L盐酸胍,50 mmol/L Tris,pH=8.0,0.5% Triton X-100,1% Tween-20,实验室自制,50 μL/管分装,室温存放备用);纸基法洗涤液(10 mmol/L Tris,pH=8.0,实验室自制,200 μL/管分装,室温存放备用)。
1.2 方法 1.2.1 6 mm纸圆片的制备用直径为6 mm的打孔器对6种不同的纸材料打孔,得到若干小圆片(面积为28.26 mm2),分类保存在一次性塑料培养皿中,放在干燥环境中备用。
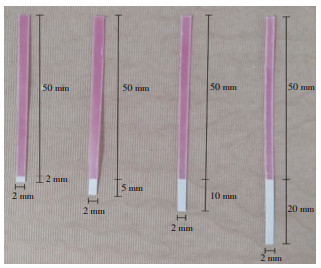
1.2.2 浸蜡试纸条的制备为了减少镊子夹取纸圆片的不便,方便操作,制作可直接拿取的浸蜡试纸条。用切纸机将直径为18 cm的定性滤纸切割成10 cm×7 cm的长方形纸片。将纸片一端浸入完全熔化的石蜡中,为方便观察,石蜡中加入了红色油溶性颜料,石蜡从纸片底部向上浸润延伸并形成一条于顶部平行的线。浸润至大约2/3的位置时将纸片取出,留下2 cm左右未浸蜡的区域。纸片在室温下晾干。用铅笔和直尺在距蜡边缘2、5、10、20 mm处划线,最后分别切割成具有2 mm×50 mm浸蜡区域和2 mm×2 mm、2 mm×5 mm、2 mm×10 mm和2 mm×20 mm未浸蜡区域的试纸条。
1.2.3 HPV DNA纸基快速提取方法 1.2.3.1 纸基法提取HPV 16型质粒DNA取20 μL 5×103 copies/mL HPV 16型质粒与50 μL自制裂解液混合并振荡15 s。用镊子夹取1片纸圆片,插入到上述的样本裂解液中,停留10 s,接着插入到200 μL自制洗涤液中,停留10 s,最后插入到38 μL实时荧光定量PCR反应液中,停留10 s,丢掉纸圆片,洗脱液直接作为PCR扩增的模板。
1.2.3.2 纸基法提取临床宫颈脱落细胞样本HPV DNA为了方便拿取,用浸蜡试纸条替代纸圆片提取临床宫颈脱落细胞中的HPV DNA。取20 μL待测宫颈脱落细胞样本与50 μL自制裂解液混合振荡15 s。拿取1条浸蜡试纸条,依次插入到70 μL样本裂解液、200 μL洗涤液和38 μL PCR反应液中,在3种溶液中各停留10 s,丢掉试纸条,洗脱液直接作为PCR扩增的模板。
1.2.4 煮沸法HPV DNA提取 1.2.4.1 煮沸法提取HPV 16型质粒DNA取20 mL 5×103 copies/mL HPV 16型质粒,振荡混匀,13 000 r/min离心5 min,弃上清,保留沉淀物。向样本管加入50 μL核酸提取液,混合并振荡15 s。放入100 ℃恒温金属浴中煮沸10 min。13 000 r/min离心10 min,保留上清液,备用。
1.2.4.2 煮沸法提取临床宫颈脱落细胞样本HPVDNA按照深圳港龙公司说明书进行操作。取200 μL待测宫颈脱落细胞样本,振荡混匀,13 000 r/min离心5 min,倒掉上清液,保留沉淀物。向样本管分别加入50 μL核酸提取液,混合并振荡15 s。设置恒温金属浴100 ℃煮沸10 min。13 000 r/min离心10 min,保留上清液,备用。
1.2.5 紫外分光光度计检测由于纸基法所提取的DNA均洗脱在扩增液中,无法直接用紫外分光光度计检测提取的DNA的浓度和纯度。因此设置1组平行试验,用38 μL灭菌水代替PCR反应液,将洗涤后的纸圆片浸入灭菌水中,用紫外分光光度计对洗脱在灭菌水中的核酸进行检测。灭菌水作为空白对照,取2 μL样本上机检测其浓度和D(260)/D(280)比值。
1.2.6 实时荧光定量PCR检测参照港龙HPV核酸检测试剂盒进行。取煮沸法提取的HPV DNA、处理后的HPV阴性对照品、HPV强阳性对照品和HPV临界阳性对照品各2 μL,分别加入至配置好的PCR反应混合液中,混匀并短暂离心,立即上机检测。纸基法提取的HPV DNA洗脱在PCR反应混合液中,短暂离心后直接上机检测。设置PCR反应体系(40个循环:变性95 ℃ 15 s,退火52 ℃ 30 s,延伸62 ℃ 1 min),通过扩增曲线和Ct值判断扩增结果(Ct≤37为阳性,若37 < Ct≤40则需重新检测,重新检测后Ct < 40为阳性)。
1.2.7 HPV DNA纸基快速提取方法灵敏度分析将已知浓度为2.5×106 copies/mL的HPV 16型阳性质粒5倍稀释,得到1.6×102、8×102、4×103、2×104、1×105、5×105、2.5×106 copies/mL的梯度溶液,用纸基法和煮沸法分别进行HPV DNA提取并扩增,根据实时荧光定量PCR的Ct值分析其提取灵敏度。
1.2.8 HPV DNA纸基快速提取方法重复性分析通过相对标准偏差(RSD)考察方法的重复性,选择2×104 copies/mL的HPV 16型质粒样本,分别用纸基法和煮沸法进行5次重复性提取和扩增。
1.3 统计学分析正态分布计量资料用x±s表示。用SPSS 20.0对数据进行分析处理,P < 0.05表示差异有统计学意义。
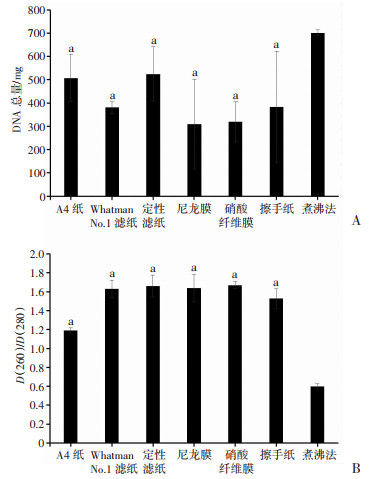
2 结果 2.1 纸基快速HPV DNA提取方法纸材料的选择用镊子分别夹取6种材料直径为6 mm的纸圆片各1片,用纸基法和和煮沸法对5×103 copies/mL HPV 16型质粒进行核酸提取,重复3次。紫外分光光度法检测结果显示(图 1):纸基法6种纸材料提取的DNA总量均比煮沸法低,纸材料中DNA提取总量定性滤纸>A4纸>擦手纸>Whatman No.1滤纸>硝酸纤维膜>尼龙膜。如图 1B所示:纸基法提取的核酸纯度均高于煮沸法,纸材料中定性滤纸、Whatman No.1滤纸、硝酸纤维膜和尼龙膜提取的核酸纯度没有明显差异,综合分析认为纸基法中定性滤纸核酸提取效率最好。煮沸法提取的DNA纯度较低,原因可能是因为仅将样本进行煮沸提取,没有经过纯化步骤或煮沸法提取的核酸溶液与核酸裂解液混合在一起,核酸裂解液的某些成分可能干扰吸光度检测。
|
|
a: P < 0.05, 与煮沸法比较 A:DNA总量;B:DNA纯度 图 1 6种纸材料和煮沸法HPV DNA的提取效率(n=3) |
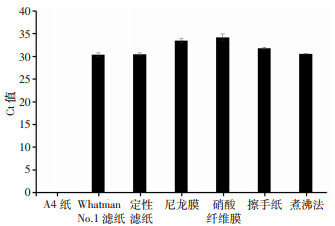
实时荧光定量PCR结果显示(图 2):除A4纸外,其他纸材料提取的DNA均可成功扩增且根据Ct值判断为阳性,结果与煮沸法一致。从图 2可以看出:Whatman No.1滤纸扩增的Ct值与定性滤纸差异不大,从经济角度考虑,定性滤纸的价格远低于Whatman No.1滤纸的价格,且定性滤纸提取的DNA扩增重复性(RSD为0.93%)较好,所以最终选择定性滤纸作为纸基HPV DNA提取的材料。结合紫外分光光度法和实时荧光定量PCR分析,纸基法核酸提取效率高的纸材料,扩增效果不一定好,例如A4打印纸提取的DNA总量仅低于定性滤纸,但无法进行荧光定量PCR扩增,原因可能是A4纸中的荧光增白剂抑制了荧光定量PCR扩增反应。
|
| 图 2 6种纸材料和煮沸法提取DNA的扩增Ct值(n=3) |
2.2 浸蜡试纸条核酸结合区面积对扩增效果的影响
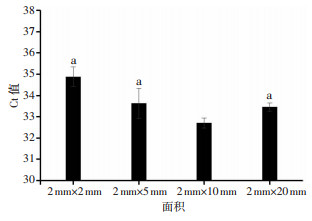
分别拿取核酸结合区为2 mm×2 mm、2 mm×5 mm、2 mm×10 mm和2 mm×20 mm的试纸条,对5×103 copies/mL的HPV 16型质粒样本进行提取,重复3次,通过荧光定量PCR的Ct值判断结果(图 3)。结果表明(图 4):4种面积提取的DNA均可成功扩增,但扩增效率有所差异。2 mm×2 mm~2 mm×10 mm随着核酸结合区面积的增大,Ct值减小,扩增效果越好。但当核酸结合区面积增加为2 mm×20 mm时,Ct值不再减小,提示核酸结合区面积为2 mm×10 mm的浸蜡试纸条提取的DNA扩增效果最好,因此选择该面积的浸蜡试纸条来进行核酸提取。实验中核酸结合区面积增加为2 mm×20 mm时Ct值不再减小,原因可能是面积增加到2 mm×10 mm时,HPV DNA与试纸条结合量达到饱和,结合区面积再增大时,核酸结合量没有增加,所以扩增效率不再提高。
|
| 图 3 4种不同核酸结合面积试纸条的浸蜡试纸条 |
|
| a: P < 0.05,与2 mm×10 mm比较 图 4 4种核酸结合区面积试纸条提取的DNA的扩增Ct值(n=3) |
2.3 吸附时间、漂洗时间、释放时间对核酸扩增效果的影响
设计不同吸附时间、漂洗时间及释放时间的三因素三水平正交实验(时间水平分别为5、10 s和15 s),对5×103 copies/mL HPV 16型质粒进行提取,通过实时荧光定量PCR检测,考察吸附时间、洗涤时间及释放时间对纸基法核酸提取效果的影响。结果表明(表 1):Ct值最小、扩增效率最高的组合为A2B2C3,即吸附时间为10 s,漂洗时间为10 s,释放时间为10 s。通过极差(R)分析得出对扩增Ct值的影响程度为:吸附时间>释放时间>漂洗时间。
| 试验号 | 吸附时间/s | 漂洗时间/s | 释放时间/s | Ct值 |
| 1 | 5 | 5 | 5 | 30.17 |
| 2 | 5 | 10 | 15 | 30.98 |
| 3 | 5 | 15 | 10 | 30.34 |
| 4 | 10 | 5 | 15 | 29.81 |
| 5 | 10 | 10 | 10 | 29.31 |
| 6 | 10 | 15 | 5 | 30.56 |
| 7 | 15 | 5 | 10 | 29.42 |
| 8 | 15 | 10 | 5 | 30.39 |
| 9 | 15 | 15 | 15 | 29.37 |
| K1 | 91.49 | 89.40 | 91.12 | |
| K2 | 89.68 | 90.68 | 89.07 | |
| K3 | 89.18 | 90.27 | 90.16 | |
| k1 | 30.50 | 29.80 | 30.37 | |
| k2 | 29.89 | 30.23 | 29.69 | |
| k3 | 29.73 | 30.09 | 30.05 | |
| R | 0.77 | 0.43 | 0.68 |
2.4 纸基快速HPV DNA提取方法的性能评价 2.4.1 灵敏度分析
结果显示(图 5):两种方法提取1.6×102 copies/mL质粒时均无扩增,在8×102~2.5×106 copies/mL,随着HPV质粒样品浓度的增加,Ct值随之减小且均可判断为阳性,两种方法Ct值变化趋势一致,纸基法和煮沸法均能检测低至8×102 copies/mL的HPV 16阳性质粒。
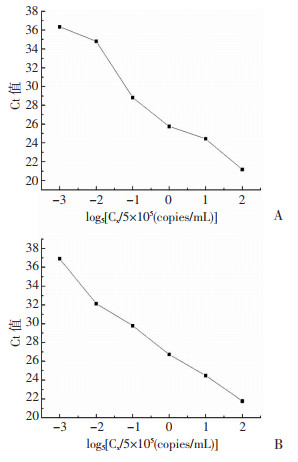
|
| 图 5 纸基法(A)和煮沸法(B)提取不同浓度HPV质粒的扩增Ct值 |
2.4.2 重复性分析
纸基法和煮沸法提取的DNA 5次均能成功扩增,纸基法Ct值为31.20±0.36,煮沸法Ct值为29.38±0.30,计算得出RSD分别为1.15%和1.02%,证明纸基快速HPV DNA提取方法和煮沸法均有良好的重复性。
2.5 HPV DNA纸基快速提取方法的应用 2.5.1 不同样本添加量对扩增结果的影响以3种不同的高危型HPV阳性宫颈脱落细胞样本为例(16、58、45型阳性样本各1例),分别将1、10、20、50、100 μL样本与50 μL自制裂解液混合振荡15 s,用试纸条进行HPV DNA提取并扩增,重复3次,考察样本添加量对扩增结果的影响。结果表明(图 6):1 μL的样本添加量无法进行扩增,而添加量在10~100 μL均可成功扩增,且Ct值无明显差别。因此,纸基法只需10 μL的样本添加量即可实现HPV DNA的提取和扩增,与HPV核酸检测试剂盒推荐的煮沸法加样量200 μL相比,避免了样本的浪费,对珍贵样本的检测具有重要意义。
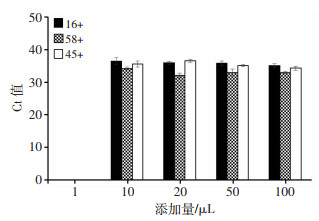
|
| 图 6 不同样品添加量的扩增Ct值(n=3) |
2.5.2 纸基法提取临床样本HPV DNA
为考察纸基法能否应用于临床宫颈脱落细胞样本HPV DNA提取,通过实时荧光定量PCR与煮沸法进行结果比较。检测临床宫颈脱落细胞样本18例,其中高危型HPV阳性样本13例(39、68、18、56、59、51、58、16、45、31、33、52、35型阳性各1例),阴性样本5例,每个样本重复3次。结果显示(图 7):18例临床宫颈脱落细胞样本经过纸基法和煮沸法提取和扩增,13例高危型HPV阳性样本检测结果均为阳性,5例阴性样本均为阴性,纸基法和煮沸法Ct值无明显差别。表明HPV DNA纸基快速提取方法与煮沸法结果一致,HPV DNA纸基快速提取法适用于临床宫颈脱落细胞样本HPV DNA提取和检测。
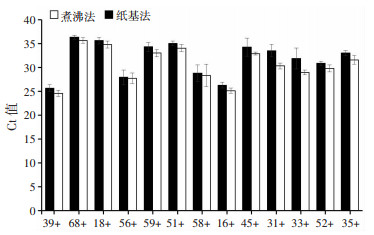
|
| 图 7 纸基法和煮沸法提取临床标本HPV DNA的扩增Ct值(n=3) |
3 讨论
宫颈癌是全球女性发病率第2位的恶性肿瘤,严重影响女性健康[18]。宫颈癌很大程度上是由高危型HPV持续感染造成的[19]。早期筛查和及时诊断是有效控制其传播的关键。核酸提取是分子生物学检测的关键环节,快速、有效的核酸提取是后续核酸扩增和检测的基础和前提。常见的HPV DNA提取方法有煮沸法[10]、苯酚-氯仿法、吸附柱法、磁微粒法[11-12]和核酸快速提取装置。这些方法耗时且复杂,涉及许多液体处理步骤,对操作人员和设备有较高要求,只能在实验室环境中进行,不适用于现场应用。纸基核酸提取法具有成本低、操作简单、快速、不依赖仪器、适用于现场检测的优点,在DNA提取方面应用广泛。CONNELLY等[20]设计了一种折纸装置,通过纸的折叠起到阀门作用,1.5 h内从猪的黏液性痰中提取细菌DNA。GAN等[21]开发了一种全自动纸基微流控装置,采用碱裂解法裂解样本,用Fusion 5纸片成功提取到血液DNA。SHI等[22]制备了一种96孔Whatman滤纸自旋板,成功实现番茄叶片等植物组织DNA的高通量提取。此外,纸基核酸提取技术同样适用于RNA的提取。ZOU等[13]用Whatman No.1滤纸圆片提取侵染番茄的黄瓜花叶病毒,经环介导等温扩增后得到明显条带。KOLLURI等[23]设计了一种纸和塑料组合装置(SNAPflex),成功提取和纯化全血中的HIV RNA。BATULE等[24]以纸张为基底制备了用于病毒RNA提取和检测的设备,使用手持RNA提取纸带装置成功捕获人血清样本中的登革病毒及寨卡病毒RNA,并在1 h内得到检测结果。纸基核酸提取技术使病原体检测更加快速便捷,促进了现场检测技术的发展。
本研究建立的纸基核酸提取方法利用了纤维素纸的4个特性:①纤维素纸通过毛细作用快速吸收相对大量的DNA;②在碱性盐溶液中通过物理或化学方法快速吸附DNA;③经过洗涤,纤维素纸上仍保留足够量的核酸,而抑制物被快速洗脱[13];④能够使结合的核酸快速释放到扩增反应液中。DNA在PCR反应体系中释放的原因可能是溶液pH值或组成成分的改变,导致DNA与纸纤维的结合力减弱,有研究表明扩增反应液中的三磷酸脱氧核糖核苷酸(dNTPs)对DNA具有解吸附作用[13, 25]。纤维素纸的多孔结构增加了反应表面积,但也可能会消耗试剂中的关键成分,进而抑制化学反应。另外,纸材料孔隙大小、光学特性、表面化学性质、裂解液、洗涤液的组成成分等因素也会影响核酸提取能力。纸基核酸提取法与实验室内其他提取方法不同,其目的是在实验室之外的环境中完成核酸提取,以便实现POCT检测,相比于传统核酸提取效率的评价因素(DNA提取量、纯度等),速度、便携性、成本问题是该方法更为重要的考虑因素。
本研究通过对HPV DNA纸基快速提取方法的纸材料、核酸结合区面积、吸附时间、漂洗时间、释放时间等影响核酸提取效率的因素进行探究,用1条核酸结合区面积为2 mm×10 mm的浸蜡定性滤纸条对18例临床宫颈脱落细胞样本进行HPV DNA提取,经实时荧光定量PCR扩增,结果与常规煮沸法一致,证明该方法适用于临床宫颈脱落细胞HPV DNA的提取,检出限为8×102 copies/mL,每个样本提取时间 < 1 min。
综上所述,本研究建立的HPV DNA纸基快速提取方法,省略了传统核酸提取过程中加热、离心和移液等步骤,简化了操作过程,减少了交叉污染,具有简单快速、成本低、无需仪器的优点,为纸基病原体核酸现场检测技术的开发奠定了基础。后续实验可结合重组聚合酶扩增技术或可视化检测技术,真正实现室温条件下核酸提取、扩增及检测,不再局限于实验室环境,在条件有限地区的现场快速检测方面有良好的应用前景。
| [1] |
刘建华, 王萍. 高危型HPV感染导致宫颈癌发生的风险评估[J]. 医学研究生学报, 2017, 30(12): 1233-1237. LIU J M, WANG P. Evaluation of high-risk human papilloma virus infection inducing cervical cancer[J]. J Med Postgra, 2017, 30(12): 1233-1237. |
| [2] |
王晓明, 戴卫健, 余道军, 等. 多重实时荧光定量PCR方法在高危型人乳头瘤病毒E6/E7 mRNA检测中的应用[J]. 临床检验杂志, 2020, 38(11): 841-844. WANG X M, DAI W J, YU D J, et al. Application of multiplex real-time fluorescent quantitative PCR in the detection of high-risk human papillomavirus E6/E7 mRNA[J]. Chin J Clin Lab Sci, 2020, 38(11): 841-844. |
| [3] |
程跃建. HPV DNA实时荧光定量PCR检测与宫颈癌相关性研究[J]. 检验医学与临床, 2018, 15(24): 3718-3720. CHENG Y J. The evaluation of real-time fluorescence quantitative PCR in the correlation of the HPV DNA and cervical cancer[J]. Lab Med Clin, 2018, 15(24): 3718-3720. |
| [4] |
FAUZI F H, HAMZAN N I, RAHMAN N A, et al. Detection of human papillomavirus in oropharyngeal squamous cell carcinoma[J]. J Zhejiang Univ Sci B, 2020, 21(12): 961-976. |
| [5] |
WANG Y, GE G, MAO R, et al. Genotyping of 30 kinds of cutaneous human papillomaviruses by a multiplex microfluidic loop-mediated isothermal amplification and visual detection method[J]. Virol J, 2020, 17(1): 99. |
| [6] |
VASILYEVA D, TISCORNIA-WASSERMAN P, GONZALEZ A A. Negative Roche cobas HPV testing in cases of biopsy-proven invasive cervical carcinoma, compared with hybrid capture 2 and liquid-based cytology[J]. J Am Soc Cytopathol, 2021, 10(2): 128-134. |
| [7] |
KIM S Y, SEO D Y, MOON J Y. Comparison of DNA extraction methods for the detection of foodborne pathogenic bacteria from livestock manure composts[J]. J Food Hygiene Safety, 2019, 34(6): 557-61. |
| [8] |
WANG Y Q, KE Y Q, LIU W J, et al. A one-pot toolbox based on Cas12a/crRNA enables rapid foodborne pathogen detection at attomolar level[J]. ACS Sens, 2020, 5(5): 1427-1435. |
| [9] |
潘亭亭, 汪伟伟, 吉栩. 高通量自动化磁珠提取血凝块DNA的方法研究[J]. 中国卫生标准管理, 2020, 11(12): 132-136. PAN T T, WANG W W, JI X. Method for high throughput automatic DNA extraction from blood Clot[J]. China Health Standard Management, 2020, 11(12): 132-136. |
| [10] |
BAI Y, RONCANCIO D, SUO Y, et al. A method based on amino-modified magnetic nanoparticles to extract DNA for PCR-based analysis[J]. Colloids Surf B Biointerfaces, 2019, 179: 87-93. |
| [11] |
余巨全, 巩建华, 柯尊伟. 对中国黄牛毛囊DNA六种提取方法的研究[J]. 基因组学与应用生物学, 2020, 39(4): 1540-8. YU J Q, GONG J H, KE Z W. Study on six methods of extracting DNA from hair follicle of bos taurina[J]. Genomics Appl Biol, 2020, 39(4): 1540-1548. |
| [12] |
TSOU J H, LENG Q, JIANG F. A CRISPR test for detection of circulating nuclei acids[J]. Transl Oncol, 2019, 12(12): 1566-1573. |
| [13] |
ZOU Y, MASON M G, WANG Y, et al. Nucleic acid purification from plants, animals and microbes in under 30 seconds[J]. PLoS Biol, 2017, 15(11): e2003916. |
| [14] |
MASON M G, BOTELLA J R. Rapid (30-second), equipment-free purification of nucleic acids using easy-to-make dipsticks[J]. Nat Protoc, 2020, 15(11): 3663-77. |
| [15] |
MARTINEZ A W, PHILLIPS S T, BUTTE M J, et al. Patterned paper as a platform for inexpensive, low-volume, portable bioassays[J]. Angew Chem Int Ed Engl, 2007, 46(8): 1318-1320. |
| [16] |
MARTINEZ A W, PHILLIPS S T, WHITESIDES G M, et al. Diagnostics for the developing world: microfluidic paper-based analytical devices[J]. Anal Chem, 2010, 82(1): 3-10. |
| [17] |
杨璐, 吴文如, 付菲, 等. 新型快速中药材DNA提取方法的探索与应用[J]. 中草药, 2019, 50(2): 502-509. YANG L, WU W R, FU F, et al. Exploration and application of a new method for rapid extraction of DNA from Chinese medicinal materials[J]. Chin Tradit Herb Drug, 2019, 50(2): 502-509. |
| [18] |
FREDDIE, BR AY, JACQUES, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA A Cancer J Clin, 2018, 68(6): 394-424. |
| [19] |
靳荣, 李红芳. 高危型HPV持续感染对宫颈癌前病变进展的影响[J]. 中国妇幼保健, 2020, 35(3): 406-409. JIN R, LI H F. The effect of persistent high-risk HPV infection on the progression of cervical precancerous lesions[J]. Matern Child Health Care China, 2020, 35(3): 406-409. |
| [20] |
CONNELLY J T, ROLLAND J P, WHITESIDES G M. "Paper machine" for molecular diagnostics[J]. Anal Chem, 2015, 87(15): 7595-7601. |
| [21] |
GAN W, ZHUANG B, ZHANG P, et al. A filter paper-based microdevice for low-cost, rapid, and automated DNA extraction and amplification from diverse sample types[J]. Lab Chip, 2014, 14(19): 3719-3728. |
| [22] |
SHI R, PANTHEE D R. A novel plant DNA extraction method using filter paper-based 96-well spin plate[J]. Planta, 2017, 246(3): 579-584. |
| [23] |
KOLLURI N, ALBARRAN N, FAN A, et al. SNAPflex: a paper-and-plastic device for instrument-free RNA and DNA extraction from whole blood[J]. Lab Chip, 2020, 20(18): 3386-3398. |
| [24] |
BATULE B S, SEOK Y, KIM M G. Paper-based nucleic acid testing system for simple and early diagnosis of mosquito-borne RNA viruses from human serum[J]. Biosens Bioelectron, 2020, 151: 111998. |
| [25] |
TANAKA T, SAKAI R, KOBAYASHI R, et al. Contributions of phosphate to DNA adsorption/desorption behaviors on aminosilane-modified magnetic nanoparticles[J]. Langmuir, 2009, 25(5): 2956-2961. |




