2. 400038 重庆,陆军军医大学(第三军医大学)军事预防医学系环境卫生学教研室
2. Department of Environmental Health, College of Military Preventive Medicine, Army Medical University(Third Military Medical University), Chongqing, 400038, China
结直肠癌(colorectal cancer,CRC)居全球癌症发病率的第3位(10%)、病死率第2位(9.4%),估算仅2020年全球CRC患者达193万人,因CRC死亡的人数约为94万人[1]。近年来,尽管在结直肠癌的治疗方面取得较大进展,但结直肠癌的发病率和病死率仍然呈现不断上升的趋势[2]。结直肠癌发病隐匿,就诊时常已至中晚期导致患者预后、生活质量和生存率大大降低。因此,寻找新的治疗手段,对预防和干预结直肠癌进展,改善患者预后有重要意义。
新近研究证实:诱导细胞衰老是抑制肿瘤细胞生长的重要机制[3]。细胞衰老主要表现为周期停滞状态,且细胞增殖能力不可逆转。虽然衰老细胞不分裂,但它们仍然具有代谢活性,能分泌衰老相关的分泌因子,具有如细胞扁平化、空泡化等形态学改变,衰老相关β-半乳糖苷酶(SA-β-gal)活性的增高,细胞增殖能力下降以及周期阻滞等衰老特征[4]。有研究显示:DNA损伤、氧化应激或癌基因激活等非端粒刺激可引起细胞应激性衰老,此时DNA损伤修复反应等信号持续激活并通过p53-p21或p16-Rb途径引发细胞周期阻滞,使细胞提前进入衰老状态[5]。研究表明:在化疗或放疗时,致死剂量下可观察到癌细胞死亡,但在亚致死剂量下则发现细胞有大量衰老[6],衰老的肿瘤细胞可被免疫细胞有效清除,从而抑制肿瘤生长[7]。与诱导细胞凋亡相比,以低剂量的放、化疗诱导细胞衰老可在达到治疗效果的同时减少副作用,提高肿瘤患者的生活质量。因此,在癌症治疗中诱导癌细胞衰老是目前广受关注的癌症治疗策略[8]。
二甲双胍(1,1-二甲基双胍盐酸盐,Met)是一种双胍类衍生物,大量流行病学和实验研究结果提示:Met可抑制多种肿瘤细胞的增殖、对癌症患者的预防和治疗具有一定的作用,已成为一种潜在的癌症治疗候选药物[9-10]。既往认为Met的抗癌作用可能与诱导癌细胞周期阻滞和凋亡、抑制上皮间质转化有关[11-12],但近年来,Met通过诱导如乳腺癌[13-14]、肝癌[15-16]等恶性肿瘤细胞衰老抑制细胞增殖的研究已越来越受关注。目前关于Met是否能诱导结直肠癌细胞衰老以及具体机制仍不清楚。因此,本研究分析不同浓度Met作用对结直肠癌细胞衰老的影响,并探讨其可能的衰老诱导机制。
1 材料与方法 1.1 材料人结直肠癌SW480、LOVO细胞购于美国ATCC公司,Met购自Sigma Aldrich公司,溶于无菌PBS分装后,于-20 ℃储存备用。胎牛血清、高糖培养基DMEM购于美国HyClone公司。CCK-8试剂购于日本东仁公司,EdU试剂盒购于广州锐博生物有限公司,细胞周期及凋亡试剂盒购于美国BD公司,细胞衰老试剂盒购于上海杰美基因有限公司。ELISA试剂盒购于上海江莱生物技术公司,蛋白磷酸酶2A(protein phosphatase 2A, PP2A)抑制剂LB-100购于上海碧云天公司。PP2A-C、AKT、p-AKT、P53、P21、β-actin抗体及辣根过氧化酶标记的抗兔、抗鼠二抗购自美国Cell Signaling Technology公司,p-PP2A-C购自美国Santa Cruz公司。
1.2 方法 1.2.1 细胞培养人结直肠癌LOVO、SW480细胞培养在含有10%胎牛血清、1%青-链霉素的高糖培养基DMEM中,37 ℃、5%CO2条件培养。
1.2.2 CCK-8检测Met对细胞活力的影响取对数生长期细胞,胰酶消化制成细胞悬液,细胞数8 000/孔接种于96孔板,分为6组,每组设5个复孔(n=5),待细胞贴壁后,加入终浓度为0、2.5、5.0、10.0、20.0、40.0 mmol/L的Met,于37 ℃、5%CO2条件培养24、48、72 h。检测时每孔加入含10% CCK-8溶液100 μL,37 ℃孵育1 h,检测450 nm处的光密度值D(450)值。
1.2.3 流式细胞仪检测细胞凋亡细胞按15×104/孔接种于6孔板,分为6组(n=3),贴壁后加入终浓度为0、2.5、5.0、10.0、20.0、40.0 mmol/L的Met,37 ℃、5%CO2培养72 h后,用不含EDTA的胰酶消化,室温295×g离心5 min,预冷1×PBS重悬细胞后295×g离心5 min,以1×Binding Buffer 300 μL重悬细胞,加入5 μL Annexin V-FITC混匀,室温避光孵育15 min,加入5 μL的PI染色,加1×Binding Buffer 200 μL上机检测。
1.2.4 EdU实验细胞接种于24孔板,贴壁后加入终浓度5.0 mmol/L的Met培养72 h,按试剂盒说明书步骤,300 μL含EdU培养基(1 000 ∶1稀释)孵育2 h,PBS清洗2次,4%多聚甲醛300 μL室温固定30 min,2 mg/mL甘氨酸300 μL孵育5 min,PBS清洗5 min,加入300 μL渗透剂孵育10 min,PBS清洗后加入300 μL的1×Apollo®染色反应液,避光、室温、摇床孵育30 min,300 μL渗透剂清洗3次,100 μL甲醇清洗2次、PBS清洗1次,300 μL 1× Hoechst 33342室温避光孵育30 min后,PBS洗3次,荧光显微镜下检测。
1.2.5 克隆形成实验LOVO、SW480细胞按2 000/孔接种于6孔板,分为对照组、Met组(n=3)。细胞贴壁后,实验组加入终浓度为5.0 mmol/L的Met,对照组加入等体积培养液,每3天换液1次,培养14 d,待有明显克隆形成后,PBS清洗、结晶紫染色5 min,依次以PBS、蒸馏水清洗后晾干、计数,计算克隆形成率。
1.2.6 细胞周期的检测细胞按15×104/孔接种于6孔板,分为对照组、Met组(n=3),贴壁后加入5.0 mmol/L的Met处理72 h,胰酶消化、预冷PBS洗涤后,逐滴加入-20 ℃预冷的75%乙醇1 mL,于-20 ℃固定18 h以上。295×g离心5 min,PBS清洗后,以抗体染色缓冲液清洗细胞1次,加入PI/RNase染色液500 μL,室温避光孵育15 min。4 ℃避光保存样品,1 h内上流式细胞仪检测。
1.2.7 光学显微镜观察Met对细胞形态的影响以5.0 mmol/L的Met处理细胞72 h,4%多聚甲醛室温固定30 min,PBS清洗3次后于普通光学显微镜下观察。
1.2.8 SA-β-gal染色实验细胞接种于6孔板,贴壁后以5.0 mmol/L的Met处理细胞72 h。按说明书操作,弃原培养液后加入1 mL清理液,1 mL固定液室温固定5 min,以1 mL酸性液清洗细胞表面2次后,加入1 mL预热的染色工作液。于37 ℃、无CO2恒温孵育过夜,倒置显微镜下观察。
1.2.9 Western blot检测相关蛋白的表达经Met处理的细胞,PBS清洗3遍后,加入细胞裂解液IP、蛋白酶抑制剂PMSF以及磷酸酶抑制剂混合液,细胞刮收集细胞,于冰上裂解30 min,4℃、10 625×g,离心15 min,收集上清备用。蛋白浓度测定采用BCA法。将定量好的蛋白按总体积的1/5加入5×SDS-PAGE蛋白上样缓冲液,混匀后100 ℃水浴15 min。聚丙烯酰胺凝胶电泳分离蛋白样品后,将蛋白转移到PVDF膜上,封闭液封闭,一抗孵育过夜,二抗孵育1 h后,再次洗膜3次×15 min。ECL上机曝光显影。
1.2.10 ELASA检测PP2A酶活性将LOVO、SW480细胞接种于6孔板,贴壁后用5.0 mmol/L的Met处理72 h,按1.2.9的方法收集细胞,提取上清备用。然后根据ELISA试剂盒操作步骤检测PP2A酶活性。
1.3 统计学分析数据以x±s表示,两组间比较采用非配对t检验,多组间比较采用单因素方差分析,进一步的两两比较,若方差齐采用LSD法,若方差不齐采用Dunnett’s T3检验,以P < 0.05为差异有统计学意义。采用SPSS 25.0统计软件进行数据分析,GraphPad 8.0软件进行绘图。
2 结果 2.1 Met对结直肠癌细胞的抑制作用以不同浓度Met(0、2.5、5.0、10.0、20.0、40.0 mmol/L)处理结直肠癌LOVO、SW480细胞24、48、72 h后,CCK-8实验结果显示:随着Met浓度的增加以及作用时间的延长,两种细胞的活力均下降,呈现明显的时间和剂量关系(图 1)。高剂量Met对细胞活性的抑制十分明显,在10.0 mmol/L及以下的中低剂量经72 h作用后,细胞虽还保留有相当的活性,但已可看到增殖受到明显的抑制(P < 0.001),5.0 mmol/L作用72 h时,两种细胞的抑制率均超过了20%。即使在最低的2.5 mmol/L剂量下,也能观察到对细胞有一定的抑制作用,细胞48 h存活率:LOVO为(90.20±2.70)%(P=0.010),SW480为(91.80±0.89)%(P < 0.001);72 h存活率:LOVO为(82.24±4.38)%(P= 0.007),SW480为(88.97±1.11)%(P < 0.001)。以上结果提示:Met对结直肠癌细胞增殖有明显的抑制作用。
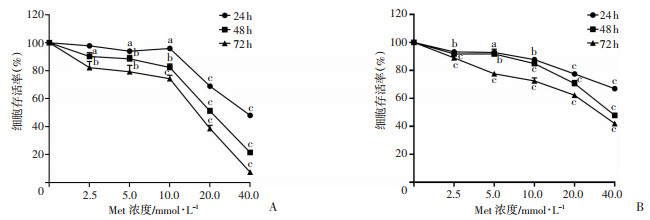
|
| a:P < 0.05,b:P < 0.01,c:P < 0.001,与0 mmol/L比较 图 1 CCK-8检测不同浓度Met对结直肠癌细胞LOVO(A)、SW480(B)活力的影响(n=5) |
2.2 Met对结直肠癌细胞凋亡的影响
细胞活性研究结果显示:即使是中低剂量Met对结直肠癌细胞也呈现以剂量和时间依赖方式的明显抑制作用。由于既往研究提示Met可能直接诱导细胞凋亡,为了明确对结直肠癌细胞的抑制作用是来自于凋亡还是非凋亡的贡献,在前面实验结果基础上,选择细胞抑制作用最明显的72 h时间点,检测细胞凋亡情况。结果显示:Met浓度≥10.0 mmol/L时有较明显的诱导凋亡作用(P < 0.05),而≤5.0 mmol/L时细胞无明显凋亡发生(图 2)。为减少后续效应中来自凋亡的影响,选择5.0 mmol/L作为后续实验的作用剂量。
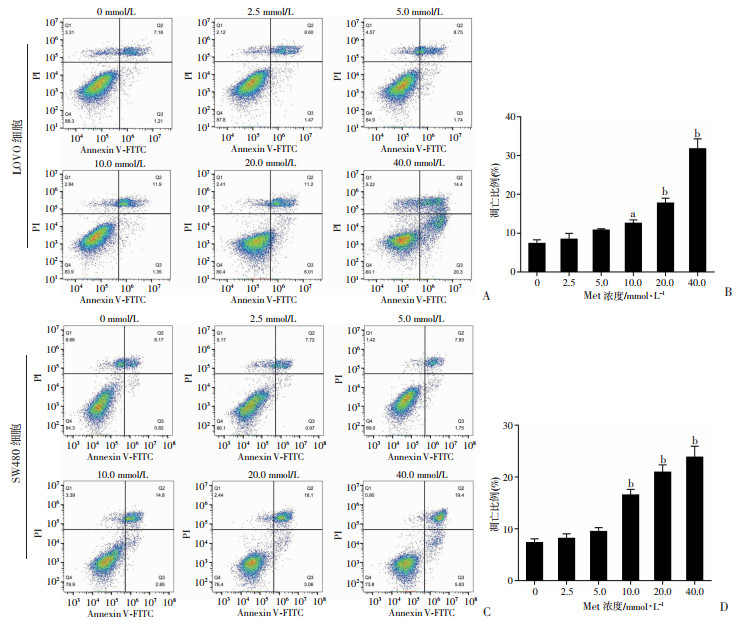
|
|
a:P < 0.05,b:P < 0.01,与0 mmol/L比较 A、C:LOVO细胞、SW480细胞凋亡检测;B、D:LOVO细胞、SW480细胞凋亡比例 图 2 流式细胞仪检测Met对结直肠癌细胞凋亡的影响(n=3) |
2.3 低剂量Met抑制结直肠癌细胞克隆形成
用5.0 mmol/L Met处理结直肠癌细胞2周后,克隆形成实验结果如图 3所示:Met处理后,结直肠癌细胞集落数形成明显减少,LOVO细胞克隆形成数为对照组的(48.97±1.64)%(P < 0.001),SW480细胞克隆形成数为对照组的(12.65±0.85)%(P < 0.001)。结果表明:Met能够抑制结直肠癌细胞的克隆形成能力。
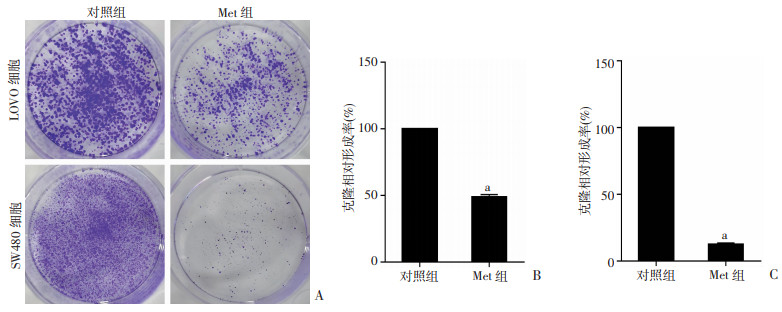
|
| A:克隆形成实验;B、C:LOVO、SW480细胞克隆相对形成率 a:P < 0.001,与对照组比较 图 3 克隆形成实验检测5.0 mmol/L Met对结直肠癌细胞LOVO、SW480克隆形成的影响(n=3) |
2.4 低剂量Met抑制结直肠癌细胞的增殖
为进一步观察Met对结直肠癌细胞增殖的影响,采用EdU掺入法检测细胞增殖情况。结果如图 4所示:相对于对照组,经5.0 mmol/L的Met处理后的细胞,其EdU阳性率明显降低,LOVO细胞EdU阳性染色细胞数为(26.47±2.32)%,较对照组(38.80±5.21)%明显减少(P < 0.001),SW480细胞EdU阳性染色细胞数为(24.09±4.05)%,较对照组(36.34±4.67)%明显减少(P < 0.001)。结果表明:Met通过抑制DNA的合成,进而抑制细胞增殖。

|
| 图 4 EdU实验检测5.0 mmol/L Met对结直肠癌细胞增殖的影响(n=9) |
2.5 Met诱导结直肠癌细胞G0/G1期阻滞
为检测Met对结直肠癌细胞增殖的抑制效果是否受到周期调控的影响,采用流式细胞仪进行检测分析。结果显示(图 5):5.0 mmol/L的Met处理后,细胞周期G0/G1期明显增加[LOVO:对照组(57.43±1.02)%,Met组(68.93±3.10)%,P=0.004;SW480:对照组(50.03±2.72)%,Met组(62.10±1.74)%,P=0.003]。结果表明:Met可能通过诱导G0/G1期阻滞来抑制细胞的增殖。
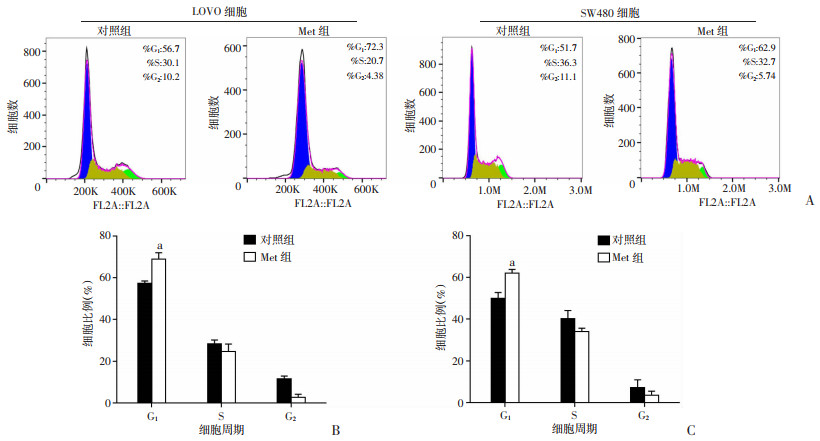
|
| A:流式细胞仪检测Met处理对LOVO细胞、SW480细胞周期的影响;B、C:LOVO细胞、SW480细胞周期比例 a:P < 0.01,与对照组比较 图 5 流式细胞仪检测Met对结直肠癌细胞周期的影响(n=3) |
2.6 Met诱导细胞中SA-β-gal活性增加
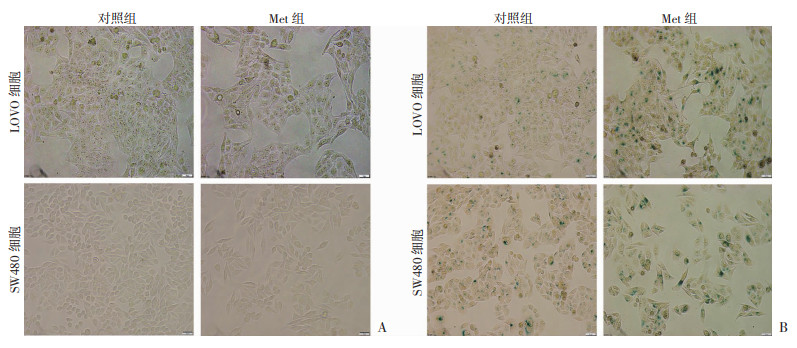
以5.0 mmol/L的Met处理结直肠癌细胞72 h后,可见处理组细胞数目明显少于对照组,细胞体积、细胞核体积均明显增大,且细胞呈现大而扁平的衰老样形态(图 6A)。经SA-β-gal染色发现(图 6B):处理组中呈蓝染SA-β-gal阳性细胞显著增多[LOVO:对照组(5.43±1.37)%,Met组(17.56±1.89)%,P < 0.001;SW480:对照组(8.49±2.12)%,Met组(20.02±3.68)%,P < 0.001],提示Met明显诱导了结直肠癌细胞发生衰老样改变。
|
| A:光镜下观察两种细胞形态(×200);B:两种细胞SA-β-gal染色(×200,n=9) 图 6 Met对细胞衰老的影响 |
2.7 Met通过PP2A相关通路诱导结直肠癌细胞衰老
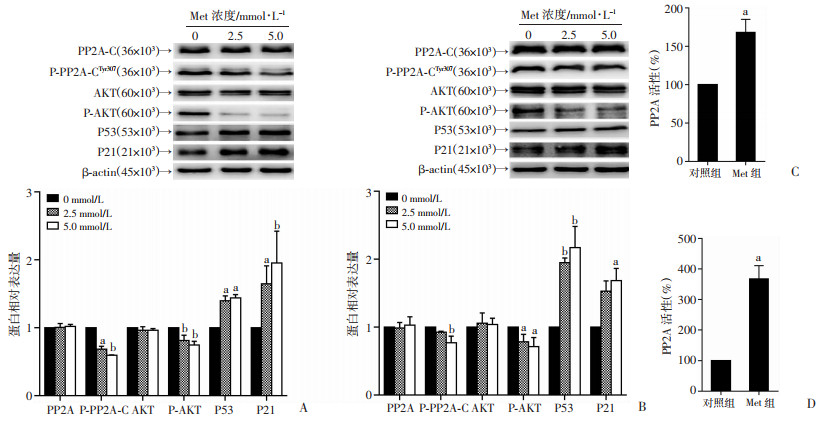
为探讨Met诱导结直肠癌细胞衰老是否与PP2A有关,Western blot检测结果显示:Met处理后PP2A蛋白表达未发生变化,但在其C亚基(PP2A-C)Tyr307位点上的磷酸化水平则显著降低。由于PP2A-C可通过磷酸化失活,进一步检测PP2A酶活性,结果显示:Met处理后细胞中PP2A酶活性显著升高(P < 0.05),其变化与PP2A-C磷酸化水平降低的影响是一致的。此外,Met作用后,PP2A下游靶蛋白AKT的磷酸化水平降低,衰老相关蛋白P53、P21的表达则明显增加(图 7)。以上结果表明:PP2A/AKT信号通路可能参与了Met诱导的结直肠癌细胞衰老过程。
|
|
a:P < 0.05;b:P < 0.01,与对照组或0 mmol/L比较 A、B:Western blot检测LOVO细胞、SW480细胞PP2A相关通路蛋白表达;C、D:LOVO细胞、SW480细胞PP2A磷酸酶活性 图 7 Met对PP2A相关通路蛋白表达及酶活性的影响(n=3) |
2.8 PP2A激活参与Met诱导的结直肠癌细胞衰老
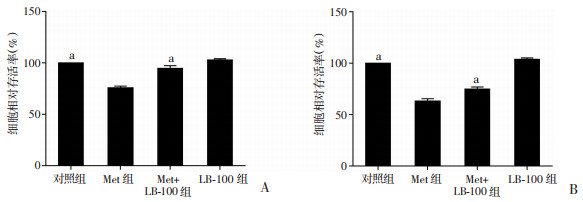
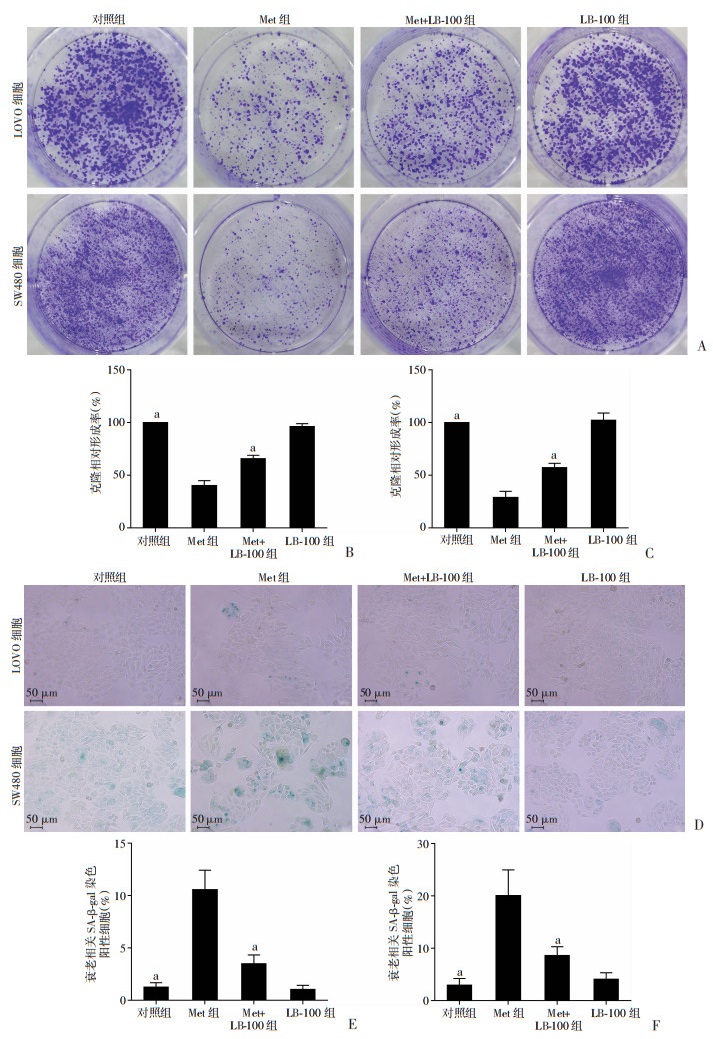
为进一步验证Met抑制细胞增殖及诱导细胞衰老是否与激活PP2A有关,以PP2A抑制剂LB-100(LB-100 μmol/L)与Met(5.0 mmol/L)共处理后,再次检测细胞增殖及衰老情况。结果如图 8、9所示:与对照组相比,Met单独处理组细胞活力和克隆形成率均明显降低(P < 0.001),衰老细胞则明显增加(P < 0.001),而LB-100+Met处理组较单独Met处理组显示出更高的细胞活力和增殖(P < 0.001),但衰老细胞明显减少[LOVO:Met组(10.55±1.86)%,Met+LB-100组(3.48±0.85)%,P < 0.001;SW480:Met组(20.07±4.89)%,Met+ LB-100组(8.61±1.68)%,P < 0.001],单用LB-100组与对照组比较无明显差异。以上结果提示PP2A激活参与了Met诱导结直肠癌细胞衰老的过程。
|
| a:P < 0.001,与Met组比较 图 8 CCK-8检测LOVO细胞(A)、SW480细胞(B)活性(n=5) |
|
|
a:P < 0.001,与Met组比较 A:LOVO、SW480细胞克隆形成;B、C:LOVO细胞、SW480细胞克隆形成率比较(n=3);D:LOVO、SW480细胞SA-β-gal染色观察;E、F:LOVO细胞、SW480细胞SA-β-gal染色阳性细胞计数(n=9) 图 9 PP2A抑制剂联合Met对结直肠癌细胞增殖及衰老的影响 |
3 讨论
近年来,Met对包括结直肠癌在内的多种肿瘤的抑制效应广受关注,但相关分子机制仍有待进一步阐明。体内外研究证实Met诱导的AMPK激活可单独或与其他抗癌疗法协同抑制结直肠癌细胞生长,但其抗癌作用不仅与AMPK的激活有关,可能还存在其他的作用机制[17-19]。本研究分析了不同浓度的Met对结直肠癌细胞的效应,发现Met以时间-剂量依赖的方式对结直肠癌细胞有显著的抑制作用,并发现其抑制作用在较高剂量(≥10.0 mmol/L)时主要体现为诱导凋亡,但在低剂量时则通过非凋亡途径实现。低剂量(5.0 mmol/L)Met可诱导细胞呈现典型衰老样形态,同时衰老相关SA-β-gal阳性细胞数增多,且周期阻滞在G0/G1期,提示Met剂量较低时对细胞的抑制作用主要可能来自于诱导细胞衰老。有研究报道Met具有诱导肝癌、乳腺癌等其他肿瘤细胞衰老的效应[13-16],但是否能诱导结直肠癌细胞衰老及其机制并不清楚。
蛋白磷酸酶2(PP2A)在调控细胞代谢、增殖、周期、凋亡以及细胞转化等一系列生理过程中发挥着重要作用[20],但PP2A在肿瘤细胞中的作用尚不清楚。在癌基因诱导的细胞衰老过程中,敲减PP2A-B56γ可抑制Ras引起的成纤维细胞衰老[21],人黑色素瘤细胞中过表达PP2A-B56α则可诱导OIS[22],以上结果均提示PP2A信号通路在调控细胞衰老过程中可能具有重要作用。PP2A常通过不同的分子机制失活,包括催化亚基(PP2A-C)在Tyr307处的过度磷酸化,影响任何支架或调节亚基的突变或下调,以及内源性PP2A抑制剂(如SET或CIP2A)的过表达等[23]。近年来,PP2A-C过度磷酸化被认为与急性髓系白血病[24]或阿尔茨海默病[25]等有关,有报道在结直肠癌中存在PP2A-C的过度磷酸化,但其意义尚不完全清楚[26],但有研究发现Met能激活PP2A,并与其去磷酸化有关[27]。
为进一步探讨Met对结直肠癌细胞的衰老诱导是否通过调控PP2A来实现,本研究用Met诱导结直肠癌细胞衰老后,发现Met可下调PP2A-C亚基在Tyr307位点上的磷酸化水平使PP2A激活,PP2A酶活性显著增加,从而抑制了下游AKT磷酸化水平,使衰老相关蛋白P53、P21的表达上调,表明低剂量Met可能通过PP2A激活介导的衰老抑制了结直肠癌细胞的生长和增殖。而用PP2A抑制剂LB-100处理后,Met诱导的增殖抑制和细胞衰老明显改善,提示Met对结直肠癌细胞衰老的作用主要是由于PP2A的激活所引起的。近来有研究显示:用PP2A激活剂(FTY720或Forskolin)与标准化疗药物联用在抗肿瘤作用中显示出相加效应[26],在结直肠癌中,FTY720通过抑制PP2A的内源性抑制因子SET和CIP2A的表达从而激活PP2A,但对PP2A-C在Tyr307位点磷酸化则无影响。因此,对部分存在PP2A-C过度磷酸化的结直肠癌患者,Met可能具有潜在的治疗应用价值。
本研究证实了Met可诱导结直肠癌细胞衰老并初步分析了其作用机制。但是尚缺乏Met诱导结直肠癌细胞衰老的体内研究证据,对其作用机制也仅初步分析了PP2A途径,并不能确定是否还存在其他可能的衰老诱导机制。此外,在Tyr307位点之外的PP2A过度磷酸化的结直肠癌,Met是否也能发挥同样的肿瘤抑制作用,也需进一步研究。
综上所述,本研究发现Met可通过诱导结直肠癌细胞衰老而非凋亡途径来抑制细胞的增殖,其诱导衰老可能与Met抑制PP2A磷酸化,使PP2A活化并激活下游相关通路有关。但Met激活PP2A后的进一步作用机制、是否还存在其他调控通路、Met是否能与标准化疗药物联合应用等仍需进一步的研究探索。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. |
| [2] |
WU C, LI M, MENG H, et al. Analysis of status and countermeasures of cancer incidence and mortality in China[J]. Sci China Life Sci, 2019, 62(5): 640-647. |
| [3] |
WYLD L, BELLANTUONO I, TCHKONIA T, et al. Senescence and cancer: A review of clinical implications of senescence and senotherapies[J]. Cancers(Basel), 2020, 12(8). |
| [4] |
ZHOU D, BORSA M, SIMON A K. Hallmarks and detection techniques of cellular senescence and cellular ageing in immune cells[J]. Aging Cell, 2021, 20(2): e13316. |
| [5] |
OU H L, SCHUMACHER B. DNA damage responses and p53 in the aging process[J]. Blood, 2018, 131(5): 488-495. |
| [6] |
EWALD J A, DESOTELLE J A, WILDING G, et al. Therapy-induced senescence in cancer[J]. J Natl Cancer Inst, 2010, 102(20): 1536-1546. |
| [7] |
XUE W, ZENDER L, MIETHING C, et al. Senescence and tumour clearance is triggered by p53 restoration in murine liver carcinomas[J]. Nature, 2007, 445(7128): 656-660. |
| [8] |
CAIRNEY C J, BILSLAND A E, EVANS T R, et al. Cancer cell senescence: a new frontier in drug development[J]. Drug Discov Today, 2012, 17(5/6): 269-276. |
| [9] |
MALLIK R, CHOWDHURY T A. Metformin in cancer[J]. Diabetes Res Clin Pract, 2018, 143: 409-419. |
| [10] |
SAFE S, NAIR V, KARKI K. Metformin-induced anticancer activities: recent insights[J]. Biol Chem, 2018, 399(4): 321-335. |
| [11] |
KAMARUDIN M N A, SARKER M M R, ZHOU J R, et al. Metformin in colorectal cancer: molecular mechanism, preclinical and clinical aspects[J]. J Exp Clin Cancer Res, 2019, 38(1): 491. |
| [12] |
XIA C, YANG F, HE Z, et al. iTRAQ-based quantitative proteomic analysis of the inhibition of cervical cancer cell invasion and migration by metformin[J]. Biomed Pharmacother, 2020, 123: 109762. |
| [13] |
LI P, ZHAO M, PARRIS A B, et al. p53 is required for metformin-induced growth inhibition, senescence and apoptosis in breast cancer cells[J]. Biochem Biophys Res Commun, 2015, 464(4): 1267-1274. |
| [14] |
WILLIAMS C C, SINGLETON B A, LLOPIS S D, et al. Metformin induces a senescence-associated gene signature in breast cancer cells[J]. J Health Care Poor Underserved, 2013, 24(1 suppl): 93-103. |
| [15] |
YI G, HE Z, ZHOU X, et al. Low concentration of metformin induces a p53-dependent senescence in hepatoma cells via activation of the AMPK pathway[J]. Int J Oncol, 2013, 43(5): 1503-1510. |
| [16] |
ZHOU X, CHEN J, CHEN L, et al. Negative regulation of Sirtuin 1 by AMP-activated protein kinase promotes metformin-induced senescence in hepatocellular carcinoma xenografts[J]. Cancer Lett, 2017, 411: 1-11. |
| [17] |
ABU E, STRASSBURGER W, QAISER T, et al. Differences in p53 status significantly influence the cellular response and cell survival to 1, 25-dihydroxyvitamin D3-metformin cotreatment in colorectal cancer cells[J]. Mol Carcinog, 2017, 56(11): 2486-2498. |
| [18] |
HOSONO K, ENDO H, TAKAHASHI H, et al. Metformin suppresses azoxymethane-induced colorectal aberrant crypt foci by activating AMP-activated protein kinase[J]. Mol Carcinog, 2010, 49(7): 662-671. |
| [19] |
MOGAVERO A, MAIORANA M V, ZANUTTO S, et al. Metformin transiently inhibits colorectal cancer cell proliferation as a result of either AMPK activation or increased ROS production[J]. Sci Rep, 2017, 7(1): 15992. |
| [20] |
FOWLE H, ZHAO Z, GRAÑA X. PP2A holoenzymes, substrate specificity driving cellular functions and deregulation in cancer[J]. Adv Cancer Res, 2019, 144: 55-93. |
| [21] |
吴燕芳. PP2A复合物在Ras引起的细胞衰老中的功能初探[D]. 江苏大学, 2017. WU Y F. The preliminary study on the function of PP2A complex in cellular senescence induced by Ras[D]. Jiangsu University, 2017. |
| [22] |
MANNAVA S, OMILIAN A R, WAWRZYNIAK J A, et al. PP2A-B56α controls oncogene-induced senescence in normal and tumor human melanocytic cells[J]. Oncogene, 2012, 31(12): 1484-1492. |
| [23] |
O'CONNOR C M, PERL A, LEONARD D, et al. Therapeutic targeting of PP2A[J]. Int J Biochem Cell Biol, 2018, 96: 182-193. |
| [24] |
CRISTÓBAL I, GARCIA-ORTI L, CIRAUQUI C, et al. PP2A impaired activity is a common event in acute myeloid leukemia and its activation by forskolin has a potent anti-leukemic effect[J]. Leukemia, 2011, 25(4): 606-614. |
| [25] |
XIONG Y, JING X P, ZHOU X W, et al. Zinc induces protein phosphatase 2A inactivation and tau hyperphosphorylation through Src dependent PP2A(tyrosine 307) phosphorylation[J]. Neurobiol Aging, 2013, 34(3): 745-756. |
| [26] |
CRISTÓBAL I, RINCÓN R, MANSO R, et al. Hyperphosphorylation of PP2A in colorectal cancer and the potential therapeutic value showed by its forskolin-induced dephosphorylation and activation[J]. Biochim Biophys Acta, 2014, 1842(9): 1823-1829. |
| [27] |
KAWASHIMA I, KIRITO K. Metformin inhibits JAK2V617F activity in MPN cells by activating AMPK and PP2A complexes containing the B56alpha subunit[J]. Exp Hematol, 2016, 44(12): 1156-1165. |




