2. 400016 重庆,重庆医科大学附属第一医院神经外科;
3. 402160 重庆,重庆医科大学附属永川医院: 神经外科
2. Department of Neurosurgery, the First Affiliated Hospital of Chongqing Medical University, Chongqing, 400016, China;
3. Department of Neurosurgery, Yongchuan Hospital, Chongqing Medical University, Chongqing, 402160
蛛网膜下腔出血(subarachnoid hemorrhage,SAH)是一种致残程度高、致死率高的神经外科急重症[1-2]。既往研究已证实:脑血管痉挛导致的继发性脑损伤是引起SAH后脑损伤的主要原因,但关于脑血管痉挛近20年的研究并未给治疗SAH后脑损伤带来明显的效果[3]。近来大量研究表明:血管平滑肌细胞(vascular smooth muscle cells,VSMC)表型转化可能在脑卒中后血管功能紊乱中发挥着至关重要的作用, 提示早期血管改变可能是SAH后早期脑损伤中极其重要的病理生理过程[4-5]。其中,ET-1与血管平滑肌细胞表型转化密切相关。而克拉生坦(clazosentan,Cla)是一种选择性内皮素受体拮抗剂,预防SAH后缺血和梗死事件的双盲随机临床试验表明其可降低严重血管痉挛的发生率[6]。本研究探讨克拉生坦改变VSMC表型转化而改善血管损伤的机制,可为临床治疗SAH提供新思路。
1 材料与方法 1.1 材料 1.1.1 实验动物50只清洁级SD雄性大鼠(230~ 250 g),饲养于湿度(52±2)%、温度(25±3)℃的SPF级动物房动物房,采用标准的12 h光/暗循环,自由饮水,自由摄食,适应性培养1周。所有实验动物购于广东省医学实验动物中心,动物批号:C305-4 [SYXK(粤) 2009-0019]。
1.1.2 主要试剂包括:克拉生坦(豪夫迈·罗氏有限公司,规格:50 mg/150 mg);RIPS裂解液(美国Thermo Scientific公司);BCA蛋白定量试剂盒(美国Sigma公司);兔抗鼠β-actin单克隆抗体、兔抗鼠α-SMA单克隆抗体、兔抗鼠SM-22α单克隆抗体、兔抗鼠MGP单克隆抗体、兔抗鼠OPN单克隆抗体(美国Abcam公司);ECL显影试剂盒(上海碧云天生物科技有限公司);CCK-8试剂盒(日本同仁公司);ELISA试剂盒(荷兰Biotechnology公司);4%多聚甲醛(上海翊圣生物科技有限公司)。
1.2 方法 1.2.1 SAH血管痉挛平滑肌细胞模型制备10%水合氯醛(4 mL/kg)腹腔注射,SD大鼠麻醉生效后,失血法处死,生理盐水灌注致流出液清亮,无菌环境下剥离出脑组织,小心剥离出基底动脉、Willis环与大脑中动脉及其分支血管血管,剪成1~2 mm长的小段以获取VSMC细胞悬液。行原代细胞培养并传代,向细胞培养基中加入自身全血使氧合血红蛋白终浓度达10-6mol/L以构建SAH血管痉挛平滑肌细胞模型。
1.2.2 细胞分组及干预将VSMC细胞分为空白对照组(Control)、模型组(Model)、克拉生坦低剂量组(L-Cla)、克拉生坦中剂量组(M-Cla)及克拉生坦高剂量组(H-Cla)。空白对照组采用普通培养液培养,模型组采用SAH细胞培养液培养,不同剂量克拉生坦组在采用SAH细胞培养液培养的基础上,分别加入1、5 mg及10 mg克拉生坦进行培养。
1.2.3 SAH大鼠模型制备10%水合氯醛腹腔注射,SD大鼠麻醉生效后,经口气管插管,并以动物专用呼吸机维持呼吸,仰卧于操作台上,固定四肢,颈部备皮,常规消毒后,于显微镜下沿颈部正中分离,暴露左侧颈外动脉并离断,将一端尖锐的丝线由一侧的颈外动脉残端进入,经颈总动脉导入同侧的颈内动脉, 直至颅内颈内动脉分叉处,至有阻力即到颈内动脉分叉处,再置入2~3 mm,即用丝线尖端刺破分叉处并留置2~3 s,抽出丝线,颈外动脉残端结扎,构建SAH模型。
1.2.4 动物分组及干预40只SD大鼠采用随机数字表法分为5组,即空白对照组(Control)、模型组(Model)、克拉生坦低剂量组(L-Cla)、克拉生坦中剂量组(M-Cla)及克拉生坦高剂量组(H-Cla),每组8只。空白对照组大鼠不刺破血管,其他操作同SAH模型构建,模型组及不同剂量克拉生坦组大鼠常规构建SAH模型,且不同剂量克拉生坦组在SAH建模成功后3 h,经分别尾静脉注射1、5、10 mg克拉生坦。术后将大鼠放入笼中,并注意保暖。
1.2.5 Wetern blot检测VSMC表型转化标志蛋白表达细胞弃去培养基,PBS洗涤3次后,加入适量混匀的细胞裂解液及蛋白酶抑制剂,冰上裂解30 min,收集细胞,4 ℃、12 000 r/min离心15 min,取上清液。使用BCA蛋白定量试剂盒对提取的蛋白进行定量,各组以30~60 μg相同的蛋白上样量,煮沸变性后进行10%SDS - PAGE凝胶电泳。电泳完成后,使用半干转仪转移至PVDF膜,然后用5%脱脂牛奶封闭1 h,随后用1%脱脂牛奶稀释一抗,4 ℃孵育过夜。次日使用TBST洗脱一抗,37 ℃孵育二抗1 h,PBS洗涤3次,采用ECL化学发光剂显影。
1.2.6 ELISA检测内皮素-1(ET-1)水平细胞弃去培养基,PBS洗涤3次后,加入适量混匀的细胞裂解液及蛋白酶抑制剂,冰上裂解30 min,3 000 r/min常温离心10 min,取上清液。各组大鼠经胃静脉取血2 mL,室温静置30 min后,3 000 r/min常温离心10 min,分离上层血清。采用双抗体夹心ELISA法,检测细胞/血清中ET-1水平。所有操作严格按说明书执行,试剂盒批内变异 < 2.5%,批间变异 < 5%。
1.2.7 CCK-8检测细胞增殖收集对数生长期细胞,离心后重悬细胞,调整悬液细胞浓度至5 000/mL,96孔板每孔加入细胞悬液100 μL,每组3个复孔,常规培养。分别于0、24、48、72 h时每孔加入10 μL CCK-8试剂,继续置于培养箱中放置2 h,用酶标仪测定其在450 nm处的光密度值D(450),表示细胞增殖能力,绘制细胞生长曲线,观察各组细胞增殖能力变化情况。
1.2.8 划痕实验检测细胞迁移情况各组细胞按2×105/孔接种于6孔板中,常规培养,待细胞贴壁为单层细胞状态时,于超净台中,采用无菌10 μL枪头垂直于6孔板划线,各做3条横线与垂直的竖线,采用PBS缓慢冲洗6孔板,去除划线处理的细胞。常规培养24 h,于光学显微镜下观察划痕处细胞运动情况。细胞运动率=(初始划痕宽度-24 h后划痕宽度)/初始划痕宽度×100%。
1.2.9 改良Garcia评分评估神经功能缺损情况各组大鼠于术后72 h进行神经功能缺陷评分,采用改良Garcia量表评分:根据大鼠笼内5 min自主活动、四肢对称运动、前肢伸展运动、攀爬能力、本体感觉、触碰胡须反应等6个方面神经功能表现情况进行评分,根据严重程度不同记为0~3分,总分为18分,得分越低,说明神经功能缺损越严重。
1.2.10 HE染色检测血管平滑肌直径及厚度显微镜下采用镊子取各组大鼠大脑基底动脉及中动脉,置于包埋盒内,浸于4%多聚甲醛中固定过夜。常规乙醇梯度脱水,石蜡包埋。将切片置于二甲苯及梯度酒精中依次浸泡脱蜡,苏木精染色40 s,1%盐酸乙醇冲洗后,置于伊红溶液中染色3 s,自来水冲洗后,将切片置于梯度酒精及二甲苯溶液中进行脱水和透明处理。随后使用中性树脂覆盖玻片进行封固。于光学显微镜下观察并采集图片,观察不同组别血管平滑肌平均直径及厚度情况。
1.3 统计学分析应用SPSS 19.0统计软件。采用Shapro-Wilk检验数据是否符合正态分布,Bartlett检验进行方差齐性检验。符合正态分布的计量资料以x±s表示,多组数据间比较采用单因素方差分析,两组间均数比较采用SNK-q检验。P < 0.05为差异有统计学意义。
2 结果 2.1 克拉生坦对VSMC表型转化标志蛋白表达的影响Western blot检测结果显示:与Control组比较,Model组和各Cla干预组VSMC细胞中α-SMA、SM-22α蛋白表达较低(P < 0.05),MGP、OPN蛋白表达较高(P < 0.05);与Model组比较,L-Cla、M-Cla、H-Cla组α-SMA、SM-22α蛋白表达较高(P < 0.05),MGP、OPN蛋白表达较低(P < 0.05);H-Cla组α-SMA、SM-22α蛋白表达高于L-Cla、M-Cla组(P < 0.05),其MGP、OPN蛋白表达低于L-Cla、M-Cla组(P < 0.05),见图 1。
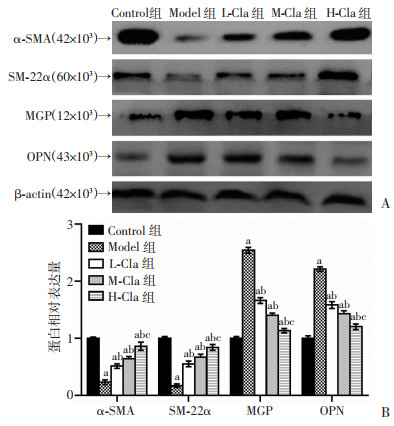
|
| A:Western blot检测;B:半定量分析 a:P < 0.05,与Control组比较;b:P < 0.05,与Model组比较;c:P < 0.05,与L-Cla、M-Cla组比较 图 1 克拉生坦对VSMC表型转化标志蛋白表达的影响 |
2.2 克拉生坦对VSMC细胞ET-1表达的影响
ELISA检测结果显示:与Control组比较,Model组和各Cla干预组VSMC细胞中ET-1水平较高(P < 0.05);L-Cla、M-Cla、H-Cla组低于Model组(P < 0.05);M-Cla组、H-Cla组ET-1水平低于L-Cla组(P < 0.05),H-Cla组低于M-Cla组(P < 0.05),见图 2。
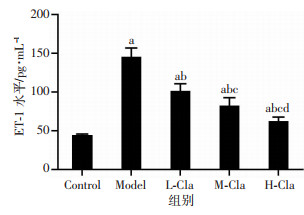
|
| a:P < 0.05,与Control组比较;b:P < 0.05,与Model组比较;c:P < 0.05,与L-Cla组比较;d:P < 0.05,与M-Cla组比较 图 2 ELISA检测克拉生坦对VSMC细胞ET-1水平的影响 |
2.3 克拉生坦对VSMC细胞增殖能力的影响
CCK-8检测结果显示:与Control组比较,Model组和各Cla干预组VSMC细胞在24、48、72 h的细胞增殖活性较高(P < 0.05);与Model组比较,L-Cla、M-Cla、H-Cla各组不同时间点的细胞增殖活性较低(P < 0.05);M-Cla组、H-Cla组不同时点增殖活性低于L-Cla组(P < 0.05),H-Cla组不同时点增殖活性低于M-Cla组(P < 0.05),见图 3。
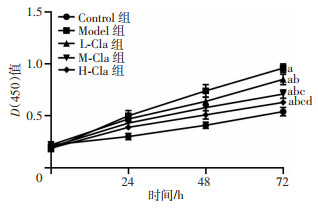
|
| a:P < 0.05,与Control组比较;b:P < 0.05,与Model组比较;c:P < 0.05,与L-Cla组比较;d:P < 0.05,与M-Cla组比较 图 3 CCK-8检测克拉生坦对VSMC细胞增殖能力的影响 |
2.4 克拉生坦对VSMC细胞迁移能力的影响
细胞划痕实验结果显示:与Control组比较,Model组和各Cla干预组VSMC细胞迁移能力较高(P < 0.05);L-Cla组、M-Cla组、H-Cla组低于Model组(P < 0.05);M-Cla组、H-Cla组低于L-Cla组(P < 0.05),H-Cla组低于M-Cla组(P < 0.05),见图 4。
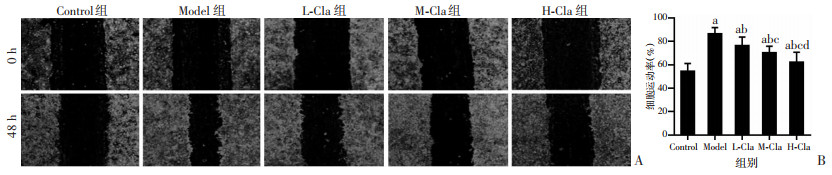
|
| A:划痕实验检测各组细胞迁移(×40):B:各组细胞运动率 a:P < 0.05,与Control组比较;b:P < 0.05,与Model组比较;c:P < 0.05,与L-Cla组比较;d:P < 0.05,与M-Cla组比较 图 4 克拉生坦对VSMC细胞迁移能力的影响 |
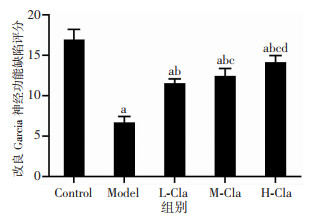
2.5 克拉生坦对SAH大鼠神经功能的影响
改良Garcia神经功能缺陷评分结果显示:与Control组比较,Model组及各Cla干预组大鼠Garcia评分较低(P < 0.05);与Model组比较,L-Cla、M-Cla、H-Cla组大鼠Garcia评分较高(P < 0.05),且随着Cla干预剂量的增加,大鼠Garcia评分增加(P < 0.05),见图 5。
|
| a:P < 0.05,与Control组比较;b:P < 0.05,与Model组比较;c:P < 0.05,与L-Cla组比较;d:P < 0.05,与M-Cla组比较 图 5 克拉生坦对SAH大鼠神经功能的影响 |
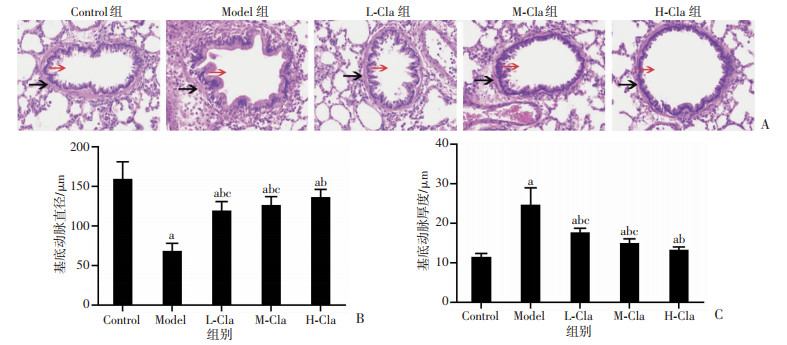
2.6 克拉生坦对SAH大鼠血管重塑的影响
HE染色结果显示:Model组各Cla干预组大鼠基底动脉直径小于Control组(P < 0.05),基底动脉厚度则明显厚于Control组(P < 0.05);与Model组比较,L-Cla、M-Cla、H-Cla组大鼠基底动脉直径较大(P < 0.05),其基底动脉厚度较小(P < 0.05);H-Cla组大鼠基底动脉直径大于L-Cla组和M-Cla组(P < 0.05),其基底动脉厚度则明显小于L-Cla组和M-Cla组(P < 0.05),见图 6。
|
|
a:P < 0.05,与Control组比较;b:P < 0.05,与Model组比较;c:P < 0.05,与H-Cla组比较 A: HE染色检测各组大鼠血管平滑肌直径及厚度(×40) 黑色箭头示血管平滑肌的厚度;红色箭头示血管直径; B: 各组大鼠血管平滑肌直径; C: 各组大鼠血管平滑肌厚度 图 6 克拉生坦对SAH大鼠血管重塑的影响 |
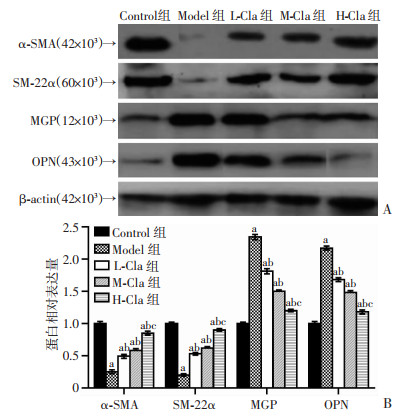
2.7 克拉生坦对SAH大鼠VSMC表型转化标志蛋白表达的影响
大鼠基底动脉组织蛋白检测结果显示:Model组和L-Cla、M-Cla、H-Cla组大鼠中α-SMA、SM-22α蛋白表达低于Control组(P < 0.05),MGP、OPN蛋白表达高于Control组(P < 0.05);与Model组比较,L-Cla、M-Cla、H-Cla组α-SMA、SM-22α蛋白表达较高(P < 0.05),MGP、OPN蛋白表达较低(P < 0.05);H-Cla组α-SMA、SM-22α蛋白表达高于L-Cla组和M-Cla组(P < 0.05),其MGP、OPN蛋白表达低于L-Cla组和M-Cla组(P < 0.05),见图 7。
|
| A:Western blot检测;B:半定量分析 a:P < 0.05,与Control组比较;b:P < 0.05,与Model组比较;c:P < 0.05,与L-Cla、M-Cla组比较 图 7 克拉生坦对SAH大鼠VSMC表型转化标志蛋白表达的影响 |
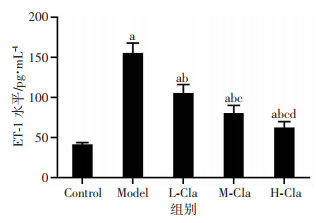
2.8 克拉生坦对SAH大鼠血清ET-1水平的影响
大鼠尾静脉血ELISA检测结果显示:与Control组比较,Model组和各Cla干预组大鼠血清ET-1水平明显较高(P < 0.05);L-Cla、M-Cla、H-Cla组则明显低于Model组(P < 0.05);M-Cla组、H-Cla组低于L-Cla组(P < 0.05),H-Cla组低于M-Cla组(P < 0.05),见图 8。
|
| a:P < 0.05,与Control组比较;b:P < 0.05,与Model组比较;c:P < 0.05,与L-Cla组比较;d:P < 0.05,与M-Cla组比较 图 8 ELISA检测克拉生坦对SAH大鼠血清ET-1水平的影响 |
3 讨论
蛛网膜下腔出血(SAH)死亡率可高达50%,而且超过50%的幸存者长期遗留神经功能障碍,严重影响患者的生活质量[7]。针对SAH后病理生理变化的研究发现:脑血管痉挛是导致神经功能损害的主要原因之一[8]。血管痉挛是指动脉在一段时间内的异常收缩状态,由于血管壁平滑肌强烈收缩,管腔狭窄,从而造成血液缓慢,局部组织灌注不足。SAH后由于血管平滑肌细胞的强烈收缩,可导致脑供血不足,严重者可继发脑梗死,进而导致SAH患者遗留神经功能障碍,大大降低患者预后质量[9-10]。如何减轻SAH后血管痉挛成为亟待解决的问题。
目前常用于神经外科预防或改善血管痉挛的药物为尼莫地平,尼莫地平是一种选择性的脑血管平滑肌钙拮抗剂,可通过改善平滑肌细胞内钙离子稳态,减轻脑血管痉挛[11]。目前,临床上应用尼莫地平预防或改善脑血管痉挛,但仍有部分患者可出现脑缺血或脑梗死的情况。因此,寻找新的药物,更好地减轻脑血管痉挛迫在眉睫。脑血管痉挛的病理机制多样,目前文献指出:血管平滑肌的强烈收缩是导致脑血管痉挛的主要原因[12],由此推论,减轻血管平滑肌的强烈收缩可能减轻血管痉挛。近年来研究发现,VSMC的表型转化与血管平滑肌的强烈收缩密切相关[13]。众所周知,健康人动脉血管的VSMC以收缩型为主,其主要功能是维持血管的弹性和收缩血管,收缩型VSMC增殖、迁移能力差,形态上胞体呈梭形或带状,含大量肌丝和结构蛋白,合成细胞器如粗面内质网、高尔基复合体含量较少,合成基质的能力差,体积小。分泌型VSMC也称合成型VSMC,其主要存在于病理血管中,主要功能是增殖、迁移入内膜及合成细胞外基质蛋白,形态上类似成纤维细胞,肌丝和结构蛋白含量少,合成细胞器增多,合成和分泌基质蛋白能力强,体积较收缩型大。当VSMC以收缩型为主时,其主要收缩型标志蛋白为α-SMA,其在收缩型细胞中优势表达,而在分泌型平滑肌细胞中表达甚微;骨桥蛋白(OPN)则是分泌型平滑肌细胞标志蛋白[14-15]。研究发现:当VSMC发生表型转化时,即VSMC由收缩型向分泌型转变,即出现收缩型VSMC α-SMA表达降低,而分泌型VSMC的OPN表达增加[16]。研究表明血管痉挛与VSMC表型转化密切相关,血管痉挛发生时,VSMC由收缩型向分泌型转换时导致血管壁增厚、血管直径变小[17]。因此,抑制VSMC的表型转化可减轻血管痉挛。
克拉生坦是一种选择性内皮素受体拮抗剂,可用于预防SAH后缺血和梗死事件,能有效降低严重血管痉挛的发生率[18]。但目前克拉生坦在日本仍处于3期临床试验阶段,尚未真正应用于临床[19]。克拉生坦缓解血管痉挛的机制尚未清楚。研究表明:克拉生坦与VSMC表型转化密切相关[20],但其如何导致VSMC表型转化的机制尚未明确。传统意义上血管收缩程度与内皮素-1(ET-1)与内皮素-1受体(ET-1R)的结合度相关,ET-1与其受体结合只是单纯地通过影响Ca2+的稳态而影响血管直径变化,从而影响血管痉挛[21-22]。早期研究表明:克拉生坦抑制血管痉挛的主要机制为ET-1与ET-1R相结合,二者结合后引起VSMC内Ca2+稳态失衡进而影响血管直径的变化[23-24]。近年来研究发现,克拉生坦可通过拮抗ET-1R从而减轻血管痉挛[25]。基于此,本研究拟通过体内外实验,探究不同剂量克拉生坦对SAH体内外模型中VSMC表型转化的影响,进一步观察克拉生坦对ET-1R的拮抗作用是否参与VSMC表型转化及血管痉挛的抑制调节。
本研究结果显示:克拉生坦干预能明显改善VSMC中α-SMA、SM-22α蛋白等收缩型标志蛋白相对表达量,降低MGP、OPN等分泌型蛋白相对表达量,同时改善VSMC的增殖活性、迁移能力,降低ET-1分泌水平。与此同时,随着克拉生坦干预剂量的增加,VSMC中α-SMA、SM-22α蛋白相对表达量进一步升高,MGP、OPN蛋白相对表达量则进一步降低,ET-1水平相对减少,VSMC的增殖活性和迁移能力也进一步改善,提示克拉生坦可抑制VSMC表型转化,参与调节VSMC的增殖和迁移能力,且作用效果呈剂量依赖性,且该作用与克拉生坦对ET-1的拮抗作用有关。为了进一步验证该实验结论,本研究采用SD大鼠构建SAH模型,并在造模成功后经尾静脉进行克拉生坦干预,利用体内实验中探究克拉生坦对VSMC表型转化的影响。结果显示:克拉生坦干预组大鼠α-SMA、SM-22α蛋白等收缩型标志蛋白表达明显高于模型组,MGP、OPN等分泌型蛋白表达则明显低于模型组,血清ET-1水平也明显较低,且随着克拉生坦干预剂量的增加,蛋白相对表达量和血清ET-1水平改变明显,与体外研究结果一致,进一步证实克拉生坦对VSMC表型转化具有剂量依赖性的抑制作用,其抑制作用可能与克拉生坦自身对ET-1的拮抗有关。动物模型实验结果还显示:克拉生坦干预组大鼠神经功能缺损缓解情况具有明显优势,各干预组大鼠Garcia评分明显高于模型组水平,且干预组大鼠基底动脉直径明显增大,而血管壁厚度明显减小,提示克拉生坦对VSMC表型转化的抑制作用能有效改善SAH后血管病理性重塑,改善血管壁厚度和血管直径,从而发挥神经功能损伤修复作用。
综上所述,克拉生坦对脑血管平滑肌细胞表型转化具有一定的抑制作用,主要与其对收缩型标记蛋白表达促进、合成分泌型标记蛋白表达抑制有关,其可通过与ET-1的拮抗作用,抑制VSMC表型转化,改善细胞增殖和迁移能力,从而参与VSMC的病理性重塑和神经功能损伤修复。
| [1] |
董漪, 郭珍妮, 李琦, 等. 中国脑血管病临床管理指南(节选版): 蛛网膜下腔出血临床管理[J]. 中国卒中杂志, 2019, 14(8): 814-818. DONG Y, GUO Z N, LI Q, et al. Chinese stroke association guidelines for clinical management of cerebrovascular disorders (excerpts): clinical management of subarachnoid hemorrhage[J]. Chin J Stroke, 2019, 14(8): 814-818. |
| [2] |
LIAO W H, SU Y J, LIU C H. Junctional bradycardia caused by subarachnoid hemorrhage[J]. Interdiscip Neurosurg, 2021, 23: 100986. |
| [3] |
刘思齐, 张艳, 孙娟, 等. 蛛网膜下腔出血后继发性脑血管痉挛的研究进展[J]. 解剖学报, 2019, 50(4): 537-542. LIU S Q, ZHANG Y, SUN J, et al. Progress of mechanism and therapy on cerebral vasospasm after subarachnoid hemorrhage[J]. Acta Anat Sin, 2019, 50(4): 537-542. |
| [4] |
肖雪, 侯翠柳, 王筱筱, 等. NKT细胞通过下调PDGFRβ抑制Ang Ⅱ诱导的小鼠血管平滑肌细胞表型转换[J]. 中国病理生理杂志, 2020, 36(8): 1345-1350. XIAO X, HOU C L, WANG X X, et al. NKT cells inhibit Ang Ⅱ-induced phenotypic transformation of mouse vascular smooth muscle cells by down-regulating PDGFRβ[J]. Chin J Pathophysiol, 2020, 36(8): 1345-1350. |
| [5] |
邓娟, 于晓江, 杨洋, 等. 血管平滑肌细胞表型转化在心血管疾病中作用的研究进展[J]. 生理科学进展, 2020, 51(2): 107-112. DENG J, YU X J, YANG Y, et al. Research progress of vascular smooth muscle cell phenotypic modulation in cardiovascular diseases[J]. Prog Physiol Sci, 2020, 51(2): 107-112. |
| [6] |
孙慧, 侯玉立, 崔林林, 等. 克拉生坦防治动脉瘤性蛛网膜下腔出血后脑血管痉挛的疗效及安全性的系统评价[J]. 中华临床医师杂志(电子版), 2016, 10(19): 2887-2891. br> SUN H, HOU Y L, CUI L L, et al. Efficacy and safety of clazosentan for cerebral vasospasm after aneurysmal subarachnoid hemorrhage: a systematic review[J]. Chin J Clin Electron Ed, 2016, 10(19): 2887-2891. |
| [7] |
KONCZALLA J, KASHEFIOLASL S, BRAWANSKI N, et al. Cerebral vasospasm and delayed cerebral infarctions in 225 patients with non-aneurysmal subarachnoid hemorrhage: the underestimated risk of Fisher 3 blood distribution[J]. J Neurointerv Surg, 2016, 8(12): 1247-1252. |
| [8] |
VARSOS G V, BUDOHOSKI K P, CZOSNYKA M, et al. Cerebral vasospasm affects arterial critical closing pressure[J]. J Cereb Blood Flow Metab, 2015, 35(2): 285-291. |
| [9] |
DINC N, QUICK-WELLER J, TRITT S, et al. Vasospasm of the basilar artery following spontaneous SAH-clinical observations and implications for vascular research[J]. Neurosurg Rev, 2019, 42(4): 983-989. |
| [10] |
KONCZALLA J, KASHEFIOLASL S, BRAWANSKI N, et al. Cerebral vasospasm-dependent and cerebral vasospasm-independent cerebral infarctions predict outcome after nonaneurysmal subarachnoid hemorrhage: a single-center series with 250 patients[J]. World Neurosurg, 2017, 106: 861-869.e4. |
| [11] |
KELLER E, KRAYENBVHL N, BJELJAC M, et al. Cerebral vasospasm: results of a structured multimodal treatment[J]. Acta Neurochir Suppl, 2005, 94: 65-73. |
| [12] |
HANSEN-SCHWARTZ J. Cerebral vasospasm: a consideration of the various cellular mechanisms involved in the pathophysiology[J]. Neurocrit Care, 2004, 1(2): 235-246. |
| [13] |
HALD E S, ALFORD P W. Smooth muscle phenotype switching in blast traumatic brain injury-induced cerebral vasospasm[J]. Transl Stroke Res, 2014, 5(3): 385-393. |
| [14] |
CHENG M F, SONG J N, LI D D, et al. The role of rosiglitazone in the proliferation of vascular smooth muscle cells after experimental subarachnoid hemorrhage[J]. Acta Neurochir(Wien), 2014, 156(11): 2103-2109. |
| [15] |
ZHANG H R, JIANG L, GUO Z D, et al. PPARβ/δ, a novel regulator for vascular smooth muscle cells phenotypic modulation and vascular remodeling after subarachnoid hemorrhage in rats[J]. Sci Rep, 2017, 7: 45234. |
| [16] |
HE J C, LIU M D, LIU Z, et al. Recombinant osteopontin attenuates experimental cerebral vasospasm following subarachnoid hemorrhage in rats through an anti-apoptotic mechanism[J]. Brain Res, 2015, 1611: 74-83. |
| [17] |
袁瑞军, 唐杨烽, 刘晓红, 等. 转录因子SP1调控血管平滑肌细胞表型转化在主动脉夹层发病中的作用[J]. 国际心血管病杂志, 2016, 43(6): 365-368, 374. YUAN R J, TANG Y F, LIU X H, et al. The effects of transcription factor SP1 on phenotypic switching of vascular smooth muscle cells in pathogenesis of aortic dissection[J]. Int J Cardiovasc Dis, 2016, 43(6): 365-368, 374. |
| [18] |
SCHUBERT G A, SCHILLING L, THOMÉC. Clazosentan, an endothelin receptor antagonist, prevents early hypoperfusion during the acute phase of massive experimental subarachnoid hemorrhage: a laser Doppler flowmetry study in rats[J]. J Neurosurg, 2008, 109(6): 1134-1140. |
| [19] |
MACDONALD R L. Clazosentan: an endothelin receptor antagonist for treatment of vasospasm after subarachnoid hemorrhage[J]. Expert Opin Investig Drugs, 2008, 17(11): 1761-1767. |
| [20] |
BECK J, RAABE A. Clazosentan: prevention of cerebral vasospasm and the potential to overcome infarction[J]. Acta Neurochir Suppl, 2011, 110(Pt 2): 147-150. |
| [21] |
KÄSTNER S, OERTEL M F, SCHARBRODT W, et al. Endothelin-1 in plasma, cisternal CSF and microdialysate following aneurysmal SAH[J]. Acta Neurochir (Wien), 2005, 147(12): 1271-1279. |
| [22] |
LEI Q, LI S, ZHENG R B, et al. Endothelin-1 expression and alterations of cerebral microcirculation after experimental subarachnoid hemorrhage[J]. Neuroradiology, 2015, 57(1): 63-70. |
| [23] |
VERGOUWENM D. Effect of endothelin-receptor antagonists on delayed cerebral ischemia after aneurysmal subarachnoid hemorrhage remains unclear[J]. Stroke, 2009, 40(12): e714. |
| [24] |
PARENT R, LAVALLÉE M. Endothelin-dependent effects limit flow-induced dilation of conductance coronary vessels after blockade of nitric oxide formation in conscious dogs[J]. Cardiovasc Res, 2000, 45(2): 470-477. |
| [25] |
MACDONALD R L, HIGASHIDA R T, KELLER E, et al. Clazosentan, an endothelin receptor antagonist, in patients with aneurysmal subarachnoid haemorrhage undergoing surgical clipping: a randomised, double-blind, placebo-controlled phase 3 trial (CONSCIOUS-2)[J]. Lancet Neurol, 2011, 10(7): 618-625. |




