2. 400016 重庆,重庆医科大学基础医学院: 病理学教研室
2. Department of Pathology, College of Basic Medical Sciences, Chongqing Medical University, Chongqing, 400016, China
人口老龄化进程加快,研究衰老生物学与老年性疾病是当今社会科学和生命科学共同关注的研究课题。阿尔茨海默病(Alzheimer’s disease, AD)、帕金森病(Parkinson’s disease,PD)等神经系统退行性疾病随年龄增长而发病率增高。目前认为,神经元退变、衰老、丢失和死亡是慢性神经性系统退行性疾病的关键因素,这与神经干细胞(neural stem cells, NSCs)衰老密切相关[1-5],迄今还没有找到有效防治方法。
当归是中医临床“补血”要药,有补益气血,延缓衰老,修复损伤等作用[6]。课题组前期研究证明:当归多糖(Angelica sinensis polysaccharide,ASP)是当归中重要的抗衰老成分,可以通过抗氧化应激损伤调控组织细胞衰老[7]。本研究通过构建D-半乳糖(D-galactose,D-gal)致大鼠脑衰老模型和NSCs体外衰老模型,探讨ASP拮抗氧化致衰剂D-gal对脑衰老与NSCs衰老影响及其机制。本研究旨在为阐释祖国医学抗衰老理论和现代医学抗衰老新理论提供实验依据,也为抗衰老天然药物有效成分用于防治神经退行性疾病提供新思路。
1 材料与方法 1.1 实验动物3月龄SPF级雄性SD大鼠40只,体质量180~200 g,由重庆医科大学实验动物中心提供[合格证号SCXK(渝)2007-0001]。
1.2 主要试剂包括:ASP(陕西慈缘生物技术公司,纯度≥95 %);D-gal(美国Sigma公司);GSH试剂盒(南京建成科技有限公司);衰老相关β-半乳糖苷酶(SA-β-Gal)、超氧化物歧化酶(SOD)、丙二醛(MDA)检测试剂盒(上海碧云天生物技术研究所);IL-1β、IL-6试剂盒(武汉博士德公司);Nestin抗体(武汉三鹰公司);神经干细胞完全培养基(广州赛业公司);qRT-PCR试剂盒(日本TaKaRa公司)。
1.3 大鼠衰老模型构建与分组给药大鼠分为4组,每组10只。衰老模型组:皮下注射D-gal[120 mg/(kg·d),42 d];ASP衰老模型组, 同衰老模型组处理,第15天起腹腔注射ASP[100 mg/(kg·d),28 d];对照组,皮下注射等量生理盐水42 d;ASP对照组,注射等量生理盐水14 d,第15天起腹腔注射ASP(同ASP衰老模型组)。于药物注射完成第2天进行相关指标检测。
1.4 衰老大鼠空间学习记忆能力检测(水迷宫实验)定位航行实验:每天1次,共6 d,大鼠背朝池壁,轮流从4个入水点下水,记录在120 s内寻找到平台的时间(逃避潜伏期),如果120 s以上未找到平台,则潜伏期记为120 s,引导大鼠上平台并停留30 s。空间探索试验:第7天,撤去隐形平台,将大鼠由某一入水点下水,记录大鼠入水后120 s内的游泳轨迹,计算大鼠逃避潜伏期、穿越原平台所在位置的次数及在原平台象限停留时间的百分比。
1.5 脑组织衰老检测(Sa-β-Gal染色)制备海马冠状部冷冻切片,按照SA-β-gal试剂盒说明书进行操作,37 ℃孵育过夜,光学显微镜观察海马DG区蓝染细胞即为衰老神经细胞,采用用ImageJ图像分析法计算SA-β-Gal染色阳性区相对光密度值(ROD)。
1.6 海马匀浆中IL-1β、IL-6含量与SOD、MDA和GSH活性检测制备海马组织匀浆,离心并收集上清液,BCA法测定蛋白浓度。按试剂盒说明方法测定海马匀浆中IL-1β、IL-6(pg/mg)含量与SOD(U/mg)、MDA(nmol/mg)、GSH(μmol/L)活性。
1.7 检测海马细胞端粒长度(Southern blot法)与海马端粒酶活性(TRAP-PCR银染法)提取海马组织DNA,37 ℃酶消化2 h,1%琼脂糖凝胶电泳分离DNA,虹吸法转移DNA至尼龙膜,预杂交1 h,加入端粒探针,42 ℃杂交过夜。洗膜30 min,封闭液封闭15 min。用Strptavdin-HRP缓冲液37 ℃振荡40 min,PBS洗3次,DAB显色液显色10 min后,置X线片夹中显影。按L=Σ(ODi ∶ l ∶Li)/Σ(ODi)公式计算端粒长度;ODi为所测条带中对应于每一个Marker位置上的光密度值,Li为对应的每一个Marker的分子长度。取新鲜海马组织,生理盐水清洗组织后按照试剂盒说明书要求进行端粒酶活性测量。酶活力比值=荧光强度/蛋白浓度,计算端粒酶活力。
1.8 神经干细胞分离纯化与分组取SD胎鼠,取全脑分离、纯化与培养细胞,培养至第3代,用Nestin免疫荧光鉴定NSCs。将NSCs以5×105/mL接种至细胞培养瓶中,分为4组:对照组,常规培育48 h;ASP组,常规培养24 h, 再添加ASP(终浓度100 μg/mL)共同培育24 h;衰老模型组,加入D-gal(终浓度10 mg/mL)培育48 h;ASP衰老模型组,加入D-gal培育24 h,再加入ASP共同培育24 h。于建模结束后第2天检测相关指标。
1.9 流式细胞仪检测NSCs的ROS水平收集并调整NSCs为1×106/mL,悬浮于稀释好的DCFH-DA中,37 ℃孵育20 min,无血细胞培养基洗涤细胞3次,去除未进入细胞内的DCFH-DA;流式细胞仪检测细胞内ROS水平,以DCF的平均荧光强度表示其含量。
1.10 酶标比色法检测NSCs的MDA含量制备NSCs培养上清液,BCA法测定蛋白浓度。按试剂盒说明书方法测定光密度值D(532),计算NSCs上清液的MDA含量。
1.11 qRT-PCR检测NSCs的p19、p21、p53 mRNA表达用TRIzol方法提取NSCs的RNA,通过D(260)/D(280)的比例检测RNA的质量。逆转录进行cDNA的合成。94 ℃预变性5 min,1个循环;变性94 ℃ 5 min,退火61 ℃ 5 min,延伸72 ℃ 5 min,30个循环;延伸72 ℃ 3 min。引物序列见表 1。
| 引物 | 引物序列(5'→3') | 片段长度/bp |
| GAPDH | 上游:CCCACGGCAAGTTCAACGGCA 下游:TGGCAGGTTTCTCCAGGCGGC |
606 |
| p19 | 上游:ACCCCAAGTGAGGGTTTTCT 下游:GATCCTCTCTGGCCTCAACA |
106 |
| p21 | 上游:GTGATGTCCGACCTGTTCC 下游:GCAAAGTTCCACCGTTCTC |
139 |
| p53 | 上游:GCCATCTACAAGAAGTCACAGC 下游:GATGATGGTAAGGATAGGTCGG |
285 |
1.12 统计学分析
数据用x±s表示,采用GraphPad Prism 7.0统计软件进行单因素方差分析。检验水准α=0.05。
2 结果 2.1 小鼠衰老生物学动态情况随着注射D-gal时间和累积剂量的增加,衰老模型组小鼠毛发逐渐枯燥,色暗淡,精神不振,活动力下降,进食减少,大便不成形,体质量增加缓慢,呈典型的自然衰老体征,其余3组无明显衰老体征。
2.2 ASP对脑衰老大鼠空间学习记忆能力的影响定位航行实验结果显示:衰老模型组大鼠找到隐形平台前的逃避潜伏期显著长于对照组,ASP衰老模型组的逃避潜伏期短于衰老模型组(P < 0.05,图 1);空间探索实验结果显示:衰老模型组大鼠跨越原平台所在位置的次数和在原平台象限停留时间的百分比显著低于对照组,ASP衰老模型组跨越原平台的次数和在原平台象限停留时间的百分比明显高于衰老模型组(P < 0.05,表 2)。
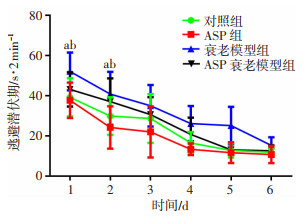
|
| a:P < 0.05,与对照组比较;b:P < 0.05,与ASP衰老模型组比较 图 1 ASP对脑衰老大鼠定位航行实验的影响 |
| 组别 | 跨越原平台次数/次·2 min-1 | 原平台象限停留时间百分比(%) |
| 对照组 | 10.20±1.85 | 35.91±7.64 |
| ASP组 | 10.70±1.46 | 37.33±5.34 |
| 衰老模型组 | 8.80±1.87a | 26.48±3.14a |
| ASP衰老模型组 | 9.96±1.45b | 39.22±4.46b |
| a:P < 0.05,与对照组比较;b:P < 0.05,与衰老模型组比较 | ||
2.3 ASP对脑衰老模型大鼠海马神经细胞衰老的影响
衰老模型组大鼠海马SA-β-gal染色阳性细胞数量较对照组明显增高;而ASP衰老模型组较衰老模型组阳性细胞数量明显降低(P < 0.05,图 2)。

|
| A:SA-β-gal染色;B:统计分析结果 1:对照组;2:ASP组;3:衰老模型组;4:ASP衰老模型;a:P < 0.05,与对照组比较;b:P < 0.05,与衰老模型组比较 图 2 ASP对脑衰老大鼠海马神经细胞衰老的影响 |
2.4 ASP对脑衰老大鼠海马抗氧化能力的影响
衰老模型组大鼠海马中SOD含量、GSH活性较对照组均降低,而MDA含量显著增高;ASP衰老模型组大鼠海马中SOD含量、GSH活性较衰老模型组增高, 而MDA含量降低(P < 0.05,图 3)。
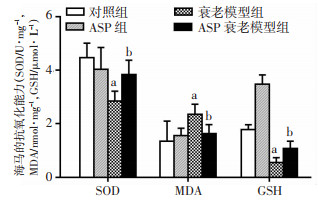
|
| a:P < 0.05,与对照组比较;b:P < 0.05,与衰老模型组比较 图 3 ASP对脑衰老大鼠海马抗氧化能力的影响 |
2.5 ASP对脑衰老大鼠海马IL-1β,IL-6含量的影响
衰老模型组大鼠海马区IL-1β、IL-6显著高于对照组; 而ASP衰老模型组IL-1β、IL-6显著低于衰老模型组(P < 0.05,表 3)。
| 组别 | IL-1β/pg·mg-1 | IL-6/pg·mg-1 |
| 对照组 | 0.46±0.02 | 56.05±3 |
| ASP组 | 0.45±0.01 | 50.17±9.31 |
| 衰老模型组 | 0.62±0.03a | 70.54±11.58a |
| ASP衰老模型组 | 0.56±0.02b | 62.08±10.19b |
| a:P < 0.05,与对照组比较;b:P < 0.05,与衰老模型组比较 | ||
2.6 ASP对脑衰老大鼠海马区端粒长度及端粒酶活性的影响
衰老模型组大鼠海马区细胞的端粒长度缩短和端粒酶活性下降较对照组明显;而ASP衰老模型组较衰老模型组明显增高(图 4)。
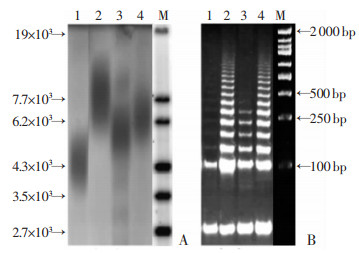
|
| 1:衰老模型组;2:ASP组;3:ASP衰老模型组;4:对照组;M:标准 图 4 ASP对衰老大鼠海马端粒长度(A)和端粒酶活性(B)的影响 |
2.7 NSCs的Nestin表达鉴定
从SD胎鼠大脑中成功分离、培养出NSCs。NSCs可以继续培养成为神经球,免疫荧光鉴定NSCs的Nestin表达呈阳性(绿色荧光),见图 5。

|
| A:未染色的神经球;B:DAPI免疫荧光染色阳性的神经球;C:Nestin免疫荧光染色阳性的神经球 图 5 免疫荧光染色鉴定NSCs的Nestin表达 |
2.8 ASP对衰老NSCs的ROS水平和MDA含量的影响
衰老模型组NSCs的ROS水平、MDA含量高于对照组;而ASP衰老模型组低于衰老模型组(P < 0.05,表 4)。
| 组别 | ROS荧光强度 | MDA/nmol·mg-1 |
| 对照组 | 129.74±3.89 | 95.10±6.35 |
| ASP组 | 94.10±2.47 | 82.70±5.34 |
| 衰老模型组 | 187.71±12.23a | 117.20±7.56a |
| ASP衰老模型组 | 161.50±9.45b | 97.40±5.41b |
| a:P < 0.05,与对照组比较;b:P < 0.05,与衰老模型组比较 | ||
2.9 ASP对衰老NSCs的p19、p21、p53 mRNA表达的影响
qRT-PCR检测结果显示:衰老组p19、p21、p53 mRNA表达较对照组明显增高;而ASP衰老模型组较衰老模型组明显降低(P < 0.05,图 6)。
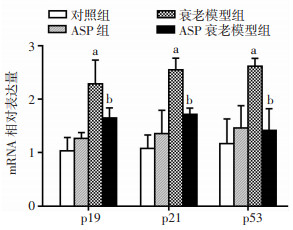
|
| a:P < 0.05,与对照组比较;b:P < 0.05,与衰老模型组比较 图 6 ASP对衰老NSCs的p19、p21、p53 mRNA表达的影响 |
3 讨论
课题组前期研究证明:当归多糖可以延缓脑衰老和NSCs的衰老[8]。本研究采用氧化致衰剂D-gal[6]构建衰老大鼠模型,探讨ASP拮抗D-gal对脑衰老和NSCs衰老的机制。SA-β-gal染色是鉴定细胞衰老的特异性生物学标志[9],本研究发现:D-gal致衰大鼠表现出明显的空间学习记忆能力降低,且SA-β-Gal染色显示衰老模型大鼠海马组织中衰老细胞数量明显增多,提示脑衰老模型成功建立。注射ASP干预致衰过程可以显著减轻D-gal对大鼠空间学习记忆能力的损害,并减少海马组织中衰老细胞数量。
D-gal致衰机制是氧自由基所致的氧化应激损伤,氧化应激损伤学说是细胞衰老的主流学说[10-11],MDA、SOD、GSH是评价细胞氧化应激损伤和衰老的重要指标。本研究发现:D-gal可以诱导海马组织产生大量的MDA,并减少SOD含量,消耗GSH存量,这些都是促进脑衰老发生的主要因素[12]。注射ASP干预衰老过程后,海马内MDA含量明显减少,同时SOD含量增加,GSH消耗量减少,提示ASP可通过提高海马的抗氧化损伤与清除自由基的能力拮抗D-gal对海马的致衰作用。
氧化应激和炎症反应紧密相关,也是诱发衰老的主流原因[13]。文献[14]报道:神经胶质细胞被激活是脑源性炎症性细胞因子的根源,过多炎症因子释放使神经元间相互作用发生障碍,进而导致空间学习记忆功能受损。本研究观察到:注射ASP干预衰老模型大鼠或正常大鼠,使海马内IL-1β、IL-6水平显著降低,提示ASP可能通过抑制慢性炎症过程,从而拮抗致衰剂对海马的损伤。
端粒损耗的速度是衡量“生物衰老”的重要方法,端粒酶在维持端粒长度中起作用[15-17]。本研究发现:衰老模型大鼠海马区端粒长度与端粒酶活性明显低于正常对照组,注射ASP后,大鼠海马区端粒长度缩短受到抑制,端粒酶活性降低得以阻滞,提示ASP可通过调控端粒系统达到延缓脑衰老的作用。
NSCs是神经系统特定区域内具有高度自我更新能力与多向分化潜能的未分化细胞,可增殖分化为神经元、少突胶质细胞和星形胶质细胞等[10]。NSCs对中枢神经系统的发育、维持和修复有着极为重要的作用。有研究结果表明:脑衰老与NSCs衰老有密切相关,干预NSCs衰老进程可以有效延缓脑衰老[18]。本研究从胎大鼠脑中成功的提取、纯化与鉴定了大鼠NSCs[19],并建立了NSCs体外衰老模型。研究结果显示:ASP体外干预D-gal致衰过程后,NSCs中的MDA含量与ROS水平显著降低,进一步验证了ASP抗氧化损伤作用。p19-p21-p53信号通路是控制细胞衰老的重要通路[20]。本研究发现:衰老NSCs的p19、p21、p53 mRNA表达明显增高,ASP干预致衰过程后,p19、p21、p53 mRNA表达明显下降。提示ASP通过提高抗氧化能力和降低衰老相关基因的表达拮抗了D-gal对NSCs的致衰作用,也许是APS拮抗D-gal致脑衰老机制之一。
综上所述,ASP可能通过调控细胞端粒长度和端粒酶活性,下调衰老相关基因表达,降低炎症因子表达,提高细胞抗氧化能力,进而拮抗D-gal对NSCs和海马细胞的致衰作用。
| [1] |
DE HAAN G, LAZARE S S. Aging of hematopoietic stem cells[J]. Blood, 2018, 131(5): 479-487. |
| [2] |
REN R T, OCAMPO A, LIU G H, et al. Regulation of stem cell aging by metabolism and epigenetics[J]. Cell Metab, 2017, 26(3): 460-474. |
| [3] |
ZHU J H, MU X Y, ZENG J, et al. Ginsenoside Rg1 prevents cognitive impairment and Hippocampus senescence in a rat model of D-galactose-induced aging[J]. PLoS ONE, 2014, 9(6): e101291. |
| [4] |
GLORIOSO C, SIBILLE E. Between destiny and disease: genetics and molecular pathways of human central nervous system aging[J]. Prog Neurobiol, 2011, 93(2): 165-181. |
| [5] |
OLARIU ANA, CLEAVER K M, CAMERON H A. Decreased neurogenesis in aged rats results from loss of granule cell precursors without lengthening of the cell cycle[J]. J Comp Neurol, 2007, 501(4): 659-667. |
| [6] |
邱竹, 姜蓉, 汪子铃, 等. 当归多糖对D-半乳糖致衰老小鼠睾丸的保护作用[J]. 解剖学报, 2019, 50(4): 506-511. QIU Z, JIANG R, WANG Z L, et al. Protective effects of Angelica sinensis polysacchairides on the testis of aging model mice induced by D-galactose[J]. Acta Anat Sin, 2019, 50(4): 506-511. |
| [7] |
MU X Y, ZHANG YY, LI J, et al. Angelica sinensis polysaccharide prevents hematopoietic stem cells senescence in D-galactose-induced aging mouse model[J]. Stem Cells Int, 2017, 2017: 3508907. |
| [8] |
姚辉. 当归多糖延缓D-半乳糖所致巢蛋白-绿色荧光蛋白小鼠脑衰老作用及其机制[J]. 解剖学报, 2016, 47(6): 731-737. YAO H. Anti-aging effects of Angelica sinensis polysaccharides on brain aging induced by D-galactose in nestin-green fluorescent protein transgenic mice and its mechanism[J]. Acta Anat Sin, 2016, 47(6): 731-737. |
| [9] |
TOMINAGA T, SHIMADA R, OKADA Y, et al. Senescence-associated-β-galactosidase staining following traumatic brain injury in the mouse cerebrum[J]. PLoS ONE, 2019, 14(3): e0213673. |
| [10] |
吴奇, 王顺和, 程霄, 等. 神经干细胞衰老与核因子E2相关因子2/抗氧化反应元件信号通路的关系[J]. 解剖学报, 2020, 51(6): 815-820. WU Q, WANG S H, CHENG X, et al. The relationship between neural stem cell senescence and nuclear factor E2-related factor/antioxidant response element signaling pathway[J]. Acta Anat Sin, 2020, 51(6): 815-820. |
| [11] |
汪子铃, 邱竹, 陈雄斌, 等. D-半乳糖诱导衰老小鼠睾丸结构与功能变化及其氧化应激相关机制[J]. 中国组织化学与细胞化学杂志, 2016, 25(6): 476-481, 500. WANG Z L, QIU Z, CHEN X B, et al. Change in the testis structure and function of D-gal induced aging mice and the oxidative stress-related mechanism[J]. Chin J Histochem Cytochem, 2016, 25(6): 476-481, 500. |
| [12] |
GENG Y Q, GUAN J T, XU X H, et al. Senescence-associated beta-galactosidase activity expression in aging hippocampal neurons[J]. Biochem Biophys Res Commun, 2010, 396(4): 866-869. |
| [13] |
JURK D, WANG C F, MIWA S, et al. Postmitotic neurons develop a p21-dependent senescence-like phenotype driven by a DNA damage response[J]. Aging Cell, 2012, 11(6): 996-1004. |
| [14] |
WANG Z, LI DD, LIANG Y Y, et al. Activation of astrocytes by advanced glycation end products: cytokines induction and nitric oxide release[J]. Acta Pharmacol Sin, 2002, 23(11): 974-980. |
| [15] |
NUSSEY D H, BAIRD D, BARRETT E, et al. Measuring telomere length and telomere dynamics in evolutionary biology and ecology[J]. Methods Ecol Evol, 2014, 5(4): 299-310. |
| [16] |
ZHU Y K, LIU X W, DING X L, et al. Telomere and its role in the aging pathways: telomere shortening, cell senescence and mitochondria dysfunction[J]. Biogerontology, 2019, 20(1): 1-16. |
| [17] |
MANNA S, MCCARTHY C, MCCARTHY F P. Placental ageing in adverse pregnancy outcomes: telomere shortening, cell senescence, and mitochondrial dysfunction[J]. Oxid Med Cell Longev, 2019, 2019: 3095383. |
| [18] |
HU W X, JING P W, WANG L, et al. The positive effects of Ginsenoside Rg1 upon the hematopoietic microenvironment in a D-Galactose-induced aged rat model[J]. BMC Complementary Altern Med, 2015, 15(1): 1-8. |
| [19] |
ENCINAS J M, MICHURINA T V, PEUNOVA N, et al. Division-coupled astrocytic differentiation and age-related depletion of neural stem cells in the adult hippocampus[J]. Cell Stem Cell, 2011, 8(5): 566-579. |
| [20] |
周鑫, 张磊, 扶世杰, 等. 少阳主骨方介导p19~(Arf)-p53-p21~(Cip1)信号通路调控食蟹猴关节软骨退变的机制[J]. 南方医科大学学报, 2018, 38(3): 346-352. ZHOU X, ZHANG L, FU S J. The mechanism of Shaoyang Zhugufang mediating the p19Arf-p53-p21Cip1 signaling pathwayto regulate the degeneration of cynomolgus monkey articular cartilage[J]. J South Med Univ, 2018, 38(3): 346-352. |




