2. 400042 重庆,陆军军医大学(第三军医大学)大坪医院妇产科
2. Department of Obstetrics and Gynecology, Daping Hospital, Army Medical University (Third Military Medical University), Chongqing, 400042, China
宫腔粘连(intrauterine adhesions,IUA)是引起不孕的主要原因。宫腔镜宫腔粘连电切术(transcervical resection of adhesions,TCRA)是目前治疗宫腔粘连的金标准,但术后再粘率高达62.5%[1],妊娠率仅22.5%~33.3%[2],由于宫腔粘连的病因和发病机制尚不明确,因此长期以来临床治疗以“手术治疗”为主,通过手术恢复宫腔形态,术后放置宫内节育器、球囊、羊膜移植或者透明质酸等辅助手段,降低粘连复发率,但重度宫腔粘连(severe intrauterine adhesions,sIUA)临床治疗效果仍不理想。新的治疗策略和治疗手段的发展有赖于对该病病因和发病机制的了解,但宫腔粘连的确切发病机制尚不清楚。
转化生长因子β1(transforming growth factor-β1,TGF-β1)/Smad4信号通路参与宫腔粘连的发病过程,核转录共抑制因子(ski-related novel protein N,SnoN)是TGF-β1/Smad信号通路的核转录共抑制因子及负性调节因子[3],但其在子宫内膜纤维化疾病——宫腔粘连领域的研究,目前国内外文献少见报道。本实验拟通过检测正常和重度宫腔粘连宫内膜组织中SnoN、TGF-β1、Smad4的表达情况,初步探讨SnoN、TGF-β1、Smad4蛋白之间的关系,及其与宫腔粘连疾病的关系。
1 资料与方法 1.1 研究对象及分组选取2019年1月至2020年10月在重庆市妇幼保健院和陆军军医大学(第三军医大学)大坪医院妇科门诊宫腔镜检查诊断为重度宫腔粘连的患者20例。入选标准:根据1988年美国生育协会(American Fertility Society, AFS)宫腔镜宫腔粘连评分标准[1],宫腔镜确诊为重度宫腔粘连(AFS评分9~12分)的初治者;年龄18~40岁,参与研究者近6个月内未使用过性激素类药物;手术实施为月经干净第3~7天。排除标准:既往有宫腔粘连分粘手术病史;合并心、肝、肾、脑、肺等重要脏器或血液系统疾病;乳腺肿瘤、乳腺增生等乳腺疾病;不明原因的阴道出血;有血栓性疾病史、家族史或血栓形成高危因素者。选取同期宫腔无病变的子宫纵隔妇女20例作为对照组。所有患者签署知情同意书。本研究经重庆市妇幼保健院伦理委员会批准[2021伦审(科)006号]。
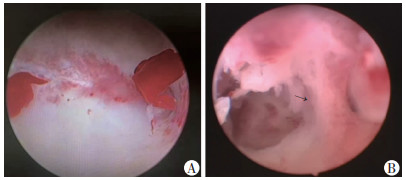
1.2 标本收集及处理所有研究对象在月经干净后3~7 d内在静脉麻醉下行宫腔镜手术,确诊为重度宫腔粘连者,先用宫腔镜微型钳钳取粘连组织内膜后,再行宫腔粘连分离术,恢复宫腔形态(对照组采集宫腔内正常子宫内膜组织),见图 1。以上获取的标本经用PBS漂洗去残留血液、黏液后,置于无菌纱布上沾干,部分标本置入液氮冻存,部分以10% 福尔马林固定。
|
| A:对照组(子宫纵隔患者的一侧宫腔形态); B: sIUA组↑:示粘连带 图 1 宫腔镜观察对照组与sIUA组子宫内膜组织 |
1.3 仪器及试剂
鼠抗人单克隆SnoN抗体购自美国Thermo Fisher公司,兔抗人多克隆TGF-β1抗体购自北京博奥森公司;兔抗人多克隆Smad4抗体购自美国Cell Signaling公司,宫腔镜及光学显微镜BX40购自日本奥林巴斯公司;CMIAS系列多功能真彩病理图像分析系统购自北京麦克奥迪图像技术有限公司;TRIzol®试剂及生物系统7300plus PCR仪器购自美国Thermo Fisher公司;分光光度计购自美国Hercules公司;ReverTra Ace®试剂盒及PCR Master Mix试剂盒购自中国上海丰田生物科技公司;PCR引物由上海基因科技公司设计;PBS、TBS、封闭蛋白干粉均购自博士德公司;辣根过氧化物酶标记的山羊抗兔IgG均购自北京中杉金桥生物公司;鼠兔通用型免疫组化试剂盒(Envision法,鼠/兔)购自丹麦DAKO公司。
1.4 方法 1.4.1 免疫组化检测部分组织标本经石蜡包埋,4 μm连续切片,用苏木精-伊红(HE)染色观察细胞学变化,用Envision免疫组化二步法检测SnoN、TGF-β1、Smad4蛋白(稀释比均为1∶100)表达情况。严格按照试剂盒说明书进行操作,阳性对照切片由试剂公司提供,染色结果阳性。阴性对照用PBS缓冲液代替一抗,染色结果阴性。光镜下观察到组织中出现棕黄色颗粒为阳性。CMIAS 2000型多功能真彩病理图像分析系统计算平均光密度(averageoptical density,AOD)和积分光密度(integral opticaldensity,IOD)。并使用以下公式计算:AOD=IOD/面积。
1.4.2 Western blot检测按常规方法从宫内膜组织中提取蛋白,SDS-PAGE步骤按常规操作,电泳(100 mV, 1.5 h)、封闭(5%的脱脂牛奶,1 h)。分别应用不同的抗体(SnoN稀释比1∶1 000;TGF-β1稀释比1∶100; Smad4稀释比1∶1 000)孵育,然后再与过氧化物酶标记的二抗山羊抗兔IgG-HRP(稀释比1∶1 000)孵育,应用化学增强发光方法显示条带,使用凝胶成像分析系统进行扫膜,并分析出实验结果,计算蛋白的相对表达量。
1.4.3 RT-qPCR检测使用TRIzol®试剂从子宫内膜组织中提取总RNA。用琼脂糖凝胶电泳评估RNA的质量和数量,并用分光光度计确定光密度D(260)/D(280)比值。所有RNA制剂的D(260)/D(280)比值为1.83~2.03。使用ReverTra Ace®试剂盒合成该cDNA。然后,使用实时PCR Master Mix试剂盒和应用生物系统7300plus PCR仪器,通过SYBR-Green反应扩增mRNA。采用2-△△Ct方法计算相对基因表达量。设计并合成PCR引物(表 1)。
| 基因 | 序列(5′→3′) | 产物长度/bp |
| TGF-β1 | 上游CCGCGTGCTAATGGTGGAAAC 下游GCCGGTTGCTGAGGTATCGC |
230 |
| Smad4 | 上游GGGGCAGCCATAGTGAAGGAC 下游CGGCATAGGCGGGTGGTG |
197 |
| SnoN | 上游TGCCCCAAATGTGTCACTTACTTC 下游GCGGAGATGAAGCGGCAGC |
320 |
| β-actin | 上游ACCCCGTGCTGCTGACCGAG 下游TCCCGGCCAGCCAGGTCCA |
250 |
1.5 统计学分析
采用GraphPad Prism 8.0统计软件进行分析。计量资料以
两组患者的年龄、体质量指数比较差异无统计学意义,但两组患者的妊娠次数、分娩次数、妊娠相关的宫腔手术次数、术前子宫内膜厚度、AFS评分比较差异有统计学意义(P < 0.05,表 2)。再次证明妊娠次数及妊娠相关的宫腔手术次数是宫腔粘连发病的主要因素。
| 临床参数 | 对照组(n=20) | sIUA组(n=20) | P值 |
年龄(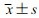 )/岁 )/岁 |
30.40±4.95 | 32.25±2.65 | >0.05 a |
体质量指数(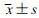 )/kg·m -2 )/kg·m -2 |
22.90 ±2.36 | 22.57±3.14 | >0.05 a |
| 妊娠次数[例(%)] | <0.05 b | ||
| 0 | 9(45.0) | 3(15.0) | |
| 1 | 4(20.0) | 3(15.0) | |
| 2 | 4(20.0) | 6(30.0) | |
| ≥3 | 3(15.5) | 8(40.0) | |
| 分娩次数[例(%)] | <0.05 b | ||
| 0 | 15(75.5) | 10(50.5) | |
| 1 | 5(25.0) | 7(35.0) | |
| ≥2 | 0(0.0) | 3(7.5) | |
| 与妊娠有关的宫腔手术[例(%)] | <0.05 b | ||
| 0 | 9(45.0) | 0(0.0) | |
| 1 | 6(30.0) | 4(20.0) | |
| 2 | 3(15.0) | 6(30.0) | |
| ≥3 | 2(10.0) | 10(50.0) | |
| 子宫内膜厚度[均数(范围)]/mm | 0.50(0.40~0.60) | 0.39(0.29~0.49) | <0.01 c |
| AFS评分[均数(范围)] | 0 | 10.0(9.0~12.0) | - |
| a: t检验; b: χ2检验; c: Mann-Whitney U检验 | |||
2.2 SnoN在宫内膜组织中的定位和表达
SnoN蛋白在对照组和sIUA组中均有阳性表达(棕黄色颗粒为阳性表达),主要表达在子宫内膜腺上皮细胞,两者在各组中的表达定位情况见图 2A。免疫组化分析结果显示,sIUA组SnoN蛋白表达较对照组显著下降(P < 0.05, 图 2B)。Western blot和RT-qPCR分析结果均显示:sIUA组SnoN表达较对照组亦显著下降(P < 0.01, 图 2C~E)。重度宫腔粘连子宫内膜组织中SnoN表达下调,提示SnoN可能参与宫腔粘连发病。

|
| A:免疫组化检测SnoN在子宫内膜的表达(×200) ↑:示阳性表达;B:sIUA组中SnoN蛋白的表达水平较对照组降低(AOD);C、D:Western blot检测SnoN蛋白在子宫内膜中的表达及半定量分析;E:RT-qPCR检测SnoN基因在子宫内膜的表达a:P < 0.05,b:P < 0.01 图 2 SnoN在对照组及sIUA组患者子宫内膜的定位和表达 |
2.3 TGF-β1、Smad4在宫内膜组织中的定位和表达
TGF-β1、Smad4蛋白在对照组和sIUA组中均有阳性表达(棕黄色颗粒为阳性表达),主要在子宫内膜腺上皮细胞和间质细胞的细胞质中表达(图 3A)。免疫组化检测显示,sIUA组TGF-β1、Smad4表达明显增加(P < 0.05,图 3B)。Western blot和RT-qPCR分析结果均显示:sIUA组TGF-β1、Smad4蛋白表达明显增加(P < 0.01,图 3C~H)。TGF-β1是宫腔粘连发病的主要促纤维化因子,而Smad4是TGF-β1信号通路的下游分子,提示宫腔粘连发病与TGF-β1/Smad4信号通路有关。

|
| A:免疫组化检测TGF-β1、Smad4在子宫内膜的表达(×200) ↑:示阳性表达;B:各组TGF-β1、Smad4蛋白的表达;C、D、F、G:Western blot检测TGF-β1、Smad4在子宫内膜的表达及半定量分析;E、H:RT-qPCR检测TGF-β1、Smad4在子宫内膜的表达a:P < 0.05,b:P < 0.01 图 3 TGF-β1、Smad4在对照组及sIUA组患者子宫内膜的定位和表达 |
2.4 SnoN、TGF-β1、Smad4蛋白表达的相关性
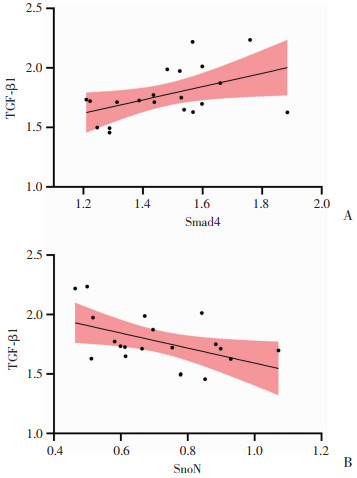
应用Spearman相关性分析对照组和sIUA组中SnoN、TGF-β1、Smad4表达的相关性,结果显示:在sIUA组患者宫内膜组织中,TGF-β1与Smad4的蛋白表达水平呈正相关(r=0.468 9, P < 0.05),TGF-β1与SnoN的蛋白水平呈负相关(r=-0.483 5, P < 0.05,图 4),而SnoN、TGF-β1、Smad4的基因表达水平无相关关系。在对照组患者宫内膜组织中SnoN、TGF-β1、Smad4的基因及蛋白表达水平差异均无统计学意义。
|
| A:TGF-β1与Smad4的相关性;B:TGF-β1与SnoN的相关性 图 4 TGF-β1与SnoN、Smad4蛋白表达的相关性分析 |
3 讨论
宫腔粘连是指创伤、感染、炎症等因素致子宫内膜损伤,引起纤维化增生过度,导致宫壁相互粘连的一种纤维化性疾病,严重影响女性生殖生理健康,我国的发病率高达25%~30%[4-5]。宫腔粘连的发病原因主要为人工流产、清宫术等宫腔操作手术。本研究也证明,宫腔粘连的发病与孕产次数、妊娠相关的刮宫术密切相关。近年来,随着我国二胎政策的开放,因不良妊娠行宫腔手术的患者明显增多,使宫腔粘连的发病率呈上升趋势。研究表明宫腔粘连的发生可能与细胞因子、雌激素、微小RNA等作用有关,但其发病机制目前仍不明确[5]。
TGF-β1被认为是最有效的促纤维化途径之一,Smad(1~10)是TGF-β1信号下游信号分子,TGF-β1/Smad信号传导通路中,TGF-β与TGF- β受体Ⅰ、Ⅱ结合形成聚体复合物,激活Smad2/3,磷酸化后的Smad2/3蛋白与Smad4结合转移至细胞核参与调节靶基因[6-7]。TGF-β1/Smad信号通路是调控纤维化疾病的主要经典信号通路之一,通过诱导细胞分化、迁移、侵袭或增生性改变参与心、肾、肺、肝等纤维化疾病的发病,TGF-β1、Smad在心肌梗死、肾、肺、肝硬化组织中的表达明显上调[8]。近年来,研究表明TGF-β1/Smad信号通路参与子宫内膜纤维化过程[9],TGF-β1、Smad4在重度宫腔粘连宫内膜组织表达高于正常宫内膜[10-11]。
SnoN蛋白是原癌蛋白Ski家族成员之一,SnoN是TGF-β1/Smad通路的核转录共抑制因子及负性调节因子,通过与Smad蛋白复合体相互作用调节TGF-β1靶基因的转录[3]。研究表明[12-16]:SnoN可负向调控TGF-β1/Smad参与器官组织纤维化过程,SnoN过表达的模型可抑制组织细胞纤维化,而SnoN表达减少有促进组织纤维化功能,在肺纤维化中,核转录共抑制因子SnoN可特异地与TGF-β1/Smad通路中的Smad2、Smad3以及Smad4 C端MAD同源结构域结合,形成复合物,从而阻止Smad与TGF-β1反应启动子结合,发挥负性调控作用,阻止肺纤维化的发生、发展。LIU等[17]发现上调SnoN可抑制TGF-β1/Smad信号通路,抑制高糖诱导的肾小管纤维化过程,SnoN上调负向调控TGF-β1/Smad信号通路,可逆转肾脏组织的EMT过程,减轻纤维化,但其在子宫内膜纤维化研究方面国内外文献少见报道。本研究结果提示:SnoN蛋白及基因表达水平在正常宫内膜组织中较高,而在重度宫腔粘连组织中明显下调,SnoN与TGF-β1的蛋白表达水平呈负相关,而TGF-β1与Smad4的蛋白表达水平呈正相关。提示:SnoN可能通过参与调控TGF-β1信号通路参与宫腔粘连的发病过程。
本研究不足之处在于仅探讨SnoN、TGF-β1、Smad4的表达及关系,缺乏细胞及动物实验干预深入机制的研究。今后可进一步利用基因敲除和过表达等手段研究宫腔粘连中SnoN表达的变化,明确SnoN、TGF-β1、Smad4之间的相互作用,以及对宫腔粘连发病的影响。此外,这项研究为小样本实验,且子宫内膜组织量较少,尤其是重度宫腔粘连宫内膜组织,RT-qPCR结果差异较大,故还需要大样本的实验进一步验证。
综上,SnoN可能通过参与调控TGF-β1信号通路参与宫腔粘连的发病过程,SnoN表达下调可能是宫腔粘连发病的关键。然而,SnoN与宫腔粘连发病的具体分子机制还需要实验进一步研究,对这些机制的深入理解有助于阐明宫腔粘连的发病机制,为宫腔粘连的治疗提供新思路。
| [1] |
The American Fertility Society. Classifications of adnexal adhesions, distal tubal occlusion, tubal occlusion secondary to tubal ligation, tubal pregnancies, müllerian anomalies and intrauterine adhesions[J]. Fertil Steril, 1988, 49(6): 944-955. DOI:10.1016/s0015-0282(16)59942-7 |
| [2] |
ZHANG L, XU W H, FU X H, et al. Therapeutic role of granulocyte colony-stimulating factor (G-CSF) for infertile women under in vitro fertilization and embryo transfer (IVF-ET) treatment: a meta-analysis[J]. Arch Gynecol Obstet, 2018, 298(5): 861-871. DOI:10.1007/s00404-018-4892-4 |
| [3] |
PAN D, ZHU Q, LUO K. SnoN functions as a tumour suppressor by inducing premature senescence[J]. EMBO J, 2009, 28(22): 3500-3513. DOI:10.1038/emboj.2009.250 |
| [4] |
罗丽兰. 不孕与不育[M]. 北京: 人民卫生出版社, 2009: 262-263. LUO L L. Infertility and infertility[M]. Beijing: People's Medical Publishing House, 2009: 262-263. |
| [5] |
陈坤菊, 史小荣, 代晓琴. 宫腔粘连的预防方法研究进展[J]. 国际妇产科学杂志, 2017, 44(5): 576-580. CHEN K J, SHI X R, DAI X Q. Research progress in the prevention method of intrauterine adhesion[J]. J Int Obstet Gynecol, 2017, 44(5): 576-580. DOI:10.3969/j.issn.1674-1870.2017.05.022 |
| [6] |
HILL C S. Transcriptional control by the SMADs[J]. Cold Spring Harb Perspect Biol, 2016, 8(10): a022079. DOI:10.1101/cshperspect.a022079 |
| [7] |
WALLDÉN K, NYMAN T, HÄLLBERG B M. SnoN stabilizes the SMAD3/SMAD4 protein complex[J]. Sci Rep, 2017, 7: 46370. DOI:10.1038/srep46370 |
| [8] |
WALTON K L, JOHNSON K E, HARRISON C A. Targeting TGF-β mediated SMAD signaling for the prevention of fibrosis[J]. Front Pharmacol, 2017, 8: 461. DOI:10.3389/fphar.2017.00461 |
| [9] |
LI J X, CEN B H, CHEN S P, et al. MicroRNA-29b inhibits TGF-β1-induced fibrosis via regulation of the TGF-β1/Smad pathway in primary human endometrial stromal cells[J]. Mol Med Rep, 2016, 13(5): 4229-4237. DOI:10.3892/mmr.2016.5062 |
| [10] |
李灿宇, 党秋红, 刘欢欢, 等. TGF-β1和smad4在中重度宫腔粘连组织中的表达及临床意义[J]. 中国妇产科临床杂志, 2018, 19(4): 347-349. LI C Y, DANG Q H, LIU H H, et al. Expressions of TGF-β1, Smad4 in endometrium of patients with moderate and severe uterine adhesion[J]. Chin J Clin Obstet Gynecol, 2018, 19(4): 347-349. DOI:10.13390/j.issn.1672-1861.2018.04.016 |
| [11] |
付青, 卢秀琴, 王延明, 等. 宫腔粘连分子机制的研究进展[J]. 临床与实验病理学杂志, 2019, 35(9): 1079-1081. FU Q, LU X Q, WANG Y M, et al. Research progress on molecular mechanism of uterine adhesion[J]. Chin J Clin Exp Pathol, 2019, 35(9): 1079-1081. DOI:10.13315/j.cnki.cjcep.2019.09.015 |
| [12] |
LIU L R, SHI M J, WANG Y Y, et al. SnoN upregulation ameliorates renal fibrosis in diabetic nephropathy[J]. PLoS ONE, 2017, 12(3): e0174471. DOI:10.1371/journal.pone.0174471 |
| [13] |
ZEGLINSKI M R, HNATOWICH M, JASSAL D S, et al. SnoN as a novel negative regulator of TGF-β/Smad signaling: a target for tailoring organ fibrosis[J]. Am J Physiol Heart Circ Physiol, 2015, 308(2): H75-H82. DOI:10.1152/ajpheart.00453.2014 |
| [14] |
TECALCO-CRUZ A C, RÍOS-L®PEZ D G, VÁZQUEZ-VICTORIO G, et al. Transcriptional cofactors Ski and SnoN are major regulators of the TGF-β/Smad signaling pathway in health and disease[J]. Signal Transduct Target Ther, 2018, 3: 15. DOI:10.1038/s41392-018-0015-8 |
| [15] |
AI K, ZHU X, KANG Y, et al. miR-130a-3p inhibition protects against renal fibrosis in vitro via the TGF-β1/Smad pathway by targeting SnoN[J]. Exp Mol Pathol, 2020, 112: 104358. DOI:10.1016/j.yexmp.2019.104358 |
| [16] |
张秀莉, 李万成. SnoN在肺纤维化TGF-β1/smad通路中的作用[J]. 生命的化学, 2018, 38(2): 236-240. ZHANG X L, LI W C. The effect of SnoN in pulmonary fibrosis TGF-β1/Smad pathway[J]. Chem Life, 2018, 38(2): 236-240. DOI:10.13488/j.smhx.20180209 |
| [17] |
LIU L, WANG Y, YAN R, et al. Oxymatrine inhibits renal tubular EMT induced by high glucose via upregulation of SnoN and inhibition of TGF-β1/smad signaling pathway[J]. PLoS ONE, 2016, 11(3): e0151986. DOI:10.1371/journal.pone.0151986 |




