2. 563000 贵州 遵义, 遵义市第一人民医院(遵义医科大学第三附属医院): 肿瘤科
2. Department of Oncology, Zunyi First People's Hospital (Third Affiliated Hospital of Zunyi Medical University), Zunyi, Guizhou Province, 563000, China
结直肠癌(colorectal cancer, CRC)发病率、死亡率在全球恶性肿瘤排行榜中分别居第三位和第四位[1]。手术、放疗或辅助化疗是临床常用的CRC治疗手段,然而化疗药物的长期使用往往产生较大的毒副作用。此外,化疗耐药可诱发CRC复发和转移,导致治疗失败[2]。香叶木素是一种存在于豆类、橄榄叶和柑橘类植物中的天然类黄酮,其对乳腺癌、鼻咽癌多种肿瘤细胞具有细胞毒性作用[3-4]。研究表明香叶木素可诱导CRC细胞凋亡,抑制裸鼠移植瘤形成[5-6]。但香叶木素对CRC细胞迁移的影响及其对抗CRC的确切机制尚不清楚。非编码RNA(ncRNA)是蛋白编码能力缺失的功能性RNA,主要包括长链ncRNA(lncRNA)和微小RNA(miRNA)。多项研究表明lncRNA、miRNA的表达失调与肿瘤细胞的增殖失控、凋亡抵抗和异常转移有关,是癌症治疗的潜在靶点[7]。有报道指出lncRNA STX17-AS1在CRC组织中表达上调,STX17-AS1高表达可增加CRC细胞的增殖和转移能力,具有致癌作用[8]。靶基因预测到miR-383-5p是STX17-AS1的潜在靶点。已有研究证实miR-383-5p在CRC患者血清中低表达,上调miR-383-5p可提高CRC患者新辅助化疗的敏感性[9]。然而,STX17-AS1是否靶向miR-383-5p调控CRC细胞增殖、凋亡和迁移并不清楚。本研究分析了香叶木素对CRC细胞增殖、凋亡、迁移以及STX17-AS1、miR-383-5p表达的影响,并以STX17-AS1/miR-383-5p为切入点探讨香叶木素抗CRC的潜在分子机制。
1 材料与方法 1.1 材料 1.1.1 组织来源本研究收集2019年1-12月在本院确诊且接受手术治疗的29例CRC患者(男性19例,女性10例,年龄36~68岁,中位年龄53岁)的癌组织和癌旁组织。患者术前均未接受化疗或放疗,患者或其家属均签订了书面知情同意书,本研究的开展获得本院医学伦理委员会的批准[伦理(2018)-16号]。组织样本切除后立即置于液氮中冷冻,后保存在-80 ℃冰箱直到用于实验。
1.1.2 细胞和试剂人结直肠癌细胞HCT116购自中国科学院上海细胞库;香叶木素(纯度为95.7%,批号111788-200801)购于中国食品药品检定研究院;Lipofectamine2000、TRIzol试剂购自美国Invitrogen公司;STX17-AS1的小干扰RNA(si-STX17-AS1)、小干扰RNA阴性对照(si-NC)、miR-383-5p模拟物(mimics)、miRNA模拟物阴性对照(miR-NC)、miR-383-5p抑制物(anti-miR-383-5p)、STX17-AS1过表达质粒(pcDNA-STX17-AS1)、荧光素酶报告载体购自上海吉玛制药公司;细胞计数试剂盒(CCK-8)购自上海碧云天生物公司;膜联蛋白V-异硫氰酸荧光素(AnnexinV- FITC)/碘化丙啶(PI)凋亡检测试剂盒购于北京百奥莱博生物公司;TaqMan miRNA检测试剂盒购于美国Thermo Fisher公司;SYBR Green qPCR Master Mix试剂盒、逆转录试剂盒购于美国MCE公司;兔源Cleaved Caspase-3多克隆抗体(ab2302)、兔源GAPDH多克隆抗体(ab9485)、山羊抗兔IgG二抗(ab128915)、双荧光素酶报告基因检测试剂盒购于美国Abcam公司。
1.2 方法 1.2.1 细胞培养、转染和分组HCT116细胞采用DMEM培养基(补充10%胎牛血清、1%青链霉素)在含5% CO2、37 ℃、饱和湿度的培养箱中培养,每周换液2~3次,0.25%胰蛋白酶消化80%融合细胞,1∶3比例传代。将第5代对数期HCT116细胞以2×105个/孔密度接种6孔板,细胞50%融合时按照Lipofectamine 2000使用说明分别转染si-STX17-AS1、si-NC、miR-383-5p mimics、miR-NC、anti-miR-383-5p、pcDNA-STX17-AS1至HCT116细胞,转染48 h后,RT-qPCR检测转染效果。
实验分组:正常培养的HCT116细胞记为对照组;用含10、20、40 μmol/L香叶木素的培养液孵育HCT116细胞24 h[3],分别记为香叶木素10 μmol/L组、20 μmol/L组、40 μmol/L组;转染si-STX17-AS1、转染si-NC、转染miR-383-5p mimics、转染miR-NC的HCT116细胞依次记为si-STX17-AS1组、si-NC组、miR-383-5p组、miR-NC组;用含40 μmol/L香叶木素的培养液孵育转染pcDNA-STX17-AS1、转染anti-miR-383-5p的HCT116细胞24 h,依次记为香叶木素+pcDNA-STX17-AS1组、香叶木素+anti-miR-383-5p组。
1.2.2 CCK-8法检测细胞活力将5×103个转染或未转染HCT116细胞接种于96孔板,细胞贴壁后按照实验分组加入对应浓度的香叶木素孵育细胞,24 h后,更换为新鲜培养液,每孔加入10 μL CCK-8溶液,继续孵育2.5 h。酶标仪分析各孔波长450 nm处光密度值[D(450)]表示细胞活力。
1.2.3 集落形成实验检测细胞克隆能力将各组HCT116细胞按照3×102个/孔接种到6孔板,轻轻旋动平板使细胞分散均匀。放入37 ℃、含5% CO2培养箱孵育2周。每3天更换新鲜培养基。当出现肉眼可见细胞集落时终止培养。PBS清洗细胞后,室温下用4%多聚甲醛固定细胞集落15 min,姬姆萨染色20 min。显微镜下统计大于50个细胞的集落数表示细胞克隆能力。
1.2.4 划痕愈合实验检测细胞迁移将各组HCT116细胞按照1×104个/孔接种到6孔板,培养24 h后细胞的融合度达到80%左右。用100 μL移液枪头在细胞表面划一直线。用培养基洗涤2次,以去除细胞碎片。显微镜下测量初始划痕距离。放入37 ℃、含5% CO2培养箱孵育48 h,显微镜下测量48 h划痕距离。
划痕愈合率=(划痕距离初始-划痕距离48 h)/划痕距离初始×100%
1.2.5 流式细胞术检测细胞凋亡用预冷的PBS洗涤各组HCT116细胞2次,悬于1×结合缓冲液中使细胞数达到1×106个/mL。将5 μL的Annexin V-FITC、5 μL的PI依次加入到100 μL细胞悬液重悬,室温避光孵育15 min,补加400 μL的1×结合缓冲液混匀。1 h内上流式细胞仪检测细胞凋亡情况。
1.2.6 蛋白质印迹法检测Cleaved-Caspase3蛋白表达RIPA裂解液提取各组HCT116细胞的总蛋白,用BCA法测定蛋白浓度。取40 μg变性蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),并转移分离的蛋白至PVDF膜上。然后用5%脱脂牛奶在4 ℃下孵育PVDF膜过夜,然后将膜与一抗(Cleaved-Caspase3抗体1∶500稀释,内参GAPDH抗体1∶1 000稀释)室温下孵育2 h,再与辣根过氧化物酶结合的二抗(1∶10 000稀释)在室温下孵育2 h。化学发光法进行条带显色,凝胶成像系统捕获图像,Image J软件对目的蛋白灰度值进行量化分析。
1.2.7 实时定量PCR(RT-qPCR)检测STX17-AS1、miR-383-5p表达采用TRIzol试剂从临床组织样本、各组HCT116细胞中提取总RNA,利用逆转录试剂盒将1 μg总RNA反转录为cDNA。利用SYBR Green qPCR Master Mix试剂盒检测STX17-AS1表达水平。利用TaqMan miRNA检测试剂盒检测STX17-AS1表达水平。GAPDH、U6分别作为STX17-AS1、miR-383-5p的内参对照,2-ΔΔCt法分析STX17-AS1、miR-383-5p的相对水平。STX17-AS1上游引物5′-TGATAAGCTGTT-TAAACCAGAACCG-3′,下游引物5′-GGCAACATTT-CAGTTCCAGTG-3′;GAPDH上游引物5′-TGCACC-ACCAACTGCTTAGC-3′,下游引物5′-GGCATGGAC-TGTGGTCATGAG-3′;miR-383-5p上游引物5′-GGGAG-ATCAGAAGGTGATTGTGGCT-3′,下游引物5′-CAGTG-CGTGTCGTGGAGT-3′;U6上游引物5′-CTCGCTTC-GGCAGCACA-3′,下游引物5′-AACGCTTCACGAA-TTTGCGT-3′。
1.2.8 双荧光素酶报告实验根据Starbase数据库预测的STX17-AS1与miR-383-5p的结合位点,合成含有miR-383-5p结合位点序列的野生型(wt)或突变型(mut)STX17-AS1序列,上述序列分别插入荧光素酶基本载体pGL3得到荧光素酶报告质粒wt-STX17-AS1、mut-STX17-AS1。然后将荧光素酶报告质粒分别与miR-383-5p mimics、miR-NC共转染HCT116细胞。转染48 h后,采用双荧光素酶报告基因检测系统分析各组HCT116细胞的相对荧光素酶活性。
1.3 统计学方法采用SPSS 18.0进行统计分析,以3次独立重复实验的
与对照组比较,香叶木素10 μmol/L组、20 μmol/L组、40 μmol/L组HCT116细胞活力、集落形成数、划痕愈合率、STX17-AS1的相对水平均显著降低(P < 0.05),凋亡率、Cleaved-Caspase3蛋白表达、miR-383-5p的相对水平显著升高(P < 0.05)。见图 1和表 1。

|
| a: P < 0.05, 与对照组比较;b: P < 0.05,与香叶木素10 μmol/L组比较;c: P < 0.05,与香叶木素20 μmol/L组比较 A:香叶木素抑制结直肠癌细胞中STX17-AS1的表达;B:香叶木素促进结直肠癌细胞中miR-383-5p的表达;C:香叶木素促进结直肠癌细胞中Cleaved-Caspase3蛋白的表达;D:香叶木素诱导结直肠癌细胞凋亡 图 1 香叶木素对细胞凋亡的影响 |

| 组别 | STX17-AS1 | miR-383-5p | D(450)值 | 集落形成数(个) | 划痕愈合率(%) | 凋亡率(%) | Cleaved-Caspase3 |
| 对照组 | 1.00±0.00 | 1.00±0.00 | 0.87±0.08 | 127.56±4.32 | 64.23±1.02 | 7.68±0.57 | 0.18±0.01 |
| 香叶木素10 μmol/L组 | 0.73±0.05 a | 1.88±0.12 a | 0.63±0.03 a | 102.44±2.71 a | 50.65±0.71 a | 11.87±0.60 a | 0.40±0.03 a |
| 香叶木素20 μmol/L组 | 0.45±0.03 ab | 2.67±0.15 ab | 0.47±0.03 ab | 82.44±1.42 ab | 39.89±0.65 ab | 17.52±0.67 ab | 0.63±0.03 ab |
| 香叶木素40 μmol/L组 | 0.14±0.02 abc | 4.21±0.21 abc | 0.31±0.02 abc | 61.56±1.34 abc | 29.36±0.56 abc | 22.67±0.83 abc | 0.83±0.05 abc |
| F值 | 1292.842 | 825.630 | 238.884 | 958.799 | 3515.774 | 846.272 | 648.546 |
| P值 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
| a:P < 0.05,与对照组比较;b:P < 0.05,与香叶木素10 μmol/L组比较;c:P < 0.05,与香叶木素20 μmol/L组比较 | |||||||
2.2 STX17-AS1和miR-383-5p在结直肠癌中的表达
结直肠癌组织中STX17-AS1的相对水平较癌旁组织显著升高(P < 0.05),miR-383-5p的相对水平较癌旁组织显著降低(P < 0.05),见图 2A和2B。结直肠癌组织中STX17-AS1、miR-383-5p表达水平呈负相关关系,见图 2C。

|
| A:STX17-AS1在结直肠癌组织中高表达;B:miR-383-5p在结直肠癌组织中低表达;C:STX17-AS1和miR-383-5p负相关;a:P < 0.05 图 2 STX17-AS1和miR-383-5p表达的检测(n=29) |
2.3 STX17-AS1和miR-383-5p靶向关系的验证
Starbase预测到miR-383-5p与STX17-AS1序列间存在特异性结合位点,见图 3A。荧光素酶活性检测结果见图 3B,miR-383-5p mimics与wt-STX17-AS1共转染组的细胞相对荧光素酶活性显著低于miR-NC与wt-STX17-AS1共转染组(P < 0.05);miR-383-5p mimics与mut-STX17-AS1共转染组的细胞相对荧光素酶活性同miR-NC与mut-STX17-AS1共转染组相比差异无统计学意义。
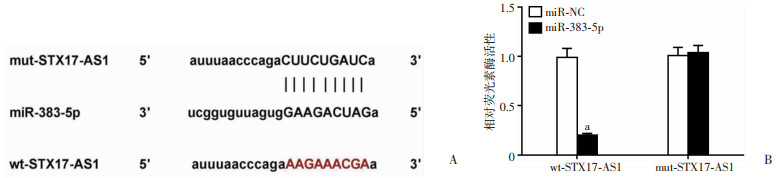
|
| A:STX17-AS1和miR-383-5p互补序列;B:荧光素酶活性检测a:P < 0.05,与miR-NC比较 图 3 STX17-AS1和miR-383-5p靶向关系的验证 |
2.4 抑制STX17-AS1对结直肠癌细胞增殖、迁移和凋亡的影响
与si-NC组比较,si-STX17-AS1组HCT116细胞STX17-AS1的相对水平、细胞活力、集落形成数、划痕愈合率均显著降低(P < 0.05),凋亡率、Cleaved-Caspase3蛋白表达、miR-383-5p的相对水平显著升高(P < 0.05),见图 4和表 2。

|
| 1:si-NC组;2:si-STX17-AS1组;a:P < 0.05,与si-NC组比较 A:抑制STX17-AS1处理后STX17-AS表达量降低;B:抑制STX17-AS1处理后miR-383-5p表达量升高;C:抑制STX17-AS1可促进Cleaved-Caspase3蛋白的表达;D:抑制STX17-AS1可诱导凋亡 图 4 抑制STX17-AS1对细胞凋亡的影响 |
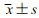
| 组别 | D(450)值 | 集落形成数(个) | 划痕愈合率(%) | 凋亡率(%) | Cleaved-Caspase3 |
| si-NC组 | 0.88±0.07 | 126.89±6.03 | 64.38±1.32 | 7.91±0.58 | 0.17±0.01 |
| si-STX17-AS1组 | 0.24±0.02 a | 53.22±1.75 a | 24.55±0.86 a | 24.29±0.83 a | 0.96±0.05 a |
| a:P < 0.05,与si-NC组比较 | |||||
2.5 过表达miR-383-5p对结直肠癌细胞增殖、迁移和凋亡的影响
与miR-NC组比较,miR-383-5p组HCT116细胞miR-383-5p的相对水平、凋亡率、Cleaved-Caspase3蛋白表达显著升高(P < 0.05),细胞活力、集落形成数、划痕愈合率均显著降低(P < 0.05),见图 5和表 3。

|
| 1:miR-NC组;2:miR-383-5p组 A:过表达miR-383-5p处理后miR-383-5p表达量的检测a:P < 0.05,与miR-NC组比较;B:过表达miR-383-5p可促进Cleaved-Caspase3蛋白的表达;C:过表达miR-383-5p可诱导凋亡 图 5 miR-383-5p对细胞凋亡的影响 |
| 组别 | D(450)值 | 集落形成数(个) | 划痕愈合率(%) | 凋亡率(%) | Cleaved-Caspase3 |
| miR-NC组 | 0.90±0.05 | 127.89±4.41 | 64.18±1.05 | 7.81±0.56 | 0.18±0.02 |
| miR-383-5p组 | 0.35±0.01 a | 57.56±2.01 a | 26.80±0.65 a | 23.61±0.73 a | 0.87±0.05 a |
| a:P < 0.05,与miR-NC组比较 | |||||
2.6 过表达STX17-AS1或抑制miR-383-5p逆转香叶木素对结直肠癌细胞增殖、迁移和凋亡的影响
转染pcDNA-STX17-AS1后HCT116细胞中STX17-AS1的相对水平较转染pcDNA显著升高(P < 0.05);转染anti-miR-383-5p后HCT116细胞中miR-383-5p的相对水平较转染anti-miR-NC显著降低(P < 0.05)。与对照组比较,香叶木素组HCT116细胞活力、集落形成数、划痕愈合率显著降低(P < 0.05),凋亡率、Cleaved-Caspase3蛋白表达显著升高(P < 0.05);与香叶木素组比较,香叶木素+pcDNA-STX17-AS1组、香叶木素+anti-miR-383-5p组HCT116细胞活力、集落形成数、划痕愈合率显著升高(P < 0.05),凋亡率、Cleaved-Caspase3蛋白表达显著降低(P < 0.05),见图 6和表 4。
|
| 1:对照组;2:香叶木素组;3:香叶木素+pcDNA-STX17-AS1组;4:香叶木素+anti-miR-383-5p组 A:过表达STX17-AS1或抑制miR-383-5p可减弱香叶木素对细胞凋亡的诱导作用;B:过表达STX17-AS1处理后STX17-AS1表达量的检测a: P < 0.05,与pcDNA组比较;C:抑制miR-383-5p处理后miR-383-5p表达量的检测b: P < 0.05,与anti-miR-NC组比较;D:过表达STX17-AS1或抑制miR-383-5p可减弱香叶木素对细胞中Cleaved-Caspase3蛋白的促进作用 图 6 STX17-AS1或抑制miR-383-5p对香叶木素处理的细胞凋亡的影响 |
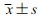
| 组别 | D(450)值 | 集落形成数(个) | 划痕愈合率(%) | 凋亡率(%) | Cleaved-Caspase3 |
| 对照组 | 0.87±0.07 | 127.22±4.10 | 64.41±1.00 | 7.84±0.50 | 0.18±0.01 |
| 香叶木素组 | 0.31±0.03 a | 62.44±1.83 a | 29.27±0.67 a | 22.55±0.98 a | 0.81±0.05 a |
| 香叶木素+pcDNA-STX17-AS1组 | 0.75±0.05 b | 114.44±2.75 b | 59.26±0.76 b | 8.71±0.26 b | 0.24±0.02 b |
| 香叶木素+anti-miR-383-5p组 | 0.65±0.04 b | 103.33±3.16 b | 54.76±1.33 b | 10.61±0.56 b | 0.27±0.02 b |
| F值 | 210.788 | 750.253 | 2 311.104 | 1 060.316 | 905.294 |
| P值 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
| a:P < 0.05,与对照组比较;b:P < 0.05,与香叶木素组比较 | |||||
3 讨论
香叶木素通过调控细胞存活、周期进展、凋亡、血管生成等多种细胞过程在多种恶性肿瘤中表现出抗癌活性[10]。CHOI等[11]指出香叶木素可有效抑制黑色素瘤细胞、人脐静脉内皮细胞增殖和迁移,抑制肿瘤进展过程中肿瘤血管的生长和扩张,显著延缓肿瘤生长。杨阳等[12]指出香叶木素明显抑制肝癌细胞增殖,诱导G2/M期阻滞和细胞凋亡。香叶木素通过下调基质金属蛋白酶2(MMP-2)和MMP-9表达水平来抑制肝癌细胞转移[13]。本研究结果表明,香叶木素处理显著降低CRC细胞HCT116活力、集落形成能力和迁移能力,增加细胞凋亡率,上调促凋亡蛋白Cleaved-Caspase3的表达水平,且表现出明显的剂量依赖性,这与KOOSHA等[5]的研究结论相符合。以上结果表明,香叶木素对CRC细胞具有促凋亡、抗增殖、抗迁移作用。
lncRNA富含miRNA的结合位点,其通过或靶向miRNA间接调控CRC进展的多个过程[14-15]。本研究发现CRC组织中STX17-AS1相对水平显著上调,而miR-383-5p的相对水平显著下调,表明STX17-AS1、miR-383-5p可能参与CRC发生。此外,荧光素酶报告实验证实miR-383-5p是STX17-AS1的靶基因,提示CRC中可能存在STX17-AS1/miR-383-5p调控分子轴。体外功能检测显示,抑制STX17-AS1表达显著降低HCT116细胞增殖和迁移能力,促进Cleaved-Caspase3蛋白表达和细胞凋亡,与WANG等[8]报道抗肿瘤作用一致。miR-383-5p已被鉴定为胃癌、乳腺癌、肺癌等多种肿瘤的抑制因子[16-18]。据报道miR-383-5p表达水平与胃癌肿瘤大小和分化程度显著相关,miR-383-5p低表达胃癌患者的生存时间较短[19]。miR-383-5p通过靶向TRIM27抑制卵巢癌细胞增殖并增强其化疗敏感性[20]。此外,miR-383-5p介导抑制LINC00096表达对三阴性乳腺癌细胞增殖和迁移的抑制作用[21]。本研究表明,过表达miR-383-5p显著降低HCT116细胞增殖和迁移能力,促进Cleaved-Caspase3蛋白表达和细胞凋亡,与HUANG等[22]报道的抗癌作用一致。香叶木素处理后HCT116细胞中STX17-AS1表达以浓度依赖方式降低,而miR-383-5p表达以浓度依赖方式增加,且沉默STX17-AS1、过表达miR-383-5p与香叶木素对CRC细胞的抗肿瘤效果一致,表明香叶木素可能通过调控STX17-AS1/miR-383-5p在CRC中发挥抗肿瘤作用。回复实验显示,过表达STX17-AS1或抑制miR-383-5p表达均可逆转香叶木素对HCT116细胞的增殖、迁移、凋亡以及Cleaved-Caspase3蛋白表达的影响,进一步说明香叶木素通过STX17-AS1/miR-383-5p轴可调控CRC细胞恶性生物学行为。
总之,本研究证实香叶木素可抑制CRC细胞增殖和迁移,促进细胞凋亡,其机制与下调STX17-AS1/miR-383-5p轴有关。这些发现为开发香叶木素防治CRC提供了理论依据,为CRC的基因治疗提供潜在靶点。
| [1] |
SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2020[J]. CA Cancer J Clin, 2020, 70(1): 7-30. DOI:10.3322/caac.21590 |
| [2] |
RATHORE R, MCCALLUM J E, VARGHESE E, et al. Overcoming chemotherapy drug resistance by targeting inhibitors of apoptosis proteins (IAPs)[J]. Apoptosis, 2017, 22(7): 898-919. DOI:10.1007/s10495-017-1375-1 |
| [3] |
王春景, 盛月, 周强, 等. 香叶木素通过线粒体凋亡途径对人乳腺癌MCF-7细胞增殖及凋亡的影响[J]. 中药新药与临床药理, 2020, 31(2): 149-155. WANG C J, SHENG Y, ZHOU Q, et al. The effect of geraniol on the proliferation and apoptosis of human breast cancer MCF-7 cells through the mitochondrial apoptotic pathway[J]. Tradit Chin Drug Res Pharmacol, 2020, 31(2): 149-155. DOI:10.19378/j.issn.1003-9783.2020.02.005 |
| [4] |
周本益, 戴珊, 陈斌. 香叶木素通过调控p38 JNK信号通路对鼻咽癌CNE2细胞凋亡和增殖的影响[J]. 解放军医药杂志, 2020, 32(6): 24-28. ZHOU B Y, DAI S, CHEN B. The effect of geraniol on the apoptosis and proliferation of nasopharyngeal carcinoma CNE2 cells by regulating the p38 JNK signaling pathway[J]. Med J PLA, 2020, 32(6): 24-28. DOI:10.3969/j.issn.2095-140X.2020.06.005 |
| [5] |
KOOSHA S, MOHAMED Z, SINNIAH A, et al. Evaluation of anti-tumorigenic effects of diosmetin against human colon cancer xenografts in athymic nude mice[J]. Molecules, 2019, 24(14): 2522-2532. DOI:10.3390/molecules24142522 |
| [6] |
KOOSHA S, MOHAMED Z, SINNIAH A, et al. Investigation into the molecular mechanisms underlying the anti-proliferative and anti-tumorigenesis activities of diosmetin against HCT-116 human colorectal cancer[J]. Sci Rep, 2019, 9(1): 5148. DOI:10.1038/s41598-019-41685-1 |
| [7] |
CAO H L, LIU Z J, HUANG P L, et al. lncRNA-RMRP promotes proliferation, migration and invasion of bladder cancer via miR-206[J]. Eur Rev Med Pharmacol Sci, 2019, 23(3): 1012-1021. DOI:10.26355/eurrev_201902_16988 |
| [8] |
WANG J H, LU T J, KUNG M L, et al. The long noncoding RNA LOC441461 (STX17-AS1) modulates colorectal cancer cell growth and motility[J]. Cancers (Basel), 2020, 12(11): 3171-3181. DOI:10.3390/cancers12113171 |
| [9] |
SUN X, WANG X, DONG G, et al. Expression level of miR-383-5p in colorectal cancer patients following neoadjuvant chemotherapy and its clinical significance in the prognosis[J]. Minerva Med, 2020. DOI:10.23736/S0026-4806.20.06656-2 |
| [10] |
WANG C, LI S, REN H, et al. Anti-proliferation and pro-apoptotic effects of diosmetin via modulating cell cycle arrest and mitochondria-mediated intrinsic apoptotic pathway in MDA-MB-231 cells[J]. Med Sci Monit, 2019, 25(1): 4639-4647. DOI:10.12659/MSM.914058 |
| [11] |
CHOI J, LEE D H, PARK S Y, et al. Diosmetin inhibits tumor development and block tumor angiogenesis in skin cancer[J]. Biomed Pharmacother, 2019, 117: 109091. DOI:10.1016/j.biopha.2019.109091 |
| [12] |
杨阳, 林满洲, 黄艺文, 等. 香叶木素诱导人肝癌HepG2细胞凋亡及周期阻滞的机制研究[J]. 海南医学, 2016, 27(3): 15-18. YANG Y, LIN M Z, HUANG Y W, et al. Study on the mechanism of geraniol inducing apoptosis and cycle arrest of human liver cancer HepG2 cells[J]. Hainan Med, 2016, 27(3): 15-18. DOI:10.3969/j.issn.1003-6350.2016.03.004 |
| [13] |
LIU J, WEN X, LIU B, et al. Diosmetin inhibits the metastasis of hepatocellular carcinoma cells by downregulating the expression levels of MMP-2 and MMP-9[J]. Mol Med Rep, 2016, 13(3): 2401-2408. DOI:10.3892/mmr.2016.4872 |
| [14] |
XU J, MENG Q, LI X, et al. Long noncoding RNA MIR17HG promotes colorectal cancer progression via miR-17-5p[J]. Cancer Res, 2019, 79(19): 4882-4895. DOI:10.1158/0008-5472.can-18-3880 |
| [15] |
DING D Y, LI C F, ZHAO T C, et al. LncRNA H19/miR-29b-3p/PGRN axis promoted epithelial-mesenchymal transition of colorectal cancer cells by acting on WNT signaling[J]. Mol Cells, 2018, 41(5): 423-435. DOI:10.14348/molcells.2018.2258 |
| [16] |
LI X X, YUAN J P, CAO Q J, et al. MicroRNA-383-5p inhibits the proliferation and promotes the apoptosis of gastric cancer cells by targeting cancerous inhibitor of PP2A[J]. Int J Mol Med, 2020, 46(1): 397-405. DOI:10.3892/ijmm.2020.4603 |
| [17] |
ZHANG J, KONG X, SHI Q, et al. MicroRNA-383-5p acts as a potential prognostic biomarker and an inhibitor of tumor cell proliferation, migration, and invasion in breast cancer[J]. Cancer Biomark, 2020, 27(4): 423-432. DOI:10.3233/cbm-190704 |
| [18] |
ZHAO S S, GAO X Y, ZANG S Z, et al. MicroRNA-383-5p Acts as a prognostic marker and inhibitor of cell proliferation in lung adenocarcinoma by cancerous inhibitor of protein phosphatase 2A[J]. Oncol Lett, 2017, 14(3): 3573-3579. DOI:10.3892/ol.2017.6603 |
| [19] |
WEI C, GAO J J. Downregulated miR-383-5p contributes to the proliferation and migration of gastric cancer cells and is associated with poor prognosis[J]. Peer J, 2019, 7: e7882. DOI:10.7717/peerj.7882 |
| [20] |
JIANG J, XIE C, LIU Y, et al. Up-regulation of miR-383-5p suppresses proliferation and enhances chemosensitivity in ovarian cancer cells by targeting TRIM27[J]. Biomed Pharmacother, 2019, 109: 595-601. DOI:10.1016/j.biopha.2018.10.148 |
| [21] |
TIAN Y, XIA S, MA M, et al. LINC00096 promotes the proliferation and invasion by sponging miR-383-5p and regulating RBM3 expression in triple-negative breast cancer[J]. Onco Targets Ther, 2019, 12: 10569-10578. DOI:10.2147/ott.s229659 |
| [22] |
HUANG G, GUO X, YANG H. Long noncoding RNA SNHG1 promotes human prostate cancer progression by sponging miR-383-5p[J]. Anticancer Drugs, 2021, 32(3): 286-295. DOI:10.1097/cad.0000000000000916 |




