颅内动脉瘤(intracranial aneurysm,IAN)是颅内动脉管壁异常膨出或扩张引起的脑血管疾病。动脉瘤在全球的发病率大于3%,在中国的发病率为7%,其中未破裂动脉瘤的年破裂率约为0.95%[1]。动脉瘤破裂会导致蛛网膜下腔出血,不仅致残率极高,其致死率可达40%[2]。由于未破裂的颅内动脉瘤的自然病程发展与动脉瘤的大小、位置和形状相关,因此,早期发现、早期治疗、及时干预是颅内动脉瘤临床救治、良好预后的关键所在[3-4]。目前,数字减影血管造影(digital subtraction angiography,DSA)检查作为诊断颅内动脉瘤的金标准,但因有创、耗时、价格昂贵、有并发症等缺点,制约其在动脉瘤筛查中的应用[5-6]。头颈CTA诊断动脉瘤主要依靠影像科医师的经验,观察者之间灵敏度存在较大的差异,并且由于动脉瘤的体积较小以及颅内血管结构复杂等因素,人工诊断需要耗费大量的人力资源和时间,且容易漏诊、误诊[7]。自2017年以来,人工智能被广泛应用于检测颅内动脉瘤,目的是辅助影像诊断医生能够早,更准确的诊断颅内动脉瘤[8]。但是,迄今为止,多数研究[7, 9-12]缺乏DSA金标准以及外部数据的验证,抑或只关注≥3 mm的动脉瘤,限制了其模型在临床中的推广和进一步应用。因此,本研究以DSA结果作为金标准,对比分析AI诊断结果,旨在探究AI辅助诊断平台在头颈CTA检查中诊断颅内动脉瘤的应用价值。
1 材料与方法 1.1 一般资料回顾性收集2020年8月至2021年1月于本院接受头颈CTA及DSA检查的117例临床怀疑为颅内动脉瘤患者。其中男性42例,女性75例,年龄28~78(57.1±9.7)岁。主要临床表现为突发剧烈头痛、头晕、呕吐、肢体乏力或意识丧失等。纳入标准:①具有详细准确的临床资料;②行头颈CTA检查及DSA检查,且两种检查间隔时间短于2周;③AI软件能成功计算结果。排除标准:①图像质量差未达诊断要求;②血管内介入栓塞、开颅手术等术后患者;③影像资料缺失。
1.2 检查方法 1.2.1 CTA检查数据集采用西门子双源CT机(SOMATOM Definition Force, Germany)获取的头颈CTA图像。图像层厚为1.0 mm,层间距为0.7 mm,矩阵为512×512,均采用迭代重建算法。增强扫描选择对比剂示踪法,监测点置于主动脉弓层面,触发阈值为100 HU,达到阈值后延迟4 s自动触发扫描。采用双筒高压注射器(Ulrich medical) 以4.5~5.0 mL/s经右肘正中静脉注射碘普罗胺注射液(优维显,370 mg I/mL) 40~50 mL,随后以相同速率注入30 mL生理盐水。
1.2.2 DSA检查采用飞利浦Allura Xper FD20血管造影机,Philips INTEGRIS 3D-RA工作站,造影剂同上。采用Seldinger技术经股动脉插管穿刺置管行双侧颈内动脉、椎动脉血管常规注射对比剂,获得标准正位、侧位和斜位2D-DSA图像,之后对全脑血管进行旋转DSA检查,工作站中采用3D-VR、MIP等重建技术行3D-DSA重建。
1.3 图像分析DSA评价:由2名具有10年以上的神经放射学工作经验的影像诊断医师独立在后处理工作站上采用3D-DSA软件以最佳角度评估并记录动脉瘤的有无、位置、大小及数量,意见不一致时经协商达成共识。
AI评价:采用Cerebral Doc头颈AI智能辅助诊断系统软件(数坤科技头颈血管智能诊断系统V1.0),利用三维卷积神经网络(3D-CNN)自动识别头颈CTA图像中的正常血管及病变区域,并进行重建、增强、检测、分割、分类、配准、建模以及特征提取与测量(图 1),最终输出头颈CTA图像后处理结果和相关诊断结果,包括动脉瘤的有无、位置、大小及数量。
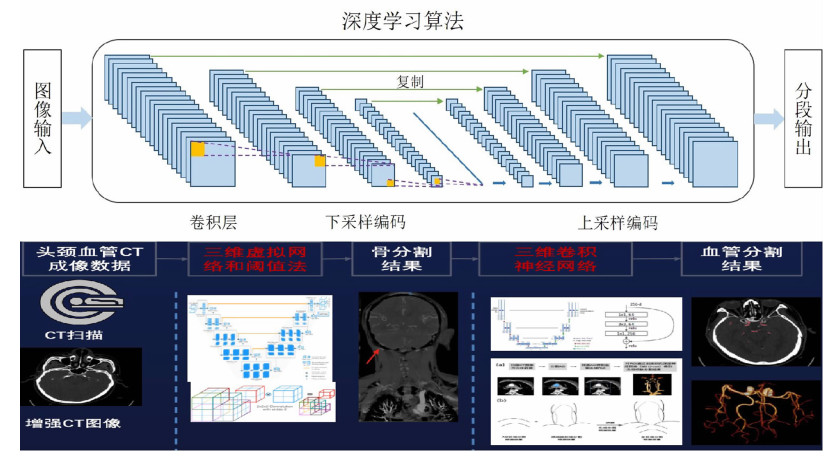
|
| 图 1 头颈AI智能辅助诊断系统网络结构和头颈CTA自动化处理流程图 |
1.4 统计学分析
采用SPSS 25.0统计学软件对数据进行分析。计量资料用x±s表示,计数资料用例数或百分比表示。以DSA结果为金标准,分别以患者和病灶为单位,计算AI软件诊断动脉瘤的敏感度、特异度和准确度,采用配对χ2检验比较两种方法间的差异。采用组内相关系数(intraclass correlation coefficient,ICC) 对AI软件在动脉瘤瘤体长径和短径的自动测量结果与DSA人工测量结果进行一致性检验:ICC>0.75为诊断一致性好,0.40<ICC<0.75为诊断一致性较好,ICC≤0.40为一致性差。以P < 0.05为差异有统计学意义。
2 结果 2.1 以患者为单位的诊断评价117例患者,其中105例经DSA确诊为颅内动脉瘤,其中82例单发,23例多发。AI软件提示103例动脉瘤患者,其中84例单发,19例多发,与DSA相比,假阳性11例,假阴性13例。AI诊断动脉瘤的敏感度、特异度和准确率分别是87.6%(92/105)、8.3%(1/12)、79.5%(93/117),其与DSA在患者水平诊断动脉瘤的差异无统计学意义(P>0.05,表 1)。
| 特征 | DSA确 诊数 | AI检 出数 | AI诊断 | P值 | ||||||
| TP | TN | FP | FN | 敏感度(%) | 特异度(%) | 准确率(%) | ||||
| 患者/例 | 105 | 103 | 92 | 1 | 11 | 13 | 87.6 | 8.3 | 79.5 | 0.839 |
| 病灶/个 | 136 | 124 | 108 | 5 | 16 | 28 | 79.4 | 23.8 | 72.0 | 0.097 |
| 病灶大小/个 | ||||||||||
| <3 mm | 29 | 21 | 16 | 5 | 5 | 13 | 55.2 | 50.0 | 53.8 | 0.096 |
| 3~5 mm | 65 | 60 | 53 | 5 | 7 | 12 | 81.5 | 58.3 | 75.3 | 0.359 |
| >5 mm | 42 | 43 | 39 | 5 | 4 | 3 | 92.9 | 44.4 | 86.3 | 1.000 |
| TP:真阳性;TN:真阴性;FP:假阳性;FN: 假阴性 | ||||||||||
2.2 以动脉瘤为单位的诊断评价
本组DSA确诊136个动脉瘤。AI软件提示124个动脉瘤,与DSA相比,假阳性16个,假阴性28个。其中AI软件漏诊28个:13个<3 mm、12个3~5 mm、3个>5 mm;误诊16个:5个<3 mm、7个3~5 mm、4个>5 mm,包括动脉血管起始部局限性膨大5个,动静脉畸形和动静脉瘘4个。AI对总体、<3 mm、3~5 mm和>5 mm的动脉瘤诊断敏感度分别为79.4%(108/136)、55.2%(16/29)、81.5%(53/65)和92.9%(39/42)。两者在病灶水平及对不同大小的动脉瘤诊断的差异无统计学意义(均P>0.05,表 1)。
2.3 以动脉瘤位置为单位的诊断评价不同位置的动脉瘤经AI与DSA诊断结果见表 2。其中AI对前交通动脉(ACoA)、后交通动脉(PCoA)、颈内动脉(ICA)、大脑中动脉(MCA)、大脑前动脉(ACA)、大脑后动脉(PCA)、基底动脉(BA)和椎动脉(VA)的诊断敏感度分别为69.6%(16/23)、66.7%(24/36)、81.1%(30/37)、84.6%(22/26)、33.3%(2/6)、50.0%(2/4)、50.0%(1/2)和50.0%(1/2)。两者对不同位置的动脉瘤诊断的差异无统计学意义(P均>0.05)。
| 动脉瘤位置 | DSA确诊数 | AI诊断 | P值 | ||||||
| TP | TN | FP | FN | 敏感度(%) | 特异度(%) | 准确率(%) | |||
| ACoA | 23 | 16 | 5 | 3 | 7 | 69.6 | 62.5 | 67.7 | 0.344 |
| PCoA | 36 | 24 | 5 | 4 | 12 | 66.7 | 55.6 | 64.4 | 0.077 |
| ICA | 37 | 30 | 5 | 4 | 7 | 81.1 | 55.6 | 76.1 | 0.549 |
| MCA | 26 | 22 | 5 | 0 | 4 | 84.6 | 100 | 87.1 | 0.125 |
| ACA | 6 | 2 | 5 | 2 | 4 | 33.3 | 71.4 | 53.8 | 0.687 |
| PCA | 4 | 2 | 5 | 1 | 2 | 50.0 | 83.3 | 70.0 | 1.000 |
| BA | 2 | 1 | 5 | 0 | 1 | 50.0 | 100 | 85.7 | 1.000 |
| VA | 2 | 1 | 5 | 2 | 1 | 50.0 | 71.4 | 66.7 | 1.000 |
| TP:真阳性;TN:真阴性;FP:假阳性;FN: 假阴性 | |||||||||
2.4 从瘤体径线测量值方面的诊断评价
从动脉瘤瘤体径线的测量值方面,AI自动后处理VR图像与CTA人工后处理VR图像和DSA图像均能清晰显示动脉瘤的位置和大小(图 2、3),其中AI自动测量和DSA人工测量结果见表 3。对总体瘤体长径、总体瘤体短径和>5 mm动脉瘤的长径测量值结果,AI和DSA的一致性分别为好、好和较好(P均<0.001)。对<3 mm动脉瘤的长径和3~5 mm动脉瘤的长径测量值结果,AI和DSA的一致性均为差(P均>0.05)。
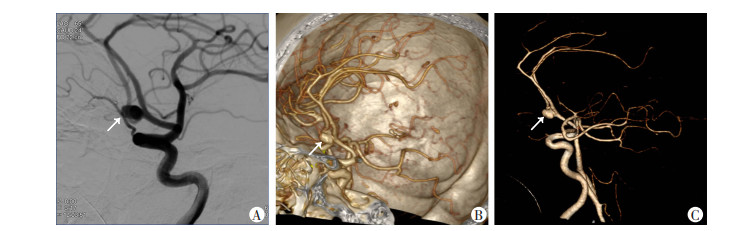
|
| A:DSA表现;B:CTA人工后处理VR图 显示前交通动脉瘤;C:AI自动后处理VR图 清晰显示前交通动脉瘤 图 2 前交通动脉瘤影像学表现箭头示前交通动脉瘤 |
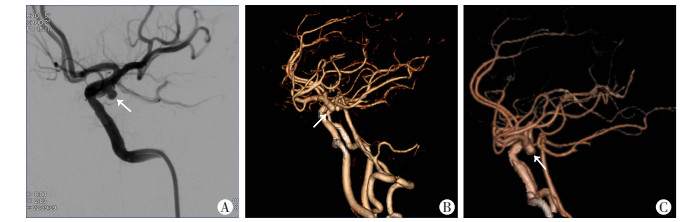
|
| A:DSA表现;B:CTA人工后处理VR图 显示前交通动脉瘤;C:AI自动后处理VR图 清晰显示前交通动脉瘤 图 3 后交通动脉瘤瘤影像学表现 箭头示后交通动脉瘤 |
| 瘤体径线 | AI | DSA | ICC | P值 |
| 总瘤体长径 | 5.6±2.7 | 5.4±3.7 | 0.778 | 0.000 |
| 总瘤体短径 | 4.8±2.3 | 3.9±2.2 | 0.822 | 0.000 |
| 动脉瘤长径<3 mm | 3.7±0.7 | 2.3±0.2 | 0.113 | 0.167 |
| 动脉瘤长径3~5 mm | 4.5±1.5 | 3.9±0.6 | 0.142 | 0.181 |
| 动脉瘤长径>5 mm | 7.5±3.1 | 8.1±4.6 | 0.722 | 0.000 |
3 讨论
颅内动脉瘤是常见的脑血管疾病,其发病率仅次于脑血栓形成和高血压脑出血,早期诊断、早期治疗可明显降低致死率和致残率。影响该疾病影像诊断准确性的因素,包括动脉瘤的大小,图像采集协议,图像质量,图像后处理方法以及阅片者经验水平的差异等[13]。有研究[10]表明动脉瘤诊断阅片者间的一致性差异范围较大(0.37~0.85),因此亟待开发高性能计算机辅助诊断(computer aided diagnosis,CAD)工具以提高动脉瘤影像检出的准确率,为患者的临床治疗和预后提供可靠影像依据。
以往AI智能辅助诊断颅内动脉瘤相关研究仅关注≥3 mm的未破裂动脉瘤,且缺乏金标准及外部数据验证,限制了其模型的推广和应用[7, 10, 12]。但近期,SHI等[13]通过与DSA结果进行比对,外部验证研究得出其AI模型在患者水平的敏感度、特异度和准确率分别为84.6%、80.2%和81.0%,对不同大小的动脉瘤诊断敏感度分别为:<3 mm的动脉瘤为37.5%,≥3 mm的动脉瘤为84.2%,>5 mm的动脉瘤为90.5%。本研究结果显示Cerebral Doc头颈AI智能辅助诊断系统软件诊断颅内动脉瘤在患者水平和病灶水平均得到了较高的敏感度和准确率,其中对>5 mm的动脉瘤诊断敏感度和准确率最高,与之结果一致。由此表明采用Cerebral Doc能有效检出动脉瘤,AI自动化诊断动脉瘤具有可行性。
临床实践中,影像诊断医生通过2D或3D图像人工判断和测量动脉瘤的位置和大小。然而,人工测量存在主观性和前后矛盾性等固有局限性,诊断结果差异大,并且无法获取动脉瘤的复杂几何特征[14-15]。在检测不同大小和位置的动脉瘤时,敏感度作为评价指标尤为重要。DAI等[12]研究的模型对位于BA、VA和PCA的动脉瘤具有100%的病灶水平敏感度,而对位于ICA、MCA和ACA的动脉瘤敏感度为93.2%、91.9%和95.7%。SHI等[13]研究的模型对位于MCA、ACoA、ACA和PCA的动脉瘤具有100%的病灶水平敏感度,而对位于PCoA、ICA和VBA的动脉瘤具有80.0%、66.7%和62.5%的敏感度。但两个研究都未对不同位置的病灶水平进行外部验证。本研究以DSA结果为金标准,对比研究发现AI诊断位于ICA和MCA的动脉瘤具有较高的敏感度,但诊断位于ACA、PCA、BA和VA的动脉瘤敏感度较低。本研究结果与既往有一定差异的原因可能与样本选择不同和AI算法不一致有关。本研究是利用基于生理结构分区的V-net网络和3D U-net网络分别进行骨分割和血管分割,确保完整识别提取颅内动脉瘤模型,进行精准的测量,以实现“数字化”动脉瘤。除此之外,本研究创新性的发现该AI软件对瘤体长径和瘤体短径,尤其是对>5 mm的动脉瘤瘤体长径的自动测量结果与DSA人工测量结果具有较好的一致性,进一步证实了AI软件作为辅助诊断工具可以为诊断医生提供更多的可靠依据。
本研究中误诊病例可归因于以下几个原因,包括:①动脉血管起始部局限性膨大;②动静脉畸形和动静脉瘘;③血管壁存在较大突起钙化斑块;④血管弯曲和折叠;⑤血管位置靠近颅骨。漏诊病例主要原因包括:①小动脉瘤(<5 mm);②动脉瘤位于前循环不常见位置。除此之外,我们发现该AI软件对目标血管位置诊断的准确性与患者检查体位相关,如患者检查过程中发生运动或摆位不正,将无法准确识别血管分段。因此,我们还需要更多样化病例的训练数据和外部验证,对该系统进行更深入的系统验证和优化,以实现AI技术在临床获得更高的患者水平和病灶水平敏感度。
本研究存在一些不足:①为回顾性单中心研究,存在一定的采样偏倚;②未讨论该系统对临床工作效率的促进作用,但文献[10, 13, 16]均已证实影像诊断医生在AI辅助的情况下,能明显提高诊断效能和工作效率。
综上所述,基于深度学习的头颈AI智能辅助诊断系统能快速、准确地诊断颅内动脉瘤,尤其是对>5 mm的动脉瘤诊断敏感度较高;能准确自动测量动脉瘤瘤体径线,可作为影像医生的辅助诊断工具进行动脉瘤的筛查。
| [1] |
SHAHZAD R, PENNIG L, GOERTZ L, et al. Fully automated detection and segmentation of intracranial aneurysms in subarachnoid hemorrhage on CTA using deep learning[J]. Sci Rep, 2020, 10(1): 21799. |
| [2] |
JOO B, AHN S S, YOON P H, et al. A deep learning algorithm may automate intracranial aneurysm detection on MR angiography with high diagnostic performance[J]. Eur Radiol, 2020, 30(11): 5785-5793. |
| [3] |
郑鉴峰, 张晓冬, 郭宗铎, 等. 介入栓塞治疗小型与中大型颅内未破裂动脉瘤的效果对比[J]. 第三军医大学学报, 2016, 38(3): 288-291, 306. ZHENG J F, ZHANG X D, GUO Z D, et al. Efficacy of embolization in treatment of small vs medium-large intracranial unruptured aneurysms: report of 54 cases[J]. J Third Mil Med Univ, 2016, 38(3): 288-291, 306. |
| [4] |
黄清海, 杨鹏飞. 颅内动脉瘤血管内介入治疗中国专家共识(2013)[J]. 中华医学杂志, 2013, 93(39): 3093-3103. HUANG Q H, YANG P F. Chinese expert consensus on endovascular interventional therapy of intracranial aneurysms (2013)[J]. Natl Med J China, 2013, 93(39): 3093-3103. |
| [5] |
时代, 蔡武, 乔方, 等. 256排CT诊断颅内小动脉瘤能力研究[J]. 临床放射学杂志, 2019, 38(8): 1357-1361. SHI D, CAI W, QIAO F, et al. Study on the ability of 256-slice CT in diagnosing intracranial small aneurysms[J]. J Clin Radiol, 2019, 38(8): 1357-1361. |
| [6] |
余娜, 严敏, 傅浪舟, 等. 应用能谱CT技术去除颅内动脉瘤弹簧圈栓塞术后金属伪影[J]. 第三军医大学学报, 2020, 42(20): 2069-2074. YU N, YAN M, FU L Z, et al. Application of spectral computed tomography for artifact removal after coil embolization of intracranial aneurysms[J]. J Third Mil Med Univ, 2020, 42(20): 2069-2074. |
| [7] |
YANG J H, XIE M F, HU C P, et al. Deep learning for detecting cerebral aneurysms with CT angiography[J]. Radiology, 2021, 298(1): 155-163. |
| [8] |
GENG C, XIA W, HUANG L, et al. Automated computer-assisted detection system for cerebral aneurysms in time-of-flight magnetic resonance angiography using fully convolutional network[J]. Biomed Eng Online, 2020, 19(1): 38. |
| [9] |
UEDA D, YAMAMOTO A, NISHIMORI M, et al. Deep learning for MR angiography: automated detection of cerebral aneurysms[J]. Radiology, 2019, 290(1): 187-194. |
| [10] |
PARK A, CHUTE C, RAJPURKAR P, et al. Deep learning-assisted diagnosis of cerebral aneurysms using the HeadXNet model[J]. JAMA Netw Open, 2019, 2(6): e195600. |
| [11] |
HANAOKA S, NOMURA Y, TAKENAGA T, et al. HoTPiG: a novel graph-based 3-D image feature set and its applications to computer-assisted detection of cerebral aneurysms and lung nodules[J]. Int J Comput Assist Radiol Surg, 2019, 14(12): 2095-2107. |
| [12] |
DAI X L, HUANG L X, QIAN Y, et al. Deep learning for automated cerebral aneurysm detection on computed tomography images[J]. Int J Comput Assist Radiol Surg, 2020, 15(4): 715-723. |
| [13] |
SHI Z, MIAO C C, SCHOEPF U J, et al. A clinically applicable deep-learning model for detecting intracranial aneurysm in computed tomography angiography images[J]. Nat Commun, 2020, 11(1): 6090. |
| [14] |
MALDANER N, STIENEN M N, BIJLENGA P, et al. Interrater agreement in the radiologic characterization of ruptured intracranial aneurysms based on computed tomography angiography[J]. World Neurosurg, 2017, 103: 876-882. |
| [15] |
SHI Z, HU B, SCHOEPF U J, et al. Artificial intelligence in the management of intracranial aneurysms: current status and future perspectives[J]. AJNR Am J Neuroradiol, 2020, 41(3): 373-379. |
| [16] |
FU F, WEI J, ZHANG M, et al. Rapid vessel segmentation and reconstruction of head and neck angiograms using 3D convolutional neural network[J]. Nat Commun, 2020, 11(1): 4829. |




