我国地形复杂,包括平原、丘陵、山川、盆地、高原等多种地形, 其中高原占据26%的面积。近年来,越来越多的人到高原地区学习、旅游、居住等[1],急进高原会导致部分人群出现高原反应,例如呼吸困难、恶心、头昏等症状[2],患者症状进行性发展,会出现神经精神症状,比如头晕、头痛、意识障碍等[3],脑组织受损害、含水量增多从而引起脑体积增大和重量增加,即出现高原脑水肿[4]。除此之外,常见高原疾病还有高原肺水肿[5]、高原红细胞增多症等[6]。严重者甚至危及生命[7]。由此,对于高原反应引起的一系列问题也成为研究热点。研究表明,大脑对氧气高度敏感,脑的高级功能包括学习、记忆和其他认知活动,容易受到损害[8]。急进高原采取及时进行复氧干预可改善急进高原缺氧后引起的大脑认知功能损伤[9]。急进高原往往引起情绪变化以及认知功能变化,这些变化与缺氧的严重程度及时间均有明显关联。本文拟采用模拟高原缺氧5 000 m条件下,分别设置急进高原24 h组和7 d组,对焦虑抑郁样行为及短期记忆进行探讨。
1 材料与方法 1.1 材料 1.1.1 实验动物健康雄性成年小鼠30只,体质量20~24 g,等级SPF级,均购买自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0006。
1.1.2 药品和试剂主要药品和试剂:无水乙醇购买自成都市科龙化工;多聚甲醛、磷酸二氢钠购买自国药集团化学试剂有限公司;枸盐酸缓冲液购买自北京中衫金桥公司;Triton-X-100购买自Sigma公司;C-Fos抗体购买自Cell Signaling Technology公司;精氨酸加压素(arginine vasopressin,AVP)抗体购自美国Santa Cruz公司;糖皮质激素受体(glucocorticoid receptor, GR)抗体购自美国Santa Cruz公司;ACTH ELISA试剂盒、皮质醇ELISA试剂盒购自Enzo公司。
1.1.3 仪器和设备主要仪器设备有:高原环境模拟舱,由贵州风雷航天与第三军医大学联合研制;冰冻切片机,购自Leica公司,型号CM1950型;照相仪器品牌为ZEISS,型号AX10型。高架十字迷宫、新物体识别、黑白箱、旷场实验设备购自深圳市瑞沃德生命科技有限公司。
1.2 方法 1.2.1 动物分组与处理将C57成年雄性小鼠分为3组,第一组为对照组,放在学校动物房饲养。第二组为24 h组,该组小鼠放在高原环境模拟低压氧舱内24 h,海拔高度5 000 m,24 h过后取出。第三组小鼠为7 d缺氧组,该组小鼠放在高原环境模拟低压氧舱内7 d,海拔高度5 000 m,7 d后取出。
1.2.2 行为学检测旷场实验、高架实验、明暗箱实验用于检测小鼠的焦虑样行为;新物体识别实验用于检测小鼠的短期记忆;悬尾实验和强迫游泳用于检测小鼠抑郁样行为。
旷场实验形状大小为40 cm×40 cm×30 cm灰色树脂材质的盒子。将小鼠按照同一方位放入盒子内,用摄像头采集30 min。采用的软件为Ethovision 11.0软件,对小鼠总的运动路程和在中心区域(用软件对盒子底部以4×4方式划分为16个小的正方形,中心的4个小格为中心区域)停留时间进行分析。
高架十字迷宫实验迷宫含有中间区域(6 cm×6 cm),两个开臂(30 cm×6 cm×15 cm), 两个闭臂(30 cm×6 cm×15 cm)。放置小鼠时,采用面向开臂由中间区域这一部位放入,让小鼠自由探索,采集时间为10 min。采用Ethovision 11.0软件分析统计小鼠在开臂停留时间百分比(开臂时间/总时间×100%)。
明暗箱实验明暗箱有两个箱体,明箱(20 cm×15 cm× 25 cm)和暗箱(20 cm×15 cm×25 cm)。明箱和暗箱之间连接的有门,允许小鼠来回穿梭。每只小鼠由固定的明箱放置进去,采集时间10 min。用Ethovision 11.0软件分析统计暗箱中停留时间。
新物体识别实验采用材质为不透明树脂玻璃箱体。新物体形状、颜色和纹理等方面有所区别,大小相近。实验开始24 h前,让小鼠适应5 min,使小鼠熟悉开场的环境。实验开始时,在箱子同侧放上物体,让其在箱体内探索10 min。完成训练1 h后,检测小鼠对物体的记忆能力。换一个新物体代替之前的其中一个旧物体,该物体具有相似的尺寸,但形状和颜色有区别。随后,将小鼠依次放入箱体,记录小鼠的活动10 min。识别系数(DI)计算如下:DI=Tn/(Tf+Tn)×100%:Tn和Tf分别是小鼠探索新物体和熟悉物体所用时间。
悬尾试验(Tail suspension test, TST)拿胶带固定小鼠尾部后1/3,悬挂于悬尾仪器上,采集时间6 min,统计小鼠不动时间。强迫游泳实验小鼠放置在透明圆柱形塑料瓶里,采集记录6 min小鼠游泳时间,统计小鼠不动时间。
1.2.3 免疫组化检测收集的脑组织充分脱水后,对脑组织进行适当修整,用包埋剂固定脑组织。设置脑组织切片厚度为30微米,进行切片。首先放入Triton中, 30 min以上,然后孵C-Fos抗体、AVP抗体,C-Fos抗体来源为兔抗,稀释比例1 ∶4 000,C-Fos抗体孵育后,室温放置2 d,2 d后孵育二抗。二抗稀释比例:1 ∶500, 温度37 ℃,2~3 h。山羊来源AVP,稀释比例1 ∶1 000,4 ℃孵育过夜。抗山羊594荧光二抗, 稀释比例1 ∶400,于室温孵育2 h。兔来源GR, 稀释比例1 ∶500,4 ℃孵育过夜。抗兔Cy3稀释比例1 ∶400,于室温孵育2 h。经Dapi复染后,贴片,封片。
1.2.4 ELISA法检测收集的血液放入采血管中,于4 ℃、3 000 r/m离心15分钟,取上清。操作步骤严格按照ELISA试剂盒说明书执行。用多功能酶标仪在450 nm、405 nm波长处检测吸光度值,以ELISA Calc软件拟合标准曲线,从而计算各指标的相应浓度。
1.2.5 统计方法数据均以 x±s表示,采用SPSS 24.0统计软件进行分析数据,采用单因素方差分析,组间比较以LSD方法进行多重比较,以P < 0.05为差异有统计学意义,检验水准:α=0.05。
2 结果 2.1 7天高原缺氧组小鼠出现焦虑样行为在旷场实验中,与对照组相比,24 h高原缺氧处理组以及7 d高原缺氧处理组小鼠的平均速度、总路程、中央路程未出现显著性差异(图 1B、图 1D、图 1E),说明急性高原缺氧对小鼠的探索行为无显著影响;中心区停留时间、中央路程与总路程之比可以反映小鼠的焦虑水平,三组小鼠在中心区停留时间以及中央路程与总路程之比均未出现显著性差异(图 1C、图 1F)。
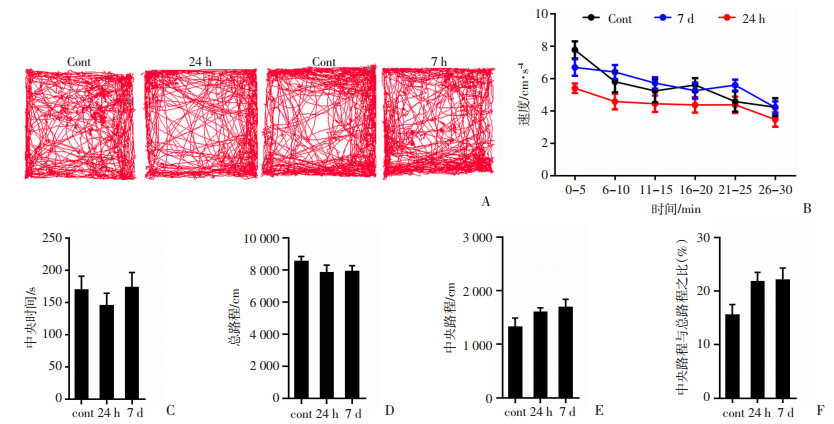
|
| A:30 min内小鼠运动轨迹图;B:小鼠每5 min内的平均速度;C:旷场实验中心区域停留时间;D:旷场实验总路程;E: 中央路程;F:中央路程与总路程之比。(n=10,a:P < 0.05与对照组相比较。) 图 1 高原缺氧小鼠旷场实验结果 |
在明暗箱行为学实验中,3组小鼠在暗箱停留时间未出现显著性差异(图 2A),比较明暗箱穿梭次数,与对照组相比,24 h和7 d高原缺氧处理组均未出现显著性差异。与24 h处理组相比,7 d处理组小鼠的穿梭次数减少,达到统计学差异。如图 2B所示。
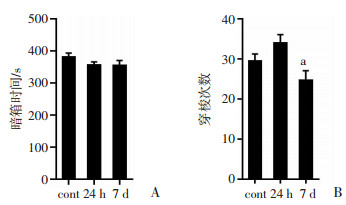
|
| A:暗箱时间;B:穿梭次数。(n=10,a:P < 0.05与24 h组相比较。) 图 2 高原缺氧小鼠明暗箱实验结果 |
高架十字迷宫实验结果显示,7 d高原缺氧组小鼠在开臂的时间显著低于对照组(图 3A,P < 0.05),提示7 d高原缺氧组小鼠出现焦虑样行为。但24 h高原缺氧组小鼠和对照组相比较,无明显差异。24 h高原缺氧组与7 d高原缺氧组相比较,亚组之间差异非常高。穿梭次数的单因素方差分析结果可知,3组小鼠均无明显统计学差异,如图 3B所示。
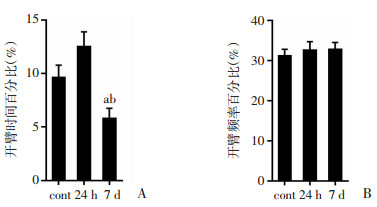
|
| A:开臂时间百分比;B:开臂频率百分比。(对照组、7 d组n=10,24 h组n=8,a:P < 0.05与对照组相比较,b:P < 0.001与24 h组相比较。) 图 3 高原缺氧小鼠高架十字迷宫实验结果 |
2.2 高原缺氧组小鼠短期记忆未受明显影响
本次实验研究发现,两组高原缺氧处理组小鼠和对照组小鼠相比在识别系数上有下降的趋势,但尚未达到显著差异(图 4)。这表明高原缺氧组小鼠的短期记忆能力尚未受到显著影响。
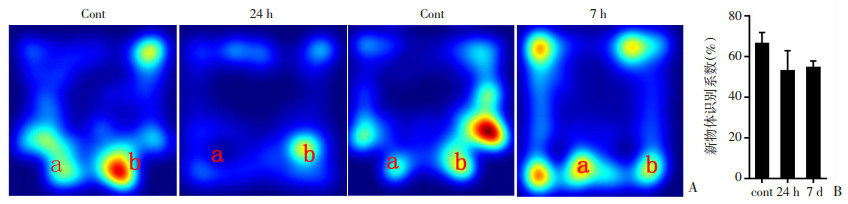
|
| A:小鼠热图(a: 旧物体,b: 新物体) B:新物体识别系数(control组n=9,24 h组n=7、7 d组n=10) 图 4 高原缺氧小鼠新物体识别实验结果 |
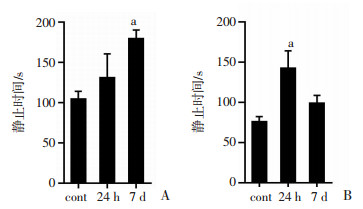
|
| A:悬尾实验(n=10,a:P < 0.01与对照组相比较);B:强迫游泳实验(n=10,a:P < 0.05与对照组相比较)。 图 5 高原缺氧小鼠悬尾实验和强迫游泳实验 |
2.3 高原缺氧组小鼠产生抑郁样行为改变
悬尾实验和强迫游泳是用来检测小鼠抑郁样行为。在悬尾实验中,实验结果表明,与对照组相比24 h高原缺氧处理组小鼠静止时间无明显改变,高原缺氧持续时间到7 d时,静止时间明显升高,出现典型抑郁样行为(P < 0.01)。强迫游泳实验中,与对照组相比较,24 h高原缺氧组静止时间增多,达到显著性差异(P < 0.05),表明24 h高原缺氧处理组小鼠出现抑郁样行为。
2.4 7d缺氧组小鼠下丘脑部位的C-Fos蛋白被激活C-Fos蛋白通常被称为第三信使,可以使外界刺激转变为基因表达,是反映神经元活动的标志。如图 6所示,平原对照组小鼠下丘脑室旁核的C-Fos蛋白未激活,而7 d高原缺氧组小鼠下丘脑室旁核的C-Fos蛋白被激活,表明下丘脑室旁核参与了该反应。

|
| 红色:C-Fos,蓝色:DAPI染色细胞核。A、C:对照组小鼠下丘脑部位;B、D:7 d缺氧组小鼠下丘脑部位,C、D为A、B图中方框的局部放大图,箭头所示为C-Fos表达阳性细胞 图 6 免疫荧光显示高原缺氧小鼠下丘脑部位C-Fos表达的变化 |
2.5 下丘脑-垂体-肾上腺轴调节高原缺氧环境引起的焦虑和抑郁样行为
高原缺氧作为一种环境刺激,会引起机体产生应激反应,激活交感神经系统和下丘脑-垂体-肾上腺轴(Hypothalamic-pituitary-adrenocortical axis,HPA)。AVP是下丘脑室旁核大细胞神经元分泌的一种神经肽,在急性应激时迅速分泌。与平原对照组小鼠相比较,7d高原缺氧组小鼠下丘脑中的AVP数量明显升高(P < 0.01),表明高原缺氧导致机体应激水平提高而引起下丘脑内分泌发生变化。GR为糖皮质激素受体,与平原对照组小鼠相比较,7d高原缺氧组小鼠下丘脑中的GR阳性细胞数量明显升高(P < 0.01)。提示小鼠下丘脑中糖皮质激素分泌增多,用来调节该应激反应。如图 7所示。
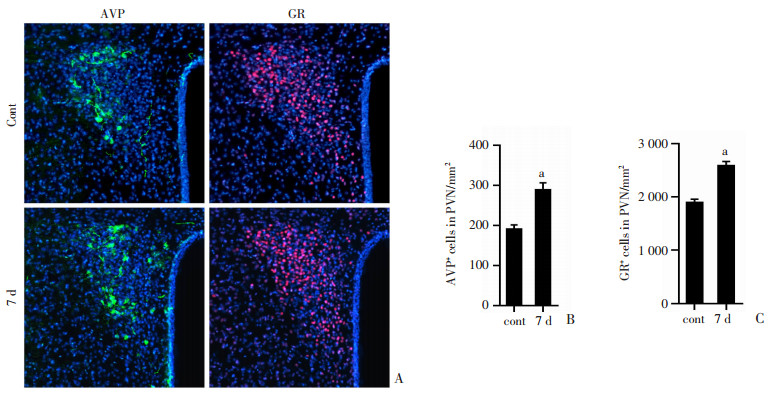
|
| A:红色为GR表达,绿色为AVP表达,蓝色为DAPI染色细胞核;B:AVP数量统计图;C:GR数量统计图 图 7 免疫荧光显示高原缺氧小鼠下丘脑部位AVP、GR表达的变化 |
由垂体产生的促肾上腺皮质激素(adrenocorticotropic hormone, ACTH)与平原对照组相比较,24 h高原缺氧组略有升高,而7 d高原缺氧组小鼠ACTH浓度已经达到显著性差异。肾上腺分泌的皮质醇浓度与平原对照组小鼠相比较,24 h高原缺氧组小鼠出现了显著性差异,而7 d组小鼠血液中皮质酮浓度有所降低,但仍然略高于平原对照组,揭示皮质酮浓度含量升高又负反馈到下丘脑,抑制促肾上腺皮质激素释放激素的分泌。如图 8所示。
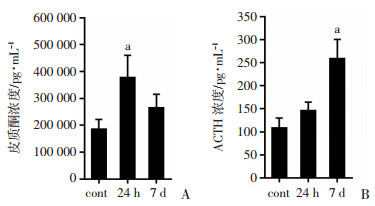
|
| A: 皮质酮浓度(n=4,a:P < 0.05与对照组相比较);B: ACTH浓度(n=3,a:P < 0.05与对照组相比较) 图 8 高原缺氧小鼠皮质酮浓度和ACTH浓度的变化 |
3 讨论
对于急进高原人群来说,高原缺氧环境对情绪方面的影响十分明显。研究表明,当高原海拔达到4 000米时,情绪会出现比较明显的变化,随着海拔升高,情绪失控现象会更趋严重,有一定危险性[10],严重的焦虑和抑郁情绪导致大脑认知功能受损。本研究采用模拟高原5 000米的环境,发现经过高原缺氧刺激后,24 h高原缺氧组小鼠在强迫游泳实验中检测出了抑郁样行为,而对焦虑无显著影响。7 d高原缺氧组小鼠在高架十字迷宫实验检测出焦虑样行为,在悬尾实验检测出明显的抑郁样行为。这些结果提示:模拟高原处理的时间越长,对情绪的影响越明显。
探索行为和运动功能会影响焦虑或抑郁行为,旷场实验中总路程可以在一定程度反映小鼠的探索行为和运动功能。我们发现24 h和7 d模拟高原处理对小鼠的探索行为和运动功能无显著影响,提示模拟高原环境产生的焦虑和抑郁样行为是特异性的行为。新物体识别用于检测短期记忆,是一种较为常见用于研究学习与记忆的记忆类型。实验模型建立的依据是啮齿类动物对陌生物体的探究天性,在实验环境中建立小鼠的熟悉物体,测试过程中若小鼠未遗忘环境中的熟悉物体,小鼠对新物体的探究时间就会比对熟悉物体的探究时间多;若小鼠遗忘了环境中的熟悉物体,小鼠对新物体的探究时间应基本与对熟悉物体的探究时间相同。新物体识别系数越高则新物体识别记忆越强,反之越弱[11]。我们发现24 h和7 d模拟高原处理对小鼠的短期记忆无显著影响。我们注意到反映短期记忆功能的识别系数高原处理组数值上低于对照组,存在下降的趋势。我们推测焦虑和抑郁对认知的影响可能与模拟高原处理的时间相关,延长高原处理的时间可能会影响认知功能。
高原缺氧作为一种外界刺激,小鼠下丘脑室旁核会发生变化,把刺激转化为内部基因调节。有文献报道[12],本研究结果也表明下丘脑-垂体-肾上腺轴会在机体受到应激时发挥重要的作用,下丘脑-垂体-肾上腺轴的调节对适应环境的改变尤为重要。首先下丘脑经过刺激分泌促肾上腺皮质激素释放激素[13],作用于垂体,然后垂体分泌促肾上腺皮质激素,作用于肾上腺,肾上腺释放糖皮质激素和皮质酮等物质,随着血液循环调节机体发生改变。最后,糖皮质激素和皮质酮又负反馈到下丘脑,抑制促肾上腺皮质激素释放激素的分泌。如果下丘脑-垂体-肾上腺轴经过外界刺激受到破坏,会造成机体功能发生异常,导致神经系统[14]、免疫系统[15]等出现问题。C-Fos蛋白可以用以标记脑区内被激活的神经元,我们发现7 d高原缺氧处理组小鼠下丘脑内室旁核的神经元被显著激活,提示下丘脑室旁核参与该应激反应的调控。这些激活的神经元是如何进行焦虑和抑郁样行为的调控需进一步研究。
综上所述,本研究结果显示小鼠经过高原缺氧环境刺激后,24 h内,引起了抑郁样行为。随着时间的推移,7天后,除了抑郁样行为外,还产生了焦虑样行为。表明急进高原的24 h内,对情绪的影响非常明显,时间越长,对情绪的影响越严重。建议急进高原人群,可以采取间断吸氧[16]、采用红景天中成药[17]等方法减轻高原缺氧环境对人体带来的伤害。本研究虽就高原缺氧环境下引起的情绪问题做了阐述,对其中的机制进行了研究,但由于起作用的关键分子尚未阐明,仍需要进一步研究。
| [1] |
黄琴, 关巍, 冯喜英. 高原环境对肺组织的影响[J]. 临床肺科杂志, 2014, 19(9): 1696-1698, 1699. HUANG Q, GUAN W, FENG X Y. The influence of high altitude environment on lung tissue[J]. J Clin Pulm Med, 2014, 19(9): 1696-1698, 1699. |
| [2] |
胡光涛, 陈许波, 杨柳, 等. 高原驻训军人抑郁情绪与心理应激、心理弹性的相关性[J]. 西南国防医药, 2019, 29(4): 485-487. HU G T, CHEN X B, YANG L, et al. Correlation of depression with psychological stress and resilience of soldiers stationed at high altitude[J]. Med J Natl Defending Forces Southwest China, 2019, 29(4): 485-487. |
| [3] |
廉国锋, 李锏, 罗勇军, 等. 高原脑水肿发病机制及防治研究进展[J]. 人民军医, 2020, 63(4): 343-346, 357. DOI: CNKI:SUN:RMJZ.0.2020-04-013 LIAN G F, LI J, LUO Y J, et al. Research progress on the pathogenesis and prevention of high altitude cerebral edema[J]. People Mil Surg, 2020, 63(4): 343-346, 357. DOI: CNKI:SUN:RMJZ.0.2020-04-013 |
| [4] |
FIORE D C, HALL S, SHOJA P. Altitude illness: risk factors, prevention, presentation, and treatment[J]. Am Fam Physician, 2010, 82(9): 1103-1110. |
| [5] |
SYDYKOV A, MAMAZHAKYPOV A, MARIPOV A, et al. Pulmonary hypertension in acute and chronic high altitude maladaptation disorders[J]. Int J Environ Res Public Health, 2021, 18(4): 1692. |
| [6] |
贾守宁, 孙梦茹, 马春花, 等. 红景天苷对高原红细胞增多症大鼠红细胞膜结构和功能的影响[J]. 中草药, 2020, 51(15): 3960-3967. JIA S N, SUN M R, MA C H, et al. Effects of salidroside on structure and function of erythrocyte membrane in high altitude polycythemia rats[J]. Chin Tradit Herb Drugs, 2020, 51(15): 3960-3967. |
| [7] |
LUKS A M, SWENSON E R, BÄRTSCH P. Acute high-altitude sickness[J]. Eur Respir Rev, 2017, 26(143): 160096. |
| [8] |
PRASAD J, BAITHARU I, SHARMA A K, et al. Quercetin reverses hypobaric hypoxia-induced hippocampal neurodegeneration and improves memory function in the rat[J]. High Alt Med Biol, 2013, 14(4): 383-394. |
| [9] |
王黎, 史清海, 胡科妍, 等. 优化及复氧对急进高原缺氧大鼠认知功能障碍的改善作用[J]. 华南国防医学杂志, 2018, 32(1): 5-7, 41. WANG L, SHI Q H, HU K Y, et al. Improvement of optimization and reoxygenation on cognitive dysfunction in plateau hypoxia rats[J]. Mil Med J South China, 2018, 32(1): 5-7, 41. |
| [10] |
陈甄, 张广波, 周迪, 等. 急性高原低氧环境对不同情绪状态脑电功率的影响[J]. 中国应用生理学杂志, 2020, 36(6): 556-561. CHEN Z, ZHANG G B, ZHOU D, et al. Effects of acute high altitude hypoxia on EEG power in different emotional states[J]. Chin J Appl Physiol, 2020, 36(6): 556-561. |
| [11] |
田奡文. 孤啡肽对新物体识别记忆的调节作用及机制研究[D]. 南昌: 南昌大学, 2019. TIAN A W. The role ofnociceptin in novel object recognition memory and the undelying mechanisms[D]. Nanchang: Nanchang University, 2019. |
| [12] |
MCEWEN B S, EILAND L, HUNTER R G, et al. Stress and anxiety: structural plasticity and epigenetic regulation as a consequence of stress[J]. Neuropharmacology, 2012, 62(1): 3-12. |
| [13] |
HERMAN J P, FLAK J, JANKORD R. Chronic stress plasticity in the hypothalamicparaventricular nucleus[J]. Prog Brain Res, 2008, 170: 353-364. |
| [14] |
阮俊勇, 雷涛, 董旭, 等. 急性低压低氧环境对脑功能及其结构影响的研究进展[J]. 中华物理医学与康复杂志, 2020, 42(9): 858-860. RUAN J Y, LEI T, DONG X, et al. Research progress on the effects of acute low pressure and hypoxia environment on brain function and structure[J]. Chin J Phys Med Rehabil, 2020, 42(9): 858-860. |
| [15] |
霍军丽, 董秋峰, 王国霞. 丹参酮ⅡA对高原缺氧大鼠认知功能障碍的影响[J]. 神经解剖学杂志, 2019, 35(5): 505-509. HUO J L, DONG Q F, WANG G X. The effects of Tanshinone ⅡA on high altitude hypoxia-induced cognitive deficits in rats[J]. Chin J Neuroanat, 2019, 35(5): 505-509. |
| [16] |
蔡明春, 黄庆愿, 徐刚, 等. 间断性高原低氧-复氧对大鼠心脏的影响[J]. 中国循证心血管医学杂志, 2019, 11 (11): 1315-1318. DOI: CNKI:SUN:PZXX.0.2019-11-010 CAI M C, HUANG Q Y, XU G, et al. Influence of intermittent plateau hypoxia/reoxygenation on rat heart[J]. Chin J Evid Based Cardiovasc Med, 2019, 11(11): 1315-1318. DOI: CNKI:SUN:PZXX.0.2019-11-010 |
| [17] |
胡晓兰, 邱水凤, 梅如焕, 等. 红景天注射液对油酸诱导兔急性肺损伤的防治作用[J]. 中草药, 2008(11): 1706-1709. HU X L, QIU S F, MEI R H, et al. Preventive and therapeutic effects of Hongjingtian injection on acute lung injury induced by oleic acid in rabbits[J]. Chin Tradit Herb Drugs, 2008(11): 1706-1709. |




