动脉粥样硬化(atherosclerosis,AS)是一种慢性炎症疾病,为多种心脑血管病的共同基础,其特征是炎性细胞和胆固醇在动脉壁中积聚并涉及全血管病变[1]。近年来,AS造成的心脑血管病死率在逐年上升,严重威胁着人类的健康[2]。而血管平滑肌细胞(vascular smooth muscle cell,VSMCs)过度增殖和异常迁移是AS发生发展中的关键环节[3-4],维持VSMCs增殖与凋亡之间的动态平衡,减少VSMCs的异常迁移对于维持血管正常生理功能至关重要,也是AS潜在的治疗靶点[5]。褪黑素(melatonin,Mel)是松果体分泌的一种吲哚类激素,具有抗炎与抗氧化、调节心血管系统功能的作用。既往的研究[6-7]发现,Mel可以作用于血管VSMCs,具有调节血管VSMCs的作用,但其具体的调节机制目前尚不明确,考虑可能与其抑制VSMCs的过度增殖有关。氧化型低密度脂蛋白(oxidized low- density lipoprotein, ox-LDL)是导致动脉粥样硬化和血管钙化的关键因素,可促进血管平滑肌细胞成骨样分化和钙化。本研究拟通过探讨不同浓度Mel对ox-LDL诱导的VSMCs增殖、细胞周期的影响,并检测与细胞周期及增殖相关蛋白的变化以阐明Mel调控血管VSMCs的分子机制,以期为治疗AS提供新的思路。
1 材料与方法 1.1 主要材料与试剂细胞株:人VSMCs购于中国科学院上海细胞库。ox-LDL、Mel、胎牛血清与胰蛋白酶购自美国Sigma公司,DMEM培养基购自美国Thermo Fisher Scientific公司,CCK-8试剂盒与PI试剂盒购自美国Promega公司,化学发光液(ECL)、RIPA裂解液与BCA蛋白检测试剂盒购自上海碧云天生物研究所。鼠抗PCNA、兔抗α-SMA、兔抗Cyclin A、兔抗P21、兔抗p-P21以及鼠抗β-actin抗体购自英国Abcam公司,兔抗ERK1/2与兔抗p-ERK1/2抗体购自美国CST公司,TRITC标记山羊抗兔IgG、FITC标记山羊抗鼠IgG以及HRP标记山羊抗兔IgG抗体购自美国Santa Cruz公司。
1.2 细胞培养将VSMCs置于含10%胎牛血清、1% 青-链霉素的DMEM培养基中,在37 ℃、5%CO2细胞培养箱内进行培养,每隔2天更换1次培养液。待细胞长满培养瓶瓶底后,采用PBS缓冲液洗涤细胞,加入0.25%胰蛋白酶消化并传代培养,本实验选用第3~6代细胞进行。
1.3 细胞分组与处理使用终浓度分别为0、10、20、50、100 μg/mL的ox-LDL诱导VSMCs 48 h,检测各组细胞增殖情况。使用50 μg/mL的ox-LDL诱导VSMCs 0、6、12、24、48 h,检测各组细胞增殖情况。在50 μg/mL的ox-LDL诱导VSMCs 24 h基础上,使用终浓度分别为1、1×103、1×105、1×106 nmol/L的Mel处理VSMCs 48 h,检测各组细胞增殖情况。使用ox-LDL联合Mel处理VSMCs,具体分组包括:空白对照组(VSMCs正常培养不进行任何处理),Mel组(1×105 nmol/L Mel处理VSMCs 48 h),ox-LDL组(50 μg/mL ox-LDL诱导VSMCs 24 h),ox-LDL+ Mel组(使用50 μg/mL的ox-LDL诱导VSMCs 24 h后,接着使用1×105 nmol/L的Mel处理VSMCs 48 h),并进行后续实验。
1.4 CCK-8实验将生长良好的VSMCs以1×104/孔接种于96孔细胞培养板上,在37 ℃、5%CO2的细胞培养箱中过夜培养。按照1.3进行不同处理,每孔设置3个复孔。接着,每孔加入10 μL CCK-8溶液,混合均匀并置于细胞培养箱内继续培养1 h,培养结束后,使用酶联免疫检测仪测定每孔在波长450 nm处的光密度值D(450)。
1.5 流式细胞术将生长良好的VSMCs接种于6孔细胞培养板,按照使用ox-LDL联合Mel处理VSMCs,并进行实验分组及药物干预,实验结束后收集细胞,PBS洗涤细胞,用预冷的75%乙醇重悬细胞,在-20 ℃下固定24 h,弃去乙醇,再次使用PBS洗涤并重悬细胞,每组取450 μL细胞悬液,加2 μL RNase在37 ℃下孵育10 min,再加入500 μL碘化丙啶,37 ℃避光孵育30 min,通过流式细胞仪检测细胞周期分布。
1.6 免疫荧光染色细胞爬片,处理完毕后,取出6孔板中的载玻片,PBS洗涤玻片,用4% 多聚甲醛固定15 min。室温下采用0.2%Triton X-100透化15 min。用PBS洗涤玻片。用5%胎牛血清室温封闭1 h,分别将鼠抗PCNA(1∶100)、兔抗α-SMA(1∶50)作为一抗加入,以在4 ℃下孵育过夜。次日PBS洗涤玻片后,滴加TRITC标记的山羊抗兔IgG(1∶100)或FITC标记山羊抗鼠IgG(1∶100)作为二抗,暗室室温孵育1 h,PBS洗涤。滴加DAPI染细胞核10 min,PBS再次洗涤后封片,在荧光显微镜观察并进行图像采集。
1.7 Western blot检测将VSMCs按照ox-LDL联合Mel处理VSMCs,并进行实验分组及药物干预,收集各组细胞,使用RIPA裂解液抽提细胞总蛋白,按BCA蛋白检测试剂盒步骤测定蛋白浓度。制备10% SDS-PAGE胶,通过50 V恒压电泳1.5 h,各条带明显分开后将电压调整为110 V电泳1 h来分离蛋白,分离后切胶并在恒流200 mA下转膜4 h,5% 脱脂奶粉室温封闭2 h。分别加鼠抗PCNA(1∶2 000)、兔抗α-SMA(1∶1 000)、兔抗Cyclin A(1∶1 000)、兔抗P21(1∶1 000)、兔抗p-P21(1∶1 000)、兔抗ERK1/2(1∶1 000)、兔抗p-ERK1/2(1∶1 000)、鼠抗β-actin(1∶1 000)抗体,在4 ℃下孵育过夜,次日加HRP标记的山羊抗兔IgG抗体(1∶5 000)后室温孵育2 h,滴加化学发光液ECL显影,使用Image-Pro Plus 6.0分析蛋白质的灰度值。
1.8 统计学分析采用SPSS 23.0软件分析,实验结果以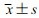
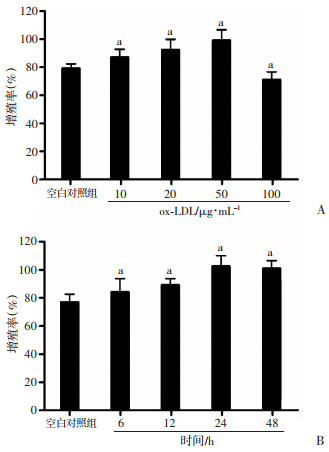
CCK-8法细胞活力测定结果表明,与空白对照组比较,10、20、50 μg/mL的ox-LDL处理VSMCs 48 h可显著促进细胞增殖(P < 0.01),说明在一定范围(0~50 μg/mL)内,ox-LDL呈浓度依赖性地促进VSMCs增殖,其中50 μg/mL ox-LDL作用效果最为显著(P < 0.01)。而ox-LDL浓度继续增加至100 μg/mL时,VSMCs增殖率较对照组显著下降(P < 0.01,图 1A)。
|
|
a: P < 0.01,与空白对照组比较 A:不同浓度ox-LDL对VSMC增殖的影响;B:50 μg/mL ox-LDL作用不同时间对VSMC增殖的影响 图 1 ox-LDL对VSMCs增殖的影响(n=5, 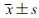 |
接着使用50 μg/mL ox-LDL处理VSMCs 6、12、24、48 h,与空白对照组(0 h)比较,6~24 h时ox-LDL呈时间依赖性地促进VSMCs增殖,其中50 μg/mL ox-LDL作用24 h效果最为显著(P < 0.01,图 1B)。因此后续实验选择50 μg/mL ox-LDL处理VSMCs 24 h建立ox-LDL诱导模型。
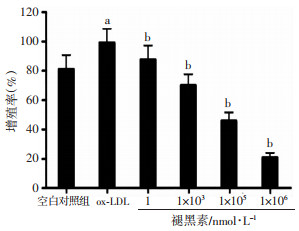
2.2 Mel对ox-LDL诱导的VSMCs增殖的影响CCK-8法细胞活力测定结果表明,与空白对照组比较,ox-LDL组(50 μg/mL ox-LDL处理VSMCs 24 h)VSMCs细胞存活率显著提高(P < 0.01);而1、1×103、1×105、1×106 nmol/L的Mel均可不同程度抑制ox-LDL诱导的VSMC增殖(P < 0.01),其中1×105 nmol/L Mel处理下细胞存活率为50%左右,因此Mel处理浓度以1×105 nmol/L为宜(图 2)。
|
a: P < 0.01,与空白对照组比较;b: P < 0.01,与ox-LDL组比较
图 2
Mel对ox-LDL诱导下VSMCs增殖的影响(n=5,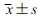 |
2.3 Mel对ox-LDL诱导的VSMCs细胞周期的影响
流式细胞仪分析细胞周期,结果显示,与空白对照组比较,ox-LDL组VSMCs内S期与G1期细胞显著增加,G2期细胞显著下降(P < 0.01),而Mel组S、G1期细胞显著下降,G2期细胞显著增加(P < 0.01);与ox-LDL组比较,ox-LDL+Mel组G1期与S期细胞显著下降,G2期细胞显著增加(P < 0.01,图 3)。
|
A:流式细胞术检测结果;B:各组细胞周期统计分析a: P < 0.01,与空白对照组比较;b: P < 0.01,与ox-LDL组比较
图 3
各组VSMCs细胞周期分布情况(n=5, |
2.4 Mel对ox-LDL诱导的VSMCs内PCNA与α-SMA蛋白表达的影响
免疫荧光染色检测结果显示,ox-LDL组VSMCs内有大量PCNA、α-SMA表达,均较空白对照组显著升高(P < 0.01),而Mel组PCNA与α-SMA的阳性率较对照组显著下降(P < 0.01);与ox-LDL组比较,ox-LDL+Mel组PCNA与α-SMA的阳性率显著下降(P < 0.01,图 4)。

|
1:空白对照组;2:ox-LDL组;3:褪黑素组;4:ox-LDL+褪黑素组;a: P < 0.01,与空白对照组比较;b: P < 0.01,与ox-LDL组比较
图 4
各组VSMCs细胞PCNA(A)、α-SMA(B)免疫荧光染色(左)与阳性表达定量分析(右) (n=5,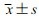 |
Western blot检测结果与上述结果一致,与空白对照组比较,ox-LDL组VSMCs内PCNA蛋白与α-SMA蛋白表达显著升高,而Mel组PCNA、α-SMA蛋白表达显著下降(P < 0.01);ox-LDL+Mel组PCNA、α-SMA蛋白表达较ox-LDL组显著下降(P < 0.01,图 5)。
|
1:空白对照组;2:ox-LDL组;3:褪黑素组;4:ox-LDL+褪黑素组;a: P < 0.01,与空白对照组比较;b: P < 0.01,与ox-LDL组比较
图 5
各组VSMCs细胞PCNA与α-SMA的蛋白表达量(n=5,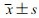 |
2.5 Mel对ox-LDL诱导的VSMCs内Cyclin A、p-ERK1/2、p-P21蛋白表达的影响
Western blot检测结果显示,ox-LDL组VSMCs内Cyclin A、p-ERK1/2蛋白表达显著升高,而p-P21蛋白表达显著下降(P < 0.01)。Mel组检测结果与此相反,即Cyclin A与p-ERK1/2蛋白表达显著下降,p-P21蛋白表达显著升高(P < 0.01);与ox-LDL组比较,ox-LDL+Mel组Cyclin A与p-ERK1/2蛋白表达显著下降,而p-P21蛋白表达显著升高(P < 0.01,图 6)。

|
1:空白对照组;2:ox-LDL组;3:褪黑素组;4:ox-LDL+褪黑素组;a: P < 0.01,与空白对照组比较;b: P < 0.01,与ox-LDL组比较
图 6
各组VSMCs细胞Cyclin A、p-ERK1/2和p-P21的蛋白表达量(n=5, |
3 讨论
AS是多种心血管疾病病理与生理的病变基础,虽然经过多年研究,但目前AS的发病机制尚未完全明确,其病变复杂漫长,并涉及脂质代谢紊乱、炎症免疫、氧化应激、细胞增殖等多种过程间的相互作用[4, 8]。VSMCs在维持血管形状和机械稳定性中起着主要作用,而VSMCs的异常增殖与迁移是AS发病的基础[3]。有研究表明,VSMCs过度增殖跟ox-LDL诱导的体内氧化和抗氧化平衡失调有关,氧化损伤导致了细胞向内膜下增殖,血管壁增厚和管腔狭窄,从而加速了AS病变进程[9-10]。因此,寻找控制VSMCs过度增殖的靶点和有效药物,已成为当前防治AS性心血管疾病的重要方法之一。既往的研究已经发现Mel可以影响VSMCs的增殖与迁移[6],但其具体的机制尚不十分明确,我们考虑其可能是通过干预VSMCs细胞周期,从而抑制ox-LDL诱导的VSMCs增殖。
3.1 Mel可能通过干预细胞周期来实现对VSMCs功能的影响本研究使用不同浓度ox-LDL刺激VSMCs后发现ox-LDL在一定范围(0~50 μg/mL)内能够明显促进VSMCs的增殖,与他人既往的研究结果相一致。同时发现50 μg/mL ox-LDL诱导24 h可通过增加细胞S期与G2/M期比例、减少G0/G1期比例来加速细胞周期进程,并促进细胞增殖。细胞增殖活力是反映增殖程度的重要指标[11],抑制VSMCs的周期循环进程已被认为是控制VSMCs增殖与迁移的有效策略[12]。
既往的研究提示Mel具有保护血管VSMCs功能,减少细胞凋亡的作用。因此,我们拟通过研究不同浓度Mel对ox-LDL诱导的VSMCs增殖的影响,来揭示Mel影响VSMCs的可能分子机制。首先,通过流式细胞仪分析细胞周期发现不同浓度的Mel可以抑制ox-LDL诱导的VSMCs增殖,并且这种作用随着Mel浓度增加而增强,但当Mel浓度超过1×105 nmol/L时,细胞存活明显减少。在1×105 nmol/L Mel作用下,细胞S期与G2/M期比例减少,并可使G0/G1期阻滞。由此表明,Mel可以通过干预细胞周期来抑制由ox-LDL诱导的VSMCs增殖。进一步的分子生物学研究也证实了这一点。通过上述实验结果,我们认为Mel可能通过干预细胞周期来实现对VSMCs功能的影响。
3.2 抑制ERK1/2信号通路,调控VSMCs细胞周期,可抑制VSMCs过度增殖细胞外调节蛋白激酶1/2(ERK1/2)是MAPK的一个亚家族,是将信号从表面受体传导至细胞核并产生生物学效应的关键。磷酸化激活的ERK1/2由胞质转位到核内,进而介导ELK-1、ATF、Ap-1、c-fos和c-Jun的转录活化,参与细胞增殖与分化、细胞形态维持及细胞凋亡等多种生物学反应。既往的研究证实,激活ERK信号通路可促进主动脉平滑肌细胞增殖[13]。ox-LDL诱导VSMC增殖的同时,伴随MAPK的活化,并可诱导ERK1/2的活化。ERK1/2活化可激活其下游底物MSKl、P90RSK、C-Myc、ELK-1的磷酸化,从而启动细胞增殖功能。使用ERK1/2的特异阻断剂可抑制ox-LDL诱导的VSMCs的增殖。本研究在利用Mel干预ox-LDL诱导的VSMCs增殖过程,使用Western blot分析观察到ERK1/2信号通路变化,结果显示,ox-LDL可以诱导ERK1/2蛋白磷酸化,从而启动VSMCs增殖过程。而在使用Mel进行干预后,该过程可以被明显抑制。该结果提示,Mel抑制VSMCs增殖与其特异性阻断ERK1/2信号通路有关。
细胞增殖是通过细胞周期调控的,而细胞周期又受正调节因子和负调节因子的调节。Cyclin A作为一种细胞周期蛋白,能够通过调节DNA合成和促进细胞有丝分裂起到正向作用[14]。p21是一种重要的细胞周期调控蛋白,参与细胞的生长、分化、衰老及死亡过程,同时又与肿瘤发生密切相关,在细胞的生理、病理过程中发挥着重要的作用。过去的研究证实p21能够与Cyclin D/cdk形成复合物使细胞周期停滞在G1期;它还可以通过C端与PCNA相互作用,阻断PCNA活化DNA聚合酶的活性从而抑制DNA的合成,使细胞周期停滞[15]。既往研究发现Mel具有调节P21蛋白的功能[16]。本研究通过Western blot分析发现,Mel可以通过上调p21表达并抑制Cyclin A蛋白的作用,从而起到调控VSMCs细胞周期的作用。VSMC表型的转化是许多血管增生性疾病,如动脉粥样硬化、血管成形术后再狭窄等和移植性血管病变中共同的细胞病理基础。α-平滑肌肌动蛋白(α-SMA)是平滑肌的标志物,常用来反映VSMCs数量及其收缩能力的改变[17],是VSMCs早期分化的特异性标志,也是应用最多的收缩型标志蛋白。增殖细胞核抗原(PCNA)是反映细胞增殖的标志物,其表达水平的高低可反映细胞的增殖活性[18]。本研究分别通过免疫荧光染色和Western blot检测观察Mel对ox-LDL诱导的VSMC增殖标志物PCNA以及α-SMA表达的影响,结果发现,Mel可显著抑制由ox-LDL诱导的VSMCs内PCNA、α-SMA表达的升高。这些结果进一步揭示了Mel对VSMCs细胞周期的作用,可能通过调控VSMCs细胞周期,起到抑制VSMCs增殖的作用。VSMCs并不是终末端分化型的细胞,在血管发育过程中VSMCs从去分化型逐渐发展为分化型,在病理条件下又可以从分化型转化回去分化型。VSMCs这种随微环境因素变化调控表型发生逆转,在内膜损伤修复、血管性疾病发生发展进程中发挥重要作用。
综上所述,Mel具有抑制VSMCs增殖的作用,其机制可能是通过抑制ERK1/2信号通路,使得ERK1/2表达减弱,从而调节PCNA、α-SMA、Cyclin A蛋白及p21蛋白表达,调控VSMCs细胞周期,起到抑制VSMCs过度增殖的作用。本研究的结果可望为探索AS的发病机制及药物作用靶点提供新的思路和实验依据。
| [1] |
PARMA L, BAGANHA F, QUAX P H A, et al. Plaque angiogenesis and intraplaque hemorrhage in atherosclerosis[J]. Eur J Pharmacol, 2017, 816: 107-115. DOI:10.1016/j.ejphar.2017.04.028 |
| [2] |
JAIN T, NIKOLOPOULOU E A, XU Q B, et al. Hypoxia inducible factor as a therapeutic target for atherosclerosis[J]. Pharmacol Ther, 2018, 183: 22-33. DOI:10.1016/j.pharmthera.2017.09.003 |
| [3] |
LACOLLEY P, REGNAULT V, NICOLETTI A, et al. The vascular smooth muscle cell in arterial pathology: a cell that can take on multiple roles[J]. Cardiovasc Res, 2012, 95(2): 194-204. DOI:10.1093/cvr/cvs135 |
| [4] |
袁帅, 廖思聪, 王大新. 血管平滑肌细胞与动脉粥样硬化关系的研究进展[J]. 实用心脑肺血管病杂志, 2018, 26(2): 6-8, 12. YUAN S, LIAO S C, WANG D X. Progress on relationship between vascular smooth muscle cell and atherosclerosis[J]. Pract J Cardiac Cereb Pneumal Vasc Dis, 2018, 26(2): 6-8, 12. DOI:10.3969/j.issn.1008-5971.2018.02.002 |
| [5] |
张强, 徐立. Ox-LDL在动脉粥样硬化中的致病机制及检测方法研究进展[J]. 国际检验医学杂志, 2018, 39(19): 2432-2436. XU L, ZHANG Q. Pathogenesis and detection of ox-LDL in atherosclerosis[J]. Int J Lab Med, 2018, 39(19): 2432-2436. DOI:10.3969/j.issn.1673-4130.2018.19.025 |
| [6] |
ZHAO T, ZHANG H, JIN C, et al. Melatonin mediates vasodilation through both direct and indirect activation of BKCa channels[J]. J Mol Endocrinol, 2017, 59(3): 219-233. DOI:10.1530/JME-17-0028 |
| [7] |
刘振华, 李步潆, 段维勋, 等. 褪黑素抑制磷酸钙诱导的大鼠主动脉血管平滑肌细胞凋亡[J]. 中国体外循环杂志, 2016, 14(2): 112-115, 119. LIU Z H, LI B Y, DUAN W X, et al. Melatonin inhibits apoptosis of rat aortic vascular smooth muscle cells induced by CaPO4[J]. Chin J Extracorpor Circ, 2016, 14(2): 112-115, 119. DOI:10.13498/j.cnki.chin.j.ecc.2016.02.13 |
| [8] |
ZHANG Y, LIU N M, WANG Y, et al. Endothelial cell calpain as a critical modulator of angiogenesis[J]. Biochim Biophys Acta Mol Basis Dis, 2017, 1863(6): 1326-1335. DOI:10.1016/j.bbadis.2017.03.021 |
| [9] |
雷灵亮, 贝俊杰. 动脉粥样硬化斑块内血管生成的研究进展及治疗策略[J]. 心血管病学进展, 2019, 40(3): 478-482. LEI L L, BEI J J. Progress and treatment strategies of plaque angiogenesis in atherosclerosis[J]. Adv Cardiovasc Dis, 2019, 40(3): 478-482. DOI:10.16806/j.cnki.issn.1004-3934.2019.03.044 |
| [10] |
CORNELISSEN A, GUO L, SAKAMOTO A, et al. New insights into the role of iron in inflammation and atherosclerosis[J]. EBio Medicine, 2019, 47: 598-606. DOI:10.1016/j.ebiom.2019.08.014 |
| [11] |
KWON H, LEE J J, LEE J H, et al. Cinnamon and its components suppress vascular smooth muscle cell proliferation by up-regulating cyclin-dependent kinase inhibitors[J]. Am J Chin Med, 2015, 43(4): 621-636. DOI:10.1142/S0192415X1550038X |
| [12] |
OZER N K, TAHA S, AZZI A. Homocysteine induces DNA synthesis and proliferation of vascular smooth muscle cells by interfering with MAPK kinase pathway[J]. Biofactors, 2005, 24(1/2/3/4): 193-199. DOI:10.1002/biof.5520240123 |
| [13] |
WANG S C. PCNA: a silent housekeeper or a potential therapeutic target?[J]. Trends Pharmacol Sci, 2014, 35(4): 178-186. DOI:10.1016/j.tips.2014.02.004 |
| [14] |
SHINDE A V, HUMERES C, FRANGOGIANNIS N G. The role of α-smooth muscle actin in fibroblast-mediated matrix contraction and remodeling[J]. Biochim Biophys Acta Mol Basis Dis, 2017, 1863(1): 298-309. DOI:10.1016/j.bbadis.2016.11.006 |
| [15] |
ELKADY A I, HUSSEIN R A, ABU-ZINADAH O A. Differential control of growth, apoptotic activity and gene expression in human colon cancer cells by extracts derived from medicinal herbs, Rhazya stricta and Zingiber officinale and their combination[J]. World J Gastroenterol, 2014, 20(41): 15275-15288. DOI:10.3748/wjg.v20.i41.15275 |
| [16] |
徐丽, 金清东, 宫喜, 等. 褪黑素的抗胃癌效应及其引起的Bcl-2、Bax、p21和p53的表达变化[J]. 生理学报, 2014, 66(6): 723-729. XU L, JIN Q D, GONG X, et al. Anti-gastric cancer effect of melatonin and Bcl-2, Bax, p21 and p53 expression changes[J]. Acta Physiol Sin, 2014, 66(6): 723-729. DOI:10.13294/j.aps.2014.0086 |
| [17] |
YU S, CHEN Y, CHEN S, et al. Klotho inhibits proliferation and migration of angiotensin Ⅱ-induced vascular smooth muscle cells (VSMCs) by modulating NF-κB p65, Akt, and extracellular signal regulated kinase (ERK) signaling activities[J]. Med Sci Monit, 2018, 24: 4851-4860. DOI:10.12659/msm.908038 |
| [18] |
LI T, WANG F, DANG Y, et al. P21 and P27 promote tumorigenesis and progression via cell cycle acceleration in seminal vesicles of TRAMP mice[J]. Int J Biol Sci, 2019, 15(10): 2198-2210. DOI:10.7150/ijbs.35092 |




