2. 550004 贵阳,中国医学科学院成体干细胞转化研究重点实验室;
3. 563000 贵州 遵义,遵义医科大学附属医院儿科学教研室
2. Key Laboratory of Adult Stem Cell Translational Research, Chinese Academy of Medical Sciences, Guiyang, Guizhou Province, 550004;
3. Department of Pediatrics, the Affiliated Hospital of Zunyi Medical University, Zunyi, Guizhou Province, 563000, China
核糖体是细胞合成蛋白质的必要场所,其中合成过程需要多种核糖体蛋白(ribosomal proteins, RPs)的参与,合成蛋白质的过程也需精确调控。RPs广泛存在于细胞中,参与RNA结合的过程,其中包括参与DNA修复、凋亡、翻译调节、发育控制等[1-2]。一些RPs的突变可能易导致核糖体生物发生过程的障碍,从而引起游离的RPs积聚,最终引起核糖体功能障碍而导致多种疾病[3]。人核糖体蛋白L15(ribosomal protein L15,RPL15)是核糖体L15E蛋白家族的成员,是核糖体大亚基60S的一部分,位于真核细胞的核仁内,在核糖体大亚基的组装过程中发挥重要的作用[4]。
随着对RPL15的深入研究,RPL15表达水平与多种疾病的发生或发展密切相关,在胃癌、食管癌、胰腺癌及结肠癌中均发现RPL15的异常表达,并且这些异常表达与癌症的发展和预后息息相关[5-8]。在先天性红系再生障碍性贫血(diamond-blackfan anemia,DBA)中也发现了一个由RPL15基因突变引起的DBA新亚型,确定了RPL15为一个新的DBA致病基因[9]。DBA是一种罕见的先天性骨髓疾病,也被认为是一种核糖体病,患病者具有核糖体蛋白基因突变,DBA的主要表型为红细胞再生障碍性贫血、皮肤和骨骼异常以及癌症易感性。在临床上治疗DBA的方法主要为通过红细胞输注和糖皮质激素治疗来缓解病程,通过造血干细胞移植以期完全缓解[10]。改变一种核糖体蛋白的表达会影响细胞的存活[11]。然而对于DBA的发病机制及核糖体缺陷如何产生一系列独特而多样的异常表型仍不清楚。
虽然利用小鼠模型进行造血发育过程的研究有一定的优势,但相对于斑马鱼,小鼠作为实验动物仍存在发育慢、成本昂贵等局限性。斑马鱼作为与人类造血调控高度保守的模式生物,其优势便显现出来。已有研究表明,RPL15作为DBA的致病基因之一,在胚胎发育过程中有着重要的作用,但尚未报道RPL15在早期胚胎发育过程中对造血发育的影响。本研究旨在通过显微注射吗啉代反义寡核苷酸(morpholino antisense oligo,MO)技术下调斑马鱼中核糖体蛋白l15(rpl15)基因的表达,并通过检测早期造血发育过程中的关键转录因子的表达情况,以期了解rpl15基因在造血发育过程中可能的作用。
1 材料与方法 1.1 材料 1.1.1 实验动物实验中采用的Tüebingen品系野生型斑马鱼的胚胎与幼鱼均由本实验室自行繁育。
1.1.2 试剂与仪器斑马鱼血红蛋白O-dianisidine染色试剂盒购自苏州木芮生物科技有限公司;反转录试剂First Stand cDNA Synthesis Kit、NE-PERTM细胞核和细胞质提取试剂盒、BCA蛋白质定量试剂盒购自美国Thermo Fisher公司;DIG RNA Labeling Mix、蛋白酶K、anti-DIG-AP购自瑞士Roche公司;T3/T7 polymerase购自美国Promega公司;Talent荧光定量检测试剂盒(SYBR Green)购自天根生化有限公司;TRIzol试剂、NucAwayTM Spin Columns购自美国Ambion公司;BCIP/NBT购自日本VectorLab公司;Rabbit Anti-RPL15抗体和Goat Anti-Rabbit IgG H & L(HRP)均购自英国Abcam公司;PVDF膜和ECL化学发光液均购自美国Millipore公司;TUNEL试剂盒购自美国Promega公司;荧光定量PCR仪购自美国Bio-Rad公司;分子杂交箱购自美国UVP公司;显微注射仪、拉针仪购自日本成茂公司;体视显微镜购自日本Nikon公司。
1.2 实验方法 1.2.1 斑马鱼胚胎收集斑马鱼野生型Tüebingen品系养殖标准参照The Zebrafish book[12],养殖在本课题组28.5 ℃的14 h光照/10 h黑暗的循环水系统中[13]。按照雌雄1∶2或者1∶1的比例将性成熟[>90受精后天数(days post-fertilization,dpf)]的斑马鱼进行配对,并在两鱼中间用透明胶板隔开,在第2天光照刺激5~10 min后拔去胶板,约在0.5 h后收集斑马鱼胚胎,加入胚胎培养液eggwater(0.06 mg/mL海盐、0.5 mg/L亚甲基蓝)并置于28.5 ℃的培养箱中孵化,每天更换eggwater 2次并吸出死胚。
1.2.2 吗啉代反义寡核苷酸及显微注射rpl15 MO(5′CACTGTTACACCACCTGGCATCTTG-3′)用于下调斑马鱼rpl15的表达,是针对pre-RNA在第2外显子/第2内含子的剪接而设计,用于特异性阻断rpl15的2号内含子的剪接过程。control MO(5′-GCGCCATT-GCTTTGCAAGAATT-3′)作为对照组(CO),是一段无意义的25个碱基序列。以上两种Morpholino均由美国Gene tools公司合成。斑马鱼交配后及时收集胚胎,使用显微注射仪将0.5 μg/μL浓度的MO注入1个或2个细胞期的野生型胚胎中,经前期研究发现,最适注射量为每枚胚胎3 nL的Morpholino。
1.2.3 O-dianisidine血红蛋白染色分别收集rpl15 MO注射组(MO)和野生型组(WT)的受精后小时数(hours post-fertilization,hpf)为24 hpf和36 hpf的胚胎,每组20枚左右,置于1.5 mL的Epp管中。根据试剂盒说明书,加入1 mL现配的染色液避光染色,置于摇床上室温条件下慢摇染色20 min。弃去染液后再加入1 mL的漂洗液室温慢摇5 min,重复洗涤3次,在体视显微镜下观察并拍照。
1.2.4 实时荧光定量PCR收集MO组和WT组的胚胎,每组50枚左右,使用蛋白酶K脱卵膜后,再加入1 mL的TRIzol充分匀浆处理,经氯仿抽提2次,然后异丙醇沉淀、75%乙醇洗涤晾干后,加入适量DEPC水溶解。得到总RNA按照First Stand cDNA Synthesis Kit试剂盒说明书反转录得到的cDNA。按照Talent荧光定量检测试剂盒(SYBR Green)的要求制备实时荧光定量PCR的反应体系,在95 ℃,10 min;95 ℃,10 s;55 ℃,20 s条件下扩增40个循环。根据斑马鱼的mRNA序列设计引物,引物由上海英杰生命技术有限公司合成,序列见表 1。
| 引物名称 | 引物序列(5′→3′) | 产物长度/bp |
| rpl15 | 上游: ACAAGGCCAAACAAGGCTATG 下游: TAGGAGTTCAGGACCCGGAG |
199 |
| gata1 | 上游: ATTATTCCACCAGCGTCCAG 下游: TGGGGTTGTAGGGAGAGTTTAG |
147 |
| pu.1 | 上游: TCTGGTGGGTGGATCGAGAA 下游: TGACTTCTCCCGTCTTTCCG |
159 |
| mpo | 上游: CCGAGATGGCGATAGGTTGT 下游: GGAATCTCTATCAGTCTCTTTCCA |
223 |
| runx1 | 上游: CAATGACCTGCGTTTCGTGG 下游: ACTGCTTCATCCGGCTTCTG |
168 |
| c-myb | 上游: ATGCTATTGATTCGGCCCCA 下游: GCAAAGAAAAGTGGGGGCAC |
116 |
| scl | 上游: TAGCAATCGAGTCAAGCGCA 下游: CAATTTTGGGCTGCGAACCATC |
71 |
| lmo2 | 上游: TCGGAGACCGCTTCTTTCTG 下游: CCTGACCAAACAGTCTGAGGTA |
110 |
| hbae3 | 上游: AGCTACACGCCTTCATGCTG 下游: TGTCCACGGAAACATGCACC |
126 |
| hbbe1 | 上游: TCGTGTACCCCTGGACTCAG 下游: ACAGTTTTACCGTGGGCAGC |
103 |
| gapdh | 上游: AGGCAAGGCGGCAAAC 下游: AAGACACCAGTAGACTCCACAAC |
124 |
1.2.5 Western blot法检测斑马鱼rpl15蛋白表达变化
收集WT组及rpl15 MO注射组的胚胎,每组50枚,使用NE-PERTM细胞核和细胞质提取试剂分别提取斑马鱼胚胎细胞质和细胞核的蛋白质,经BCA蛋白定量后上样。变性的蛋白在SDS-PAGE凝胶中进行电泳分离,然后湿转至甲醇激活的PVDF膜上。再以5%的脱脂奶粉封闭1 h;1×TBST洗3次后,加入稀释1 000倍的Rabbit Anti-RPL15抗体于4 ℃孵育过夜;1×TBST洗3次后,加入稀释2 000倍的Goat Anti-Rabbit IgG H & L(HRP)室温孵育2 h;1×TBST洗3次后,根据ECL检测试剂盒说明书配制曝光液,使用化学发光分析仪检测并扫描图像。
1.2.6 斑马鱼胚胎全胚原位杂交收集24 hpf和36 hpf的WT组及rpl15 MO注射组的胚胎,每组35枚,脱膜后用4% PFA固定,甲醇梯度脱水后置于-20 ℃中冻存备用。固定好的胚胎洗去多余甲醇,36 hpf的胚胎用蛋白酶K进行通透处理,先置于68 ℃杂交炉中预杂交1 h,向24 hpf样本中加入提前制备好的地高辛标记的gata1、pu.1、mpo、scl、lmo2反义mRNA探针,向36 hpf样本中加入地高辛标记的runx1、c-myb探针,68 ℃条件下杂交过夜。第2天依次用不同浓度的SSC缓冲液洗去多余的探针,加入稀释5 000倍的anti-DIG-AP于4 ℃反应过夜。第3天用MABT洗掉多余抗体,再加入新鲜配制的BCIP/NBT避光显色,在体式显微镜下观察到出现蓝紫色杂交信号即终止染色,并用4% PFA固定后,将胚胎放在均匀涂抹甲基纤维素的玻璃皿上,在体视显微镜下拍照。
1.2.7 斑马鱼整胚TUNEL染色收集24 hpf的WT组及rpl15 MO注射组的胚胎,每组15枚并用4% PFA固定,梯度脱水后置于-20 ℃冻存,第2天取出进行梯度复水,然后根据TUNEL试剂盒配制TUNEL染色液,染色在37 ℃温箱中孵育1 h,然后用荧光显微镜拍照。
1.3 统计学分析实验均重复3次或3次以上,并用GraphPad Prism 8.0软件进行统计与制图,其中所有数据以
分别提取24 hpf和36 hpf时的rpl15 MO注射组(MO)、control MO注射组(CO)和WT组斑马鱼的总RNA,反转录为cDNA,qRT-PCR实验结果显示,MO组rpl15的mRNA表达量明显低于CO组及WT组(P < 0.001),而CO组与WT组之间差异无统计学意义(图 1A)。提取48 hpf时3组的蛋白质,利用Western blot检测rpl15蛋白表达量的变化,MO组的rpl15蛋白相对表达量明显低于CO组和WT组(P < 0.001),而CO组与WT组之间差异无统计学意义(图 1B)。表明注射rpl15 MO能成功下调斑马鱼rpl15的表达。
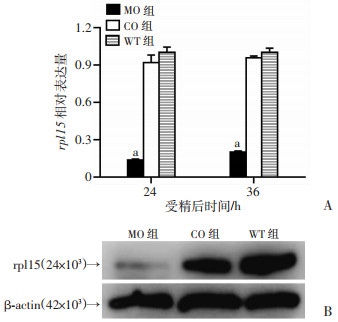
|
| A:qRT-PCR检测下调斑马鱼胚胎rpl15基因的mRNA表达a: P < 0.001,与WT组比较;B:Western blot检测48 hpf斑马鱼胚胎rpl15蛋白水平的表达 图 1 qRT-PCR及Western blot法检测rpl15 MO的有效性 |
2.2 下调rpl15表达对斑马鱼胚胎发育的影响
与WT组相比,MO组的胚胎出现体节弯曲、发育迟缓、心包肿大、黑色素分布异常等异常表型(图 2)。
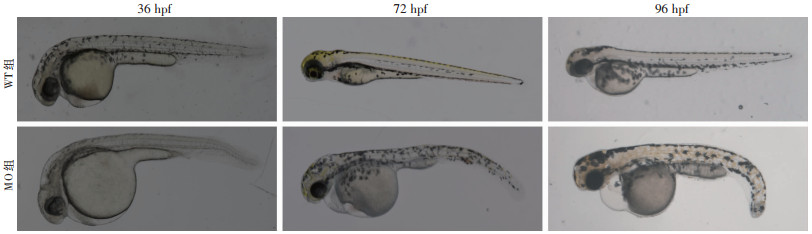
|
| 图 2 rpl15缺乏的斑马鱼胚胎表现出形态异常 |
2.3 O-dianisidine血红蛋白染色及红系特异性标记物的mRNA表达
在体式显微镜下观察MO组及WT组的血红蛋白染色结果,发现在24 hpf和36 hpf时,MO组的血红蛋白表达量明显少于WT组(图 3A)。在48 hpf时,MO组的斑马鱼胚胎的红系特异性标记物hbae3和hbbe1的mRNA表达水平明显低于WT组(图 3B)。

|
| A:斑马鱼O-dianisidine血红蛋白染色↑:示染色结果区域;B:48 hpf时两组hbae3及hbbe1的mRNA表达a: P < 0.001,与WT组比较 图 3 斑马鱼O-dianisidine血红蛋白染色及hbae3、hbbe1的mRNA水平的变化 |
2.4 rpl15基因表达下调对斑马鱼早期造血发育的关键转录因子的影响
原位杂交结果显示,24 hpf的MO组红系特异性转录因子gata1阳性杂交信号明显少于WT组,髓系特异性转录因子pu.1的表达量、粒系转录因子mpo的阳性表达量与WT组无显著差异(图 4A~F)。在36 hpf,MO组斑马鱼胚胎的定向造血标志转录因子runx1和c-myb的表达较WT组无明显差别(图 4)。

|
| ↑:示阳性杂交信号 图 4 原位杂交技术检测早期造血发育过程的关键转录因子的表达变化(×30) |
2.5 原位杂交法检测rpl15基因表达下调对斑马鱼造血分化过程的关键因子scl、lmo2的影响
原位杂交结果显示,MO组24 hpf lmo2的表达量与WT组相比无明显差别,24 hpf及36 hpf的scl的表达量较WT组均明显减少(图 5)。
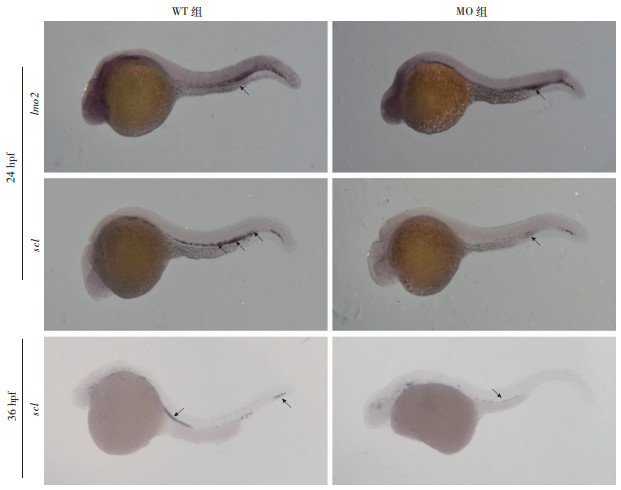
|
| ↑:示阳性杂交信号 图 5 原位杂交技术检测造血分化的关键因子scl和lmo2的变化(×30) |
2.6 TUNEL检测ICM区的造血祖细胞凋亡情况
使用TUNEL法分别检测24 hpf的MO组斑马鱼胚胎和WT组胚胎的细胞凋亡情况,发现MO组斑马鱼胚胎的中间细胞团造血区(intermediate cell mass,ICM)的凋亡细胞数与WT组间无明显差别(图 6)。提示rpl15对于红系发育的调控可能与细胞凋亡无关。
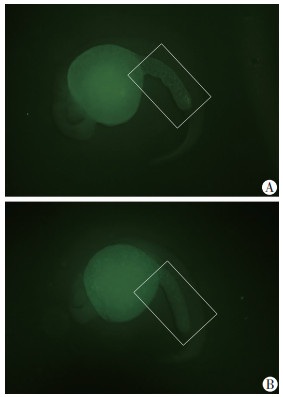
|
| A:WT组;B:MO组;方框为ICM区 图 6 斑马鱼胚胎在24 hpf时ICM区的凋亡变化(×30) |
2.7 rpl15基因表达下调对斑马鱼早期造血发育过程关键转录因子mRNA水平的影响
qRT-PCR结果显示,24 hpf的斑马鱼胚胎的MO组gata1的mRNA表达量较WT组明显降低(P < 0.05,图 7A),而两组之间24 hpf的pu.1、mpo的mRNA表达量差异无统计学意义(P>0.05)。36 hpf的MO组斑马鱼胚胎runx1、c-myb的表达量与WT组间无明显差异(图 7B)。在24 hpf,MO组斑马鱼胚胎scl的表达量较WT明显减少(P < 0.01,图 7A),而lmo2的表达量与WT组之间无明显差异。
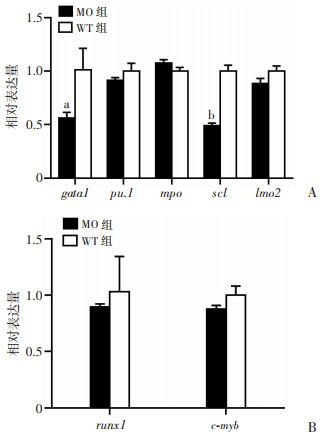
|
| A:RT-PCR检测24 hpf两组gata1、pu.1、mpo、scl、lmo2的mRNA表达;B:qRT-PCR检测36 hpf两组runx1、c-myb的mRNA表达a:P < 0.05,b:P < 0.01,与WT组比较 图 7 斑马鱼胚胎关键转录因子的mRNA表达变化 |
3 讨论
编码核糖体成分和核糖体生物发生因子的基因突变可引起“核糖体病”[4, 14]。多达19个RP基因已经被确定为DBA的相关致病基因[2-4]。由于患者样本的可获得性有限,缺乏合适的动物模型,携带致病RP基因纯合突变的敲除小鼠在发育早期死亡,杂合突变体没有表现出异常症状[15]等原因,对DBA的发病机制仍然知之甚少,临床上也没有有效的治疗方法,因此,亟需探索新的方法,为研究DBA的发病机制及临床治疗方法提供基础。
斑马鱼(Danio Rerio)造血调控的基因高度保守[16-18]。在斑马鱼的研究中,一些疾病建模技术已发展至成熟,如使用吗啉代反义寡核苷酸(Morpholino, MO)敲低靶基因的表达或使用CRISPR/Cas9系统敲除目标基因来建立疾病模型[19]。Morpholino技术由于其便利性及可行性已经越来越多地应用于斑马鱼基因功能的研究中,通过显微注射的方式将Morpholino直接注射至斑马鱼的胚胎中,干扰靶基因结合的过程,从而使得靶基因能被沉默[20]。
脊椎动物的造血发育是一个复杂的、多因素协调的过程[21]。斑马鱼的造血过程与人类一样分为原始造血与定向造血两个阶段[22]。原始造血过程主要受到特异性红系前体细胞标志物gata1的影响,在红系标志转录因子gata1与髓系转录因子pu.1、粒系标志物mpo间有着交叉抑制作用[23]。简而言之,当红系转录因子gata1的表达受到抑制时,pu.1和mpo的表达则会相应增多。为了探究rpl15基因在早期造血发育过程中的作用,本研究利用MO技术,下调斑马鱼中rpl15的表达,发现斑马鱼初级红系的造血发育过程受到抑制,血红蛋白生成量、特异性红系前体细胞标志转录因子的表达均随着rpl15的下调而减少,但pu.1及mpo的表达却没有明显变化,斑马鱼胚胎呈现出类似DBA的仅红系发育障碍的表型。
斑马鱼的定向造血的过程的特点是能自我更新与多向分化,定向造血的调控过程通过转录因子runx1及c-myb的调控来实现,当定向造血转录因子的表达减低时,会导致红系、髓系及粒系细胞的生成量均减少[24]。本研究中,rpl15表达减少对定向造血的关键转录因子runx1和c-myb均未产生影响,表明rpl15的减少并未影响斑马鱼定向造血发育的过程,也并非通过影响定向造血的过程而引起红系造血发育过程的障碍。
基于gata1与pu.1的相互抑制的作用[23],理论上,当红系发育受到抑制时,前体细胞向髓系与粒系的分化应当相应的增多,但本研究中髓系与粒系并未受到影响,结合原始红细胞的生成过程,我们推测斑马鱼rpl15下调对红系发育的抑制可能不仅仅是由于影响了前体细胞的发育而引起。
为了探究rpl15下调引起的红系发育障碍是否由于除前体细胞发育异常的其他原因,我们进一步检测了下调rpl15的表达对在24 hpf时初级造血细胞的正常分化过程中的关键基因scl、血液祖细胞标记基因lmo2的影响。研究表明,rpl15下调引起scl的显著减少,而lmo2的表达变化未见明显差异。scl在造血发育过程中起着不可或缺的作用,它是既参与初级原始造血又参与定向造血过程的基因。当检测到髓系转录因子与粒系转录因子的表达无明显变化时,推测可能是由于rpl15的下调导致间接影响了髓系发育过程,使得原本受到交互抑制作用应当高表达的髓系标记基因pu.1的表达降低,从而间接抵消了由于gata1降低引起的pu.1表达上调,最终导致检测不到pu.1明显的表达变化。换句话说,敲低rpl15导致scl表达下调,进而引起初级造血髓系标志物pu.1及粒系造血标志转录因子mpo的表达下调,从而可能抵消了gata1与pu.1、mpo由于交互抑制本应引起的pu.1与mpo的表达上调,因此我们无法检测到pu.1及mpo表达量的变化。
rpl15的表达下调使野生型斑马鱼胚胎呈现类似于人DBA的红系特异性障碍的表型,但髓系与粒系造血均未受到明显的影响,红系祖细胞未出现明显凋亡,还发现胚胎的scl表达量显著减少,而lmo2的表达量无明显差别,这说明了在斑马鱼的早期造血过程中可能是由于早期造血发育的gata1与scl表达下降而导致的红系造血发育的障碍。本研究提示,rpl15在早期的造血发育过程中有着重要的作用,下调rpl15的表达抑制了斑马鱼早期的造血发育,并可能与gata1和scl表达明显降低有关,为进一步研究rpl15的功能奠定了基础。
| [1] |
PELLETIER J, THOMAS G, VOLAREVIC S. Ribosome biogenesis in cancer: new players and therapeutic avenues[J]. Nat Rev Cancer, 2018, 18(1): 51-63. DOI:10.1038/nrc.2017.104 |
| [2] |
NIKULIN A D. Structural aspects of ribosomal RNA recognition by ribosomal proteins[J]. Biochemistry (Mosc), 2018, 83. DOI:10.1134/s0006297918140109 |
| [3] |
LESSARD F, BRAKIER-GINGRAS L, FERBEYRE G. Ribosomal proteins control tumor suppressor pathways in response to nucleolar stress[J]. Bioessays, 2019, 41(3). DOI:10.1002/bies.201800183 |
| [4] |
ASPESI A, ELLIS S R. Rare ribosomopathies: insights into mechanisms of cancer[J]. Nat Rev Cancer, 2019, 19(4): 228-238. DOI:10.1038/s41568-019-0105-0 |
| [5] |
WANG H, ZHAO L N, LI K Z, et al. Overexpression of ribosomal protein L15 is associated with cell proliferation in gastric cancer[J]. BMC Cancer, 2006, 6: 91. DOI:10.1186/1471-2407-6-91 |
| [6] |
YAN T T, FU X L, LI J, et al. Downregulation of RPL15 may predict poor survival and associate with tumor progression in pancreatic ductal adenocarcinoma[J]. Oncotarget, 2015, 6(35): 37028-37042. DOI:10.18632/oncotarget.5939 |
| [7] |
DONG Z, JIANG H, LIANG S, et al. Ribosomal protein L15 is involved in colon carcinogenesis[J]. Int J Med Sci, 2019, 16(8): 1132-1141. DOI:10.7150/ijms.34386 |
| [8] |
SULIMA S O, HOFMAN I J F, DE KEERSMAECKER K, et al. How ribosomes translate cancer[J]. Cancer Discov, 2017, 7(10): 1069-1087. DOI:10.1158/2159-8290.cd-17-0550 |
| [9] |
WLODARSKI M W, DA COSTA L, O'DONOHUE M F, et al. Recurring mutations in RPL15 are linked to Hydrops fetalis and treatment independence in Diamond-Blackfan anemia[J]. Haematologica, 2018, 103(6): 949-958. DOI:10.3324/haematol.2017.177980 |
| [10] |
VLACHOS A, MUIR E. How I treat Diamond-Blackfan anemia[J]. Blood, 2010, 116(19): 3715-3723. DOI:10.1182/blood-2010-02-251090 |
| [11] |
ANNAPINA R, GIULIA R J I J O M E. Ribosomal proteins control or bypass p53 during nucleolar stress[J]. Int J Mol Sci, 2017, 18(1): 140. DOI:10.3390/ijms18010140 |
| [12] |
WESTERFIELD M. The zebrafish book(Danio rerio)[M]. Inst of Neuro Science, 1994: 3-5.
|
| [13] |
彭涛, 周唯君, 刘含, 等. CRISPR/Cas9技术敲除斑马鱼rpl15基因对斑马鱼红系造血发育的影响[J]. 第三军医大学学报, 2021, 43(8): 683-691. PENG T, ZHOU W J, LIU H, et al. Effects of rpl15 gene knockout by CRISPR/Cas9 on zebrafish erythroid hematopoietic development[J]. J Third Mil Med Univ, 2021, 43(8): 683-691. DOI:10.16016/j.1000-5404.202010180 |
| [14] |
NARLA A, EBERT B L. Ribosomopathies: human disorders of ribosome dysfunction[J]. Blood, 2010, 115(16): 3196-3205. DOI:10.1182/blood-2009-10-178129 |
| [15] |
KAZEROUNIAN S, YUAN D, ALEXANDER M S, et al. Rpl5-inducible mouse model for studying diamond-blackfan anemia[J]. Discoveries(Craiova), 2019, 7(3). DOI:10.15190/d.2019.9 |
| [16] |
ABLAIN J, ZON L I. Of fish and men: using zebrafish to fight human diseases[J]. Trends Cell Biol, 2013, 23(12): 584-586. DOI:10.1016/j.tcb.2013.09.009 |
| [17] |
OYARBIDE U, TOPCZEWSKI J, COREY S J. Peering through zebrafish to understand inherited bone marrow failure syndromes[J]. Haematologica, 2019, 104(1): 13-24. DOI:10.3324/haematol.2018.196105 |
| [18] |
RABY L, VOLKEL P, LE BOURHIS X, et al. Genetic engineering of zebrafish in cancer research[J]. Cancers (Basel), 2020, 12(8): 2168. DOI:10.3390/cancers12082168 |
| [19] |
HWANG W Y, FU Y, REYON D, et al. Efficient genome editing in zebrafish using a CRISPR-Cas system[J]. Nat Biotechnol, 2013, 31(3): 227-229. DOI:10.1038/nbt.2501 |
| [20] |
STAINIER D, RAZ E, LAWSON N D, et al. Guidelines for morpholino use in zebrafish[J]. PLoS Genet, 2017, 13(10). DOI:10.1371/journal.pgen.1007000 |
| [21] |
ORKIN S H, ZON L I. Hematopoiesis: an evolving paradigm for stem cell biology[J]. Cell, 2008, 132(4): 631-644. DOI:10.1016/j.cell.2008.01.025 |
| [22] |
GORE A V, PILLAY L M, VENERO GALANTERNIK M, et al. The zebrafish: a fintastic model for hematopoietic development and disease[J]. Wiley Interdiscip Rev Dev Biol, 2018, 7(3). DOI:10.1002/wdev.312 |
| [23] |
CANTOR A B, ORKIN S H. Transcriptional regulation of erythropoiesis: an affair involving multiple partners[J]. Oncogene, 2002, 21(21): 3368-3376. DOI:10.1038/sj.onc.1205326 |
| [24] |
BRESCIANI E, CARRINGTON B, WINCOVITCH S, et al. CBFβ and RUNX1 are required at 2 different steps during the development of hematopoietic stem cells in zebrafish[J]. Blood, 2014, 124(1): 70-78. DOI:10.1182/blood-2013-10-531988 |




