2. 810007 西宁,解放军第941医院超声诊断科;
3. 400042 重庆,陆军特色医学中心肿瘤科
2. Department of Ultrasonography, No. 941 Hospital of PLA Joint Logistic Support Force, Xining, Qinghai Province, 810007;
3. Department of Oncology, Daping Hospital, Army Medical University (Third Military Medial University), Chongqing, 400037, China
近年,以免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)如PD-1单抗(帕博利珠单抗和纳武利尤单抗)或PD-L1单抗(度伐利尤单抗和阿替利珠单抗)等为代表的免疫治疗在非小细胞肺癌(non-small cell lung cancer, NSCLC)的治疗中取得了巨大的进展,改变了NSCLC治疗的格局[1]。但仍有许多患者不能从这些药物中获益,且免疫相关不良反应(immune-related adverse events,irAEs)的发生率在不同个体之间也存在一定差异。由于ICIs药物本身具有免疫原性,输注后可能产生抗药物抗体(anti-drug antibody,ADA)。ADA可能与药物形成的免疫复合物(immune complex,IC)结合,从而阻断药物与靶点的结合,使抗体失去与PD-1或PD-L1结合的位点,从而使临床疗效不佳;或者Fc受体识别IC使清除率增强,可产生免疫应答诱导毒性。总之,这些机制可能导致药物有效性丧失、药代动力学改变及输注过程中的过敏反应[2-3]。
OAK研究回顾性分析显示ADA阳性的阿替利珠单抗病例临床获益减少[4-5]。在需要增强免疫治疗的患者中,ADA的滴度及在治疗期间是否一直存在对疾病的疗效有影响[6]。不同免疫检查点抑制剂诱导ADA的发生率差异较大,有研究显示阿替利珠单抗、帕博利珠单抗、度伐利尤单抗和阿维单抗的ADA阳性率分别为54.1%、2.1%、2.9%和5.9%[7-9]。在Ⅲ期KEYNOTE-006研究中,帕博利珠单抗相比依匹单抗在既往未经治疗的黑色素瘤患者中有更优的无进展生存期(progression-free survival, PFS)及总生存期(overall survival, OS)[10]。在晚期尿路上皮癌的二线治疗中,帕博利珠单抗治疗的OS长于阿替利珠单抗[11-12],既往研究结果提示ADA可能是导致其临床疗效及不良反应差异的原因。
目前,国内尚无关于帕博利珠单抗或纳武利尤单抗在晚期NSCLC中ADA检测及其临床意义的相关研究,国外文献多是基于随机对照临床研究的回顾性分析,真实世界临床应用中极为缺乏ADA与ICIs疗效、疾病进展及irAEs的相关性研究。本研究选取真实世界中两个中心使用帕博利珠单抗或纳武利尤单抗治疗的Ⅲ/Ⅳ期NSCLC患者,检测血清中ADA的产生并分析其临床意义。
1 资料与方法 1.1 患者及血样采集本研究分别通过陆军军医大学第二附属医院(2019-研第127-02)和陆军特色医学中心[伦理审批药字(2019)第02-01号]伦理委员会批准,经患者签署知情同意书后采集其血液样本,将血样采集到有肝素的采血管中,2 000 r/min离心10 min分离血浆,液氮冷冻保存。收集2016年4月至2019年9月在上述2家医院进行ICIs治疗的Ⅲ/Ⅳ期NSCLC患者的预存血样标本,采血时间为首次输注后2个月左右,其中12例患者使用纳武利尤单抗治疗(每次3 mg/kg,输注60 min,2次输注间隔时间约2周);14例患者使用帕博利珠单抗治疗(每次2 mg/kg,输注30 min,2次输注间隔时间约3周)。
1.2 方法 1.2.1 纳武利尤单抗和帕博利珠单抗的ADA检测使用酶联免疫法测定血浆中ADA水平。Matriks Biotek品牌的Shikari®(S-ATN)和Shikari®(S-ATP)试剂盒用于定量测定血浆中抗纳武利尤单抗和抗帕博利珠单抗抗体。取预先包被好纳武利尤单抗或帕博利珠单抗的96孔板,将100 μL检测缓冲液加入要使用的孔中,再加入10 μL即用型阴性对照、阳性对照和样品到微量滴定板的相应孔中,分别为:孔A1(阴性对照)、B1(阴性对照)、C1(阳性对照)、D1~F1(均为同一样品),其余样品标记顺序类推。用封板膜覆盖96孔板,轻轻摇晃使孔中的液体混匀,在室温下孵育60 min。移除封板膜,移除孵育溶液,用300 μL清洗缓冲液清洗微孔3次,最后一次置于厚吸水纸上排干多余的溶液。每孔加入100 μL的辣根过氧化物酶,用封板膜覆盖,在室温下孵育60 min。移除封板膜,移除孵育溶液,用300 μL清洗缓冲液清洗微孔3次,最后一次置于厚吸水纸上排干多余的溶液。将100 μL TMB底物缓冲液加入每孔中,在室温下避光孵育20 min(无须封板膜覆盖)。将100 μL的终止液加入每孔中使反应停止,轻轻摇晃使液体混匀,此时孔中液体从蓝色变为黄色。用分光光度计在30 min内测量各个样品孔在波长450 nm处的光密度值(optical density, OD)。
1.2.2 ADA结果判读为使运行有效,设置阳性对照和阴性对照。阳性对照的OD值应≥1.000,阴性对照的OD值应 < 0.200,否则,为技术不正确或者怀疑试剂可能变质,应重复运行。通过临界值评估结果,临界值为阴性对照的平均光密度(mean optical density,MOD)乘以3来估计。
1.2.3 临床评价标准治疗前28 d内有影像学基线评价,基线评价尽量接近第一次输注药物的时间,间隔8~12周再次对患者行影像学检查,依据RECIST 1.1标准[13]评估患者疗效,肿瘤负荷完全消失为完全缓解(complete response, CR),肿瘤长径缩小≥30%评价为部分缓解(partial response, PR),出现新病灶或肿瘤长径增加≥20%评价为疾病进展(progressive disease, PD),靶病灶长径缩小未达PR或增大未达PD则评价为疾病稳定(stable disease, SD)。irAEs的判定及分级参照2019年中国临床肿瘤学会(CSCO)免疫检查点抑制剂相关的毒性管理指南。其严重程度分为4级,从低到高分别为G1、G2、G3和G4级。
1.2.4 生存随访对NSCLC患者进行随访,以查阅病例及电话随访为主。记录患者的最佳总体反应率(best overall response, bOR;在首次免疫治疗至疾病出现进展或任何原因死亡,期间疾病出现的单次最佳反映状态,包括CR+PR)、PFS(从首次用药的时间到第一次肿瘤进展或者死亡时间)和OS(从首次用药的时间开始至任何原因引起死亡随访的时间)。
1.3 统计学分析采用GraphPad Prism 8.0版本进行作图并统计分析,使用Kaplan-Meier法绘制生存曲线并进行生存分析。通过描述性统计呈现患者临床基本特征,连续性变量采用中位数及范围表示;计量资料采用t检验、计数资料采用卡方检验进行统计分析,P < 0.05为差异有统计学意义。
2 结果 2.1 患者临床特征纳入使用纳武利尤单抗及帕博利珠单抗的患者分别为12例和14例,PS评分1分占比较多,分别为58.3%及78.6%;病例类型分为肺腺癌和肺鳞癌,其中肺腺癌较多,分别为66.7%及64.3%;未吸烟者较多,分别为58.3%及57.1%,其余为肺鳞癌病例。使用纳武利尤单抗及帕博利珠单抗的临床分期分为Ⅲ期及Ⅳ期,Ⅳ期病例占比较多,分别为75.0%及78.6%。使用纳武利尤单抗的治疗中,二线单药方案治疗病例较多;使用帕博利珠单抗的治疗中,二线联合治疗方案病例较多,见表 1。
| 临床特征 | 纳武利尤单抗(n=12) | 帕博利珠单抗(n=14) | 总计(n=26) |
| 年龄/岁 | 64(52~85) | 63(54~75) | 64(52~85) |
| 性别 | |||
| 男 | 10(83.3) | 10(71.4) | 20 |
| 女 | 2(16.7) | 4(28.6) | 6 |
| PS评分 | |||
| 0 | 1(8.3) | 1(7.1) | 2 |
| 1 | 7(58.3) | 11(78.6) | 18 |
| 2 | 4(33.4) | 2(14.3) | 6 |
| 病理类型 | |||
| 肺腺癌 | 8(66.7) | 9(64.3) | 17 |
| 肺鳞癌 | 4(33.3) | 5(35.7) | 9 |
| 吸烟(是/否) | 5(41.7)/7(58.3) | 6(42.9)/8(57.1) | 11/15 |
| 临床分期(Ⅲ/Ⅳ期) | 3(25.0)/9(75.0) | 3(21.4)/11(78.6) | 6/20 |
| 免疫治疗 | |||
| 一线 | 3(25.0) | 5(35.7) | 8 |
| 二线 | 9(75.0) | 9(64.3) | 18 |
| 联合 | 3(25.0) | 12(85.7) | 15 |
| 单药 | 9(75.0) | 2(14.3) | 11 |
2.2 临床疗效
在首次用药后2个月左右采血,随访时间3.5~29.6个月。12例使用纳武利尤单抗治疗的患者,3例PR,9例SD,bOR为25.0%,mPFS为4.1(1.9~26.9)个月,mOS为12.4(4.8~26.9)个月。14例使用帕博利珠单抗治疗的患者,7例PR,5例SD,2例PD,bOR为50.0%,mPFS为10.9(2.2~25.3)个月,mOS为19.0(3.5~29.6)个月(图 1)。
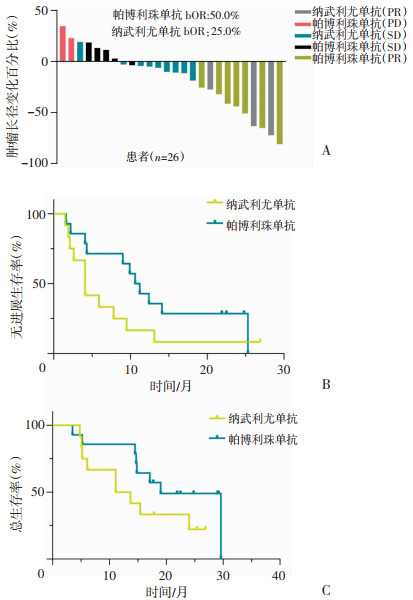
|
| A:最佳总体反应率(bOR);B:无进展生存期;C:总生存期 图 1 NSCLC患者免疫治疗临床效果评估 |
2.3 ADA状态与临床疗效的关系
接受纳武利尤单抗治疗的12例患者中,阴性对照的MOD为0.046 7,阳性OD为1.188 1,ADA检测结果全部为阴性。接受帕博利珠单抗治疗的14例患者中,阴性对照的MOD为0.045 6,阳性OD为1.371 2,ADA检测阴性11例,阳性3例;3例ADA阳性患者的bOR为100.0%,mPFS为9.9(4.1~10.6)个月、mOS为19.0(14.8~29.2)个月,11例ADA阴性患者的bOR为36.4%,mPFS为12.4(2.2~25.3)个月、mOS为29.6(3.5~29.6)个月。生存曲线分析显示,帕博利珠单抗治疗的ADA阳性患者,mPFS和mOS在数值上均显著短于ADA阴性患者,mPFS(P=0.280)及mOS(P=0.874)差异无统计学意义(图 2)。
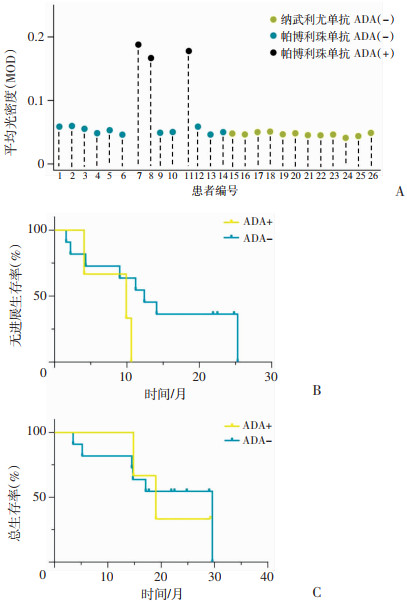
|
| A:ADA状态;B、C:分别为使用帕博利珠单抗ADA阳性患者及ADA阴性患者的mPFS及mOS 图 2 ADA状态与临床疗效的关系 |
2.4 ADA的检测状态对临床进展的影响
使用纳武利尤单抗的12例患者,采血时影像进展有3例,未进展有9例,12例ADA检测均为阴性;采血后6个月内出现影像进展9例,6个月后进展3例。使用帕博利珠单抗的14例患者,采血时均未出现影像进展,其中3例ADA检测为阳性;采血后出现影像进展时间大于6个月的病例有9例,小于6个月病例有5例(图 3A);ADA阳性患者采血后出现临床进展中位数为7.5个月,短于ADA阴性患者的8.6个月,但差异无统计学意义(P=0.365),见图 3B。

|
| A:ADA状态与临床进展的关系;B:使用帕博利珠单抗病例采血后出现疾病进展时间 图 3 ADA检测状态对临床进展的影响 |
2.5 ADA状态与irAEs的关系
使用纳武利尤单抗治疗的12例患者,5例发生irAEs,其中3例为G2级,发生在采血前,2例为G3级,发生在采血后。使用帕博利珠单抗治疗的14例患者,3例ADA阳性患者中,2例在采血前发生irAEs,分别为G2和G3级,irAEs发生比例为66.7%;11例ADA阴性患者中,3例在采血前发生irAEs,分别G2、G2、G3级,irAEs发生比例为27.3%。大多数irAEs表现为皮疹、腹泻、甲状腺功能异常、肝损伤等。
3 讨论既往大量研究证明,对于肿瘤细胞上PD-L1表达≥50%的NSCLC患者,帕博利珠单抗治疗较含铂化疗方案显著改善了患者的PFS及OS[14]。关于其产生的抗肿瘤作用、使用过程中的输注反应及使用后的免疫相关不良反应机制目前已有较为深入的研究,期望在临床获益最大化的同时降低irAEs的发生。但关于NSCLC患者使用纳武利尤单抗或帕博利珠单抗产生ADA对临床疗效及irAEs的影响研究报道较少,真实世界的数据更为缺乏。在12项临床试验中,对3 655例晚期或转移性癌症患者进行了帕博利珠单抗免疫原性评估,在不同癌种中ADA发生率存在差异,在NSCLC患者中的发生率最高,头颈部鳞状细胞癌、结直肠癌和溃疡性结肠炎的发生率相当,白血病和黑色素瘤的发生率最低[15];ADA阳性及ADA阴性的irAEs发生率相当。此研究收集了大量数据,但未探究ADA的产生对临床疗效以及irAEs的影响,这是前瞻性临床试验中符合方案的临床数据,未能反映临床实践中的整体人群数据。因此,ICIs产生ADA对临床疗效及irAEs的影响是值得探讨的领域。
由于不同ICIs产生的ADA不同,所采用的检测试剂盒不同,只能针对不同ICIs分别进行检测。本研究回顾性收集了12例纳武利尤单抗及14例帕博利珠单抗治疗的NSCLC患者血浆样本,通过酶联免疫法对血浆进行ADA定量分析,通过电话及病例随访对患者的疾病进展、使用免疫治疗期间是否产生irAEs及生存情况进行评估确定,验证ADA状态对临床疗效、疾病进展及irAEs的产生及其程度的影响。ADA可能与药物靶向结合,从而导致药物被清除或中和,致使治疗效果降低或者丧失[16]。在CTLA-4阻断剂的研究中,结果表明ADA阳性状态与OS显著缩短及风险比显著增加相关[17-18]。本研究中使用纳武利尤单抗或帕博利珠单抗的NSCLC患者,其bOR、mPFS和mOS与既往研究结果一致[19-20]。在12例使用纳武利尤单抗的患者ADA检测为全阴性,无法判断ADA状态与临床疗效的相关性。14例使用帕博利珠单抗的患者中检测到3例ADA阳性病例,其mPFS和mOS在数值上显著小于ADA阴性患者,采血后出现PD的ADA阳性病例较ADA阴性病例也更早出现进展,即ADA阳性对疾病进展具有一定的预测作用。关于ADA与irAEs的相关性,有研究报道,ADA形成的免疫复合物除了可诱导强效的免疫调节作用,激活补体系统、单核细胞及NK细胞等的活化,还可能会诱导更多的irAEs产生[21]。irAEs涉及的靶器官范围广,有时甚至威胁生命,及时的诊断及临床干预能避免病情恶化[22-23]。然而,本研究中irAEs的发生及分级与ADA状态无明显相关性,帕博利珠单抗的ADA阳性患者发生≥2级irAEs为66.7%,均为采血前发生,难以判断ADA对irAEs的影响。本研究具有一定的局限性,由于样本量较小,ADA对临床疗效、疾病进展及irAEs的影响有待将来更多研究证实。尽管存在局限性,但本研究揭示了真实世界中病例的ADA状态与临床疗效、疾病进展及irAEs的初步关系。随着精准治疗的到来,将更需要观测对药物有反应的个体之间的差异,以及出现的不良反应的表现形式,在治疗过程中多角度的对疾病进行观测,可使患者从治疗中获益最大。
| [1] |
RIBAS A, WOLCHOK J D. Cancer immunotherapy using checkpoint blockade[J]. Science, 2018, 359(6382): 1350-1355. DOI:10.1126/science.aar4060 |
| [2] |
SATHISH J G, SETHU S, BIELSKY M C, et al. Challenges and approaches for the development of safer immunomodulatory biologics[J]. Nat Rev Drug Discov, 2013, 12(4): 306-324. DOI:10.1038/nrd3974 |
| [3] |
MANEIRO J R, SALGADO E, GOMEZ-REINO J J. Immuno-genicity of monoclonal antibodies against tumor necrosis factor used in chronic immune-mediated Inflammatory conditions: systematic review and meta-analysis[J]. JAMA Intern Med, 2013, 173(15): 1416-1428. DOI:10.1001/jamainternmed.2013.7430 |
| [4] |
DIEGO E, ANGELO P, NATHALIE C, et al. Antidrug antibodies against immune checkpoint blockers: impairment of drug efficacy or indication of immune activation?[J]. Clin Cancer Res, 2020, 26(4): 787-792. DOI:10.1158/1078-0432.CCR-19-2337 |
| [5] |
RITTMEYER A, BARLESI F, WATERKAMP D, et al. Atezolizumab versus docetaxel in patients with previously treated non-small-cell lung cancer (OAK): a phase 3, open-label, multicentre randomised controlled trial[J]. Lancet, 2017, 389(10066): 255-265. DOI:10.1016/s0140-6736(16)32517-x |
| [6] |
VAN SCHOUWENBURG P A, RISPENS T, WOLBINK G J. Immunogenicity of anti-TNF biologic therapies for rheumatoid arthritis[J]. Nat Rev Rheumatol, 2013, 9(3): 164-172. DOI:10.1038/nrrheum.2013.4 |
| [7] |
European Medicines Agency, Committee for Medicinal Products for Human Use (CHMP). Assessment report for Bavencio (avelumab). [2021-05-06]. https://www.ema.europa.eu/en/documents/assessment-report/bavencio-epar-public assessment-report_en.pdf.
|
| [8] |
U.S. Food and Drug Administration. IMFINZI (durvalumab)-FDA. [2021-05-06]. https://www.accessdata.fda.gov/drugsatfda_docs/label/2018/ 761069s002lbl.pdf.
|
| [9] |
U.S. Food and Drug Administration. KEYTRUDA (pembro-lizumab)-FDA. [2021-05-06]. https://www.accessdata.fda.gov/drugsatfda_docs/label/2019/125514s040lbl.pdf.
|
| [10] |
SCHACHTER J, RIBAS A, LONG G V, et al. Pembrolizumab versus ipilimumab for advanced melanoma: final overall survival results of a multicentre, randomised, open-label phase 3 study (KEYNOTE-006)[J]. Lancet, 2017, 390(10105): 1853-1862. DOI:10.1016/s0140-6736(17)31601-x |
| [11] |
BELLMUNT J, DE WIT R, VAUGHN D J, et al. Pembrolizumab as second-line therapy for advanced urothelial carcinoma[J]. N Engl J Med, 2017, 376(11): 1015-1026. DOI:10.1056/nejmoa1613683 |
| [12] |
POWLES T, DURÁN I, VAN DER HEIJDEN M S, et al. Atezolizumab versus chemotherapy in patients with platinum-treated locally advanced or metastatic urothelial carcinoma (IMvigor211): a multicentre, open-label, phase 3 randomised controlled trial[J]. Lancet, 2018, 391(10122): 748-757. DOI:10.1016/S0140-6736(17)33297-X |
| [13] |
SEYMOUR L, BOGAERTS J, PERRONE A, et al. iRECIST: guidelines for response criteria for use in trials testing immunotherapeutics[J]. Lancet Oncol, 2017, 18(3): e143-e152. DOI:10.1016/s1470-2045(17)30074-8 |
| [14] |
RECK M, RODRÍGUEZ-ABREU D, ROBINSON A G, et al. Pembrolizumab versus chemotherapy for PD-L1-positive non-small-cell lung cancer[J]. N Engl J Med, 2016, 375(19): 1823-1833. DOI:10.1056/nejmoa1606774 |
| [15] |
VAN VUGT M J H, STONE J A, DE GREEF R H J M M, et al. Immunogenicity of pembrolizumab in patients with advanced tumors[J]. J Immunother Cancer, 2019, 7(1): 212. DOI:10.1186/s40425-019-0663-4 |
| [16] |
陈明镜, 杨峤, 许子寒, 等. 基于iRECIST标准的晚期NSCLC免疫治疗的真实世界研究[J]. 第三军医大学学报, 2020, 42(5): 480-486. CHEN M J, YANG Q, XU Z H, et al. Real-world research of advanced NSCLC immunotherapy based on iRECIST criteria[J]. J Third Mil Med Univ, 2020, 42(5): 480-486. DOI:10.16016/j.1000-5404.201910122 |
| [17] |
WOLBINK G J, AARDEN L A, DIJKMANS B A C. Dealing with immunogenicity of biologicals: assessment and clinical relevance[J]. Curr Opin Rheumatol, 2009, 21(3): 211-215. DOI:10.1097/bor.0b013e328329ed8b |
| [18] |
KRISHNA M, NADLER S G. Immunogenicity to biothera-peutics- the role of anti-drug immune complexes[J]. Front Immunol, 2016, 7: 21. DOI:10.3389/fimmu.2016.00021 |
| [19] |
GADGEEL S, RODRÍGUEZ-ABREU D, SPERANZA G, et al. Updated analysis from KEYNOTE-189: pembrolizumab or placebo plus pemetrexed and platinum for previously untreated metastatic nonsquamous non-small-cell lung cancer[J]. J Clin Oncol, 2020, 38(14): 1505-1517. DOI:10.1200/jco.19.03136 |
| [20] |
GETTINGER S, RIZVI N A, CHOW L Q, et al. Nivolumab monotherapy for first-line treatment of advanced non-small-cell lung cancer[J]. J Clin Oncol, 2016, 34(25): 2980-2987. DOI:10.1200/JCO.2016.66.9929 |
| [21] |
KVERNELAND A H, ENEVOLD C, DONIA M, et al. Development of anti-drug antibodies is associated with shortened survival in patients with metastatic melanoma treated with ipilimumab[J]. Oncoimmunology, 2018, 7(5): e1424674. DOI:10.1080/2162402X.2018.1424674 |
| [22] |
WANG D Y, SALEM J E, COHEN J V, et al. Fatal toxic effects associated with immune checkpoint inhibitors: a systematic review and meta-analysis[J]. JAMA Oncol, 2018, 4(12): 1721-1728. DOI:10.1001/jamaoncol.2018.3923 |
| [23] |
POSTOW M A, SIDLOW R, HELLMANN M D. Immune-related adverse events associated with immune checkpoint blockade[J]. N Engl J Med, 2018, 378(2): 158-168. DOI:10.1056/NEJMra1703481 |




