2. 215000江苏 苏州,苏州旭辉检测有限公司
2. Suzhou Xuhui Analysis Co., Ltd, Suzhou, Jiangsu Province, 215000, China
雷贝拉唑是新一代苯并咪唑类质子泵抑制剂(proton pump inhibitors,PPI),通过与胃壁细胞分泌小管细胞膜上的质子泵键合,抑制胃酸分泌。临床主要用于治疗消化性溃疡、胃食管反流性疾病、卓-艾氏综合征、幽门螺旋杆菌(Helicobacter pylori,Hp)阳性等[1]。与以往奥美拉唑、泮托拉唑等PPI相比,其与质子泵结合靶点最多,且作用最快、最持久,抑酸效果最好。雷贝拉唑包括右旋和左旋2种光学异构体,现国内临床所使用的是2种光学异构体的消旋混合物[2-3]。近年,有研究报道[4-6]雷贝拉唑右旋异构体的药理作用明显强于左旋异构体及其消旋体,是其发挥药理作用的主要成分。右旋异构体对血清胃泌素的水平基本无影响,并具有选择性抑制Hp的作用,对胃烧灼痛及胃回流的疗效与症状缓解时间明显优于雷贝拉唑钠。
注射用右旋雷贝拉唑钠是由印度Emcure医药公司首家研发上市[7],对消化道出血需要急诊治疗,需快速、长久地抑制胃酸分泌以及预防内窥镜治疗后再出血等方面的患者较口服制剂有明显优势。关于右旋雷贝拉唑的检测方法[8]和动物实验[9-10]已有报道,但国内对注射用右旋雷贝拉唑钠在健康人体的药代和药效学研究还较少。本试验采用LC-MS-MS法测定受试者血浆中右旋雷贝拉唑含量,同时监测给药后24 h胃内pH值,探讨不同剂量注射用右旋雷贝拉唑钠的药代动力学和药效学特征,比较其与注射用雷贝拉唑钠的差异,并对药物的安全性进行评价,探索注射用右旋雷贝拉唑钠在中国人群的合适剂量范围,为临床用药提供理论依据。
1 材料与方法 1.1 仪器LC-20A高效液相色谱仪(日本SHIMADZU公司),API4000三重四级杆质谱仪(美国AB Sciex公司);3k15高速冷冻离心机(德国Sigma公司),Secura 225D-1CN型号天平(德国Sartorius公司),SB5200-DT型号超声波清洗机(宁波新芝生物科技股份有限公司);UPS2020 Ⅱ型便携式PH记录仪(荷兰Medical Measurement Systems B.V公司)。
1.2 药品与试剂右旋雷贝拉唑钠对照品,含量:95%,批号:5-JBZ-175-2;左旋雷贝拉唑钠对照品,含量:98%,批号:6-JBZ-25-2;内标右旋雷贝拉唑钠-D3,含量:99.58%,批号:5-CSZ-57-1;内标左旋雷贝拉唑钠-D3,化学含量:95%,批号:14-EQJ-21-2,生产厂家:Toronto Research Chemicals。注射用雷贝拉唑钠,商品名:奥加明,规格:20 mg/瓶,批号:J1812071,由江苏奥赛康药业股份有限公司生产。注射用右旋雷贝拉唑钠,规格:10 mg/瓶,批号:20190401,由国内某制药有限公司提供。
1.3 试验方法 1.3.1 受试者筛选共筛选健康受试者40例,男女各半。受试者签署知情同意书后,在正式参加研究之前进行常规病史询问以及相应的检查和化验,包括生命体征、体格检查;实验室检查(血尿粪常规、凝血功能、肝肾功、血脂、血糖、甲功三项等);12导联心电图、胸部X线片(正侧位);乙肝表面抗原(HBsAg)、血清抗-HIV、梅毒抗体、抗-HCV、幽门螺杆菌检测(13C呼气试验)以及育龄女性妊娠试验等,再由研究者根据结果判断受试者是否适合参加此研究。本试验方案经陆军军医大学第一附属医院医学伦理委员会审核批准(YW201841)。
1.3.2 试验方案采用随机、开放、阳性药平行对照试验设计,40例受试者按照男女分层区组随机化分为4组,每组10例,男女各半。每组受试者分别给药注射用右旋雷贝拉唑钠10 mg/qd(10 mg/qd右旋组)、10 mg/q12h(10 mg/q12h右旋组)、20 mg/q12h(20 mg/q12h右旋组)和注射用雷贝拉唑钠20 mg/q12h(20 mg/q12h消旋组),30 min恒速静脉滴注,连续给药5 d。受试者在用药第1天(首次给药)和第5天(末次给药)采集血样,分别在给药前(0 min)和给药开始后10、20、30(滴注结束即刻)、35、45 min、1、1.5、2、3、4、5、6、8、12 h从静脉采血4 mL。第2、3、4天给药前从静脉采血4 mL以测定谷浓度。分别于用药前2 d、用药第1天和第5天,将胃内pH测定仪导管插入胃内,连续监测24 h胃内pH值变化情况。受试者在试验开始前2周内未服用任何可能影响本品吸收、代谢的药物。给药前1晚禁食过夜(禁食时间不少于8 h)。分别于第1天和第5天禁食早餐,试验期间统一清淡饮食,不使用除试验制剂以外的任何药物,不接受烟、酒及含咖啡的饮料,避免剧烈运动。试验期间观察受试者的不良反应发生情况和一般情况。
1.3.3 色谱条件色谱柱:Chiralpark IE色谱柱(4.6×150 mm, 5 μm),日本Daicel株式会社;保护柱:Chiral Cartridge Holder(4×10 mm),日本Daicel株式会社;柱温:40 ℃;流动相:5 mmol/L乙酸铵∶乙腈=20∶80(体积比);流速:1 mL/min;进样体积:5 μL;运行时间:6 min;自动进样器温度:4 ℃。
1.3.4 质谱条件ESI离子源:正离子模式,多反应监测(MRM);离子喷雾电压(IonSpray Voltage):5 500 V;气帘气(CUR):25 psi;雾化气(GS1):50 psi;辅助气(GS2):50 psi;离子源温度(TEM):550 ℃;碰撞气(CAD):8 psi。定量离子对:右旋雷贝拉唑m/z 360.2→242.0;右旋雷贝拉唑-D3 m/z 363.5→245.4。去簇电压(DP):20/20 eV;碰撞能量:30/30 eV。
1.3.5 血浆样本处理方法取血浆样品100 μL,与500 μL内标溶液(右旋雷贝拉唑-D3浓度为100 ng/mL乙腈溶液)混合,涡旋约1 min,4 ℃下离心10 min(13 000 r/min),取上清液200 μL转移至进样瓶中,进样5 μL进行LC-MS/MS分析。
1.3.6 方法学验证配制浓度分别为1、5、10、50、100、200、500、1 000 ng/mL的血浆样品。按1.3.5方法处理后,进样分析。标准曲线以待测物峰面积与内标峰面积之比为纵坐标(y),以待测物浓度与内标(内标浓度归1)之比为横坐标(x),线性拟合成标准曲线,权重设置为w=1/x2;特异性分析6个不同个体空白血浆;以定量下限及低、中、高浓度(1、3、160、800 ng/mL)4个浓度的质控(quality control,QC)样本考察批内、批间的准确度、精密度,每个浓度至少各6份,准确度以实测值/真实值×100%表示,精密度以测定QC样本的变异系数(CV)表示;考察低、中、高(3、160、800 ng/mL)3个浓度的提取回收率和基质效应,每个浓度至少6个样品,且6个样品的生物基质来自6个不同的个体;考察稀释因子为5倍的稀释可靠性,重复稀释一个浓度超过定量上限的稀释质控样品6次,使其浓度落在标准曲线线性范围内;稳定性以反映待测物生物样品或溶液在日常分析中所处的环境为考察条件。
1.3.7 胃内24 h的pH值监测方法导管使用前需在pH为7.0的缓冲液中浸泡至少10 min,再先后分别用pH为7.0和1.0的标准液进行校准。校准程序完成后,用清水漂洗导管后经鼻咽腔置于胃内,当记录仪显示pH值为1.0~2.0时,将导管缓慢退出,当值上升到5.0以上,等待10 s待数值稳定后(预计这个位置在食管下括约肌下缘下5~8 cm处),固定导管。从用药开始,连续记录胃内24 h pH值,禁食早餐。首次给药开始后2 h方可饮水,每次饮水不超过100 mL,每次间隔超过30 min,首次给药开始后4 h进食午餐,10 h后进食晚餐,监测于次日晨满24 h时结束,移出导管。
1.4 统计学分析根据所得血药浓度数据,采用WinNonlin7.0软件用非房室模型计算药代动力学参数,由OrionⅡ便携式pH测量系统(MMS)软件系统获得给药前后各时间段胃内pH值数据。用SAS.9.4统计软件分析各剂量组间的药代动力学和药效学参数。
2 结果 2.1 方法学验证结果右旋雷贝拉唑标准曲线的线性范围为1~1 000 ng/mL,用加权最小二乘法进行线性回归后,得线性回归方程:y=0.015 3x+0.000 096(r=0.999 95),线性关系良好;6份不同供体的空白血浆内源性物质不干扰样品的测定,左旋雷贝拉唑与右旋雷贝拉唑对应异构体之间分离度良好,空白样品、LLOQ样品及代表受试者血浆样品的典型色谱图见图 1;定量下限及低、中、高质控浓度的批内、批间准确度分别为94.5%~106.2%、97.8%~101.5%;批内、批间精密度(CV%)均小于12.4%;提取回收率均值为100.3%~109.5%,内标提取回收率均值为105.1%;稀释因子为5倍时,稀释可靠性良好;基质效应和残留不影响右旋雷贝拉唑的准确定量。右旋雷贝拉唑工作溶液室温避光条件下放置24 h、-25 ℃冰箱放置7 d稳定性良好;其血浆样品室温放置8 h、-25 ℃冰箱放置14 d、-75 ℃冰箱放置135 d、冻融5次循环、处理后样品自动进样器放置50 h的稳定性均良好。
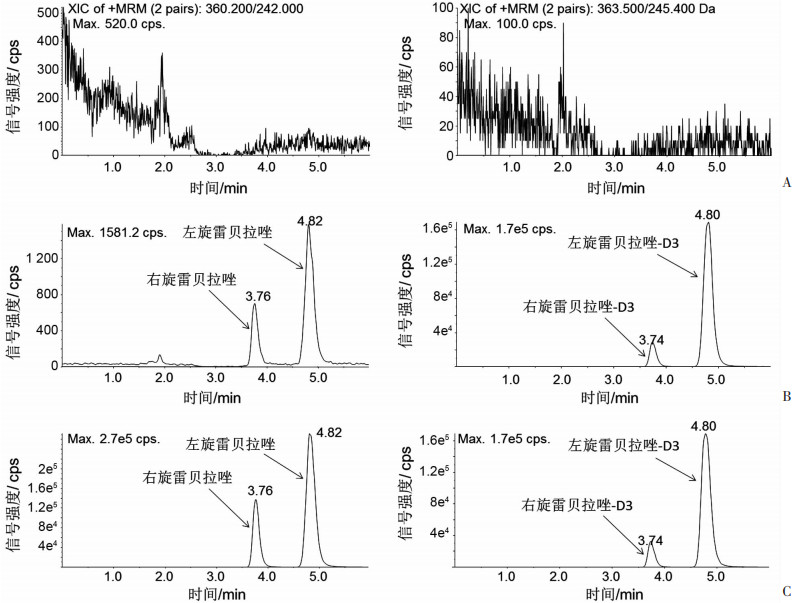
|
| A:空白血浆样品;B:LLOQ血浆样品;C:注射用雷贝拉唑对照组给药后血浆样品 图 1 待测物(左)及内标(右)的典型HPLC-MS/MS色谱图 |
2.2 人口统计学特征
共纳入40名健康志愿者,分为4组,每组男女各半。试验分组情况和各组人口统计学特征见表 1。
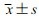
| 组别 | 药物 | 用法 | 用量/mg | 参数 | |||
| 年龄/岁 | 身高/cm | 体质量/kg | BMI/kg·m-2 | ||||
| 10 mg/qd右旋组 | 注射用右旋雷贝拉唑 | 1次/1 d | 10 | 27.60±4.50 | 166.80±5.16 | 62.35±7.48 | 22.37±2.11 |
| 10 mg/q12h右旋组 | 注射用右旋雷贝拉唑 | 1次/12 h | 10 | 30.20±4.71 | 163.50±9.71 | 58.00±6.43 | 21.72±1.79 |
| 20 mg/q12h右旋组 | 注射用右旋雷贝拉唑 | 1次/12 h | 20 | 27.60±6.26 | 162.00±8.51 | 59.85±7.75 | 22.77±1.96 |
| 20 mg/q12h消旋组 | 注射用雷贝拉唑 | 1次/12 h | 20 | 29.00±4.00 | 162.30±6.77 | 58.10±5.81 | 22.06±1.97 |
2.3 药代动力学结果
各组健康受试者首次和末次静脉输注注射用右旋雷贝拉唑钠和注射用雷贝拉唑钠后右旋雷贝拉唑的平均血药浓度-时间曲线见图 2;首次和末次给药后各剂量组非房室模型主要的药代动力学(PK)参数见表 2、3。首次给药后血浆中右旋雷贝拉唑的PK参数分析结果显示:20 mg/q12h消旋组的Cmax、AUC0-t、AUC0-∞等PK参数比10 mg/qd右旋组和10 mg/q12h右旋组高;比20 mg/q12h右旋组低。末次给药后各组Cmax, ss、AUC0-t, ss、AUC0-∞, ss、AUCss、Cav参数的大小关系与首次给药一致。末次给药后各组蓄积因子(Rac) (%)均约等于1。
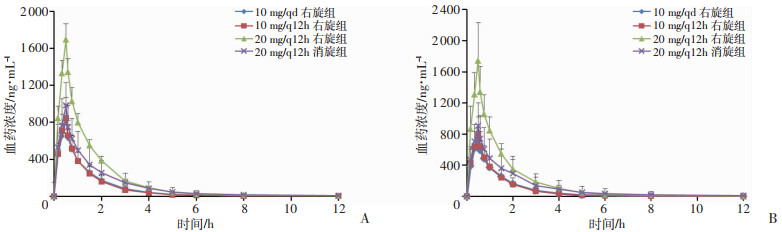
|
| 图 2 健康受试者单次(A)和多次(B)注射给药后各组平均血药浓度-时间曲线(n=10) |
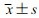
| 组别 | Cmax(×103 ng/mL) | AUC0-t(×103 h·ng/mL) | AUC0-∞(×103 h·ng/mL) | Tmax(h) | T1/2z(h) | |||||||||||||||||||||||||
| 10 mg/qd右旋组 | 0.82±0.17 | 1.04±0.22 | 1.05±0.22 | 0.50±0.00 | 1.72±0.72 | |||||||||||||||||||||||||
| 10 mg/q12h右旋组 | 0.85±0.22 | 1.02±0.39 | 1.03±0.40 | 0.50±0.00 | 1.30±0.55 | |||||||||||||||||||||||||
| 20 mg/q12h右旋组 | 1.70±0.46 | 2.19±0.59 | 2.21±0.59 | 0.51±0.03 | 1.93±0.73 | |||||||||||||||||||||||||
| 20 mg/q12h消旋组 | 0.99±0.28 | 1.50±0.96 | 1.54±1.04 | 0.50±0.00 | 1.94±0.92 | |||||||||||||||||||||||||
| 组别 | Vz(×104mL) | CLz(×104mL/h) | λz(1/h) | MRT0-t(h) | MRT0-∞(h) | AUC_%Extrap | ||||||||||||||||||||||||
| 10 mg/qd右旋组 | 2.49±1.30 | 0.99±0.17 | 0.48±0.21 | 1.22±0.20 | 1.28±0.23 | 0.51±0.30 | ||||||||||||||||||||||||
| 10 mg/q12h右旋组 | 1.89±0.55 | 1.11±0.44 | 0.61±0.22 | 1.07±0.32 | 1.12±0.37 | 0.48±0.41 | ||||||||||||||||||||||||
| 20 mg/q12h右旋组 | 2.58±0.96 | 0.98±0.33 | 0.43±0.21 | 1.27±0.26 | 1.35±0.33 | 0.61±0.53 | ||||||||||||||||||||||||
| 20 mg/q12h消旋组 | 4.02±1.38 | 1.71±0.76 | 0.46±0.28 | 1.39±0.60 | 1.57±0.88 | 1.38±2.01 | ||||||||||||||||||||||||
| 组别 | Cmax, ss(×103 ng/mL) | AUC0-t, ss(×103 h·ng/mL) | AUC0-∞, ss(×103 h·ng/mL) | AUCss(×103 h·ng/mL) | Cav(ng/mL) | Tmax(h) | ||||||||||||||||||||||||||||||||||||
| 10 mg/qd右旋组 | 0.74±0.13 | 0.97±0.19 | 0.98±0.19 | 0.98±0.19 | 40.70±7.81 | 0.50±0.00 | ||||||||||||||||||||||||||||||||||||
| 10 mg/q12h右旋组 | 0.79±0.23 | 1.00±0.42 | 1.01±0.43 | 1.00±0.42 | 83.39±34.76 | 0.50±0.00 | ||||||||||||||||||||||||||||||||||||
| 20 mg/q12h右旋组 | 1.74±0.49 | 2.21±0.51 | 2.22±0.52 | 2.21±0.51 | 184.37±42.57 | 0.50±0.00 | ||||||||||||||||||||||||||||||||||||
| 20 mg/q12h消旋组 | 0.91±0.29 | 1.54±1.13 | 1.58±1.22 | 1.54±1.13 | 128.05±94.34 | 0.50±0.00 | ||||||||||||||||||||||||||||||||||||
| 组别 | T1/2z(h) | Vz, ss(×104mL) | CLz, ss (×104mL/h) | λz(1/h) | AUC_%Extrap | MRT0-∞, ss(h) | Rac | |||||||||||||||||||||||||||||||||||
| 10 mg/qd右旋组 | 1.59±0.55 | 1.35±0.31 | 1.05±0.17 | 0.49±0.19 | 0.69±0.40 | 1.29±0.23 | 1.00±0.00 | |||||||||||||||||||||||||||||||||||
| 10 mg/q12h右旋组 | 1.56±0.87 | 1.29±0.42 | 1.16±0.47 | 0.53±0.19 | 0.78±0.64 | 1.19±0.40 | 1.02±0.03 | |||||||||||||||||||||||||||||||||||
| 20 mg/q12h右旋组 | 1.82±0.67 | 1.27±0.28 | 0.96±0.29 | 0.44±0.18 | 0.68±0.65 | 1.36±0.33 | 1.02±0.02 | |||||||||||||||||||||||||||||||||||
| 20 mg/q12h消旋组 | 2.13±0.82 | 2.39±0.57 | 1.80±0.86 | 0.40±0.24 | 1.41±2.03 | 1.65±0.89 | 1.03±0.03 | |||||||||||||||||||||||||||||||||||
2.4 药效学结果
用MMS软件获得给药前后各时间段的胃内pH值数据,40名健康受试者单次和多次用药后胃内24 h pH监测结果见图 3。从数据结果看,各剂量组用药后胃内pH值均快速升高,大部分时间维持在较高水平。且第1、5天胃内pH值的变化趋势基本一致。

|
| 图 3 健康受试者第1天(A)和第5天(B)注射给药后各组每小时胃内pH平均值变化趋势 |
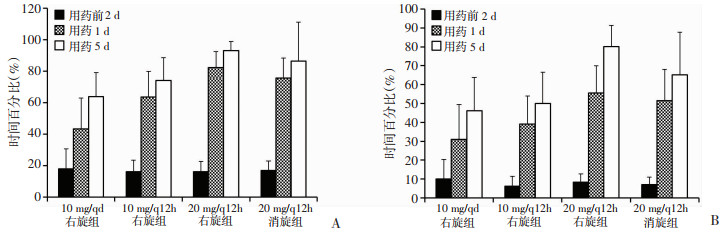
本试验的主要药效指标为:①用药第1天和第5天胃内pH>4.0和pH>6.0的时间占总时间百分比[TpH>4(%)和TpH>6(%)]见图 4。时间百分比=(pH>4.0或pH>6.0的有效时间/总有效时间)×100%。从数据结果看,相对于基线期(用药前2 d)各剂量组均能提高胃内pH>4.0和pH>6.0的时间百分比,随着剂量增加以及用药时间的增加,抑制胃酸分泌的效果有一定增强的趋势,此疗效指标显示试验组中20 mg/q12 h右旋组的疗效优于其他试验组和消旋组。②用药第1天和第5天胃内pH>4.0和pH>6.0的平均时间见表 4。从数据结果看,相对于基线期(用药前2 d),用药后各组胃内pH>4.0或pH>6.0的平均时间均延长,且维持在较高水平。平均时间由长到短分别为20 mg/q12h右旋组>20 mg/q12h消旋组>10 mg/q12h右旋组>10 mg/qd右旋组。
|
| 图 4 健康受试者用药前2 d及用药后第1、5天胃内TpH>4(%)(A)和TpH>6(%)(B)变化趋势 |
| 组别 | 胃内pH>4.0 | 胃内pH>6.0 | |||||
| 用药前2 d | 用药第1天 | 用药第5天 | 用药前2 d | 用药第1天 | 用药第5天 | ||
| 10 mg/qd右旋组 | 4.23±3.04 | 10.39±4.68 | 15.04±3.90 | 2.38±2.48 | 7.30±4.49 | 10.92±4.31 | |
| 10 mg/q12 h右旋组 | 3.85±1.78 | 15.28±3.89 | 17.71±3.45 | 1.50±1.25 | 9.33±3.61 | 11.97±3.89 | |
| 20 mg/q12 h右旋组 | 3.85±1.61 | 19.74±2.43 | 22.36±1.40 | 1.99±1.06 | 13.33±3.48 | 19.23±2.71 | |
| 20 mg/q12 h消旋组 | 4.07±1.43 | 18.17±3.03 | 20.73±5.93 | 1.69±0.96 | 12.33±3.98 | 15.64±5.43 | |
2.5 安全性评价
试验过程中仅20 mg/q12h右旋组出现1例1件轻度不良事件(大腿后侧酸痛),判断为与药物可能有关,在未采取任何特殊措施的情况下症状消失。且各组均未出现严重不良事件(SAE)。本研究中40例健康受试者全部完成了试验,在试验用药剂量和给药次数下耐受性与安全性良好。
3 讨论针对雷贝拉唑的左右旋异构体,本试验在方法开发初期,尝试了多种色谱柱,最后选择日本Daicel公司的Chiralpark IE手性色谱柱,具有较高的灵敏度和分离度。血浆样本处理方法选择了乙腈直接沉淀蛋白的方法[10],相比于萃取法[10-11]操作更简单,能满足大批量的样本检测。按照《化学药物临床药代动力学研究技术指导原则》的要求,对建立的HPLC-MS/MS方法进行方法学确证,精密度、稳定性等各项结果均良好。试验过程中,对右旋雷贝拉唑钠向左旋的转化进行了考察。结果在该试验条件下几乎未发生相互转化,与文献[12]报道一致,对右旋雷贝拉唑的分析无影响。
药代动力学是描述一定剂量给药后体内的药物浓度的时间过程,简言之是“机体如何处置药物”;而药效学是描述与体内药物浓度相联系的药物效应强度,也就是“药物如何作用机体”。PK/PD联合模型就是结合以上两种方法来描述给某一剂量药物后的药物在体内的浓度-效应-时间之间的统一联系,由描述药物体内时间过程的药代动力学与描述体内的药物浓度的药物效应变化的药效学两部分组成。通过药代动力学与药效学结合模型揭示血浆药物浓度和效应之间的内在联系,可以帮助了解药物在体内作用部位的动力学变化过程。本试验选择胃内pH这一指标,能准确定量,可用于PPI制剂的药效学与药代动力学结合研究的可靠指标。采用线性模型(y=bx+a)分析药效的暴露-效应关系。其中x为暴露,即AUC0-t、Cmax和剂量,y为效应,即药效指标[(TpH>4(%)和TpH>6(%)],结果显示:TpH>4(%)和TpH>6(%)随着试验组药物的暴露增加有一定趋势。
药代动力学参数显示,单次和多次给药后20 mg/q12h右旋组的Cmax和AUC明显大于同剂量消旋组,建议在临床用药时雷贝拉唑右旋体使用剂量应低于消旋体,这与文献报道一致。末次给药后,Rac(%)约等于1,提示连续5 d给药后,注射用右旋雷贝拉唑钠在体内基本无蓄积。且相同组别不同性别之间单次给药及多次给药后的主要药代动力学参数差异无统计学意义。药效学参数显示第1、5天用药后大部分时间胃内pH值可维持在较高水平,2个pH值高峰期分别出现在给药后4 h之后(5~7 h)和10 h之后(11~13 h),而且每天给药1次也会出现pH值的第2个高峰期,考虑与进食相关。
由于本研究样本量较少,10 mg/q12h右旋组和20 mg/q12h消旋组用药后的Cmax、AUC0-t、AUC0-∞几何均数比值的90%置信区间均未完全落在生物等效性的参考判定区间内,尚不能认为首次给药的10 mg/q12h右旋组和20 mg/q12h消旋组具有等效性,即受试制剂在剂量减半的情况下,相对于参比制剂活性成分,右旋雷贝拉唑成分暴露量未得到等效性结论。
| [1] |
陈庆财, 赵俊, 张建义. 雷贝拉唑的药理与临床研究进展[J]. 华西药学杂志, 2014, 29(4): 467-468. CHEN Q C, ZHAO J, ZHANG J Y. The pharmacological and clinical research progress of rabeprazole[J]. West China J Pharm Sci, 2014, 29(4): 467-468. DOI:10.13375/j.cnki.wcjps.2014.04.038 |
| [2] |
BAKHEIT A H, AL-KAHTANI H M, ALBRAIKI S. Rabeprazole: a comprehensive profile[J]. Profiles Drug Subst Excip Relat Methodol, 2021, 46: 137-183. DOI:10.1016/bs.podrm.2020.07.003 |
| [3] |
袁红宇, 王永庆, 张宏文, 等. 雷贝拉唑抑制胃酸分泌的药动学-药效学结合研究[J]. 医药导报, 2014, 33(6): 699-702. YUAN H Y, WANG Y Q, ZHANG H W, et al. Combined pharmacokinetics-pharmacodynamics study of rabeprazole in inhibition of gastric acid secretion[J]. Her Med, 2014, 33(6): 699-702. DOI:10.3870/yydb.2014.06.002 |
| [4] |
张春来, 罗宏军, 姜琦, 等. 右旋雷贝拉唑钠的制备工艺改进[J]. 中国药科大学学报, 2018, 49(3): 291-294. ZHANG C L, LUO H J, JIANG Q, et al. Improved process of dexrabeprazole sodium[J]. J China Pharm Univ, 2018, 49(3): 291-294. DOI:10.11665/j.issn.1000-5048.20180306 |
| [5] |
MIURA M, KAGAYA H, TADA H, et al. Enantioselective disposition of rabeprazole in relation to CYP2C19 genotypes[J]. Br J Clin Pharmacol, 2006, 61(3): 315-320. DOI:10.1111/j.1365-2125.2005.02566.x |
| [6] |
PAI V, PAI N. Randomized, double-blind, comparative study of dexrabeprazole 10 mg versus rabeprazole 20 mg in the treatment of gastroesophageal reflux disease[J]. World J Gastroenterol, 2007, 13(30): 4100-4102. DOI:10.3748/wjg.v13.i30.4100 |
| [7] |
JAIN S C, RELIEF STUDY GROUP. A postmarketing surveillance study of dexrabeprazole in the treatment of acid peptic disorders[J]. J Indian Med Assoc, 2009, 107(2): 111-113. |
| [8] |
李蒲江, 谭淑珍, 曾巨澜, 等. 高效液相色谱法测定注射用右旋雷贝拉唑钠粉针剂含量[J]. 应用化工, 2016, 45(2): 373-376. LI P J, TAN S Z, ZENG J L, et al. Assay of dexrabeprazole sodium for injection by high performance liquid chromatography[J]. Appl Chem Ind, 2016, 45(2): 373-376. DOI:10.16581/j.cnki.issn1671-3206.20151224.040 |
| [9] |
许庆华, 李宗河, 黄菲菲, 等. 雷贝拉唑钠拆分体对大鼠实验性胃溃疡作用的比较研究[J]. 中国新药杂志, 2015, 24(8): 917-923. XU Q H, LI Z H, HUANG F F, et al. Comparison of the effects of rabeprazole sodium and its racemes on experimental gastric ulcer in rats[J]. Chin J New Drugs, 2015, 24(8): 917-923. |
| [10] |
GAO Y H, XU J X, SU Z X, et al. The chiral bioconversion and preclinical pharmacokinetic analysis of (R)-(+)-rabeprazole in beagle dogs by HPLC and HPLC-MS/MS[J]. Biomed Chromatogr, 2013, 27(11): 1380-1386. DOI:10.1002/bmc.2932 |
| [11] |
邵华荣, 陈相峰, 王晓波, 等. 右旋雷贝拉唑钠肠溶片在Beagle犬体内的药代动力学[J]. 药物分析杂志, 2018, 38(9): 1523-1529. SHAO H R, CHEN X F, WANG X B, et al. Pharmacokinetic study of enteric coated (R)-rabeprazole sodium in Beagle dogs[J]. Chin J Pharm Anal, 2018, 38(9): 1523-1529. DOI:10.16155/j.0254-1793.2018.09.09 |
| [12] |
李相鸿, 谢海棠, 梁大虎, 等. HPLC-MS/MS法测定人血浆中右旋雷贝拉唑和左旋雷贝拉唑浓度及其人体药动学研究[J]. 中国新药杂志, 2021, 30(1): 43-49. LI X H, XIE H T, LIANG D H, et al. Determination of dexrabeprazole and levrabeprazole in human plasma by HPLC-MS/MS and its pharmacokinetic study[J]. Chin J New Drugs, 2021, 30(1): 43-49. |
| [13] |
MIURA M, TADA H, SATOH S, et al. Determination of rabeprazole enantiomers and their metabolites by high-performance liquid chromatography with solid-phase extraction[J]. J Pharm Biomed Anal, 2006, 41(2): 565-570. DOI:10.1016/j.jpba.2005.12.016 |




