2. 712000 陕西 咸阳,陕西中医药大学: 药学院;
3. 712000 陕西 咸阳,陕西中医药大学: 基础医学院
2. School of Pharmacy, Shaanxi University of Traditional Chinese Medicine, Xianyang, Shaanxi Province, 712000, China;
3. School of Basic Medicine, Shaanxi University of Traditional Chinese Medicine, Xianyang, Shaanxi Province, 712000, China
胃癌是常见恶性肿瘤疾病,与饮食习惯、环境密切相关[1-2]。临床治疗胃癌方法众多,内镜治疗仅限于淋巴结转移之前;手术根治性切除部位范围大,患者恢复时间长,且术后仍需放化疗防止癌症复发;而化疗药物长期作用于人体,副作用会影响骨髓、肝肾功能[3-4]。故抗肿瘤研究的焦点集中于植物有效成分,中药疗法被广泛用于肿瘤治疗[5]。吴茱萸碱作为中药有效成分[6],对多种恶性肿瘤有较好的抗肿瘤效果[7-8],但吴茱萸碱诱导胃癌细胞凋亡的机制尚未明确。肿瘤细胞增殖及侵袭与信号通路密切相关,丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)与癌细胞信号传递有关[9]。吴茱萸碱作为中药有效物质对多种癌症有抑制效果,故本研究用吴茱萸碱作用胃癌SGC-7901细胞,探究吴茱萸碱通过MAPK通路对人胃腺癌SGC-7901细胞抗肿瘤作用,进一步阐明吴茱萸碱抗肿瘤的分子机制。
1 材料与方法 1.1 细胞SGC-7901细胞购自安妍生物有限公司。
1.2 药品与试剂吴茱萸碱(成都瑞芬斯生物公司,纯度>98%);胎牛血清(杭州江滨生物公司);MTT试剂(南京化学试剂公司);Annexin V-FITC/PI试剂盒(常州百代生物公司);ELISA试剂盒(上海睿时生物公司);DMSO(Sigma公司);cdc2、cdc25C、cyclinB1、ERK、p-ERK、p-38、p-p38、Bcl-2、Cleaved-caspase-3、GAPDH抗体(沈阳万类生物公司);RIPA裂解液(武汉友联特生物公司);山羊抗兔IgG抗体(成都苏净科学器材公司);DMEM培养基、胰酶(HyClone公司)。
1.3 仪器HERAcell 2401型细胞培养箱(上海巴玖实业公司);Multiskan FC型酶标仪(青岛正恒试验设备公司);Sorvall ST 16R型离心机(西安康睿商贸公司);C6型流式细胞仪(无锡凯派克斯公司);电泳系统(杭州正迈科技公司);iBright CL750型凝胶成像仪(成都一科仪器设备公司)。
1.4 方法 1.4.1 细胞培养条件SGC-7901细胞:37 ℃、5%CO2、10%胎牛血清。
1.4.2 MTT法检测细胞活性SGC-7901细胞培养至对数生长期后接种至96孔板内。滴加不同梯度吴茱萸碱(浓度梯度0.5、1、2、4、8、16、32、64 μmol/L),20 μL培养基孵育2 d,弃培养基内药液,MTT溶液孵育4 h后去溶液加150 μL DMSO,490 nm测光密度值。对照组无吴茱萸碱处理,空白孔滴加DMSO。用如下公式计算细胞活性,GraphPad prism8软件计算24、48 h的半数致死量IC50。细胞活性=D(490)实验组-D(490)空白组/ D(490)对照组-D(490)空白组×100%
1.4.3 Annexin V-FITC/PI法评价细胞凋亡对数生长期SGC-7901细胞接种于12孔板上。加入含浓度为8、16、32 μmol/L吴茱萸碱不完全培养基1 mL(记为A1组,A2组,A3组),另设置相同浓度梯度处理的细胞加入阿帕替尼培养液20 mg/L(记为B1组,B2组,B3组),孵育12 h,收集细胞,按说明书操作,加入结合液、Annexinv-FITC溶液和PI溶液混匀,暗处孵育20 min,检测,无吴茱萸碱处理作为对照组观察各组细胞凋亡情况。
1.4.4 流式细胞仪检测细胞周期对数生长期SGC-7901细胞接种于6孔板上。分组与标记同1.4.3,孵育24 h,收集细胞,PBS洗涤3次,70%乙醇固定1.5 h。按照说明书步骤将RNase A、碘化丙啶(PI)与细胞混合0.5 h,温度恒定37 ℃,以不含吴茱萸碱的不完全培养基处理作为对照组,观察细胞周期。
1.4.5 Western blot检测Bcl-2、Cleaved-caspase-3水平取对数生长期细胞,接种于6 cm2的培养瓶,待细胞60%~70%融合时弃去培养基,分组与标记同1.4.3,置于5%CO2、37 ℃培养箱孵育36 h。加入RIPA裂解液提取总蛋白,BCA试剂盒定量。再加入适量的蛋白缓冲液,沸水高温变性,取40 μg蛋白,电泳(SDS-PAGE),转膜,封闭30 min,加入Bcl-2(1 ∶500)、cleaved-caspase-3(1 ∶500)GAPDH(1 ∶1 000) 4 ℃孵育12 h;TBST洗膜,加入辣根过氧化物酶标记的羊抗兔lgG二抗(1 ∶5 000),孵育1.5 h,化学发光仪曝光显影,以GAPDH为内参,计算目的蛋白的相对表达量。
1.4.6 划痕愈合实验评价细胞迁移对数生长期SGC-7901细胞接种于6孔板中。用10 μL移液器枪头在SGC-7901细胞表面进行划痕,分组与标记同1.4.3,继续孵育24 h,显微镜观察0、24 h划痕的宽度。以不含吴茱萸碱的不完全培养基处理作为对照组,比较各组划痕愈合率。划痕愈合率=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%。
1.4.7 Western blot检测蛋白水平接种SGC-7901细胞至6孔板。分组与标记同1.4.3,孵育24 h,收集细胞并提取蛋白。经凝胶电泳分离、转膜,一抗4 ℃孵育12 h,洗膜并加二抗37 ℃孵育1 h,洗膜进行显影,图像处理软件分析。以不含吴茱萸碱的不完全培养基处理作为对照组,对比cdc2、cdc25C、cyclinB1、p-ERK及p-p38蛋白水平。
1.5 统计学分析数据采用x±s表示,采用SPSS 20.0软件分析,两两比较用t检验,多组比较用方差分析,P<0.05表示差异有统计学意义。
2 结果 2.1 吴茱萸碱影响SGC-7901细胞增殖SGC-7901细胞经吴茱萸碱处理24 h及48 h的细胞活性见图 1。结果表明,SGC-7901细胞活性随着吴茱萸碱浓度的增加而降低。吴茱萸碱处理SGC-7901细胞48 h的细胞毒性大于24 h的细胞毒性。使用GraphPad prism软件计算得出吴茱萸碱对SGC-7901细胞24 h的IC50为16.78 μmol/L,48 h的IC50为7.28 μmol/L。
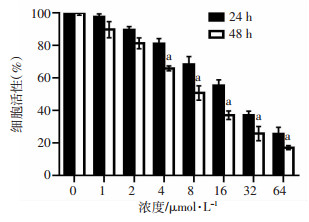
|
| a: P<0.05, 与24 h比较 图 1 吴茱萸碱对人胃癌SGC-7901细胞增殖的影响(n=6,x±s) |
2.2 吴茱萸碱影响SGC-7901细胞凋亡
采用流式细胞仪评价吴茱萸碱在8、16、32 μmol/L浓度下对SGC-7901细胞凋亡的影响。吴茱萸碱处理后,细胞凋亡率增加,显著促进SGC-7901细胞凋亡(P<0.05),且作用效果与浓度有关。与未添加p38抑制剂比较,各浓度下SGC-7901细胞凋亡率下降(P<0.05),见图 2。
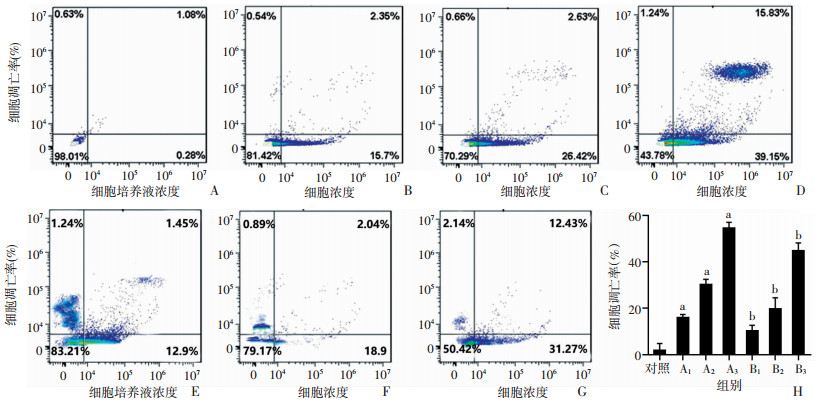
|
| A~G分别为流式检测对照、A1、A2、A3、B1、B2、B3组胃癌SGC-7901细胞凋亡率;H:各组胃癌SGC-7901细胞凋亡率统计结果 图 2 吴茱萸碱对人胃癌SGC-7901细胞凋亡率的影响(n=6,x±s) |
2.3 吴茱萸碱对细胞周期的影响
采用流式细胞仪检测吴茱萸碱在8、16、32 μmol/L浓度下对SGC-7901细胞周期的影响。SGC-7901细胞经8、16、32 μmol/L吴茱萸碱处理G2/M期细胞比例提高,作用效果与浓度有关,G0/G1期细胞所占百分比下降(P<0.05)。与A组相比,B组各组细胞G2/M期细胞比例减少(P<0.05),见图 3。为了进一步验证吴茱萸碱对细胞周期G2/M的阻滞作用,调控G2/M细胞周期相关蛋白(cdc2、cdc25C、cyclin B1),使用Western blot检测,与对照组相比,A组经吴茱萸碱处理24 h后,cdc2、cdc25C、cyclin B1的表达水平显著降低(P<0.05),与A组比较,增加抑制剂后cdc2、cdc25C、cyclin B1表达显著升高(P<0.05),表明吴茱萸可能通过下调cdc2、cdc25C、cyclin B1蛋白水平,诱导SGC-7901细胞G2/M期阻滞,见图 4。
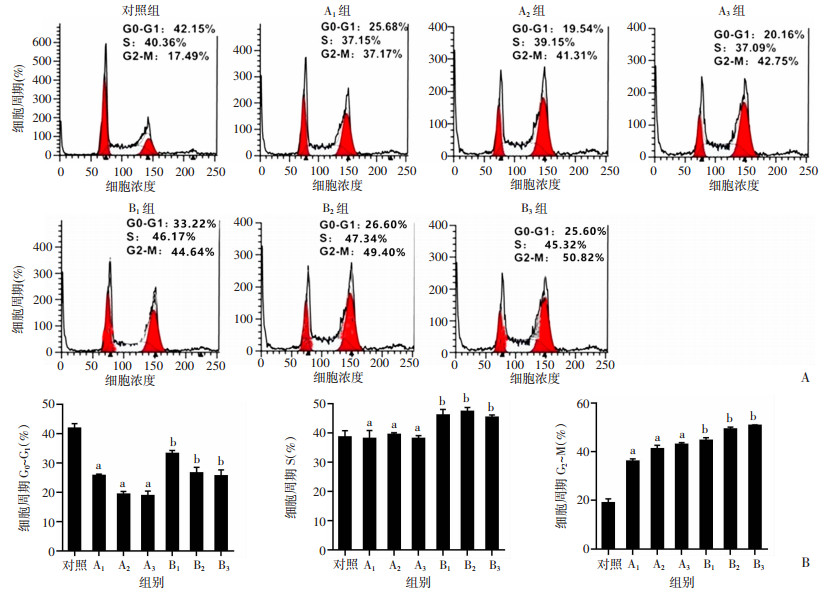
|
| A:流式检测各组SGC-7901细胞周期;B:各组SGC-7901细胞周期统计结果;a:P<0.05,与对照组比较;b:P<0.05,与A1组比较 图 3 吴茱萸碱对人胃癌SGC-7901细胞周期的影响(n=6,x±s) |
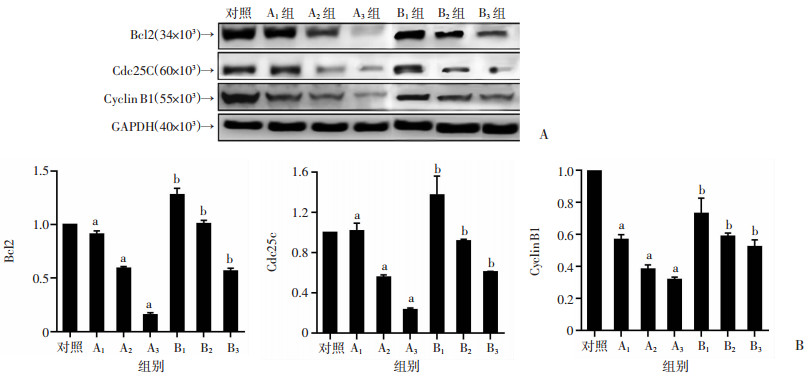
|
| A:Western blot检测各组胃癌SGC-7901细胞周期蛋白;B:各组胃癌SGC-7901细胞周期蛋白半定量结果;a:P<0.05,与对照组比较;b:P<0.05,与A1组比较 图 4 吴茱萸碱对人胃癌SGC-7901细胞周期蛋白的影响(n=6,x±s) |
2.4 细胞凋亡相关蛋白水平
与对照组比较,A组Bcl2、cleaved-caspase-3水平明显增高(P<0.05);与A组比较,B组Bcl2、cleaved-caspase-3水平明显下降(P<0.05)。见图 5。
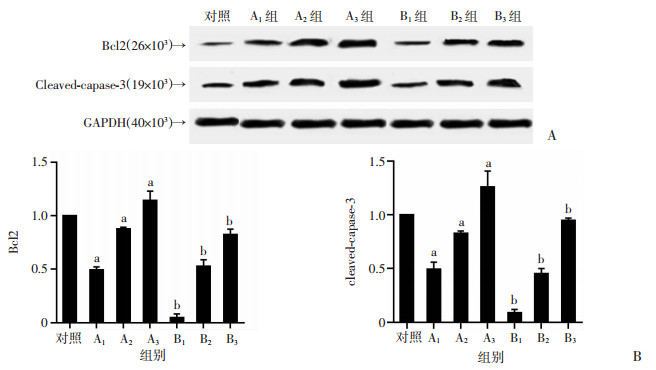
|
| A:Western blot检测各组胃癌SGC-7901细胞相关凋亡蛋白水平;B:各组胃癌SGC-7901细胞相关凋亡蛋白水平半定量结果;a:P<0.05,与对照组比较;b:P<0.05,与A1组比较 图 5 吴茱萸碱对人胃癌SGC-7901细胞相关凋亡蛋白水平的影响(n=6,x±s) |
2.5 吴茱萸碱对细胞迁移的影响
与对照组比较,A组吴茱萸碱处理后划痕愈合率逐渐降低(P<0.05),与A组比较,B组划痕愈合率明显增高(P<0.05),见图 6。

|
| A:划痕愈合实验比较各组胃癌SGC-7901细胞迁移率;B:各组胃癌SGC-7901细胞迁移率统计结果;a:P<0.05,与对照组比较;b:P<0.05,与A1组比较 图 6 吴茱萸碱对人胃癌SGC-7901细胞迁移率的影响(n=6,x±s) |
2.6 吴茱萸碱对MAPK通路相关蛋白表达的影响
与对照组比较,随着吴茱萸碱浓度的增加,A组SGC-7901细胞的p-ERK表达逐渐下调,p-p38表达则呈现上调(P<0.05),作用效果与浓度有关。与A组比较,B组p-ERK表达逐渐上调,p-p38表达则呈现下调(P<0.05),见图 7。
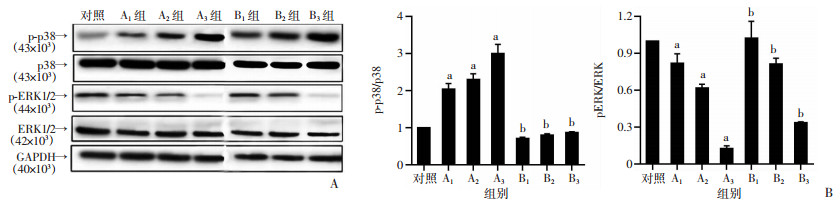
|
| A:Western blot检测各组MAPK蛋白;B:各组MAPK蛋白半定量结果;a:P<0.05,与对照组比较;b:P<0.05,与A1组比较 图 7 吴茱萸碱对人胃癌SGC-7901细胞MAPK蛋白水平的影响(n=6,x±s) |
3 讨论
胃癌为我国高发消化系统恶性肿瘤,病死率高[10-12]。癌症诊断与治疗方法的多样性,使胃癌生存率逐步上升[13]。但长期化疗及新辅助治疗可能导致肿瘤细胞耐药,对胃癌患者身心健康极为不利[14]。中医认为中药靶点多,疗效稳定[15],中医中药治疗联合化疗已经成为胃癌患者临床治疗的常规方案,这将是热门研究方向[15]。
吴茱萸归肝、脾、胃、肾经,可散寒止痛,降逆止呕,助阳止泻[16]。吴茱萸碱源于中药吴茱萸的喹诺酮类生物碱,对结肠癌细胞、恶性黑色素瘤细胞等多种肿瘤细胞有抑制作用[17-18]。本课题从细胞增殖、凋亡、迁移等方面研究吴茱萸碱通过MAPK通路对胃癌细胞SGC-7901的抑制机制,结果表明吴茱萸碱对SGC-7901细胞具有较强的细胞毒性(24 h的半数致死量IC50= 16.78 μmol/L,48 h的半数致死量IC50=7.28 μmol/L)。8、16、32 μmol/L浓度的吴茱萸碱处理后,能显著增加凋亡细胞比例。
在众多的细胞内信号通路中,MAPK途径相当重要,涉及多种细胞生命周期的调控[19]。MAPK以ERK1/2、JNK、p38-MAPK与ERK5为主要途径,ERK1/2、p38通路以磷酸化形式(p-ERK1/2、p-p38等)表现为激活状态[20-22]。MAPK/ERK通路与癌细胞产生和转移有关[22],MAPK/ERK激活能提高细胞增殖、侵袭及转移能力,故抑制MAPK/ERK信号通路有望发挥抗肿瘤作用[23-24]。MAPK/p38通路主要与氧化应激和细胞凋亡有关,研究表明MAPK/p38通路活化参与细胞氧化应激,加速细胞凋零[25]。且MAPK/p38通路在细胞周期阻滞中也发挥着重要作用,p38磷酸化可下调细胞周期蛋白表达,阻止多种肿瘤细胞的细胞增殖[26]。本课题在研究吴茱萸碱的抗肿瘤活性的基础上,通过MAPK信号通路进一步研究吴茱萸碱抑制人胃癌SGC-7901细胞的机制,结果表明8、16、32 μmol/L吴茱萸碱处理后,SGC-7901细胞p-ERK水平显著下降,p-p38水平显著上升,而在相同浓度梯度吴茱萸碱中加入p38抑制剂后,p-ERK水平上调,p-p38水平下调,提示吴茱萸碱是通过作用于MAPK/p38和MAPK/ERK信号通路发挥抗肿瘤作用。癌细胞生长与cdc2、cdc25C、cyclin B1等蛋白有关,细胞生长抑制会伴随cdc2、cdc25C、cyclin B1水平改变[27-28]。本研究中,吴茱萸碱作用下SGC-7901细胞G2/M期阻滞,cdc2、cdc25C、cyclin B1水平下调,这可能与吴茱萸碱上调MAPK通路蛋白p38,下调ERK蛋白,从而引起SGC-7901胃癌细胞G2/M期阻滞的机制有关。细胞划痕愈合实验证实了8、16、32 μmol/L吴茱萸碱均能显著抑制人胃癌SGC-7901细胞的迁移,抑制效果呈现浓度依赖性,可能与吴茱萸碱通过MAPK通路引起细胞迁移能力下降有关。
综上所述,体外细胞实验表明,吴茱萸碱通过MAPK通路下调人胃癌SGC-7901细胞分裂周期蛋白并上调凋亡蛋白,抑制细胞生长,降低胃癌SGC-7901细胞迁移能力,促进细胞凋亡,具有较好的抗肿瘤效果。本研究为吴茱萸碱在胃癌的临床应用提供实验基础,同时对MAPK信号通路相关的其他癌症抗肿瘤机制研究提供实验设计思路。
| [1] |
YUSEFI A R, BAGHERI LANKARANI K, BASTANI P, et al. Risk factors for gastric cancer: a systematic review[J]. Asian Pac J Cancer Prev, 2018, 19(3): 591-603. |
| [2] |
CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. |
| [3] |
SONG Z Y, WU Y, YANG J B, et al. Progress in the treatment of advanced gastric cancer[J]. Tumour Biol, 2017, 39(7): 1010428317714626. |
| [4] |
PAULA D P, BRASIL COSTA V I, JORGE R V, et al. Impact of protocol change on individual factors related to course of adverse reactions to chemotherapy for breast cancer[J]. Support Care Cancer, 2020, 28(1): 395-403. |
| [5] |
王晋慧, 吕邵娃, 李孟, 等. 中药有效成分体外抗乳腺癌作用机制的研究进展[J]. 中国实验方剂学杂志, 2020, 26(17): 197-203. WANG J H, LYU S W, LI M, et al. Anti-breast cancer mechanism of active ingredients of traditional Chinese medicine in vitro[J]. Chin J Exp Tradit Med Formulae, 2020, 26(17): 197-203. |
| [6] |
刘丽, 张笑敏, 许浚, 等. 吴茱萸化学成分和药理作用及质量标志物(Q-marker)的预测分析[J]. 中草药, 2020, 51(10): 2689-2702. LIU L, ZHANG X M, XU J, et al. Chemical components and pharmacological action for Euodiae Fructus and predictive analysis on its Q-marker[J]. Chin Tradit Herb Drugs, 2020, 51(10): 2689-2702. |
| [7] |
杨华清, 侯俊萍, 孙婷. 吴茱萸碱影响宫颈癌HeLa细胞的增殖与凋亡及机制研究[J]. 中国临床药理学杂志, 2020, 36(20): 3298-3301. YANG H Q, HOU J P, SUN T. Evodiamine affects cervical cancer HeLa cell proliferation and apoptosis and its mechanism[J]. Chin J Clin Pharmacol, 2020, 36(20): 3298-3301. |
| [8] |
刘璐, 王雪梅, 王岩, 等. 吴茱萸碱对胶质瘤SHG-44细胞凋亡的促进作用及其机制[J]. 中国医学科学院学报, 2020, 42(5): 591-595. LIU L, WANG X M, WANG Y, et al. Evodiamine promotes apoptosis of glioma SHG-44 cells and its mechanism[J]. Acta Acad Med Sin, 2020, 42(5): 591-595. |
| [9] |
BRAICU C, BUSE M, BUSUIOC C, et al. A comprehensive review on MAPK: a promising therapeutic target in cancer[J]. Cancers, 2019, 11(10): 1618. |
| [10] |
WU H, WANG W, TONG S, et al. Nucleostemin regulates proliferation and migration of gastric cancer and correlates with its malignancy[J]. Int J Clin Exp Med, 2015, 8(10): 17634-17643. |
| [11] |
NEVES FILHO E H, DE SANT'ANA R O, NUNES L V, et al. Histopathological regression of gastric adenocarcinoma after neoadjuvant therapy: a critical review[J]. APMIS, 2017, 125(2): 79-84. |
| [12] |
SUN Z Q, WANG Q S, YU X B, et al. Risk factors associated with splenic hilar lymph node metastasis in patients with advanced gastric cancer in northwest China[J]. Int J Clin Exp Med, 2015, 8(11): 21358-21364. |
| [13] |
SHITARA K, BANG Y J, IWASA S, et al. Trastuzumab deruxtecan in previously treated HER2-positive gastric cancer[J]. N Engl J Med, 2020, 382(25): 2419-2430. |
| [14] |
JIN P, JI X Y, KANG W Z, et al. Artificial intelligence in gastric cancer: a systematic review[J]. J Cancer Res Clin Oncol, 2020, 146(9): 2339-2350. |
| [15] |
袁选举, 邓守恒. 中医药在治疗恶性肿瘤中的研究进展[J]. 时珍国医国药, 2019, 30(9): 2232-2234. YUAN X J, DENG S H. Research progress of traditional Chinese medicine in the treatment of malignant tumors[J]. Lishizhen Med Mater Med Res, 2019, 30(9): 2232-2234. |
| [16] |
肖洋, 段金芳, 刘影, 等. 吴茱萸炮制方法和功能主治历史沿革[J]. 中国实验方剂学杂志, 2017, 23(3): 223-228. XIAO Y, DUAN J F, LIU Y, et al. Historic successive changes of euodiae fructus in processing methods and functions[J]. Chin J Exp Tradit Med Formulae, 2017, 23(3): 223-228. |
| [17] |
LIU N, LI Y X, CHEN G Z, et al. Evodiamine induces reactive oxygen species-dependent apoptosis and necroptosis in human melanoma A-375 cells[J]. Oncol Lett, 2020, 20(4): 121. |
| [18] |
GUAN X Y, ZHENG X T, VONG C T, et al. Combined effects of berberine and evodiamine on colorectal cancer cells and cardiomyocytes in vitro[J]. Eur J Pharmacol, 2020, 875: 173031. |
| [19] |
YOU Z, LIU S P, DU J, et al. Advancements in MAPK signaling pathways and MAPK-targeted therapies for ameloblastoma: a review[J]. J Oral Pathol Med, 2019, 48(3): 201-205. |
| [20] |
DROSTEN M, BARBACID M. Targeting the MAPK pathway in KRAS-driven tumors[J]. Cancer Cell, 2020, 37(4): 543-550. |
| [21] |
GUO Y J, PAN W W, LIU S B, et al. ERK/MAPK signalling pathway and tumorigenesis[J]. Exp Ther Med, 2020, 19(3): 1997-2007. |
| [22] |
LOW H B, ZHANG Y. Regulatory roles of MAPK phosphatases in cancer[J]. Immune Netw, 2016, 16(2): 85-98. |
| [23] |
PAPA S, CHOY P M, BUBICI C. The ERK and JNK pathways in the regulation of metabolic reprogramming[J]. Oncogene, 2019, 38(13): 2223-2240. |
| [24] |
HUANG Y Q, ZOU Y, LIN L H, et al. miR-101 regulates the cell proliferation and apoptosis in diffuse large B-cell lymphoma by targeting MEK1 via regulation of the ERK/MAPK signaling pathway[J]. Oncol Rep, 2019, 41(1): 377-386. |
| [25] |
MARTÍNEZ-LIMÓN A, JOAQUIN M, CABALLERO M, et al. The p38 pathway: from biology to cancer therapy[J]. Int J Mol Sci, 2020, 21(6): E1913. |
| [26] |
STRAMUCCI L, PRANTEDA A, BOSSI G. Insights of crosstalk between p53 protein and the MKK3/MKK6/p38 MAPK signaling pathway in cancer[J]. Cancers (Basel), 2018, 10(5): E131. |
| [27] |
WANG J N, ZHANG Z R, CHE Y, et al. Acetyl-macrocalin B, an ent-kaurane diterpenoid, initiates apoptosis through the ROS-p38-caspase 9-dependent pathway and induces G2/M phase arrest via the Chk1/2-Cdc25C-Cdc2/cyclin B axis in non-small cell lung cancer[J]. Cancer Biol Ther, 2018, 19(7): 609-621. |
| [28] |
LIU K, ZHENG M Y, LU R, et al. The role of CDC25C in cell cycle regulation and clinical cancer therapy: a systematic review[J]. Cancer Cell Int, 2020, 20: 213. |




