觉醒是什么?大脑如何维系觉醒呢?20世纪30年代以前,觉醒一直被认为是自然而然的发生,睡眠结束后自然就该醒了,鲜有科学家去关心或真正思考觉醒是怎么回事。直到20世纪初昏睡性脑炎病在欧洲蔓延,才促使人们认识到觉醒需要脑内特殊的结构来主动的启动和维持。昏睡性脑炎病患者典型临床特征表现为嗜睡、睡眠颠倒、昏睡等一系列觉醒障碍。1930年,奥地利神经科学家ECONOMO率先发现昏睡性脑炎病患者在下丘脑和中脑连接处有局限性的损伤[1]。这一发现由此开启了觉醒发生机制研究的历史先河。随后,MORUZZI和MAGOUN于1949年发现猫脑干网状结构在觉醒和意识状态维持中亦发挥了关键作用[2],至此,现代觉醒发生机制的理论基础得以奠定。在随后长达70余年的研究中,神经科学家先后发现了脑内存在大量的与觉醒发生密切相关的核团。尤其是近20年,随着分子生物学和单细胞活动检测技术的快速发展以及在神经科学领域的广泛应用,觉醒发生机制和觉醒功能理论不断得到更新和完善。特别值得注意的是,临床报道部分觉醒不能的患者,其觉醒发生系统并无明显的损伤,损伤部位主要出现在觉醒发生系统支配的脑功能网络。相反,单纯损伤某一觉醒发生核团,并不会导致严重觉醒障碍[3]。因此,觉醒的发生与脑功能网络的状态密不可分。本述评拟从觉醒发生的神经机制以及觉醒时脑功能网络两方面进行阐述和思考,以期为深入理解觉醒及其相关功能提供新思路。
1 觉醒发生的神经机制为了研究觉醒发生与维持的神经机制,首先必须明确判断觉醒的标准。觉醒和睡眠是机体两种截然不同的生理状态,二者可从行为和皮层脑电两个维度进行区分。在行为上,觉醒主要表现为变化多端的各种躯体活动和丰富的心理活动,对环境刺激敏感且能迅速做出各种适应性反应[4]。自脑电图技术发明后,觉醒和睡眠状态的区分有了更为客观、科学的评判标准,哺乳动物觉醒时,脑电波形上表现为低幅、高频(7 Hz以上)的特征性去同步化波。同时,肌电幅度亦较大[5]。
目前普遍认为,觉醒的产生依赖于脑内特殊的结构——促觉醒核团,一旦促觉醒核团被破坏到一定程度,觉醒将出现障碍。因此,发现和确定促觉醒核团在脑内的位置,以及鉴定其在觉醒发生中的作用,是解析觉醒发生机制的首要任务。
1.1 六大经典的促觉醒核团的鉴定为了确定与觉醒发生有关的神经核团,早期的科学研究多采用横断、毁损脑组织(药物、电毁损)、电刺激等方法,筛选及鉴定与觉醒产生和调控有关的核团。意大利生理学家MORUZZI和美国解剖学家MAGOUN(1949年)通过毁损脑的不同截面,发现破坏猫的脑干网状结构将导致动物持续处于“睡眠”状态,而电刺激浅麻醉猫的脑干网状结构,可引起大脑皮层去同步化的脑电反应,即脑电图上将出现去同步化快波——“觉醒波”,如果使用麻醉药物抑制脑干网状结构活动,可引起皮层出现高幅慢波的(睡眠)脑电[2],至此,“脑干网状结构上行激动系统”成为第一个通过科学实验被确定的与觉醒发生相关的大脑结构。
为进一步弄清脑干网状结构促觉醒的化学本质,从20世纪中叶至80年代后期,科学家在猫、家兔、大鼠、猴身上进行了大量的觉醒(行为、脑电)实验,通过毁损和刺激的方式,结合神经化学测定、神经药理学等技术方法,逐步确定了“脑干网状结构”中的胆碱能、去甲肾上腺素能、5-羟色胺(serotonin, 5-HT)能神经元以及其他脑区的多巴胺能和组胺能核团与脑电觉醒(皮层脑电图)或行为觉醒(肌肉运动)密切相关。
1.1.1 脚桥被盖核/背外侧被盖核胆碱能神经元核团对胆碱能系统促觉醒的认识,得益于早期乙酰胆碱的化学合成,以及抗胆碱药物和胆碱受体激动剂的应用,乙酰胆碱是最早确定的能够引起皮层广泛性去同步化的化学物质之一[6]。1955年RINALDI等[7]通过结合电刺激、神经药理学方法和脑电记录等,发现皮层觉醒与乙酰胆碱水平呈正相关,推测出网状上行激活系统本质上可能主要是通过释放乙酰胆碱到皮层引起皮层觉醒。然而,对于胆碱能神经元在脑内空间定位的认识却一波三折。根据猫的横切实验结果,脑干三叉神经处横断并不会影响觉醒,而横断切面向吻侧方向迁移4~5 mm后,动物会陷入昏睡状态。1972年,MORUZZI[8]曾分析和推断在脑干这两个切面之间存在调控皮层脑电觉醒的神经元。1967年,SHUTE等[9]采用免疫组化技术,发现在脚桥被盖核/背外侧被盖核存在乙酰胆碱酯酶(acetylcholinesterase, AChE)阳性表达,但随后发现AChE并非胆碱能神经元特异的分子标记,比如黑质致密部的AChE阳性神经元并非胆碱能神经元,而是多巴胺能神经元。直到20世纪80年代早期,胆碱乙酰转移酶(choline acetyltransferase, ChAT)单抗染色方法准确标记胆碱能神经元技术的应用,MESULAM等[10]才确定中脑脑桥连接处即脚桥被盖核/背外侧被盖核,确实存在胆碱能神经元聚集区。
1.1.2 蓝斑去甲肾上腺素能神经元核团早在20世纪60年代,对去甲肾上腺素的促觉醒作用已有初步认识,DELL[11]曾将去甲肾上腺素引起猫皮层觉醒的效应与脑干网状结构系统联系起来,认为网状结构激活系统可能释放肾上腺素能物质,从而与觉醒的产生相关。HANSON[12](1967年)和SCHOENFELD等[13](1969年)亦发现抑制脑内合成去甲肾上腺素的限速酶——酪氨酸羟化酶活动,去甲肾上腺素和多巴胺的水平都会下降,并使得动物进入“安静”状态。1973年,CHU等[14]率先采用在体神经电生理学技术,进一步证实位于猫脑干网状结构中蓝斑的去甲肾上腺素能神经元与觉醒和警觉的发生密切相关。这一现象随后也在大鼠和猴等动物中得到证实[15]。
1.1.3 背缝核5-羟色胺能神经元核团早期对脑内5-HT系统在睡眠觉醒发生中作用的认识颇为曲折。20世纪70年代,科学家JOUVET[16]基于毁损和神经药理学实验的结果,一直认为5-HT系统主要是在睡眠,尤其是慢波睡眠的启动和维持中起着重要作用。KOSTOWSKI等[17](1969年)、POLC等[18](1970年)陆续发现,高频刺激麻醉家兔脑干中线核团(5-羟色胺能神经元聚集区域)可促进皮层脑电觉醒。1979年,TRULSON等[19]应用在体放电活动记录技术,证实在睡眠觉醒周期中5-HT能神经元主要在觉醒期呈现高水平的放电。这一发现才逐步确定背缝核5-HT能神经元发挥促觉醒作用。
1.1.4 中脑腹侧被盖区多巴胺能神经元核团1957年,CARLSSON等[20]与同事在药理学实验中发现,小鼠腹腔内注射儿茶酚胺类前体——左旋多巴,穿过血脑屏障形成多巴胺后,能够产生行为觉醒和长时间的皮层活跃。随着免疫组化染色技术的发展,1964年,DAHLSTRÖM等[21]初步确定脑内儿茶酚胺神经元胞体的分布,3个重要且神经元数目多的脑区之一就位于中脑腹侧被盖区。1973年,法国JOUVET实验室的JONES等[22]通过电毁损中脑腹侧被盖区,发现脑内多巴胺水平显著下降,同时伴随动物行为和皮层觉醒下降。由此,推测出中脑腹侧被盖区多巴胺神经元对于行为觉醒的维持是必不可少的。
1.1.5 下丘脑结节乳头体组胺能神经元核团在20世纪60年代,MONNIER等[23](1967年)发现家兔颈外静脉注射组胺后,EEG中低频delta波显著降低,而去同步化快波则持续增强,表明组胺具有促觉醒效应。随后,SCHWARTZ等[24](1970年)与VERDIERE等[25](1975年)通过应用免疫组化技术,进一步确定脑内产生组胺的神经元位于下丘脑后部(结节乳头体核,脑内唯一含有组胺能神经元的核团)。这与当初ECONOMO根据昏睡性脑病患者症状,提出的下丘脑后部存在“觉醒发生区”观点相吻合。
1.1.6 基底前脑乙酰胆碱能神经元核团20世纪50年代末至70年代末的研究主要关注于基底前脑的促睡眠效应,因为电刺激或化学刺激基底前脑(主要是视前区,亦被称为基底前脑同步化区),在觉醒的猫中产生类似睡眠的同步化脑电,电损毁猫的基底前脑视前区将导致严重的睡眠抑制。1979年,JOHNSTON等[26]应用免疫组化技术,发现基底前脑内的神经元直接向大脑皮层发出胆碱能神经纤维投射。1986年,SZYMUSIAK等[27]采用单位放电记录技术,发现除了存在睡眠活跃的神经元外,在基底前脑中约47%的神经元表现出觉醒期活跃的放电模式。基底前脑的胆碱能神经元广泛投射到大脑皮层,而脑干的胆碱能神经元主要投射至丘脑,基于解剖学上的位置和纤维投射关系,以及皮层乙酰胆碱释放水平与皮层觉醒脑电的正相关性,SEMBA等[28]于1989年提出,基底前脑的胆碱能神经元在皮层觉醒中发挥至关重要的作用。
至此,早期六大经典的促觉醒核团/脑区:脑干网状结构中的脚桥被盖核/背外侧被盖核(胆碱能)、蓝斑(去甲肾上腺素能)、背缝核(5-羟色胺能)、中脑腹侧被盖核(多巴胺能)、下丘脑结节乳头体核(组胺能)、基底前脑(胆碱能)被逐一发现和确定。值得一提的是,早期采用的实验方法,无论是毁损还是刺激,均明显缺乏特异性,常常导致在不同的实验室,对不同的实验动物(家兔、猫、羊)甚至是相同种属动物出现相互矛盾的实验结果,使得初期在促觉醒核团的发现和确定上异常困难。进入21世纪后,随着现代分子生物学技术的快速发展,转基因、光/化学遗传学、在体钙成像、多通道记录等先进技术在神经科学领域得到广泛应用,对觉醒的发生机制有了更为清晰的认识。通过操控特定类型神经元活动,进一步明确促觉醒核团中特定神经元在觉醒中的作用。比如,背缝核中除了5-HT能神经元外,还含有一类多巴胺能神经元属于觉醒期活跃神经元。通过光遗传方法激活该类神经元后,可促使机体从睡眠转为觉醒;相反,通过化学遗传学方法抑制后,机体则进入睡眠状态[29]。同样,中脑导水管周围腹侧灰质,也存在一类功能类似的多巴胺能神经元,在觉醒期c-Fos表达量高,损伤后,觉醒减少,睡眠增多[30]。
1.2 神经肽、谷氨酸和γ-氨基丁酸能促觉醒核团鉴定神经科学家越来越清晰地认识到:觉醒的产生并不是仅仅依赖于一个核团/脑区的某一类神经元,而是需要不同脑区、不同核团、不同类型的神经元共同完成。但脑内究竟有多少个促觉醒发生脑区/核团,又有多少种不同类型的神经元参与觉醒的发生,这些问题促使觉醒领域的神经科学家一直孜孜以求地不断探索,吸引着许多甚至是非觉醒领域的神经科学家纷纷加入,众多科学家率先将前沿新技术应用于寻找更多的促觉醒核团以及促觉醒神经元,试图从细胞水平上找出觉醒发生之谜。
1.2.1 多个脑区的肽能神经元核团1998年,在全脑筛查孤儿受体过程中,DE LECEA等[31]、SAKURAI等[32]科学家同时在ECONOMO曾经提出的“觉醒发生区”——下丘脑后部(外侧下丘脑区)又发现一类分泌小分子神经肽促食欲素(orexin,又称hypocretin)的特殊神经元。该群神经元具有极强的促觉醒作用,这是继经典促觉醒核团确立后首次新发现的多肽类促觉醒系统。Orexin的合成仅存在于外侧下丘脑的神经元中,包括orexin A(含33个氨基酸残基)和orexin B(含28氨基酸残基),通过两个G蛋白偶联受体orexin receptor 1和2发挥效应。Orexin能神经元向全脑发出广泛性投射,尤其向包括基底前脑、结节乳头体核、蓝斑和中脑腹侧被盖区在内的经典促觉醒核团发出较密集的投射,并具有显著的细胞兴奋效应。无论是早期的在体单位放电记录、c-Fos蛋白表达检测,还是近期的在体光纤成像实验都证实,orexin神经元活动水平与觉醒水平高度相关:orexin神经元在觉醒期放电频率最高,c-Fos蛋白表达强,而在睡眠期放电活动显著降低,从非快速眼动睡眠向觉醒期转换时,钙荧光信号逐渐增强并维持较高的活动水平[33]。同时,微透析结合放免学检测发现,在基底前脑和下丘脑部分脑区,orexin神经末梢的递质释放量也呈现觉醒高睡眠低的变化趋势。选择性地使orexin神经元发生凋亡或敲除orexin基因、敲除orexin受体,小鼠将出现肌张力突然丧失(猝倒症)的睡眠障碍,与人发作性睡病极为相似的症状和脑电表现。目前认为,orexin神经肽分泌水平下降或orexin受体缺失是犬或人发生发作性睡病(异常睡眠侵入觉醒)的主要原因[34-35]。故orexin促醒系统对正常睡眠觉醒周期性发生起着关键性调控作用。
除了神经肽orexin外,另一类近年新发现的肽能物质——神经肽S(neuropeptide S, NPS),亦被发现具有较强的促觉醒作用。NPS由20个氨基酸组成,是脑内含量较少的神经肽之一,大部分NPS阳性神经元主要集中于脑桥中部即蓝斑腹内侧区。脑电记录显示大鼠侧脑室注射低剂量NPS(1 nmol)即可促进觉醒时间显著增加,伴随睡眠各期时间减少,起效快、维持时间短(注射后1 h内)[36]。虽然有研究显示侧脑室注射NPS后,促觉醒脑区下丘脑组胺能和orexin能神经元的c-Fos蛋白表达增加,但其促觉醒机制仍有待进一步深入研究[37]。
同时,最新研究表明,在下丘脑视前区存在一类表达速激肽1(tachykinin1, Tac1)的特殊神经元,激活此类神经元,减少睡眠,促进觉醒。即使在睡眠驱动力进一步增加的情况下,激活此类神经元都能维持觉醒状态达数小时之久。刺激这群神经元,还能促使动物从异氟烷和七氟烷气体麻醉中迅速苏醒过来。这种促觉醒作用可能与其投射到其他促觉醒核团,如外侧下丘脑促食欲素能神经元、中脑导水管周围腹外侧灰质和腹侧被盖区多巴胺神经元,以及蓝斑去甲肾上腺素能神经元等有关[38]。
1.2.2 多个脑区的谷氨酸能神经元核团近10年大量新的实验数据让神经科学家惊讶地发现,大脑的谷氨酸能神经元在觉醒发生中发挥着非常重要的作用(图 1)。觉醒期,脑内兴奋性递质谷氨酸水平增加显著,非快速眼动睡眠期下降。这些觉醒期增加的谷氨酸递质可能来自以下核团:①脑干网状结构中的臂旁核内侧区。该区域谷氨酸能神经元可支配基底前脑,其损伤后使觉醒水平降低,delta波增加,甚至导致昏迷或持续植物状态的出现[39-40];②脑干脚桥被盖核。除了早期发现的胆碱能神经元促觉醒外,选择性激活其中的谷氨酸能神经元,增加觉醒时间,抑制非快速眼动睡眠[41];③丘脑室旁核。化学遗传学方法抑制该核团内的谷氨酸能神经元,可引起觉醒时间减少。特异性激活这类神经元能够缩短麻醉向清醒转换所需时间。这种效应与外侧下丘脑orexin神经元-丘脑室旁核谷氨酸能神经元-伏隔核通路的激活有关[42];④丘脑中央内侧核、腹内侧核和背内侧丘脑。这些区域具有表达钙结合蛋白(calretinin)的一类谷氨酸能神经元,这些神经元可介导睡眠期向觉醒期的转换[43-46];⑤腹侧被盖区。该区域含有NOS1的谷氨酸能神经元,这些神经元通过兴奋伏隔核与外侧下丘脑的神经元产生觉醒[47];⑥下丘脑乳头上核。该核团中的谷氨酸能神经元直接投射至皮层,化学遗传学方法激活该类神经元后,能显著引起皮层觉醒。而选择性抑制此类谷氨酸能神经元,将减少觉醒,并抑制theta和gamma脑电活动[48];⑦下丘脑视前区。化学遗传学方法激活外侧和内侧视前区中一类含Ⅱ型囊泡膜谷氨酸转运体的谷氨酸能神经元,将启动觉醒,抑制睡眠[49];⑧内侧隔核。原位杂交实验和光电极记录显示,觉醒期,此区谷氨酸能神经元最活跃,光和化学遗传学方法激活这些谷氨酸能神经元显著增加觉醒时间,这与投射并兴奋外侧下丘脑谷氨酸能神经元有关[50];⑨基底前脑。在基底前脑,除了胆碱能神经元之外,其谷氨酸能神经元兴奋后亦能发挥促觉醒作用[51]。此外,机体能量分子ATP嘌呤系统可能也参与促觉醒过程,激活基底前脑的嘌呤P2受体,增加基底前脑兴奋性递质谷氨酸水平,并使促觉醒作用的胆碱能神经元和GABA能神经元发生去极化,促进觉醒发生,而阻断该受体将促进睡眠[52]。
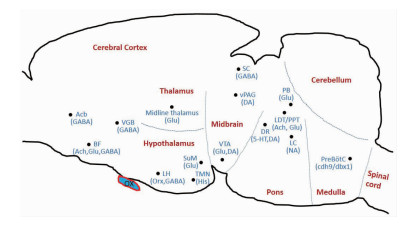
|
| Acb:accumbens nucleus(伏隔核); Ach:acetylcholine (乙酰胆碱); BF:basal forebrain(基底前脑); cdh9/dhx1:cadherin-9/Dbx1 (钙粘蛋白9/转录因子dbx1);DA:dopamine (多巴胺); DR:dorsal raphe(背缝核); 5-HT:serotonin (5-羟色胺); GABA:γ-aminobutyric acid(γ-氨基丁酸); Glu:glutamate (谷氨酸); His:histamine (组胺); LC:locus coeruleus(蓝斑); LDT:laterodorsal tegmental nucleus(背外侧被盖核); LH:lateral hypothalamus(外侧下丘脑); NA:noradrenalin (去甲肾上腺素); Orx:orexin(促食欲素); PB:parabrachial nucleus(臂旁核); PPT:pedunculopontine tegmental nucleus(脚桥被盖核); PreBötC:pre-Bötzinger complex(前钦包格复合体); SC:superior colliculus(上丘); SuM:supramammillary nucleus(乳头体上核); TMN:tubero-mammillary nucleus(结节乳头体核); VGB:ventral globuspallidus(腹侧苍白球); vPAG:ventral periaqueductal gray matter(导水管周围腹侧灰质); VTA:ventral tegmental area(腹侧被盖区); OX:optic chiasm(视交叉) 图 1 脑内主要促觉醒核团的分布 |
1.2.3 多个脑区的γ-氨基丁酸能神经元核团
γ-氨基丁酸(γ-aminobutyric acid, GABA)传统上被认为是促睡眠的神经递质,大多数促睡眠核团都是γ-氨基丁酸能神经元。然而,最近新的研究表明,γ-氨基丁酸能神经元同样也能参与觉醒的发生,包括:①基底前脑表达小清蛋白(parvalbumin)的GABA能神经元。激活这些神经元降低皮层中间抑制性神经元活动,而促进皮层激活[51];②外侧下丘脑区的GABA能神经元。光遗传学方法激活这类细胞可抑制丘脑网状核群,快速使小鼠从非快速眼动睡眠向觉醒转换[53];③中脑上丘的GABA能神经元。将夜行动物急性暴露在黑暗环境中,此区GABA能神经元活动下降,因而对腹侧被盖区多巴胺能神经元的抑制效应减弱,产生促觉醒效应[54];④基底神经节伏隔核表达D1受体的GABA能神经元。光纤记录显示此类神经元表现出与觉醒水平高度相关的活动变化,光遗传学方法激活此类神经元,诱导非快速眼动睡眠向觉醒的转换,这与减弱中脑多巴胺能神经元和外侧下丘脑orexin能神经元的抑制性输入有关,而抑制这些GABA能神经元,将抑制觉醒发生[55];⑤基底神经节腹侧苍白球中的GABA能神经元。发现伏隔核表达D1受体的GABA能神经元促觉醒效应的这一课题组,应用相似的研究策略与技术,发现腹侧苍白球的部分GABA能神经元在觉醒期活跃,非快速眼动睡眠期活动水平降低,而抑制此类神经元显著降低觉醒水平。这一课题组系统阐明了腹侧苍白球中的GABA能神经元发挥促觉醒效应的神经环路机制,发现其主要依赖于上游伏隔核的输入,并通过中脑腹侧被盖区发挥效应[56]。同时,腹侧被盖区、蓝斑的GABA能神经元还能通过调节同一脑区/核团内的谷氨酸能、多巴胺能或去甲肾上腺素能神经元等局部神经元环路,主动参与觉醒水平的调控[47, 57-58]。此外,结节乳头体核组胺能神经元神经末梢共释放组胺和GABA,其中GABA可能通过旁分泌的途径阻止组胺过度激活,调节皮层活跃程度和觉醒水平[59]。
1.2.4 其他促觉醒核团最近亦有研究表明,基本呼吸节律产生中枢——延髓前包钦格复合体(preBötC)中存在一类表达分子标记物钙粘蛋白9/转录因子Dbx1(Cdh9/Dbx1,cadherin-9/Dbx1)的特殊神经元,投射并调控蓝斑去甲肾上腺素能神经元;敲除此类神经元并不影响正常呼吸节律、叹气,但小鼠处于安静觉醒期时间显著变长,提示preBötC-蓝斑通路在调节活跃觉醒状态中具有一定的作用[60]。
此外,呼吸化学性感受通路主要汇集在脑干臂旁核。新近研究表明,除了参与正常生理情况下的觉醒发生外,臂旁核在高碳酸血症/低氧刺激产生的觉醒反应中也起着关键性作用(表 1)。有研究指出,采用敲除或光遗传学方法抑制位于外侧臂旁核的谷氨酸能神经元,尤其是其中表达降钙素基因相关肽(calcitonin gene-related peptide,CGRP)的谷氨酸能神经元,可减弱甚至阻止小鼠对于血液CO2浓度升高或缺氧所引发的觉醒反应,但并不影响声音或摇晃刺激所引起的觉醒发生[61-62]。其中,由5-HT2a型受体介导的背缝核5-羟色胺能神经元-外侧臂旁核CGRP谷氨酸能神经元神经通路,在调节外侧臂旁核谷氨酸能神经元对高碳酸血症觉醒反应的敏感性中具有至关重要的作用[63],这将有助于理解阻塞性睡眠呼吸暂停患者呼吸暂停引起觉醒产生的机制。
| 脑区 | 核团 | 神经元类型 | 文献 |
| 脑干 | 蓝斑 | 去甲肾上腺素能 神经肽S能 |
[11, 14-15] [36-37] |
| 背缝核 | 5-羟色胺能 多巴胺能 |
[17-19] [29] |
|
| 脚桥被盖核/背外侧被盖核 | 胆碱能 谷氨酸能 |
[7] [41] |
|
| 臂旁核 | 谷氨酸能 表达CGRP谷氨酸能 |
[39] [61-63] |
|
| 前包钦格复合体 | 表达Cdh9/Dbx1神经元 | [60] | |
| 腹侧被盖核 | 多巴胺能 谷氨酸能 |
[20-22] [47] |
|
| 导水管周围腹侧灰质 | 多巴胺能 | [30] | |
| 上丘 | γ-氨基丁酸能 | [54] | |
| 丘脑 | 丘脑室旁核 | 谷氨酸能 | [42] |
| 丘脑中央内侧核 | [43] | ||
| 丘脑腹内侧核 | [44] | ||
| 背内侧丘脑 | [45] | ||
| 下丘脑 | 结节乳头体核 | 组胺能 | [23-25] |
| 外侧下丘脑区 | 促食欲素能γ-氨基丁酸能谷氨酸能 | [31, 32][53][50] | |
| 乳头体上核 | 谷氨酸能 | [48] | |
| 视前区 | 表达速激肽1神经元 | [38] | |
| 谷氨酸能 | [49] | ||
| 基底前脑 | 基底前脑 | 胆碱能 | [26-28] |
| γ-氨基丁酸能 | [51] | ||
| 谷氨酸能 | [51] | ||
| 表达P2受体神经元 | [52] | ||
| 内侧隔核 | 谷氨酸能 | [50] | |
| 基底神经节 | 伏隔核 | γ-氨基丁酸能 | [55] |
| 苍白球 | γ-氨基丁酸能 | [56] |
1.3 促觉醒核团的相互联系模式
与此同时,神经科学家亦在不断地思考,如此众多的促觉醒核团和神经元类型是如何相互联系、共同协调以完成促进觉醒和维持觉醒的任务。早在20世纪80年代至90年代中期,觉醒领域的专家就开始思考和试图解析与觉醒发生相关的核团/脑区神经元间的神经环路机制。他们利用免疫组化染色、全细胞膜片钳等技术,研究了上述促觉醒脑区间神经纤维联系和分子信号机制,进一步明确了觉醒发生核团间的相互联系通路,证实脑干觉醒发生系统上行存在两条主分支,即背侧通路和腹侧通路。背侧通路是指来自脑干网状结构(脚桥被盖核/背外侧被盖核)胆碱能的兴奋性神经输入,传至丘脑非特异性核群,激活丘脑皮层通路,使皮层兴奋。腹侧通路又称单胺能通路,是指以来自脑干网状结构(蓝斑)去甲肾上腺素能、(背缝核)5-羟色胺能、中脑多巴胺能、下丘脑组胺能汇成的上行通路为主,同时来自基底前脑的胆碱能通路加入其中,最终直接广泛投射皮层,引起皮层兴奋产生觉醒[64]。长久以来,这被认为是觉醒发生的一种“标准模式”,觉醒的产生和维持需要两条通路同时发挥作用。
随着外侧下丘脑orexin促觉醒神经系统及其在觉醒稳定和维持中重要作用的重要发现,人们对促觉醒核团/脑区的相互作用模式提出了新的阐释。在体单细胞放电记录显示,促觉醒核团神经元普遍呈现出觉醒期放电频率高、睡眠期放电频率低甚至无的活动规律,而促睡眠核团神经元表现为睡眠期活动水平高、觉醒期活动放电频率低的相反的活动特征,且表现互为抑制效应。基于此,SAPER等[64]提出了“跷跷板理论”,用以解释觉醒睡眠周期转换:其中,orexin神经系统是转换的关键枢纽“开关按钮”,当orexin系统被兴奋时,通过增加神经纤维末梢神经肽的释放引起其他促觉醒核团/脑区神经元兴奋,后者活动水平增加又会通过抑制性中间神经元的作用抑制促睡眠神经元,从而终止睡眠产生觉醒;当orexin系统活动降低时,对其他促觉醒核团/脑区的兴奋性作用减弱,后者对促睡眠脑区的抑制性作用减弱,促睡眠脑区反过来抑制促觉醒脑区神经元活动,终止觉醒而进入睡眠。
2 觉醒发生系统研究的进一步思考如上所述,科学家一直致力于促觉醒核团/脑区的寻找和鉴定,到目前为止,已有20余个与觉醒发生相关的核团被确定,然而,这些核团在促觉醒发生的过程中,是否有主次之分?此外,觉醒突出表现是机体能感知、思维和运动等,表明相关脑功能网络处于工作状态,那么觉醒发生系统与脑功能网络活动内在关系是什么?对于这些问题的思考,将有助于我们进一步认识觉醒的本质。
2.1 觉醒发生系统核心组构与辅助组构许多研究表明,损毁目前已知的觉醒发生系统中的部分组构,例如基底前脑胆碱能神经元、下丘脑的orexin或组胺能神经元、蓝斑的去甲肾上腺素能或脚桥被盖核的胆碱能神经元几乎并不影响啮齿动物觉醒或睡眠各自的总数量,甚至同时损伤(基底前脑胆碱能、下丘脑orexin能、蓝斑去甲肾上腺素能神经元)对觉醒睡眠的数量都没有影响[3-4],提示这些核团/脑区可能并不是觉醒发生系统的关键组构,或其所支配的功能脑区不是大脑核心功能网络关键部分,即核心组构。这些觉醒发生系统仅仅是参与觉醒的发生,所以损伤这些非核心组构,只会影响觉醒水平,并不会导致觉醒不能。因此我们提出,目前发现的以及未知还有待发现的所有促觉醒核团/脑区所构成的觉醒发生系统,其本质上可以分为“觉醒发生核心组构”和“觉醒发生辅助组构”两个部分。觉醒发生核心组构支配脑核心功能网络的关键部分,决定觉醒的基础水平。若核心组构损伤,导致核心功能网络关键部分运转失灵,则会出现觉醒不能,使机体处于昏睡、甚至昏迷等状态。辅助组构支配除脑核心功能网络的关键部分以外的其他所有功能网络,其主要功能是兴奋脑核心功能网络中的非关键部分,配合和辅助关键核心功能网络的运行,其次通过调节其余功能网络提升觉醒水平,若辅助组构损伤,核心功能网络整体运转效率下降,觉醒能力减弱,就会导致觉醒水平下降。今后的研究重点应该是明确觉醒发生的核心组构和辅助组构的具体实际核团及环路基础,核心组构与辅助组构如何相互联系及整合协同等基本问题。
2.2 觉醒是觉醒发生系统及其支配的功能网络共同活动的结果寻找全部觉醒发生核团和完整解析觉醒发生的神经环路,是否就能真正破解觉醒之谜、理解觉醒发生的本质呢?从全脑的视角看觉醒,觉醒既涉及觉醒发生系统本身,也与觉醒发生系统支配的功能网络密不可分。大脑的功能网络划分因涉及复杂大脑的工作原理问题,目前尚未获得到公认的进展。根据大脑对信息的处理流程,我们提出大脑的六大功能网络假设,它们包括自我意识、思维、价值判断、记忆、感觉和运动等(图 2)。其中自我意识、思维、价值判断、记忆四大功能网络是大脑的核心工作网络。自我意识是大脑具有的区别自我与非我的能力,是觉醒最特征性的功能表现。有观点认为,大脑皮层前部即前额叶皮层或者大脑皮层后部可能是自我意识脑区[65]。思维是通过对脑内已贮存的知识经验与新输入信息进行系列复杂的操作处理过程,涉及所有的认知或智力活动。联合皮层被提示是思维进行的部位所在。价值判断决定思维活动方式和反应方向,是自我意识的具体代表。研究认为,杏仁体等脑区参与了价值判断的过程[66-67]。记忆是脑内外信息储存和提取过程,是思维活动产生的信息基础。哺乳动物记忆储存部位与海马、内嗅、前额叶皮层等脑结构有关[68-69]。感觉是体内外变化活动的信息在大脑的实时呈现。感觉不仅是大脑输入信息的被动反应,更可能是大脑对内外变化的实时监控。运动本质是思维活动的外部表达。
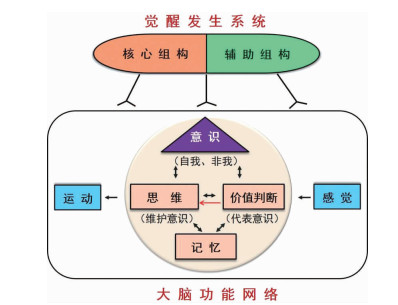
|
| 图 2 觉醒发生系统与大脑功能网络内在关系 |
我们认为,觉醒的实质是大脑上述六大功能网络可工作状态。但大脑六大功能网络自身不具有独立的可工作能力,相反,它们需要觉醒发生系统的支配,提供兴奋性输入,使各功能网络处在一定能量水平的振荡状态,以便各功能网络的信息处理。在上述自我意识、思维、价值判断和记忆四大脑功能网络构成的核心工作网络中,自我意识、思维功能网络最为关键,故,最可能是“觉醒发生核心组构”的主要投射靶点。觉醒时,在觉醒发生核心组构的兴奋支配下,自我意识功能网络活跃,大脑才能够清晰辨识自我、非我,根据个体独特的价值判断来决定思维的活动方式,使得活跃的思维活动依据记忆素材,可以完整地、有逻辑性地呈现出来,这就构成了一个基本的觉醒过程。所以,毋庸置疑,若没有促觉醒脑区/核团兴奋水平的正常“供电”保证,缺乏有效的觉醒兴奋水平,大脑的各项功能网络根本无法实现运转。另一方面,即使觉醒发生系统是正常运行的,但若六大脑功能网络内部或之间的联系出现障碍,大脑的各项功能亦无法正常呈现。此外,除了受觉醒发生系统支配外,大脑功能核心网络活动反过来也会作用于觉醒发生系统,调控觉醒状态。因此,觉醒发生系统与特定的脑功能网络相辅相成,必须两者皆完整、正常,觉醒才有意义,这才是觉醒的本质。理解了觉醒的本质,才能为揭示觉醒不能(包括睡眠,麻醉和意识障碍)的发生机制提供理论依据。
综上所述,觉醒发生神经机制的不断探索使得我们对觉醒发生的神经通路有了越来越清楚的认识,但如此众多的促觉醒核团/脑区如何协调一致在不同脑功能的需求下保证不同程度的觉醒水平仍不清楚,思维、价值判断等功能脑区位于何处仍是未解之谜,各脑功能网络又是如何联系有机结合共同工作仍处于初级探索阶段,尚有遥远的研究之路要走。上述问题一旦解答不仅有助于觉醒机制和觉醒相关功能的深刻理解,还为临床上觉醒不能的诊断和治疗,以及未来人工智能的深度研发提供更为有益的启发。
| [1] |
VON ECONOMOC. Sleep as a problem of localization[J]. J Nerv Ment Dis, 1930, 71(3): 249-259. |
| [2] |
MORUZZI G, MAGOUN H W. Brain stem reticular formation and activation of the EEG[J]. Electroencephalogr Clin Neurophysiol, 1949, 1(4): 455-473. |
| [3] |
SPER C B, FULLER P M. Wake-sleep circuitry: an overview[J]. Curr Opin Neurobiol, 2017, 44: 186-192. |
| [4] |
SCAMMELL T E, ARRIGONI E, LIPTON J O. Neural circuitry of wakefulness and sleep[J]. Neuron, 2017, 93(4): 747-765. |
| [5] |
BROWN R E, BASHEER R, MCKENNA J T, et al. Control of sleep and wakefulness[J]. Physiol Rev, 2012, 92(3): 1087-1187. |
| [6] |
RHEINBERGER MB, JASPER H. Electrical activity of the cerebral cortex in the unanesthetized cat[J]. Am J Physiol, 1937, 119(1): 186-196. |
| [7] |
RINALDI F, HIMWICH H E. Alerting responses and actions of atropine and cholinergic drugs[J]. AMA Arch Neurol Psychiatry, 1955, 73(4): 387-395. |
| [8] |
MORUZZI G. The sleep-waking cycle[J]. Ergeb Physiol, 1972, 64: 1-165. |
| [9] |
SHUTE C C, LEWIS P R. The ascending cholinergic reticular system: neocortical, olfactory and subcortical projections[J]. Brain, 1967, 90(3): 497-520. |
| [10] |
MESULAM M M, MUFSON E J, LEVEY A I, et al. Atlas of cholinergic neurons in the forebrain and upper brainstem of the macaque based on monoclonal choline acetyltransferase immunohistochemistry and acetylcholinesterase histoche-mistry[J]. Neuroscience, 1984, 12(3): 669-686. |
| [11] |
DELL P. Intervention of an adrenergic mechanism during brain stem reticular activation[M]//WOLSTENHOLME G E W, O'CONNOR M. Novartis foundation symposium, Chichester: John Wiley & Sons, 1961: 393-409.
|
| [12] |
HANSON L C. Biochemical and behavioural effects of tyrosine hydroxylase inhibition[J]. Psychopharmacologia, 1967, 11(1): 8-17. |
| [13] |
SCHOENFELD R I, SEIDEN L S. Effect of alpha-methyltyrosine on operant behavior and brain catecholamine levels[J]. J Pharmacol Exp Ther, 1969, 167(2): 319-327. |
| [14] |
CHU N, BLOOM F E. Norepinephrine-containing neurons: changes in spontaneous discharge patterns during sleeping and waking[J]. Science, 1973, 179(4076): 908-910. |
| [15] |
FOOTE S L, ASTON-JONES G, BLOOM F E. Impulse activity of locus coeruleus neurons in awake rats and monkeys is a function of sensory stimulation and arousal[J]. Proc Natl Acad Sci USA, 1980, 77(5): 3033-3037. |
| [16] |
JOVERT M. The role of monoamine and acetylcholine-containing neurons in the regulation of the sleep-waking cycle[J]. Ergeb Physiol, 1972, 64: 166-307. |
| [17] |
KOSTOWSKI W, GIACALONE E, GARATTINI S, et al. Electrical stimulation of midbrain raphe: biochemical, behavioral and bioelectrical effects[J]. Eur J Pharmacol, 1969, 7(2): 170-175. |
| [18] |
POLC P, MONNIER M. An activating mechanism in the ponto-bulbar raphe system of the rabbit[J]. Brain Res, 1970, 22(1): 47-61. |
| [19] |
TRULSON M E, JACOBS B L. Raphe unit activity in freely moving cats: correlation with level of behavioral arousal[J]. Brain Res, 1979, 163(1): 135-150. |
| [20] |
CARLSSON A, LINDQVIST M, MAGNUSSON T. 3, 4- dihydroxyphenylalanine and 5-hydroxytrytophan as reserpine antagonists[J]. Nature, 1957, 180(4596): 1200. |
| [21] |
DAHLSTRÖM A, FUXE K. Localization of monoamines in the lower brain stem[J]. Experientia, 1964, 20(7): 398-399. |
| [22] |
JONES B E, BOBILLIER P, PIN C, et al. The effect of lesions of catecholamine-containing neurons upon monoamine content of the brain and EEG and behavioral waking in the cat[J]. Brain Res, 1973, 58(1): 157-177. |
| [23] |
MONNIER M, FALLERT M, BATTACHARYA I C. The waking action of histamine[J]. Experientia, 1967, 23(1): 21-22. |
| [24] |
SCHWARTZ JC, LAMPART C, ROSE C. Properties and regional distribution of histidine decarboxylase in rat brain[J]. J Neurochem, 1970, 17(11): 1527-1534. |
| [25] |
VERDIERE M, ROSE C, SCHWARTZ J C. Synthesis and release of histamine studied on slices from rat hypothalamus[J]. Eur J Pharmacol, 1975, 34(1): 157-168. |
| [26] |
JOHNSTON M V, MCKINNEY M, COYLE J T. Evidence for a cholinergic projection to neocortex from neurons in basal forebrain[J]. Proc Natl Acad Sci USA, 1979, 76(10): 5392-5396. |
| [27] |
SZYMUSIAK R, MCGINTY D. Sleep-related neuronal discharge in the basal forebrain of cats[J]. Brain Res, 1986, 370(1): 82-92. |
| [28] |
SEMBA K, FIBIGER H C. Organization of central cholinergic systems[J]. Prog Brain Res, 1989, 79: 37-63. |
| [29] |
CHO J R, TREWEEK J B, ROBINSON J E, et al. Dorsal raphe dopamine neurons modulate arousal and promote wakefulness by salient stimuli[J]. Neuron, 2017, 94(6): 1205-1219. e8. |
| [30] |
LU J, JHOU T C, SAPER C B. Identification of wake-active dopaminergic neurons in the ventral periaqueductal gray matter[J]. J Neurosci, 2006, 26(1): 193-202. |
| [31] |
DE LECEA L, KILDUFF T S, PEYRON C, et al. The hypocretins: hypothalamus-specific peptides with neuroexcitatory activity[J]. Proc Natl Acad Sci USA, 1998, 95(1): 322-327. |
| [32] |
SAKURAI T, AMEMIYA A, ISHⅡ M, et al. Orexins and orexin receptors: a family of hypothalamic neuropeptides and G protein-coupled receptors that regulate feeding behavior[J]. Cell, 1998, 92(4): 573-585. |
| [33] |
EBAN-ROTHSCHILD A, APPELBAUM L, DE LECEA L. Neuronal mechanisms for sleep/wake regulation and modulatory drive[J]. Neuropsychopharmacology, 2018, 43(5): 937-952. |
| [34] |
SCAMMELL T E, ARRIGONI E, LIPTON J O. Neural circuitry of wakefulness and sleep[J]. Neuron, 2017, 93(4): 747-765. |
| [35] |
宋承辉, 胡志安. Orexin: 觉醒通路中一种重要的下丘脑神经肽[J]. 第三军医大学学报, 2003, 25(13): 1207-1209. SONG C H, HU Z A. Orexin: an important neuropeptide of arousal pathway from hypothalamus[J]. J Third Mil Med Univ, 2003, 25(13): 1207-1209. |
| [36] |
XU Y L, REINSCHEID R K, HUITRON-RESENDIZ S, et al. Neuropeptide S: a neuropeptide promoting arousal and anxiolytic-like effects[J]. Neuron, 2004, 43(4): 487-497. |
| [37] |
ZHAO P, SHAO Y F, ZHANG M, et al. Neuropeptide S promotes wakefulness through activation of the posterior hypothalamic histaminergic and orexinergic neurons[J]. Neuroscience, 2012, 207: 218-226. |
| [38] |
REITZ SL, WASILCZUK AZ, BEH GH, et al. Activation of preoptic tachykinin 1 neurons promotes wakefulness over sleep and volatile anesthetic-induced unconsciousness[J]. Curr Biol, 2021, 31(2): 394-405. |
| [39] |
FULLER P M, SHERMAN D, PEDERSEN N P, et al. Reassessment of the structural basis of the ascending arousal system[J]. J Comp Neurol, 2011, 519(5): 933-956. |
| [40] |
张偲, 罗芬兰, 任栓成, 等. 投射至中缝背核的脑干感觉中继核团的鉴定[J]. 第三军医大学学报, 2021, 43(9): 771-778. ZHANG C, LUO F L, REN S C, et al. Identification of sensory relay nuclei in brainstem that projecting to the dorsal raphe nucleus[J]. J Third Mil Med Univ, 2021, 43(9): 771-778. |
| [41] |
KROEGER D, FERRARI LL, PETIT G, et al. Cholinergic, glutamatergic, and GABAergic neurons of the pedunculopontine tegmental nucleus have distinct effects on sleep/wake behavior in mice[J]. J Neurosci, 2017, 37(5): 1352-1366. |
| [42] |
REN S C, WANG Y L, YUE F G, et al. The paraventricular thalamus is a critical thalamic area for wakefulness[J]. Science, 2018, 362(6413): 429-434. |
| [43] |
GENT T C, BANDARABADI M, HERRERA C G, et al. Thalamic dual control of sleep and wakefulness[J]. Nat Neurosci, 2018, 21(7): 974-984. |
| [44] |
HONJOH S, SASAI S, SCHIERECK S S, et al. Regulation of cortical activity and arousal by the matrix cells of the ventromedial thalamic nucleus[J]. Nat Commun, 2018, 9(1): 2100. |
| [45] |
MÁTYÁS F, KOMLÓSI G, BABICZKY Á, et al. A highly collateralized thalamic cell type with arousal-predicting activity serves as a key hub for graded state transitions in the forebrain[J]. Nat Neurosci, 2018, 21(11): 1551-1562. |
| [46] |
胡志安, 任栓成. 丘脑在觉醒控制中的作用[J]. 第三军医大学学报, 2018, 40(23): 2119-2121. HU Z A, REN S C. Role of the thalamus in wakefulness control[J]. J Third Mil Med Univ, 2018, 40(23): 2119-2121. |
| [47] |
YU X, LI W, MA Y, et al. GABA and glutamate neurons in the VTA regulate sleep and wakefulness[J]. Nat Neurosci, 2019, 22(1): 106-119. |
| [48] |
PEDERSEN N P, FERRARI L, VENNER A, et al. Supramammillary glutamate neurons are a key node of the arousal system[J]. Nat Commun, 2017, 8(1): 1405. |
| [49] |
MONDINO A, HAMBRECHT-WIEDBUSCH V, LI D, et al. Glutamatergic neurons in the preoptic hypothalamus promote wakefulness, destabilize NREM sleep, suppress REM sleep, and regulate cortical dynamics[J]. J Neurosci, 2021. |
| [50] |
AN S, SUN H, WU M, et al. Medial septum glutamatergic neurons control wakefulness through a septo-hypothalamic circuit[J]. Curr Biol, 2021, S0960-9822(21)00052-X. DOI: 10.1016/j.cub.2021.01.019.
|
| [51] |
XU M, CHUNG S, ZHANG S, et al. Basal forebrain circuit for sleep-wake control[J]. Nat Neurosci, 2015, 18(11): 1641-1647. |
| [52] |
YANG C, LARIN A, MCKENNA J T, et al. Activation of basal forebrain purinergic P2 receptors promotes wakefulness in mice[J]. Sci Rep, 2018, 8(1): 10730. |
| [53] |
HERRERA C G, CADAVIECO M C, JEGO S, et al. Hypothalamic feedforward inhibition of thalamocortical network controls arousal and consciousness[J]. Nat Neurosci, 2016, 19(2): 290-298. |
| [54] |
ZHANG Z, LIU W Y, DIAO Y P, et al. Superior colliculus GABAergic neurons are essential for acute dark induction of wakefulness in mice[J]. Curr Biol, 2019, 29(4): 637-644. e3. |
| [55] |
LUO Y J, LI Y D, WANG L, et al. Nucleus accumbens controls wakefulness by a subpopulation of neurons expressing dopamine D1 receptors[J]. Nat Commun, 2018, 9(1): 1576. |
| [56] |
LI Y D, LUO Y J, XU W, et al. Ventral pallidal GABAergic neurons control wakefulness associated with motivation through the ventral tegmental pathway[J]. Mol Psychiatry, 2020. |
| [57] |
BRETON-PROVENCHER V, SUR M. Active control of arousal by a locus coeruleus GABAergic circuit[J]. Nat Neurosci, 2019, 22(2): 218-228. |
| [58] |
胡志安, 罗芬兰. 2019年觉醒睡眠研究: 突破与展望[J]. 第三军医大学学报, 2020, 42(2): 319-325. HU Z A, LUO F L. Breakthroughs and perspective of wakefulness and sleep researches in 2019[J]. J Third Mil Med Univ, 2020, 42(2): 319-325. |
| [59] |
YU X, YE Z, HOUSTON C M, et al. Wakefulness is governed by GABA and histamine cotransmission[J]. Neuron, 2015, 87(1): 164-178. |
| [60] |
YACKLE K, SCHWARZ L A, KAM K, et al. Breathing control center neurons that promote arousal in mice[J]. Science, 2017, 355(6332): 1411-1415. |
| [61] |
KAUR S, PEDERSEN NP, YOKOTA S, et al. Glutamatergic signaling from the parabrachial nucleus plays a critical role in hypercapnic arousal[J]. J Neurosci, 2013, 33(18): 7627-7640. |
| [62] |
KAUR S, WANG J L, FERRARI L, et al. A genetically defined circuit for arousal from sleep during hypercapnia[J]. Neuron, 2017, 96(5): 1153-1167. e5. |
| [63] |
KAUR S, DE LUCA R, KHANDAY M A, et al. Role of serotonergic dorsal raphe neurons in hypercapnia-induced arousals[J]. Nat Commun, 2020, 11(1): 2769. |
| [64] |
SAPER C B, SCAMMELL T E, LU J. Hypothalamic regulation of sleep and circadian rhythms[J]. Nature, 2005, 437(7063): 1257-1263. |
| [65] |
PAL D, DEAN J G, LIU T, et al. Differential role of prefrontal and parietal cortices in controlling level of consciousness[J]. Curr Biol, 2018, 28(13): 2145-2152. e5. |
| [66] |
FELLOWS L K. The neuroscience of human decision-making through the lens of learning and memory[J]. Curr Top Behav Neurosci, 2018, 37: 231-251. |
| [67] |
SHENHAV A, GREENE J D. Integrative moral judgment: dissociating the roles of the amygdala and ventromedial prefrontal cortex[J]. J Neurosci, 2014, 34(13): 4741-4749. |
| [68] |
JOSSELYN S A, FRANKLAND P W. Memory allocation: mechanisms and function[J]. Annu Rev Neurosci, 2018, 41: 389-413. |
| [69] |
胡志安, 夏建霞. 觉醒系统的活动对学习记忆的影响[J]. 第三军医大学学报, 2011, 33(11): 1091-1094. HU Z A, XIA J X. Influence of activities in arousal system on learning and memory[J]. J Third Mil Med Univ, 2011, 33(11): 1091-1094. |




