2. 401420 重庆,綦江区人民医院神经内科;
3. 400014 重庆,重庆市急救医疗中心(重庆市第四人民医院)内分泌科;
4. 400038 重庆,陆军军医大学(第三军医大学)基础医学院生理学教研室
2. Department of Neurology, Qijiang People's Hospital, Chongqing, 401420;
3. Department of Endocrinology, Chongqing Emergency Medical Center (Chongqing Fourth People's Hospital), Chongqing, 400014;
4. Department of Physiology, Institute of Brain and Intelligence, College of Basic Medical Sciences, Army Medical University (Third Military Medical University), Chongqing, 400038, China
低血糖症是一组以静脉血浆血糖浓度过低、以交感神经兴奋和脑细胞缺氧为主要特点的综合征,临床表现通常为心慌、出汗、饥饿、乏力等,严重者还可出现精神不集中、烦躁、甚至昏迷等,其病因复杂,是诱发患者特别是糖尿病患者死亡的重要因素之一[1-2]。低血糖症若及时干预,症状可迅速缓解,但在临床工作中,不少患者在低血糖初期没有来得及做出生理上的调整(调节交感神经兴奋)和行为上的调整(主动摄食),就会导致血糖进一步降低或低血糖持续时间过长,进而出现意识障碍[1-3]。然而,目前对低血糖意识障碍患者缺乏系统翔实的高危因素和诱因分析,故对低血糖患者在什么情况下会导致意识障碍尚不清楚,亟需深入探讨低血糖患者出现意识障碍的高危因素及诱因,为低血糖意识障碍的临床诊疗提供参考依据。
本研究通过回顾性对照研究,对低血糖患者的高危因素和发病诱因进行分析,并按患者入院时意识障碍程度分为意识障碍组与无意识障碍组,比较两组间的高危因素及诱因的差异,并进一步总结导致低血糖意识障碍的高危因素、诱因以及升糖治疗后的转归,为提升低血糖意识障碍的诊疗水平打下一定基础,为进一步探讨低血糖意识障碍发生的机制提供一定的科学依据。
1 资料与方法 1.1 研究对象筛选2010-2020年在中国科学院大学重庆仁济医院(62例)和重庆市急救医疗中心(46例)接受低血糖住院治疗的患者共108例为研究对象。纳入标准:就诊时有心慌、出汗、乏力等低血糖症状,同时,非糖尿病患者血糖<2.8 mmol/L,糖尿病患者血糖≤3.9 mmol/L。本研究严格按相关流程在医院伦理委员会监督下进行(中国科学院大学重庆仁济医院,批准号: 2021CQSDWRMYYEC-002,批准时间: 2021-04-27)。
1.2 方法根据入院时患者在无自发睁眼时是否被动打开眼睑以观察眼球活动为界限[4],分为意识障碍组(n=72)与无意识障碍组(n=36)。比较两组患者性别、年龄、血糖水平、低血糖持续时间、血压(收缩压和舒张压)、血肌酐、单纯糖尿病占比、糖尿病仅合并高血压(diabetes mellitus and high blood pressure,DM+Hbp)占比、糖尿病合并高血压再合并1个及以上其他合并症(如慢性阻塞性肺病、冠心病、肾病、脑卒中后遗症、肿瘤等)占比(即3个及以上合并症占比)等临床资料,分析低血糖意识障碍的高危因素和发病诱因,并观察急诊头颅CT图像和意识恢复后脑电图改变以及升糖治疗后的好转率。
1.3 统计学分析采用SPSS 19.0统计软件,计数数据两两比较采用χ2检验及Fisher精确检验;计量数据两两均数比较采用单因素方差分析。P < 0.05表示差异具有统计学意义。
2 结果 2.1 低血糖意识障碍的危险因素分析低血糖急诊入院108例患者中,97例(89.80%)年龄大于60岁,76例(70.40%)有明确糖尿病基础性疾病。另外,72例有意识障碍,其平均年龄74.15岁,平均血糖水平1.93 mmol/L,其中70例好转出院,1例死亡,1例未好转签字出院;36例无意识障碍,平均年龄70.39岁,平均血糖水平2.45 mmol/L,经升糖治疗后全部好转(表 1)。
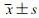
| 临床资料 | 意识障碍组(n=72) | 无意识障碍组(n=36) | P值 |
| 年龄/岁 | 74.15±11.20 | 70.39±12.95 | 0.142 |
| 男性 | 32(44.44) | 21(58.33) | 0.173 |
| 女性 | 40(55.56) | 15(41.67) | 0.173 |
| 血糖/mmol·L -1 | 1.93±0.75 | 2.45±0.56 | < 0.001 |
| 糖尿病 | 1.85±0.71(n=57) | 2.54±0.54(n=25) | < 0.001 |
| 非糖尿病 | 2.23±0.81(n=15) | 2.25±0.57(n=11) | 0.933 |
| 血肌酐/μmol·L -1 | 82.68±46.95 | 91.80±51.95 | 0.380 |
| 持续时间/h | 3.36±3.58 | 2.36±1.59 | 0.047 |
| 收缩压/mmHg | 152.14±25.24 | 148.69±26.85 | 0.514 |
| 舒张压/mmHg | 83.72±16.00 | 79.00±12.17 | 0.122 |
| 单纯糖尿病 | 15(20.80) | 3(8.30) | 0.100 |
| 糖尿病仅合并高血压 | 11(15.30) | 14(38.89) | 0.006 |
| 糖尿病合并高血压再合并其他一种及以上合并症a | 31(43.06) | 8(22.20) | 0.034 |
| 好转 | 70(97.20) | 36(100.00) | 0.381 |
| a: 其他合并症指慢性阻塞性肺病、冠心病、肾病、脑卒中后遗症、肿瘤等 | |||
意识障碍组与无意识障碍组的血糖水平、低血糖持续时间、糖尿病仅合并高血压占比、3个及以上合并症的占比差异均具有统计学意义(P < 0.05)。与无意识障碍组比较,意识障碍组血糖水平显著降低(P < 0.001),低血糖持续时间较长(P=0.047),糖尿病仅合并高血压占比较少(P=0.006),3个及以上合并症占比则较多(P=0.034)。另外,意识障碍组的平均年龄略偏高,好转率也稍偏低,但两组之间差异并无统计学意义;两组性别比例、血肌酐水平、收缩压和舒张压等差异亦无统计学意义(表 1)。
2.2 低血糖意识障碍发病诱因分析低血糖意识障碍组中使用磺脲类药物比例显著高于无意识障碍组(P=0.009);两组使用胰岛素、大量饮酒或其他不明确诱因之间并未见明显差异(表 2)。
| 发病诱因 | 意识障碍组(n=72) | 无意识障碍组(n=36) | P值 |
| 注射胰岛素 | 13(18.06) | 10(27.78) | 0.245 |
| 服用磺脲类药物 | 39(54.17) | 10(27.78) | 0.009 |
| 大量饮酒 | 3(4.17) | 1(2.78) | 0.719 |
| 其他a | 17(23.61) | 15(41.67) | 0.053 |
| a:无法提供明确诱因 | |||
2.3 脑CT影像和脑电图结果分析及转归
108例患者中共有70例进行了急诊头颅CT检查,其中35例腔隙性脑梗死,3例脑梗死(图 1),2例脑缺血灶;70例患者中,意识障碍组占51例,无意识障碍组占19例。进一步比较两组中CT影像结果显示,意识障碍组腔隙性脑梗死、脑缺血、既往脑卒中病史比例虽较无意识障碍组高,但差异并无统计学意义(表 3)。
|
| 右侧侧脑室前角旁新发梗死可能性大(红色箭头示),左侧基底节软化灶(蓝色箭头示) 图 1 低血糖伴意识障碍患者头颅CT表现 |
| 头颅CT结果 | 意识障碍组(n=51) | 无意识障碍组(n=19) | P值 |
| 腔隙性脑梗死 | 27(52.94) | 8(42.11) | 0.420 |
| 脑梗死 | 2(3.92) | 1(5.26) | 0.805 |
| 脑缺血 | 2(3.92) | 0(0.00) | 0.381 |
| 既往脑卒中史 | 7(13.73) | 2(10.53) | 0.722 |
| 好转率 | 49(96.08) | 19(100.00) | 0.916 |
经升糖治疗后,两组好转率均升高,意识障碍组中1例头颅CT正常者因反复出现心脏骤停死亡,1例治疗24 h后虽血糖恢复正常但意识仍未恢复,家属拒绝复查头颅CT,放弃治疗。
意识障碍组中有8例在纠正低血糖、意识清楚后行脑电图检查,多为部分慢波或快波,无癫痫波,为界限性脑电图(图 2)。
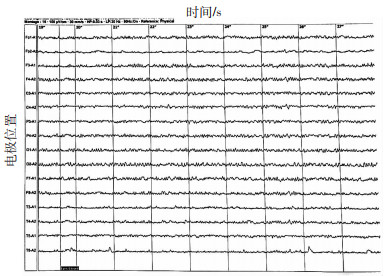
|
| 基本波率、快波、慢波、波幅特点、诱发试验均未见明确异常,为界限性脑电图 图 2 低血糖伴意识障碍患者脑电图表现 |
3 讨论
血糖是脑紧急能源需求的唯一来源,当严重低血糖时间超过6~12 h时可引起脑细胞不可逆转损害,导致意识障碍甚至引起死亡[5-6]。健康人在血糖下降至2.8~3.0 mmol/L时胰岛素分泌受到抑制,胰高血糖素分泌被激活;当血糖下降至2.8 mmol/L以下时脑功能障碍明显[7]。对非糖尿病患者而言,低血糖症诊断标准为血糖 < 2.8 mmol/L,而接受药物治疗的糖尿病患者只要血糖水平≤3.9 mmol/L就属低血糖范畴[1, 2, 5]。
发生低血糖的常见原因有饮食不规律、运动量大、不规范使用降糖药物、酗酒等[8-9],而本研究结果显示,胰岛素注射、饮酒等虽然有可能导致低血糖(与文献[8]报道类似),但它们并不是导致低血糖意识障碍的主要诱因,而口服磺脲类降糖药物才是低血糖意识障碍发生的主要诱因,分析其原因,可能是由于磺脲类药物作用时间长[10],导致低血糖持续时间长,更易诱发意识障碍发生。
在低血糖意识障碍的主要高危因素方面,本研究结果显示,低血糖程度、低血糖持续时间、3个及以上合并症者为主要危险因素,而年龄、性别、血肌酐、血压水平等虽然有差异,但差异无统计学意义,是可能的次要危险因素。目前国内也有类似报道,分析低血糖意识障碍发生可能与低血糖水平、持续时间、合并症有关[10];另有报道意识障碍发生还可能与脑脊液葡萄糖浓度有关[11]。但上述研究并未对低血糖意识障碍开展详细分组和对照分析。本研究进行了意识障碍组与非意识障碍组的分组对照研究,明确了低血糖意识障碍的高危因素,得出的结论在低血糖意识障碍方面更具针对性。
本研究结果提示:低血糖持续时间、合并3个及以上合并症与低血糖意识障碍的正相关关系。具体来说,低血糖持续时间越长无意识障碍组为(2.36±1.59)h],大脑缺血缺氧时间增加,意识障碍概率明显增加;在糖尿病合并高血压同时再合并1个及以上其他疾病(如慢阻肺/冠心病/肾病/脑卒中后遗症/肿瘤)时,即合并3个及以上合并症时,患者意识障碍的发生比例明显升高(意识障碍组为43.06%,无意识障碍组为22.20%,P=0.034);相反,糖尿病仅合并高血压患者反而意识障碍比例较少(意识障碍组为15.30%,无意识障碍组为38.89%,P=0.006),这一结果对临床诊疗低血糖意识障碍具有一定指导价值。类似报道鲜见,可能与国内外报道低血糖病例数均相对较少(25~80例),以及未细化病种组合的原因有关[3, 8-9]。针对糖尿病仅合并高血压患者,结合文献分析其意识障碍比例较低的原因,可能与高血压病患者在一定程度上提升了脑组织的灌注压,从而在一定程度上增加了脑组织的葡萄糖灌注量,导致脑组织结构与功能损害较轻有关[12]。
低血糖所致意识障碍临床表现与急性脑血管意外相似,最初都可表现为心悸、出汗、头昏、反应迟钝等表现,所以在临床救治中极易被误诊和漏诊[13-14]。本研究收集的病例中有12例因意识障碍收入神经内科,入病房后监测血糖才明确诊断为低血糖意识障碍,故第一时间发现低血糖为救治低血糖意识障碍的关键。本研究头颅CT影像学结果显示低血糖意识障碍患者并未见特异性改变,另外,经升糖治疗后患者症状可迅速缓解,且在意识恢复后的脑电图也同样未发现特异性改变。
综上所述,严重低血糖水平、低血糖持续时间长、3个及以上合并症状态(糖尿病+高血压+慢阻肺/冠心病/肾病/脑卒中后遗症/肿瘤)、使用磺脲类药物与低血糖意识障碍的发生密切相关,对于该类患者需特别警惕低血糖所致意识障碍的发生,故临床上针对该类患者应早期检测血糖,及时发现病因并针对性治疗,可以迅速纠正低血糖状态,提高好转率,减少后遗症发生。另外,对糖尿病仅合并高血压的患者相对不易出现意识障碍,其作用机制值得深入研究。本研究因受病种数量仍然偏少,以及分析因素的局限,如非糖尿病患者较少等原因,所得结论具有一定的局限性,有待于进一步开展大数据及基础实验研究,为低血糖意识障碍患者的诊治提供更加精准的帮助。
| [1] |
ALSAHLI M, GERICH J E. Hypoglycemia in patients with diabetes and renal disease[J]. J Clin Med, 2015, 4(5): 948-964. DOI:10.3390/jcm4050948 |
| [2] |
International Hypoglycaemia study group. Hypoglycaemia, cardiovascular disease, and mortality in diabetes: epidemiology, pathogenesis, and management[J]. Lancet Diabetes Endocrinol, 2019, 7(5): 385-396. DOI:10.1016/S2213-8587(18)30315-2 |
| [3] |
宋锡欣, 林继红, 庞亚楠, 等. 老年糖尿病性低血糖症59例误诊分析[J]. 医学理论与实践, 2020, 33(21): 3559-3560. SONG X X, LIN J H, PANG Y N, et al. Misdiagnosis analysis of 59 cases of senile diabetic hypoglycemia[J]. J Med Theory Pract, 2020, 33(21): 3559-3560. DOI:10.19381/j.issn.1001-7585.2020.21.020 |
| [4] |
何江弘, 谢秋幼, 徐如祥. 《欧洲昏迷和意识障碍诊断指南》(2020版)解读[J]. 中华神经创伤外科电子杂志, 2020, 6(3): 135-140. HE J H, XIE Q Y, XU R X. Interpretation of European Academy of Neurology guideline on the diagnosis of coma and other disorders of consciousness (Version 2020)[J]. Chin J Neurotraumatic Surg Electron Ed, 2020, 6(3): 135-140. DOI:10.3877/cma.j.issn.2095-9141.2020.03.002 |
| [5] |
中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2017年版)[J]. 中华糖尿病杂志, 2018, 10(1): 72-74. Chinese Diabetes Society. Guidelines for the prevention and control of type 2 diabetes in China (2017 Edition)[J]. Chin J Diabetes Mellitus, 2018, 10(1): 72-74. DOI:10.19538/j.nk2018040108 |
| [6] |
易加朝, 陈明理, 段小嬿. 25例疑似短暂性脑缺血发作的低血糖症患者脑血管病变分析[J]. 解放军预防医学杂志, 2018, 36(4): 559. YI J Z, CHEN M L, DUAN X Y. Analysis of cerebrovascular disease in 25 patients with hypoglycemia suspected of transient ischemic attack[J]. J Prev Med Chin PLA, 2018, 36(4): 559. DOI:10.13704/j.cnki.jyyx.2018.04.044 |
| [7] |
DAVIS T M E, BRUCE D G, FINN J, et al. Temporal changes in the incidence and predictors of severe hypoglycaemia in type 2 diabetes: the fremantle diabetes study[J]. Diabetes Obes Metab, 2019, 21(3): 648-657. DOI:10.1111/dom.13568 |
| [8] |
秦连柱, 李鹍, 肖明生. 老年糖尿病并发低血糖症32例临床分析[J]. 实用临床医学(江西), 2015, 16(1): 24. QIN L Z, LI H, XIAO M S. Clinical analysis of 32 cases of senile diabetes complicated with hypoglycemia[J]. Pract Clin Med (Jiangxi), 2015, 16(1): 24. |
| [9] |
杨鸥, 孔俭. 重视老年糖尿病患者低血糖的发生[J]. 中华老年病研究电子杂志, 2020, 7(1): 19-21. YANG O, KONG J. Pay attention to the occurrence of hypoglycemia in elderly patients with diabetes[J]. Chin J Geriatr Res Electron Ed, 2020, 7(1): 19-21. |
| [10] |
曹晓孚, 纪立伟, 彭净, 等. 老年患者使用磺脲类药物安全性评价[J]. 中国糖尿病杂志, 2017, 25(5): 99-102. CAO X F, JI L W, PENG J, et al. Safety evaluation of sulfonylureas in elderly patients[J]. Chin J Diabetes, 2017, 25(5): 99-102. |
| [11] |
ZHANG C, TAN Z R, TIAN F F. Impaired consciousness and decreased glucose concentration of CSF as prognostic factors in immunocompetent patients with cryptococcal meningitis[J]. BMC Infect Dis, 2020, 20(1): 69. DOI:10.1186/s12879-020-4794-5 |
| [12] |
余爱勇, 赵迎春, 赵玉武, 等. 血糖升高速度对糖尿病模型大鼠低血糖性脑损伤的影响[J]. 临床神经病学杂志, 2018, 31(2): 126-129. YU A Y, ZHAO Y C, ZHAO Y W, et al. Influence of different glucose rising velocity on hypoglycemic brain injury in diabetic model rats[J]. J Clin Neurol, 2018, 31(2): 126-129. |
| [13] |
王静. 48例低血糖症临床分析并文献回顾[J]. 中国医师杂志, 2018, 20(5): 779-781. WANG J. Clinical analysis of 48 cases of hypoglycemia and literature review[J]. J Chin Physician, 2018, 20(5): 779-781. DOI:10.3760/cma.j.issn.1008-1372.2018.05.045 |
| [14] |
武银铃, 蔡祥增, 赵玉国, 等. 低血糖脑病21例临床分析[J]. 实用糖尿病杂志, 2017, 13(1): 53-54. WU Y L, CAI X Z, ZHAO Y G, et al. Clinical analysis of 21 cases of hypoglycemic encephalopathy[J]. J Pract Diabetol, 2017, 13(1): 53-54. |




