2. 400038 重庆,陆军军医大学(第三军医大学)预防医学院毒理学研究所;
3. 463000 河南 驻马店,联勤保障部队第 990 医院泌尿外科
2. Institute of Toxicology, Faculty of Military Preventive Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038;
3. Department of Urology, No. 990 Hospital of Joint Logistics Support Force of PLA, Zhumadian, Henan Province, 463000, China
本课题组前期研究发现,钙结合酪氨酸磷酸化调节蛋白(calcium-binding tyrosine phosphorylation-regulated protein,CABYR)和纤维鞘CABYR结合蛋白(fibrous sheath CABYR binding,FSCB)均是在精子形成过程中特异性表达和装配于纤维鞘上的蛋白,二者均既具有钙结合能力,又可在获能过程中发生磷酸化调节[1-2]。推测CABYR、FSCB蛋白可通过直接或间接互相作用,装配于纤维鞘的支架蛋白AKAPs上,形成巨分子蛋白复合物,共同发挥纤维鞘的生理功能[2-4]。为深入探讨CABYR和FSCB蛋白复合物在纤维鞘中生理功能,本研究组前期首先通过CRISPR/Cas9系统构建了鼠Fscb单基因靶向敲除小鼠模型[5],对其雄鼠生殖功能进行了观察,结果发现Fscb基因敲除后雄鼠的精子运动功能及体内外受精能力与野生型雄鼠相比均无明显变化,提示该基因所编码的纤维鞘蛋白FSCB对于精子的运动和授精能力的维持可能是非必需的或可被替代的,FSCB可能并不独立发挥作用[6]。为此,本研究进一步建立Cabyr单基因和Fscb/Cabyr双基因敲除小鼠模型,同时前期研究已经证实Cabyr单基因和Fscb/Cabyr双基因敲除小鼠精子的超微结构和运动功能产生严重缺陷[7-8]。因此,本研究拟通过对该类模型雄鼠生育能力的观察,并结合精子内钙离子浓度及钙通道的特征性改变,探讨FSCB和CABYR蛋白复合物在精子纤维鞘中的可能生理功能。
1 材料与方法 1.1 主要材料Fscb/Cabyr(--/--)双基因敲除,Cabyr(--)、Fscb(--)单基因敲除小鼠及多种杂合子小鼠由本研究组前期研究制备,HTF孵育液, RIPA蛋白裂解液, WB发光液购自美国Millipore公司,抗CATSPER-1抗体、抗CATSPER-2抗体、抗CATSPER-3抗体、抗CATSPER-4抗体购自中国博奥森生物技术有限公司,Fluo-4 AM钙离子荧光探针购自美国Molecular Probes公司,Hoechst33342购自中国碧云天生物技术有限公司,BSA购自中国碧云天生物技术有限公司, 高速台式冷冻离心机购自美国Thermo公司,蛋白电泳仪、蛋白转印仪购自美国Bio-Rad公司,多功能酶标仪购自美国Thermo公司,超声波细胞粉碎机购自中国新芝生物科技公司,Fusion FX凝胶成像系统购自美国Viber lourmat公司。
1.2 方法 1.2.1 基因敲除小鼠生殖能力分析取Fscb/Cabyr(--/--)双基因敲除纯合子雄鼠,Fscb/Cabyr(++/--)单基因敲除雄鼠分别与同代野生型雌鼠按1 ∶2合笼,观察2~3个发情周期,每天对雌鼠检查其阴道栓的形成,见栓后取出雌鼠,并另外放入第2个周期的相同品系雌鼠,共观察2~3个周期,记录雌鼠见栓及怀孕、生仔情况。同时期取野生雄鼠与同代野生型雌鼠按1 ∶2合笼,同上法观察1个周期,记录雌鼠见栓及怀孕、生仔情况。
1.2.2 精子内钙离子浓度检测取Fscb/Cabyr(++/+-)、Fscb/Cabyr(--/+-)、Fscb/Cabyr(++/++)、Fscb/Cabyr(--/--)、Fscb/Cabyr(++/--)等5种基因型雄鼠按前述方法麻醉处死,将附睾获取的精子置于含0.25% BSA的HTF中于37 ℃培养箱45 min使精子获能;每个基因型精子800 r/min离心5 min,无Ca2+的HBSS清洗精子1次;加入1 mL 37 ℃水浴锅预热的含1 μmol/L Fluo-4 AM Ca2+荧光探针的HTF,动作轻柔重悬精子,放置于37 ℃培养箱中避光孵育30 min;再次800 r/min离心5 min,用37 ℃水浴锅预热的HBSS,800 r/min离心5 min,清洗2次,最后精子重悬于0.5 mL 37 ℃水浴锅预热的HTF;取20 μL样本涂于载玻片上,晾干后置于荧光显微镜下观察并随机选取视野拍照。用加样枪轻柔地吸取精子悬液100 μL加至多功能酶标仪专用96孔酶标板中,放进多功能酶标仪中,调整参数值,检测各基因型小鼠精子中钙离子水平。
1.2.3 基因敲除小鼠精子内CatSper通道的变化分析取Fscb/Cabyr(++/+-)、Fscb/Cabyr(--/+-)、Fscb/Cabyr(++/++)、Fscb/Cabyr(--/--)、Fscb/Cabyr(++/--)等5种基因型雄鼠,将附睾内精子用RIPA蛋白裂解液提取蛋白,进行Western blot分析。加样蛋白量为80 μg,电泳电压为80V恒压约30 min,待样品溴酚蓝线进入分离胶层,调节电压至120 V恒压至电泳结束。后按照“海绵垫-三层滤纸-凝胶-PVDF膜-三次滤纸-海绵垫”顺序制作转膜三明治结构,再放入有冰袋及预冷转移缓冲液的转移槽中进行转膜,80 V恒压下转膜120 min。以3% BSA封闭1 h后,按目的蛋白相对分子质量大小剪膜。抗-CATSPER(1~4)抗体均按1 ∶500稀释于一抗稀释液中,PVDF膜分别加入不同一抗,4 ℃过夜孵育,TBST洗膜15 min×3次,分别加入二抗(山羊抗兔IgG 1 ∶1 000稀释)常温孵育1 h,TBST洗膜15 min×3次,曝光。
1.3 统计学分析采用SPSS 23.0统计学软件对数据进行分析。计量资料以x±s表示,根据方差齐性结果采用单因素方差分析或Kruskal-Wallis H秩和检验分析各组间结果的差异;计数资料采用χ2检验,检验水准为α=0.05。实验数据来源于至少3次实验的平均值。
2 结果 2.1 基因敲除小鼠生育能力验证Fscb/Cabyr(--/--)与Fscb/Cabyr(++/--)两种基因型成年雄鼠各10只,分别以1 ∶2比例与野生型雌鼠合笼交配,经2~3个周期观察,合笼后检查发现阴道栓的雌鼠分别为45只和41只,但后续观察均无产仔;5只野生型雄鼠和同背景雌鼠合笼后,检查见阴道栓雌鼠9只,其中7只产仔,产仔率为77.8%,共生产29只雄鼠23只雌鼠,平均每胎产仔数为7只(表 1)。
| 组别 | 雄鼠数/只 | 见栓雌鼠数/只 | 产仔雌鼠数/只(%) | 产仔总数/只 | 平均每胎产仔数/只 |
| Fscb/Cabyr(--/--) | 10 | 45 | 0 | 0 | 0 |
| Fscb/Cabyr(++/--) | 10 | 41 | 0 | 0 | 0 |
| Fscb/Cabyr(++/++) | 5 | 9 | 7(77.8) | 52 | 7 |
2.2 基因敲除雄鼠精子内钙离子浓度检测
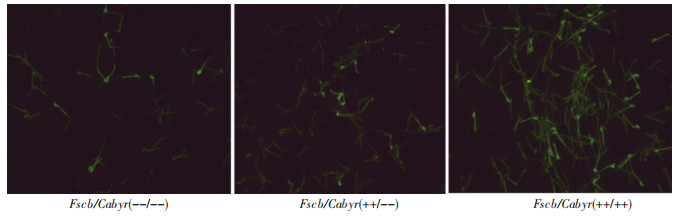
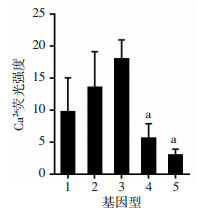
应用Fluo-4 AM钙离子荧光探针对Fscb/Cabyr (++/++)、Fscb/Cabyr(--/--)、Fscb/Cabyr(++/--)等3种基因型雄鼠精子内的钙离子进行荧光标记,荧光显微镜观察结果(图 1)显示:Fscb/Cabyr(--/--)与Fscb/Cabyr(++/--)基因型雄鼠精液中荧光染色精子密度相近,但二者较Fscb/Cabyr(++/++)基因型雄鼠荧光染色精子密度明显降低。多功能酶标仪检测Fscb/Cabyr(++/+-)、Fscb/Cabyr(--/+-)、Fscb/Cabyr(++/++)、Fscb/Cabyr(--/--)、Fscb/Cabyr(++/--)5种基因型雄鼠精子样本的荧光值见图 2,Fscb/Cabyr(--/--)及Fscb/Cabyr(++/--)基因型雄鼠精子荧光值较Fscb/Cabyr(++/++)显著降低,存在显著统计学差异(P<0.000 1);但Fscb/Cabyr(++/+-)、Fscb/Cabyr(--/+-)基因型雄鼠精子荧光值与野生型Fscb/Cabyr(++/++)比较差异无统计学意义(P>0.05)。单基因敲除Fscb/Cabyr(++/--)基因型雄鼠精子荧光值与双基因敲除Fscb/Cabyr(--/--)基因型之间差异无统计学意义(P>0.05)。
|
| 图 1 3种基因型雄鼠精子内的钙离子荧光染色结果 |
|
|
1:++/+-;2:--/+-;3:++/++;4:--/--;5:++/-- a:P<0.0001,与++/++比较 图 2 各基因型精子钙离子浓度分析结果 |
2.3 基因敲除小鼠精子内CATSPER通道的变化
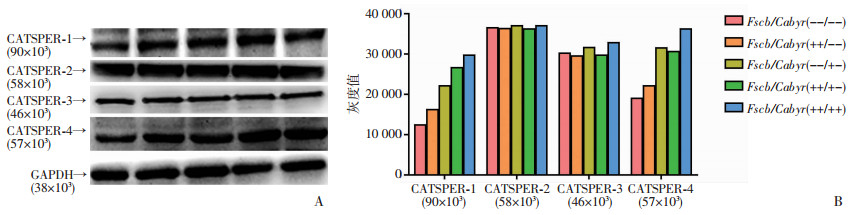
Western blot检测5种基因型雄鼠精子样本中各型CATSPER通道蛋白表达结果见图 3,CATSPER-2、CATSPER-3在各基因型小鼠中的表达无明显差异。CATSPER-1在Fscb/Cabyr(--/--)型小鼠精子中的蛋白表达较其他基因型明显减少。CATSPER-4在Fscb/Cabyr(--/--)、Fscb/Cabyr(++/--)型小鼠精子中的蛋白表达存在明显减低,而且在Fscb/Cabyr(--/--)基因型中的降低最为明显。
|
| A:Western blot检测钙通道蛋白CATSPER1-4的表达;B:半定量分析结果 图 3 各基因型雄鼠精子中各型钙通道蛋白CatSper的表达 |
3 讨论
在精子鞭毛纤维鞘中,结构蛋白、信号通路蛋白、钙结合蛋白等多类蛋白之间具有复杂而紧密的相互作用关系,共同发挥纤维鞘的生理功能[1, 9-11]。基于鼠FSCB和CABYR蛋白在精子形成过程中,在精子纤维鞘上的特异性定位以及其均具有钙结合能力和可在获能过程中发生磷酸化的基本生物学特征,而且这两种蛋白之间具有明显的相互作用,推测其可能在鞭毛纤维鞘上作为巨分子蛋白复合体的一部分发挥作用,参与精子鞭毛的形成、精子运动和获能的调节[2]。为此,本研究在前期已经获得Fscb单基因敲除小鼠模型的基础上,进一步采用CRISPR/Cas9系统及受精卵注射的方式成功建立两个能稳定遗传的Cabyr基因敲除小鼠模型品系,进而与前期建立的Fscb敲除小鼠模型[5]进行交叉繁育,最终获得Fscb/Cabyr(--/--)双基因敲除小鼠[7]。通过对Fscb/Cabyr(--/--)、Fscb/Cabyr(++/--)和Fscb/Cabyr(++/++)野生型雄鼠精子的形态学、运动参数的对比分析发现,Fscb/Cabyr(--/--)、Fscb/Cabyr(++/--)两种基因型雄鼠精子鞭毛的超微结构大部分精子纤维鞘纵行柱状体结构消失,环形肋板结构紊乱,电子密度不均匀降低,呈显著疏松或增厚表现。与野生型雄鼠比较,该两类基因型雄鼠精子的前向运动精子比率(PR)、正常精子百分率显著降低,其精子尾折叠比例显著增高。表明Fscb/Cabyr双基因敲除和Cabyr单基因敲除均对精子纤维鞘结构的形成造成显著影响,并严重影响精子的运动能力,从而强烈提示FSCB/CABYR蛋白复合物或CABYR蛋白功能的缺失可能对精子的授精功能造成影响[8, 12]。
本研究应用所获得的双基因敲除Fscb/Cabyr(--/--)雄鼠和单基因敲除Fscb/Cabyr(++/--)雄鼠各10只,分别以1 ∶2比例与野生型雌鼠合笼交配,每天检查雌鼠阴道栓的情况,见栓后即取出雌鼠,并放入相同品系另外一只雌鼠进行第2个周期观察,共观察2~3个周期。与两种雄鼠合笼后检查发现阴道栓的雌鼠分别为45只和41只,但后续观察无任何一只雌鼠产仔。而野生型Fscb/Cabyr(++/++)雄鼠5只,按1 ∶2比例与野生型雌鼠合笼,观察2个周期后,9只雌鼠见栓,其中7只雌鼠产仔52只,受孕率为77.8%,表明这两种基因敲除后雄鼠的授精能力完全丧失。同时,在本实验中进行种系繁育时,曾采用相应的杂合型雄鼠与Fscb/Cabyr(--/--)、Fscb/Cabyr(++/--)雌鼠合笼,雌鼠均可正常怀孕生仔,表明两种蛋白的缺失仅对雄性小鼠的生殖能力造成影响,而对雌性的生殖能力无影响。而且,杂合型雄鼠的生育能力也无明显影响。结合前期本研究针对Fscb单基因敲除后雄鼠精子运动能力无明显变化,生育能力无明显影响的观察结果,表明CABYR蛋白在精子纤维鞘中的结构和功能是不可或缺或不可替代的。其蛋白表达的缺失在导致精子尾部畸形率上升、运动功能缺陷的基础上,进一步引起精子授精功能的丧失。因而,本研究无论Cabyr单基因敲除还是Fscb/Cabyr双基因敲除均呈现相同的表型特征。可见,尽管单纯FSCB蛋白的缺失对授精无明显影响,但单纯CABYR蛋白的缺失则可导致精子授精功能即雄鼠的生育能力完全丧失。本研究进一步证实Cabyr基因的正常表达和功能性CABYR蛋白在纤维鞘上的正常装配对精子授精功能的维持至关重要[12]。
为进一步探讨基因敲除后所导致的精子授精功能丧失的可能机制,鉴于CABYR和FSCB蛋白均为钙结合蛋白,那么,其缺失是否对精子内钙离子浓度和钙通道造成影响,从而通过其相关信号通路,对精子运动功能造成影响?CATSPER是人和动物成熟精子上一种特异性、钙离子通透性、pH值敏感性和弱电压依赖性的离子通道,研究显示CATSPER很可能被锚固在精子鞭毛主段的支架结构纤维鞘上,以确保其有序排列,并沿着精子尾部形成1个四边形结构,负责Ca2+进入精子,促进精子运动,参与鞭毛鞭打样运动的调节[13-15]。有研究显示雄鼠体内CATSPER蛋白的失活可诱导不育[16]。CATSPER通道复合体包含4个α亚单位(CATSPER1~4)[17-18]和5个辅助亚单位(CatSperβ、γ、δ、ε和ζ)[13, 19]。基于CATSPER与CABYR和FSCB蛋白之间超微结构定位及其功能的紧密相关性,本研究进一步对Fscb/Cabyr基因敲除后精子内钙离子浓度和钙通道蛋白CATSPER1~4的表达情况进行比较,结果发现,与野生型Fscb/Cabyr(++/++)雄鼠精子比较,Fscb/Cabyr(--/--)与Fscb/Cabyr(++/--)基因型雄鼠精子内的钙离子浓度显著降低,而后两种基因型雄鼠精子内钙离子浓度之间无明显差别。而且,Fscb/Cabyr(++/+-)、Fscb/Cabyr(--/+-)基因型雄鼠精子内钙离子浓度与野生型Fscb/Cabyr(++/++)无显著差异。这表明Fscb基因的缺失不对精子内钙离子浓度造成影响,而Cabyr单基因的缺失及其蛋白表达的丧失单独就可以影响精子内钙离子浓度,从而可能导致精子运动功能的显著降低。进一步观察基因敲除后雄鼠精子内钙离子通道蛋白的表达,结果显示,在Fscb/Cabyr(--/--)型小鼠精子中的CATSPER-1蛋白表达较其他基因型明显减少。在Fscb/Cabyr(--/--)、Fscb/Cabyr(++/--)型小鼠精子中的CATSPER-4蛋白表达存在明显减低,而且在Fscb/Cabyr(--/--)基因型中的降低最为明显。本研究结果提示,精子内重要的纤维鞘蛋白的表达可能通过直接或间接的方式影响到精子内钙离子通道蛋白的表达和精子内钙离子浓度。可见Cabyr基因敲除后蛋白表达的缺失,不但严重影响纤维鞘及其周围相关亚细胞结构的正常装配,而且可能通过影响某些精子内钙离子通道蛋白的表达,从而影响精子内钙离子浓度的维持,并最终影响精子的运动功能和授精能力。本研究结果仍有待通过相关研究进一步证实。
总之,本研究前期有关结果已经表明,CABYR及FSCB两种蛋白均参与精子纤维鞘的完整结构的形成和装配,但单独CABYR蛋白功能的缺失即可导致精子大体形态和超微结构的显著异常,并导致精子运动功能的显著降低。同时,本研究发现Cabyr基因敲除后雄鼠精子内钙通道蛋白CATSPER-1和CATSPER-4的表达显著减少,钙离子浓度显著减低,根据纤维鞘结构和钙离子在精子正常运动功能维持中的重要价值。本研究结果表明Cabyr基因敲除后引起的纤维鞘结构异常以及精子内钙通道和钙离子浓度的显著降低,是导致精子运动能力显著降低并最终导致雄鼠丧失繁殖能力的主要原因。而单独FSCB蛋白的缺失不影响精子鞭毛的形态结构和运动功能,也不影响精子的授精功能。尽管从CABYR及FSCB两种蛋白的定位特征和二者的相互作用分析两种蛋白形成复合物共同参与纤维鞘的生理功能,但仅有CABYR蛋白对于精子的正常结构和授精功能是不可或缺的。
| [1] |
NAABY-HANSEN S, MANDAL A, WOLKOWICZ M J, et al. CABYR, a novel calcium-binding tyrosine phosphorylation-regulated fibrous sheath protein involved in capacitation[J]. Dev Biol, 2002, 242(2): 236-254. |
| [2] |
LI Y F, HE W, JHA K N, et al. FSCB, a novel protein kinase A-phosphorylated calcium-binding protein, is a CABYR-binding partner involved in late steps of fibrous sheath biogenesis[J]. J Biol Chem, 2007, 282(47): 34104-34119. |
| [3] |
LI Y F, HE W, KIM Y H, et al. CABYR isoforms expressed in late steps of spermiogenesis bind with AKAPs and ropporin in mouse sperm fibrous sheath[J]. Reprod Biol Endocrinol, 2010, 8: 101. |
| [4] |
LI Y F, HE W, MANDAL A, et al. CABYR binds to AKAP3 and Ropporin in the human sperm fibrous sheath[J]. Asian J Androl, 2011, 13(2): 266-274. |
| [5] |
周庭友, 孙中义, 张勇, 等. 鼠fscb基因靶向敲除载体的构建及动物模型的建立[J]. 第三军医大学学报, 2015, 37(15): 1527-1533. ZHOU T Y, SUN Z Y, ZHANG Y, et al. Construction of targeting vector and preparation of fibrous sheath CABYR-binding protein knockout mice using CRISPR / Cas9 system[J]. J Third Mil Med Univ, 2015, 37(15): 1527-1533. |
| [6] |
周庭友, 张勇, 张军, 等. FSCB基因敲除对雄性小鼠生殖功能的影响[J]. 第三军医大学学报, 2016, 38(15): 1729-1734. ZHOU T Y, ZHANG Y, ZHANG J, et al. Knockout of fibrous sheath CABYR-binding on reproductive function in male mice[J]. J Third Mil Med Univ, 2016, 38(15): 1729-1734. |
| [7] |
李中泰, 李彦锋, 刘晋祎, 等. 鼠Fscb/Cabyr双基因靶向敲除动物模型的建立和鉴定[J]. 第三军医大学学报, 2020, 42(19): 1898-1906. LI Z T, LI Y F, LIU J Y, et al. Establishment and identification of a mouse model of Fscb/Cabyr double gene knockout[J]. J Third Mil Med Univ, 2020, 42(19): 1898-1906. |
| [8] |
李中泰, 李彦锋, 刘晋祎, 等. Fscb/Cabyr双基因敲除雄性小鼠的精子形态学表型特征及运动参数变化[J]. 第三军医大学学报, 2020, 42(24): 2358-2365. LI Z T, LI Y F, LIU J Y, et al. Morphological phenotypes and changes in motility parameters of sperms in Fscb/Cabyr double knockout mice[J]. J Third Mil Med Univ, 2020, 42(24): 2358-2365. |
| [9] |
EDDY E M, TOSHIMORI K, O'BRIEN D A. Fibrous sheath of mammalian spermatozoa[J]. Microsc Res Tech, 2003, 61(1): 103-115. |
| [10] |
KIM Y H, HAIDL G, SCHAEFER M, et al. Compartmentalization of a unique ADP/ATP carrier protein SFEC (Sperm Flagellar Energy Carrier, AAC4) with glycolytic enzymes in the fibrous sheath of the human sperm flagellar principal piece[J]. Dev Biol, 2007, 302(2): 463-476. |
| [11] |
KIM Y H, JHA K N, MANDAL A, et al. Translation and assembly of CABYR coding region B in fibrous sheath and restriction of calcium binding to coding region A[J]. Dev Biol, 2005, 286(1): 46-56. |
| [12] |
YOUNG S A M, MIYATA H, SATOUH Y, et al. CABYR is essential for fibrous sheath integrity and progressive motility in mouse spermatozoa[J]. J Cell Sci, 2016, 129(23): 4379-4387. |
| [13] |
CHUNG J J, MIKI K, KIM D, et al. CatSperζ regulates the structural continuity of sperm Ca2+ signaling domains and is required for normal fertility[J]. Elife, 2017, 6: e23082. |
| [14] |
CHUNG J J, SHIM S H, EVERLEY R A, et al. Structurally distinct Ca2+ signaling domains of sperm flagella orchestrate tyrosine phosphorylation and motility[J]. Cell, 2014, 157(4): 808-822. |
| [15] |
LISHKO P V, MANNOWETZ N. CatSper: a unique calcium channel of the sperm flagellum[J]. Curr Opin Physiol, 2018, 2: 109-113. |
| [16] |
NAVARRO B, KIRICHOK Y, CHUNG J J, et al. Ion channels that control fertility in mammalian spermatozoa[J]. Int J Dev Biol, 2008, 52(5/6): 607-613. |
| [17] |
KIRICHOK Y, NAVARRO B, CLAPHAMD E. Whole-cell patch-clamp measurements of spermatozoa reveal an alkaline-activated Ca2+ channel[J]. Nature, 2006, 439(7077): 737-740. |
| [18] |
QI H Y, MORAN M M, NAVARRO B, et al. All four CatSper ion channel proteins are required for male fertility and sperm cell hyperactivated motility[J]. Proc Natl Acad Sci USA, 2007, 104(4): 1219-1223. |
| [19] |
SINGHA P, RAJENDER S. CatSper channel, sperm function and male fertility[J]. Reprod Biomed Online, 2015, 30(1): 28-38. |




