2. 450052 郑州,河南省颅脑损伤防治工程研究中心;
3. 100070 北京,首都医科大学附属天坛医院神经外科;
4. 510600 广州,华南理工大学自动化科学与工程学院
2. Henan Engineering Research Center for Prevention and Treatment of Brain Injuries, Zhengzhou, Henan Province, 450052;
3. Department of Neurosurgery, Beijing Tiantan Hospital Affiliated to Capital Medical University, Beijing, 100070;
4. School of Automation Science and Engineering, South China University of Technology, Guangzhou, Guangdong Province, 510600, China
慢性意识障碍(chronic disorders of consciousness, DOC)是严重颅脑损伤后常见的一种意识状态,DOC包括植物状态(vegetative state, VS)和微意识状态(minimally conscious state,MCS)[1]。MCS是一种对自身或外界周围环境表现出微小、波动、可重复明确行为的一种意识障碍。MCS因意识水平的差异又分为微意识状态-(MCS minu, MCS-)和微意识状态+(MCS plus, MCS+),MCS-的行为表现主要有视物追踪、疼痛定位和情感反应等,而MCS+主要是有遵嘱动作、可辨析的语言或部分交流。临床研究显示,MCS比植物状态具有更好的远期意识恢复潜力[2]。目前国内外对于MCS尚无基于循证医学的治疗指南,探寻一种安全、有效的技术来提高MCS患者的意识恢复是目前亟待解决的问题[3]。
传统经颅直流电刺激(transcranial direct current stimulation,tDCS)是一种无创的脑调控技术,它通过恒定、低强度电流调控大脑皮质,从而引起大脑皮质兴奋性的改变。传统tDCS由阴极和阳极两个片状电极构成,阳极刺激可提高皮质的兴奋性,而阴极刺激抑制皮质的兴奋性,兴奋性的改变可引起神经可塑性的变化[4]。目前有研究表明传统tDCS可以提高MCS患者皮层的兴奋性和连接性,促进其意识的恢复[5]。然而,传统tDCS电极片大小为20~35 mm2,产生的电流分布分散,靶区聚焦性差,很难解释产生的效应是靶区皮质还是邻近区域的皮质[6]。另外传统tDCS调控浅表皮质,深度有限[7]。近年来,高精度经颅直流电刺激(high-definition tDCS,HD-tDCS)作为一种新型神经调控技术被应用于多种疾病的治疗[8]。本研究采用HD-tDCS对MCS患者进行长时程重复楔前叶调控,探讨其对MCS患者意识恢复的作用,以期为MCS患者的意识康复提供新的治疗方法。
1 资料与方法 1.1 一般资料前瞻性纳入2018年6月至2021年1月郑州大学第五附属医院神经外科住院治疗的48例MCS患者,分为HD-tDCS组和对照组,两组各24例,其中男性28例,女性20例,年龄14~74岁。因肺炎、阵发性交感神经兴奋发作、肠梗阻、疗程不足等因素,HD-tDCS组和对照组各有4例,共计8例未能完成试验。最终HD-tDCS组纳入20例,对照组20例。纳入标准:符合昏迷恢复量表(Coma Recovery Scale-Revised,CRS-R)评分的MCS患者。本研究纳入的MCS患者病程均大于3个月。排除标准:楔前叶损伤;曾接受过tDCS、经颅磁刺激治疗;使用心脏起搏器、动脉瘤夹等治疗。本研究方案通过郑州大学第五附属医院伦理委员会批准(KY2020024)。
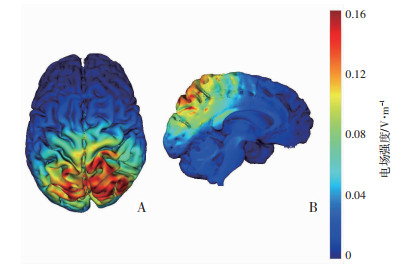
1.2 治疗方法对照组给予常规治疗,包括应用金刚脘胺(100 mg,2次/d)药物、高压氧、肢体康复和针灸治疗等。HD-tDCS组在对照组治疗基础上应用HD-tDCS(Soterix:4x1-C2, 美国)治疗。具体参数和疗程如下:采用4×1环形电极,固定在32通道的脑电图定位帽中(正极中心电极覆盖目标脑区,周围有4个阴性电极)。中心电极(阳极)按国际10-20脑电图系统置于Pz上,4个阴极电极距Pz直径约3.5 cm,对应于Cz、P3、P4、POz位置。电流强度为2 mA,持续20 min,每日2次,共2周,28次。每次刺激后都观察记录HD-tDCS刺激的不良作用,如刺激区域皮肤有无烧伤、发红,有无癫痫发作等不良反应。本研究利用SimNIBS软件,基于核磁共振模板颅脑电流有限元模型,对HD-tDCS诱导的皮质电场进行评估,确定产生的电流可以刺激到楔前叶,见图 1。
|
| A:轴位上表面观楔前叶电流分布,可见电流可刺激到双侧楔前叶皮质;B:矢状位侧面观楔前叶电流分布,可见电流可以刺激到楔前叶深部皮质 图 1 HD-tDCS楔前叶皮质电流分布模拟 |
1.3 观察指标
在4个节点(基线,单次刺激,刺激第7天、第14天)对HD-tDCS组和对照组MCS患者进行CRS-R量表评分并记录。CSR-R评分由两名高年资医师分别评定。CRS-R量表由6个子量表23个条目组成。6个子量表涉及听觉、视觉、运动、语言、沟通和唤醒功能的评分。HD-tDCS反应者被定义为HD-tDCS治疗或常规治疗后出现新的意识迹象的MCS患者(如遵嘱运动,凝视目标,视物追踪,对物体的识别、定位或使用,疼痛定位,可辨的词语,非功能或功能性交流且这些新的意识迹象前从未出现过)。
1.4 统计学分析应用SPSS 26.0统计软件对数据进行处理与分析,统计分析所有符合试验方案要求的受试者。HD-tDCS组和对照组年龄、昏迷时长和基线CRS-R评分的比较采用Man-Whitney方法。HD-tDCS组和对照组在不同节点CRS-R评分的比较采用t检验。HD-tDCS组HD-tDCS治疗前后不同节点CRS-R总分及子项目的变化比较采用Wilcoxon方法。检验水准α=0.05。年龄、昏迷时长及基线CRS-R评分以中位数(四分位数间距)表示。HD-tDCS组和对照组治疗前后不同节点CRS-R总分以x±s表示。
2 结果 2.1 患者一般情况与临床疗效HD-tDCS组和对照组在年龄、昏迷时长和基线CRS-R评分差异均无统计学意义(P=0.807、0.394、0.129),见表 1。HD-tDCS组在T1后HD-tDCS反应者有6例,T2后HD-tDCS反应者14例,T3后HD-tDCS反应者17例。9例从MCS-恢复到MCS+,其中1例T1后恢复到MCS+,2例在T2后恢复到MCS+,6例T3后恢复到MCS+。5例MCS-患者单次刺激后出现新的意识迹象,而在T3后均恢复到MCS+。HD-tDCS治疗期间未见皮肤烧伤、红肿,癫痫等不良反应。对照组只有在T3时有2例反应者,但无患者由MCS-恢复到MCS+。
| 组别 | 年龄/岁 | 昏迷时间/d | 基线CRS-R评分 |
| HD-tDCS组 | 55(43, 66) | 83(49, 137) | 9.5(7, 11) |
| 对照组 | 54(38, 64) | 103(75, 122) | 10(9, 12.5) |
2.2 HD-tDCS组、对照组在不同节点CRS-R评分的比较
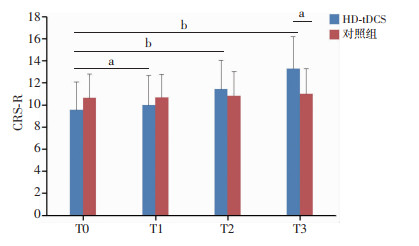
HD-tDCS组患者在T3时CRS-R评分明显高于对照组,差异有统计学意义(P=0.008),而在T1、T2时差异无统计学意义(PT1=0.359,PT2=0.435)。HD-tDCS组意识改善患者比例(85%)高于对照组(9.5%)。HD-tDCS组患者在T1、T2、T3相比于T0时CRS-R评分分值均有提高,差异均有统计学意义(PT1=0.024, PT2 < 0.001, PT3 < 0.001),随着治疗次数和时长的增加,CRS-R评分分值逐渐提高(图 2)。
|
| a: P < 0.05, b: P < 0.001 图 2 HD-tDCS组、对照组在不同节点CRS-R评分的比较 |
2.3 HD-tDCS组HD-tDCS治疗前后不同节点CRS-R子项目的变化比较
单次刺激T1与T0时比较,发现视觉子量表分值差异有统计学意义(P < 0.05),其余子量表未见明显变化。视觉、运动子量表分值在T2、T3时的分值提高的越来越明显,与T0时相比有明显差异。言语子量表分值:与T0相比,T1时改变未见差异,T2时有小幅度提高,但差异无统计学意义,T3时改变差异有统计学意义(P < 0.05)。交流子量表分值:与T0时相比,T1、T2时有小幅度提高,但差异无统计学意义,T3时有显著提高(P < 0.01)。觉醒子量表分值:与T0时水平相比,在T1时未见差异改变,T2、T3时显著提高(P < 0.01,图 3)。

|
| a: P < 0.05, b: P < 0.01,c: P < 0.001,与T0比较 图 3 HD-tDCS组在T0、T1、T2、T3时刻CRS-R子量表的变化 |
3 讨论
多项国内外研究显示传统tDCS可以提高DOC的意识恢复,尤其是MCS患者[8-15],但是这一技术还远未成熟到应用于临床实践中。传统tDCS其固有的不足,比如无法精确定位目标靶点、电流大量地衰减等无法高效刺激大脑皮层。HD-tDCS是一种新型无创神经调控技术,采用4×1小型圆环状电极片代替空间精度较差的海绵电极片,通过计算机模拟电流的脑区分布,提高了电流的聚集性,靶点定位更精确,调控脑区的电流密度更大,能够更好的诱发皮质特定区域的可塑性[16]。本研究显示长时程重复HD-tDCS调控楔前叶有助于MCS患者的意识恢复。不同时间节点CRS-R评分结果显示,随着刺激次数的增加、调控效应的累积,CRS-R分值也相应提高,而在子量表中的听觉、视觉、运动的评分也显示类似结果。每个电极通道电阻在全程刺激的监测,提高了HD-tDCS的安全性,整个研究中所有患者未发现皮肤烧伤、癫痫等不良反应。
MCS包括MCS-和MCS+两类意识状态。MCS-显示较低有意识的行为,例如视觉追踪、疼痛定位、不自主运动等,MCS+可表现出可重复的遵嘱运动。这些临床行为差异的机制已在功能影像学的研究中得到验证[17]。另外MCS比植物状态残留更完整的意识网络,具有更强的神经可塑性和意识恢复潜力[2],临床医师和家属对MCS患者的救治更加积极。因此,本研究纳入的DOC均为MCS患者,减少了患者状态差异的影响。结果显示,MCS患者在给予28次长时程重复HD-tDCS调控后,CRS-R评分在组间才有统计学意义,这可能也提示,意识相关脑网络保存相对完好,具有更大可塑性的MCS患者也需要长期重复的调控治疗,以便重塑意识环路。HD-tDCS组有30%(6/20)的MCS患者给予单次刺激后出现新的意识行为。在T2和T3后分别提高到70%(14/20)、85%(17/20)。研究还发现5例MCS-恢复到MCS+,而初始为MCS+患者的意识状态未脱离微意识状态。THIBAUT等[18]采用传统tDCS(2 mA,20 min,5次)对16例MSC患者重复刺激左侧前额叶背外侧脑区(the dorsolateral prefrontal cortex, DLPFC),发现CRS-R评分与刺激次数呈线性关系,单次刺激显效率为25%,5次刺激后提高到56%,且产生的临床改善可以持续1周。另外一项传统tDCS研究对26例DOC患者给予2次/d,10 d tDCS(2 mA,20 min),共计20次的治疗,其中30.76%(8/26)DOC刺激后立刻均出现了明显的临床提高,53.8%(14/26) DOC在20次刺激后出现新的意识行为表现[19]。本研究和传统tDCS的结果提示,单次tDCS对部分MCS患者意识恢复有效果,而长时程重复刺激对MCS患者的意识恢复作用具有更强的作用。与传统tDCS文献报道相比,HD-tDCS对MCS的反应者明显更多,这可能与刺激靶点、特殊的电流分布和强度有关,这也是HD-tDCS在DOC领域应用的优势。同时,本研究结果也提示,长时程重复HD-tDCS可以提高反应者的人数,尽管单次刺激后有新的意识行为出现的MCS-患者在28次治疗后恢复到MCS+,也不能因此作为所有MCS患者刺激效果的预测指标。
对DOC患者的临床诊断首先是基于行为学的评估,也是目前临床评估的主要手段。标准的评分系统有助于减少对MCS的误诊[20]。CRS-R评分被首推为临床应用的评分量表,能够较好区分植物状态、MCS-和MCS+[21]。CRS-R包括6个子量表,总分由每个子量表的最高分之和组成。但它不能完全用于子量表的定性分析。事实上,只要达到了子量表的特定项目评定就可以诊断为MCS。本研究结果显示,CRS-R评分在单次HD-tDCS刺激后与基线相比差异有统计学意义,随着重复刺激的增加和累积,差异更加显著。而在子量表的分析中发现,听觉、视觉、运动、语言、沟通的评分也随着刺激次数和时间的延长出现显著的差异。其中听觉和视觉量表尤其显著。这可能是MCS的听觉和视觉功能保存相对完好有关,而运动、语言、沟通量表多受肌张力障碍、肢体偏瘫、失语等因素的影响。上述研究结果提示,在CRS-R评分时需要重点关注听觉、视觉与运动量表的评分,这有助于临床上发现被误诊的MCS患者。
不同脑区的损伤对意识水平的影响存在差异,意识网络关键脑区的损伤可能更易导致严重的意识障碍,因此刺激靶点的选择是促进意识恢复的关键因素之一[22]。目前tDCS在DOC调控中常用的靶点有左侧DLPFC、后顶叶皮质和左侧初级感觉运动皮质[8-9, 11]。左侧DLPFC是目前最常用的靶点,这一区域是外部意识网络的重要组成部分[23]。但是对于该区域脑组织结构严重损伤,存在颅骨缺损或头皮伤口愈合不佳的患者,则需要选择其他靶点。楔前叶在临床和研究中较少受到关注,主要是因为其部位隐蔽,局灶性病变的研究很少涉及。楔前叶是内部意识网络的主要功能区,也是静息状态脑代谢活动最强的脑区之一,这与意识维持的高级功能密切相关[24]。在意识中央环路理论中,楔前叶也起着重要的作用。THIBAUT等[25]研究发现,tDCS刺激左侧DLPFC对MCS患者产生促醒作用,需要患者左侧DLPFC、楔前叶和关键皮质脑区的完整性和/或残存代谢活动,这也证实了楔前叶在MCS患者意识恢复中的作用。基于上述因素,本研究选择楔前叶作为靶点,HD-tDCS电流分布图显示,刺激电流可以有效地刺激到楔前叶。传统tDCS可能无法刺激到这一深部区域,国内未见报道调控楔前叶对MCS患者意识恢复作用的研究。本研究结果显示,调控楔前叶可以提高MCS患者意识相关的行为表现。
本研究也存在一些不足之处:①样本量小,需要后期开展多中心、大样本的研究;②入组MCS患者病因较复杂,需要后期的实验采用病因相对一致的随机对照研究;③本次研究未能应用脑电、事件相关诱发电位、功能核磁影像等技术,这些客观的指标有利于更好地了解HD-tDCS调控楔前叶意识恢复的机制,这也是后续需要开展的研究。
| [1] |
GIACINO J T, KATZ D I, SCHIFF N D, et al. Comprehensive systematic review update summary: Disorders of consciousness[J]. Neurology, 2018, 91(10): 461-470. |
| [2] |
LUAUTÉ J, MAUCORT-BOULCH D, TELL L, et al. Long-term outcomes of chronic minimally conscious and vegetative states[J]. Neurology, 2010, 75(3): 246-252. |
| [3] |
SCHNAKERS C, MONTI M M. Disorders of consciousness after severe brain injury: therapeutic options[J]. Curr Opin Neurol, 2017, 30(6): 573-579. |
| [4] |
郭永坤, 戴宜武, 刘春颖, 等. 经颅直流电刺激神经调控治疗慢性意识障碍的现状及前景[J]. 中华脑科疾病与康复杂志(电子版), 2019, 9(3): 181-184. GUO Y K, DAI Y W, LIU C Y, et al. Current status of transcranial direct current stimulation neuromodulation therapy for chronic disorders of consciousness[J]. Chin J Brain Dis Rehabil Electron Ed, 2019, 9(3): 181-184. |
| [5] |
NARO A, CALABRÒ R S, RUSSO M, et al. Can transcranial direct current stimulation be useful in differentiating unresponsive wakefulness syndrome from minimally conscious state patients?[J]. Restor Neurol Neurosci, 2015, 33(2): 159-176. |
| [6] |
SHEKHAWAT G S, SUNDRAM F, BIKSON M, et al. Intensity, duration, and location of high-definition transcranial direct current stimulation for tinnitus relief[J]. Neurorehabil Neural Repair, 2016, 30(4): 349-359. |
| [7] |
SHEKHAWAT G S, VANNESTE S. High-definition transcranial direct current stimulation of the dorsolateral prefrontal cortex for tinnitus modulation: a preliminary trial[J]. J Neural Transm, 2018, 125(2): 163-171. |
| [8] |
DMOCHOWSKI J P, DATTA A, BIKSON M, et al. Optimized multi-electrode stimulation increases focality and intensity at target[J]. J Neural Eng, 2011, 8(4): 046011. |
| [9] |
THIBAUT A, BRUNO M A, LEDOUX D, et al. tDCS in patients with disorders of consciousness: Sham-controlled randomized double-blind study[J]. Neurology, 2014, 82(13): 1112-1118. |
| [10] |
ANGELAKIS E, LIOUTA E, ANDREADIS N, et al. Transcranial direct current stimulation effects in disorders of consciousness[J]. Arch Phys Med Rehabilitation, 2014, 95(2): 283-289. |
| [11] |
CAVINATO M, GENNA C, FORMAGGIO E, et al. Behavioural and electrophysiological effects of tDCS to prefrontal cortex in patients with disorders of consciousness[J]. Clin Neurophysiol, 2019, 130(2): 231-238. |
| [12] |
HUANG W, WANNEZ S, FREGNI F, et al. Repeated stimulation of the posterior parietal cortex in patients in minimally conscious state: a sham-controlled randomized clinical trial[J]. Brain Stimul, 2017, 10(3): 718-720. |
| [13] |
BAI Y, XIA X Y, KANG J N, et al. TDCS modulates cortical excitability in patients with disorders of consciousness[J]. Neuroimage Clin, 2017, 15: 702-709. |
| [14] |
MARTENS G, LEJEUNE N, O'BRIEN A T, et al. Randomized controlled trial of home-based 4-week tDCS in chronic minimally conscious state[J]. Brain Stimul, 2018, 11(5): 982-990. |
| [15] |
冯枫, 孙晓龙, 琚芬, 等. 经颅直流电刺激治疗重型颅脑损伤后意识障碍的临床效果及对患者神经功能的影响[J]. 临床医学研究与实践, 2020, 5(15): 7-8, 16. FENG F, SUN X L, JU F, et al. Clinical effect of transcranial direct current stimulation in the treatment of consciousness disorder after severe craniocerebral injury and its influence on patients' neurological function[J]. Clin Res Pract, 2020, 5(15): 7-8, 16. |
| [16] |
KUO H I, BIKSON M, DATTA A, et al. Comparing cortical plasticity induced by conventional and high-definition 4×1 ring tDCS: a neurophysiological study[J]. Brain Stimul, 2013, 6(4): 644-648. |
| [17] |
BRUNO M A, MAJERUS S, BOLY M, et al. Functional neuroanatomy underlying the clinical subcategorization of minimally conscious state patients[J]. J Neurol, 2012, 259(6): 1087-1098. |
| [18] |
THIBAUT A, WANNEZ S, DONNEAU A F, et al. Controlled clinical trial of repeated prefrontal tDCS in patients with chronic minimally conscious state[J]. Brain Inj, 2017, 31(4): 466-474. |
| [19] |
ZHANG Y, SONG W Q, DU J B, et al. Transcranial direct current stimulation in patients with prolonged disorders of consciousness: combined behavioral and event-related potential evidence[J]. Front Neurol, 2017, 8: 620. |
| [20] |
WANNEZ S, GOSSERIES O, AZZOLINI D, et al. Prevalence of Coma-recovery scale-revised signs of consciousness in patients in minimally conscious state[J]. Neuropsychol Rehabil, 2018, 28(8): 1350-1359. |
| [21] |
BODIEN Y G, CARLOWICZ C A, CHATELLE C, et al. Sensitivity and specificity of the Coma recovery scale: revised total score in detection of conscious awareness[J]. Arch Phys Med Rehabil, 2016, 97(3): 490-492. e1. |
| [22] |
XIA X Y, LIU Y, BAI Y, et al. Long-lasting repetitive transcranial magnetic stimulation modulates electroencephalography oscillation in patients with disorders of consciousness[J]. Neuroreport, 2017, 28(15): 1022-1029. |
| [23] |
XIA X Y, BAI Y, ZHOU Y Z, et al. Effects of 10 hz repetitive transcranial magnetic stimulation of the left dorsolateral prefrontal cortex in disorders of consciousness[J]. Front Neurol, 2017, 8: 182. |
| [24] |
LAUREYS S, OWEN A M, SCHIFF N D. Brain function in coma, vegetative state, and related disorders[J]. Lancet Neurol, 2004, 3(9): 537-546. |
| [25] |
THIBAUT A, DI PERRI C, CHATELLE C, et al. Clinical response to tDCS depends on residual brain metabolism and grey matter integrity in patients with minimally conscious state[J]. Brain Stimul, 2015, 8(6): 1116-1123. |




